Журнал «Здоровье ребенка» 1 (69) 2016
Вернуться к номеру
Особенности цитологического состава индуцированной мокроты у детей школьного возраста, страдающих бронхиальной астмой физической нагрузки
Авторы: Безруков Л.А., Ортеменка Е.П. - Высшее государственное учебное заведение Украины «Буковинский государственный медицинский университет», г. Черновцы
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
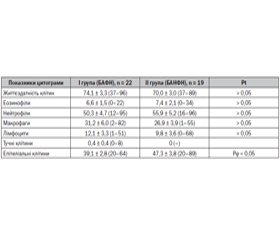
На базі обласної дитячої клінічної лікарні м. Чернівці в 41 школяра, які хворі на персистуючу бронхіальну астму (БА), вивчався характер запалення дихальних шляхів (ДШ) із метою диференційованого вибору протизапальної базисної терапії. Першу (І) клінічну групу сформували 22 дитини з фенотипом БА фізичного навантаження, а решта 19 хворих без наявності фенотипу БА фізичного навантаження увійшли до складу другої (ІІ) клінічної групи. Цитологічний аналіз індукованого мокротиння проводився за методом I.D. Pavord (1996 р.).
Хворим на БА фізичного навантаження притаманне гіпогранулоцитарне запалення ДШ із переважанням еозинофілопосередкованої реакції, асоційованої з гіперлімфоцитарною інфільтрацією бронхів. Так, бронхіальна еозинофілія (≥ 2 % еозинофілів у мокротинні) зареєстрована в 81,8 % школярів І групи та в 63,2 % — ІІ групи (Рϕ > 0,05). Водночас гіперлімфоцитарна (кількість лімфоцитів у клітинному осаді мокротиння ≥ 11 %) запальна реакція ДШ удвічі частіше реєструвалася у хворих на БА фізичного навантаження (22,7 % дітей) порівняно з пацієнтами ІІ групи (10,5 %) (Рϕ > 0,05).
У хворих без наявності фенотипу БА фізичного навантаження втричі частіше (36,8 % випадків) відмічалася значна нейтрофільна запальна відповідь ДШ (відносний вміст нейтрофілів в індукованому мокротинні ≥ 69 %) порівняно з пацієнтами І клінічної групи (13,6 %) (Рϕ < 0,05). Водночас нейтрофільний варіант запальної реакції ДШ асоціювався з вираженішим пошкодженням слизової оболонки бронхів, що проявлялося збільшенням кількості (≥ 40 % циліндричних епітеліоцитів в індукованому мокротинні) злущеного епітелію в даної когорти хворих (68,4 %) порівняно з І групою (40,9 % дітей; Рϕ < 0,05).
На базе областной детской клинической больницы г. Черновцы у 41 школьника, которые страдают персистирующей бронхиальной астмой (БА), изучали характер воспаления дыхательных путей (ДП) с целью дифференцированного выбора противовоспалительной базисной терапии. Первую (І) клиническую группу сформировали 22 ребенка с фенотипом БА физической нагрузки, а оставшиеся 19 больных без наличия фенотипа БА физической нагрузки вошли во вторую (ІІ) клиническую группу. Цитологический анализ индуцированной мокроты проводился методом I.D. Pavord (1996 г.).
Больным БА физической нагрузки присуще гипогранулоцитарное воспаление ДП с преобладанием эозинофилопосредованной реакции, ассоциированной с гиперлимфоцитарной инфильтрацией бронхов. Так, бронхиальная эозинофилия (≥ 2 % эозинофилов в мокроте) зарегистрирована у 81,8 % школьников І группы и у 63,2 % — ІІ группы (Рϕ > 0,05). При этом гиперлимфоцитарная (количество лимфоцитов ≥ 11 % в клеточном осадке мокроты) воспалительная реакция ДП вдвое чаще регистрировалась у больных БА физической нагрузки (22,7 % детей) по сравнению с пациентами ІІ группы (10,5 %) (Рϕ > 0,05).
У больных без наличия фенотипа БА физической нагрузки втрое чаще (36,8 % случаев) отмечался значительный нейтрофильный воспалительный ответ ДП (относительное содержание нейтрофилов в индуцированной мокроте ≥ 69 %) по сравнению с пациентами І группы (13,6 %) (Рϕ < 0,05). При этом нейтрофильный вариант воспалительной реакции ДП ассоциировался со значительным повреждением слизистой оболочки бронхов, что проявлялось увеличением количества (≥ 40 % цилиндрических эпителиоцитов в индуцированной мокроте) слущенного эпителия у данной когорты больных (68,4 %) по сравнению с І группой (40,9 % детей; Рϕ < 0,05).
On the basis of Regional children’s clinical hospital of Chernivtsi, in 41 school-age children with persistent bronchial asthma (BA), the nature of airways inflammation has been studied with the aim of differential choice of anti-inflammatory basic therapy. The first (I) clinical group consisted of 22 children with exercise-induced BA phenotype, and the other 19 patients without a phenotype of exercise-induced BA were included in the second (II) clinical group. Cytological analysis of induced sputum was conducted by I.D. Pavord method (1996).
Patients with exercise-induced BA are characterized by hypogranulocytic inflammation of the airways, with a predominance of eosinophil-mediated reactions associated with hyperlymphocytic infiltration of the bronchi. So, bronchial eosinophilia (≥ 2 % of eosinophils in the sputum) was registered in 81.8 % of pupils in group I and in 63.2 % — in group II (Pϕ > 0.05). Meanwhile, hyperlymphocytic (number of lymphocytes in the cellular sediment of the sputum ≥ 11 %) inflammatory response of the airways was recorded twice as often in patients with exercise-induced BA (22.7 % of children) compared to group II patients (10.5 %) (Pϕ > 0.05).
In patients without exercise-induced BA phenotype, a significant neutrophilic inflammatory response of the airways (relative content of neutrophils in the induced sputum ≥ 69 %) was three times more likely (36.8 % of cases) in comparison with patients from the I clinical group (13.6 %) (Pϕ < 0.05). At the same time, the neutrophilic type of the airway inflammatory response was associated with a significant damage of the bronchial mucosa, which manifested by an increase in the number (≥ 40 % of the cylindrical epithelial cells in the induced sputum) of desquamated epithelium in this cohort of patients (68.4 %) compared to group I (40.9 % of children; Pϕ < 0.05).
бронхіальна астма фізичного навантаження, діти, індуковане мокротиння, запалення.
бронхиальная астма физической нагрузки, дети, индуцированная мокрота, воспаление.
exercise-induced bronchial asthma, children, induced sputum, inflammation.
Статтю опубліковано на с. 72-76
Бронхіальна астма (БА) належить до кола найбільш поширених хронічних захворювань у всіх вікових групах дітей. Упродовж останніх років рівень госпіталізації та смертності від БА у світі вірогідно зменшився, проте з’явилися та загострилися інші клінічні проблеми, однією з яких є висока частка неконтрольованої та частково контрольованої БА [2].
Матеріал і методи
Результати та їх обговорення
Висновки
1. Безруков Л.О. Порівняльний аналіз цитологічного складу мокротиння школярів, хворих на бронхіальну астму, при еозинофільному та нейтрофільному характері запалення дихальних шляхів / Л.О. Безруков, О.К. Колоскова, Є.П. Ортеменка // Здоровье ребенка. — 2012. — № 2(37). — С. 28-30.
2. Вибрані питання діагностики та лікування бронхіальної астми в дітей / За ред. проф. Безрукова Л.О., проф. Колоскової О.К. — Чернівці: Місто, 2011. — 248 с.
3. Airway inflammation and bronchial hyperreactivity in steroid naive children with intermittent and mild persistent asthma / M. Toyran, A.Bakirtas, F. Dogruman-Al et al. // Pediatric Pulmonology. — 2014. — Vol. 49, № 2. — Р. 140-147.
4. An Official American Thoracic Society Clinical Practice Guideline: Exercise-induced Bronchoconstriction / J.P. Parsons, T.S. Hallstrand, J.G. Mastronarde, D.A. Kaminsky, K.W. Rundell, J.H. Hull et al. // Am. J. Respir. Crit. Care Med. — 2013. — Vol. 187, Iss. 9. — P. 1016-1027.
5. Chipps B.E. Phenotypic expression of childhood weezing and asthma: implications for therapy / B.E. Chipps, L.B. Bacharier, J.M. Harder // J. Pediatrics. — 2011. — Vol. 158, № 6. — P. 878-884.
6. Cho J.Y. Recent advances in mechanisms and treatments of airway remodeling in asthma: a message from the bench side to the clinic / J.Y. Cho // Korean J. Intern. Med. — 2011. — Vol. 26(4). — P. 367-383.
7. Damera G. Does airway smooth muscle express an inflammatory phenotype in asthma? / G. Damera, R.A. Panettieri // Br. J. Pharmacol. — 2011. — Vol. 163(1). — P. 68-80.
8. Fixman E.D. Basic mechanisms of development of airway structural changes in asthma / E.D. Fixman, A. Stewart, J.G. Martin // Eur. Respir. J. — 2007. — Vol. 29. — P. 379-389.
9. Hallstrand T.S. New insights into pathogenesis of exercise-induced bronchoconstriction / T.S. Hallstrand // Curr. Opin. Allergy Clin. Immunol. — 2012. — Vol. 12, № 1. — P. 42-48.
10. Lopes W.A. Exercise-induced bronchospasm in obese and non-obese asthmatic adolescents / W.A. Lopes, N. Leite, N. Rosário // Rev. Paul. Pediatr. — 2010. — Vol. 28(1). — P. 36-40.
11. Mechanisms of Remodeling in Asthmatic Airways / A. Shifren, C. Witt, C. Christie, M. Castro // J. Allergy (Cairo). — 2012. — Vol. 2012. — P. e1-12.
12. Practice Parameter: Pathogenesis, prevalence, diagnosis, and management of exercise-induced bronchoconstriction: a practice parameter // Annals of allergy, asthma & immunology. — 2010. — 105. — S1-S47.
13. Sputum Eosinophils and the Response of Exercise-Induced Bronchoconstriction to Corticosteroid in Asthma / MyL. Duong, P. Subbarao, M.E. Adelroth, G. Obminski, T. Strinich, M. Inman, S. Pedersen, P.M. O’Byrne // Chest. — 2008. — Vol. 133. — P. 404-411.
14. Sputum induction in severe exacerbations of asthma: safety of a modified method / M.O. Vieira, E. Pizzichini, L.J. Steidle et al. // Eur. Respir. J. — 2011. — Vol. 38(4). — P. 979-980.
15. Zedan M. Clinical asthma phenotypes and therapeutic responses / M. Zedan, G. Attia, M.M. Zedan, A. Osman et al. // ISRN Pediatrics. — 2013. — P. 1-7.
16. Zedan M. Clinical asthma phenotyping: A trial for bridging gaps in asthma management / M.M. Zedan, W.N. Laimon, A.M. Osman, M.M. Zedan // World J. Clin. Pediatr. — 2015. — Vol. 4(2). — P. 13-18.
1. Bezrukov L.O. Porivnyal'nyy analiz tsytolohichnoho skladu mokrotynnya shkolyariv, khvorykh na bronkhial'nu astmu, pry eozynofil'nomu ta neytrofil'nomu kharakteri zapalennya dykhal'nykh shlyakhiv / L.O. Bezrukov, O.K. Koloskova, Ye.P. Ortemenka // Zdorov'e rebenka. – № 2(37). - 2012. – S. 28- 30. http://www.mif-ua.com/archive/article/27254
2. Vybrani pytannya diahnostyky ta likuvannya bronkhial'noyi astmy v ditey / za red. prof. Bezrukova L.O., prof. Koloskovoyi O.K. – Chernivtsi: «Misto», 2011. – 248 s.
3. Toyran M., Bakirtas A., Dogruman-Al F. et al. Airway inflammation and bronchial hyperreactivity in steroid naive children with intermittent and mild persistent asthma. Pediatric Pulmonology 2014; 49(2):140–147. doi: 10.1002/ppul.22810.
4. Parsons J.P., Hallstrand T.S., Mastronarde J.G., Kaminsky D.A., Rundell K.W., Hull J.H. et al. An Official American Thoracic Society Clinical Practice Guideline: Exercise-induced Bronchoconstriction. Am J Respir Crit Care Med 2013; 187(9):1016–1027. doi: 10.1164/rccm.201303-0437ST/
5. Chipps B.E., Bacharier L.B., Harder J.M. Phenotypic expression of childhood weezing and asthma: implications for therapy. J Pediatrics 2011; 158(6):878-884. doi: 10.1016/j.jpeds.2011.01.057.
6. Cho J.Y. Recent advances in mechanisms and treatments of airway remodeling in asthma: a message from the bench side to the clinic. Korean J Intern Med 2011; 26 (4):367-383. http://dx.doi.org/10.3904/kjim.2011.26.4.367
7. Damera G., Panettieri R.A. Does airway smooth muscle express an inflammatory phenotype in asthma? Br J Pharmacol 2011; 163 (1):68-80. DOI:10.1111/j.1476-5381.2010.01165.x
8. Fixman E.D., Stewart A., Martin J.G. Basic mechanisms of development of airway structural changes in asthma. Eur Respir J 2007;29: 379–389. doi: 10.1183/09031936.00053506
9. Hallstrand T.S. New insights into pathogenesis of exercise-induced bronchoconstriction. Curr Opin Allergy Clin Immunol 2012; 12(1):42–48. doi: 10.1097/ACI.0b013e32834ecc67.
10. Lopesa W.A., Leite N., Rosário N. Exercise-induced bronchospasm in obese and non-obese asthmatic adolescents. Rev Paul Pediatr 2010; 28(1):36-40. http://www.scielo.br/pdf/rpp/v28n1/en_v28n1a07.pdf
11. Shifren A., Witt C., Christie C., Castro M. Mechanisms of Remodeling in Asthmatic Airways. J Allergy (Cairo) 2012; Article ID 316049: e1-12. doi: 10.1155/2012/316049.
12. Practice Parameter: Pathogenesis, prevalence, diagnosis, and management of exercise-induced bronchoconstriction: a practice parameter / Annals of allergy, asthma & immunology 2010; 105: S1-S47. doi:10.1016/j.anai.2010.09.021
13. Duong MyL., Subbarao P., Adelroth M.E., Obminski G., Strinich T., Inman M., Pedersen S., O’Byrne P.M. Sputum Eosinophils and the Response of Exercise-Induced Bronchoconstriction to Corticosteroid in Asthma. Chest 2008; 133:404–411) DOI 10.1378/chest.07-2048
14. Vieira M.O., Pizzichini E., Steidle L.J. et al. Sputum induction in severe exacerbations of asthma: safety of a modified method. Eur Respir J 2011; 38 (4):979-980. doi: 10.1183/09031936.00029511.
15. Zedan M., Attia G., Zedan M.M., Osman A. et al. Clinical asthma phenotypes and therapeutic responses. ISRN Pediatrics 2013; 2013: e1-7. doi: 10.1155/2013/824781.
16. Zedan M., Laimon W.N., Osman A.M., Zedan M.M. Clinical asthma phenotyping: A trial for bridging gaps in asthma management. World J Clin Pediatr 2015; 4(2):13-18. doi: 10.5409/wjcp.v4.i2.13

/74.jpg)