Журнал «Здоровье ребенка» 2 (70) 2016
Вернуться к номеру
Особенности клеточного звена иммунного ответа школьников, больных бронхиальной астмой позднего начала, в зависимости от ацетиляторного полиморфизма
Авторы: Марусик У.И. - Высшее учебное заведение Украины «Буковинский государственный медицинский университет», г. Черновцы, Украина; Безрукова И.У. - Областная детская клиническая больница, г. Черновцы, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. Бронхіальна астма — одне з найбільш поширених захворювань у світі, кількість хворих на яке постійно збільшується, особливо серед дітей. Вважають, що неефективність контролюючої терапії астми, що відмічається практично в половини хворих, зумовлена, зокрема, наявністю різних астма-фенотипів. Мета дослідження: для оптимізації контролю астми пізнього початку оцінити окремі показники клітинної ланки імунної системи в школярів з урахуванням ацетиляторних фенотипів.
Матеріал та методи. У пульмонологічному відділенні Обласної дитячої клінічної лікарні м. Чернівців обстежені 72 школярі, хворі на астму пізнього початку (захворювання вперше проявлялось у віці понад 6 років). Залежно від перебігу захворювання дітей розподіляли на дві клінічні групи. До першої групи увійшли 34 пацієнти, в яких визначали повільний тип ацетилювання (середній відсоток ацетильованого сульфадимезину в сечі становив менше 75,0 %). Другу клінічну групу сформували 38 школярів, у яких відмічався швидкий тип ацетилювання (середній відсоток ацетильованого сульфадимезину в сечі становив більше 75,0 %). Усім дітям методом імунофлуоресценції з використанням наборів моноклональних антитіл визначали вміст Т-лімфоцитів, Т-хелперів, Т-кілерів/Т-супресорів та В-лімфоцитів крові.
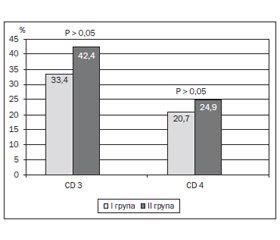
Результати. Ацетилювання повільного типу в дітей, хворих на астму пізнього початку, підвищувало ризик зниження рівня CD3 у периферичній крові практично втричі. У кожної другої дитини (54,1 ± 10,1 %) за наявності повільного характеру ацетилювання при фенотипі астми пізнього початку реєструвався знижений вміст CD8 (менше 18,0 Г/л), а в групі порівняння — тільки в 21,0 ± 9,3 % пацієнтів (Р < 0,05).
Висновки. У більшості пацієнтів із повільним ацетиляторним фенотипом перебіг бронхіальної астми пізнього початку асоціюється зі зниженням вмісту CD3, CD4, CD8 у периферичній крові та В-лімфоцитів, що опосередковано свідчить про вираженість хронічного запального алергічного процесу в даної когорти осіб та виснаженість організму.
Бронхиальная астма — одно из самых распространенных заболеваний в мире, количество больных которым постоянно увеличивается, особенно среди детей. Считают, что неэффективность контролирующей терапии астмы, которая отмечается практически у половины больных, обусловлена, в частности, наличием различных астма-фенотипов. Цель исследования: для оптимизации контроля астмы позднего начала оценить отдельные показатели клеточного звена иммунной системы у школьников с учетом ацетиляторных фенотипов.
Материал и методы. В пульмонологическом отделении Областной детской клинической больницы г. Черновцов обследованы 72 школьника, больных астмой позднего начала (заболевание впервые проявлялось в возрасте старше 6 лет). В зависимости от течения заболевания детей распределяли в две клинические группы. В первую группу вошли 34 пациента, у которых определяли медленный тип ацетилирования (средний процент ацетилированного сульфадимезина в моче составлял менее 75,0 %). Вторую клиническую группу сформировали 38 школьников, у которых отмечался быстрый тип ацетилирования (средний процент ацетилированного сульфадимезина в моче составлял более 75,0 %). Всем детям методом иммунофлуоресценции с использованием наборов моноклональных антител определяли содержание Т-лимфоцитов, Т-хелперов, Т-киллеров/Т-супрессоров и В-лимфоцитов крови.
Результаты. Ацетилирование медленного типа у детей, больных бронхиальной астмой позднего начала, повышало риск снижения уровня CD3 в периферической крови практически втрое. У каждого второго ребенка (54,1 ± 10,1 %) при наличии медленного характера ацетилирования при фенотипе астмы позднего начала регистрировалось сниженное содержание CD8 (менее 18,0 г/л), а в группе сравнения — только у 21,0 ± 9,3 % пациентов (Р < 0,05).
Заключение. У большинства пациентов с медленным ацетиляторным фенотипом течение бронхиальной астмы позднего начала ассоциируется со снижением содержания CD3, CD4, CD8 в периферической крови и В-лимфоцитов, что косвенно свидетельствует о выраженности хронического воспалительного аллергического процесса в данной когорте лиц и истощении организма.
Background. Bronchial asthma is one of the most common diseases in the world, the number of patients with this disease is increasing, especially among children. They believe that the inefficiency of controlling asthma therapy, which is observed in almost half of patients, is due particularly to the presence of different asthma-phenotypes.
Objective. To evaluate some indicators of cellular parts of the immune system in schoolchildren, considering acetylation phenotypes in order to optimize asthma control late-onset asthma.
Materials and methods. In pulmonology unit of Chernivtsi Regional Child Clinical Hospital there were examined 72 schoolchildren with late-onset asthma (disease first manifested at the age of 6 years old). By the course of the disease children were divided into two clinical groups. The first group included 34 patients with slow type of acetylation (mean percentage of acetylated sulfadimidine in urine was less than 75.0 %). The second clinical group was formed by 38 students with fast type of acetylation (mean percentage of acetylated sulfadimedin in urine was more than 75.0 %).
Blood T-lymphocytes, T-helper cells and T killer/suppressor and B-lymphocytes were tested in all children by immunofluorescent assay method using a set of monoclonal antibodies.
Results. The slow type of acetylation in children with late-onset asthma almost triple increased risk of CD3 decline in peripheral blood. Every second child (54.1 ± 10.1 %) with the slow type of acetylation and late-onset asthma had reduced CD8 level (less than 18.0 g/l), while in the comparison group only 21.0 ± 9.3 % of patients had decreased concentration (P < 0.05).
Conclusion. In the most patients with slow type of acetylation course of late-onset asthma was associated with a decrease in CD3, CD4, CD8 levels in peripheral blood and B-lymphocytes, that indirectly indicates the severity of chronic inflammatory allergic process in this cohort of persons and the exhaustion of the body.
бронхіальна астма, діти, ацетилювання, фенотипи, Т-лімфоцити, В-лімфоцити.
бронхиальная астма, дети, ацетилирование, фенотипы, Т-лимфоциты, В-лимфоциты.
bronchial asthma, children, acetylation, phenotypes, T-lymphocytes, B-lymphocytes.
Статья опубликована на с. 79-82
Вступ
Матеріали та методи
Результати
/80.jpg)
Обговорення
Висновки
1. Гнатейко О.З. Деякі аспекти проблеми ранньої діагностики бронхіальної астми в дітей / О.З. Гнатейко, О.М. Садова // Здоровье ребенка. — 2009. — № 5(20). — С. 34-38.
2. Костроміна В.П. Фактори ризику астми у дітей / В.П. Костроміна, О.О. Речкіна, К.О. Мельник // Астма та алергія. — 2013. — № 2. — С. 21-24.
3. Лапшин В.Ф. Астма-фенотипы в детском возрасте / В.Ф. Лапшин, Т.Р. Уманец // Здоров’я України. — 2009. — № 4/1. — С. 12-14.
4. Поліморфізм ксенобіотиків метаболізму генів глутанін S-трансферази (GSTT1, GSTM1) та цитохрому P450 (CYP2E1 і CYP2C19) в пацієнтів з атопічною бронхіальною астмою / Е.Ю. Брагіна, М.Б. Фреідін, І.А. Тен та ін. // Бюлетень Сибірського відділення Російської Академії медичних наук. — 2005. — № 13. — С. 121-125.
5. Уманець Т.Р. Клініко-анамнестичні особливості фенотипів бронхіальної астми у дітей / Т.Р. Уманець // Перинатология и педиатрия — 2011 — № 2(46). — С. 69-71.
6. Association between the N-acetylation genetic polymorphism and bronchial asthma / M. Nacak, A.S. Aynacioglu, A. Filiz at al. // Br. J. Clin. Oharmacol. — 2002. — V. 54(6). — P. 671-674. — doi: 10.1046/j.1365-2125.2002.01670.x.
7. Asthma endotypes: A new approach to classification of disease entities within the asthma syndrome / J. Lotvall, C.A. Akdis, L.B. Bacharier et al. // J. Allergy Сlin. immunol. — 2011. — V. 127, № 2. — P. 355-360. — doi: http://dx.doi.org/10.1016/j.jaci.2010.11.037.
8. Barta J. N-Acetyltransferases as markers for asthma and allergic / J. Barta, B. Ghosh // Atopic disorders current drug metabolism. — 2008. — V. 9, № 6. — Р. 546-553.
9. Green R.H. Stability of inflammatory phenotypes in asthma / R.H. Green, I. Pavord // Thorax. — 2012. — № 67. — Р. 665-667. — doi:10.1136/thoraxjnl-2012-201657.
10. Kim H.Y. The many paths to asthma: phenotype shaped by innate and adaptive immunity / H.Y. Kim, R.H. DeKruyff, D.T. Umetsu // Nat. Immunol. — 2010. — V. 11(7). — P. 577-584. — doi: 10.1038/ni.1892.
11. Limited Short-term Steroid Responsiveness Is Associated With Thickening of Bronchial Basement Membrane in Severe Asthma / A. Bourdin, S. Kleis, M. Chakra et al. // Chest. — 2012. — № 141(6). — P. 1504-1511. — doi:10.1378/chest.11-0232.
12. Local and systemic immunological parameters assjciated with remission of asthma symptoms in children / S. Waserman, P. Nair, D. Snider at al. // Allergy, asthma and clinical immunology. — 2012. — V. 8, Is. 16. — P. 1-14.
13. Mechanisms of peripheral tolerance to allergens / O.U. Soyer, M. Akdis, J. Ring at al. // Allergy. — 2013. — № 68. — P. 161-170. — doi: 10.1111/all.12085
14. The Heterogeneity of asthma phenotypes in children and young aduits / B. Hesselmar, A.-C. Enelund, B. Eriksson at al. // The Journal of Allergy and Clinical Immunology. — 2012. — Article ID 163089. — P. 6.
15. World Health Organization. Bronchial asthma. Fact Sheet NE 307. — Geneva: World Health Organization, 2008.
16. Yang I.V. Epigenetics and prenatal influences on asthma and allergic airway disease / I.V. Yang // Breath. — 2014. — V. 10, № 1. — P. 25-31.
1. Gnatejko OZ, Sadova O.M. [Some aspects of early diagnosis of asthma in children]. Zdorove rebenka. 2009; 5(20):34–38. Ukrainian.
2. Kostromina VP, Rechkina OO, Mel`ny`k KO [Risk factor for asthma in children]. Astma ta alergiya 2013; 2:21–24. Ukrainian.
3. Lapshy`n VF, Umanecz TR. [Asthma phenotypes in childhood]. Zdorove Ukrayiny`. 2009; 4(1):12–14. Ukrainian.
4. Bragina EYu, Freidin MB, Ten IA, Ogorodova LM [Polymorphism of xenobiotic metabolism genes of the glutathione S-transferase (GSTT1, GSTM1) and cytochrome P450 (CYP2E1 and CYP2C19) in patients with atopic bronchial asthma]. Byulleten’ Sibirskogo Otdeleniya Rossiyskoy Akademii Meditsinskikh Nauk. 2005;13:121–125. Russian.
5. Umanecz` TR [Clinical and medical history features phenotypes of asthma in children]. Pery`natology`iya i pediatriya. 2011;2(46):69-71. Ukrainian.
6. Nacak M, Aynacioglu AS, Filiz A [Association between the N-acetylation genetic polymorphism and bronchial asthma]. Br. J. Clin. Oharmacol. 2002;54(6):671-674. doi: 10.1046/j.1365-2125.2002.01670.x
7. Lotvall J, Akdis CA, Bacharier LB [Asthma endotypes: A new approach to classification of disease entities within the asthma syndrome]. J Allergy clin immunol. 2011;127(2):355-360. DOI: http://dx.doi.org/10.1016/j.jaci.2010.11.037
8. Barta J, Ghosh B [N-Acetyltransferases as markers for asthma and allergic]. Atopic disorders current drug metabolism. 2008;9(6):546-553.
9. Green RH [Stability of inflammatory phenotypes in asthma]. Thorax. 2012; 67:665-667. doi:10.1136/thoraxjnl-2012-201657
10. Kim HY, DeKruyff RH, Umetsu DT [The many paths to asthma: phenotype shaped by innate and adaptive immunity]. Nat. Immunol 2010;11(7):577-584. doi: 10.1038/ni.1892
11. Bourdin A, Kleis S, Chakra M [Limited Short-term Steroid Responsiveness Is Associated With Thickening of Bronchial Basement Membrane in Severe Asthma]. Chest. 2012;141(6):1504–1511. doi:10.1378/chest.11-0232
12. Waserman S, Nair P, Snider D [Local and systemic immunological parameters assjciated with remission of asthma symptoms in children]. Allergy, asthma and clinical immunology. 2012;8(16):1-14.
13. Soyer OU, Akdis M, Ring J [Mechanisms of peripheral tolerance to allergens]. Allergy. 2013;68:161-170. DOI: 10.1111/all.12085
14. Hesselmar B, Enelund AC, Eriksson B [The Heterogeneity of asthma phenotypes in children and young aduits]. The Journal of Allergy and Clinical Immunology. 2012; 6. Article ID 163089.
15. World Health Organization. Bronchial asthma. Fact Sheet NE 307. – Geneva: World Health Organization, 2008.
16. Yang IV [Epigenetics and prenatal influences on asthma and allergic airway disease]. Breath. 2014;10(1):25-31.