Статтю опубліковано на с. 55-59
Вступ
Резекція печінки — складна проблема хірургії з огляду на багато факторів: високу травматичність, часті ускладнення й летальність, обумовлені великою крововтратою, жовчотечою, печінковою недостатністю, формуванням жовчних нориць, абсцесів. Післяопераційні ускладнення й летальність становлять до 50 і 30 % відповідно за даними різних авторів [5, 9, 11].
Ведеться інтенсивний пошук нових способів вирішення даної проблеми: від розробки та вдосконалення методів резекції печінки до використання ряду сучасних технологій, що забезпечують надійний гемо-, біліостаз.
Незважаючи на досягнуті успіхи в техніці поділу паренхіми печінки, обробки судинно-секреторних ніжок, печінкових вен, поверхні кукси печінки, післяопераційні ускладнення після резекцій печінки діагностують у 21–65,5 % [3, 7, 10] випадків, а летальність коливається від 0,4 до 32 % [1, 6, 8].
Сьогодні біліарні ускладнення нерідко посідають перше місце в структурі хірургічних ускладнень, вони пов’язані з підвищеною частотою розвитку інфекції, печінкової недостатності й летального результату, подовжують терміни госпіталізації та відновлення пацієнтів [3, 5, 9].
Частим ускладненням резекції печінки, особливо великої, залишається жовчотеча. Незважаючи на помітне зниження частоти легеневих, інфекційних, геморагічних ускладнень і навіть печінкової недостатності [4, 9, 10], частота біліарних ускладнень після резекції печінки в останні роки практично не змінилася й становить 3–30 % [6].
Вважається, що причинами жовчотечі є: нерозпізнані та некліповані жовчні протоки на поверхні зрізу, пошкоджені під час дисекції паренхіми великі протоки у воротах печінки, спазм сфінктера Одді з подальшим збільшенням внутрішньопротокового тиску [2, 5], відторгнення некротизованих тканин з поверхні зрізу, порушення кровообігу жовчних проток при виконанні лімфодисекції [7].
Діагностика жовчотечі не викликає труднощів, коли жовч виділяється по дренажу або через рану. Припущення про жовчотечу може виникнути в разі виявлення при ультразвуковому дослідженні (УЗД) або комп’ютерній томографії (КТ) рідинних скупчень у черевній порожнині. Пункції та дренування, що виконуються під контролем УЗД або КТ, дозволяють встановити діагноз, якщо у виділеннях виявлена домішка жовчі [2, 9].
Холангіографія є найбільш інформативним методом, що дозволяє встановити факт жовчотечі й локалізацію ушкодження. В інших випадках холангіографія може бути виконана ретроградно (ендоскопічна ретроградна холангіопанкреатографія (ЕРХПГ)) або антеградно (черезшкірна черезпечінкова холангіографія). ЕРХПГ дозволяє доповнити діагностичне втручання лікувальною маніпуляцією (ендоскопічна папілосфінктеротомія, стентування, назобіліарне дренування). Ускладнення після ЕРХПГ є рідкісними (4–5 %), однак вони можуть бути досить тяжкими [11].
Магнітно-резонансна холангіографія дозволяє також виявляти жовчотечу, що виходить з протоки, не пов’язаної з основним біліарним трактом. Однак дослідження досить дороге, і його не можна доповнити лікувальним втручанням. У ряді випадків діагностика причин та локалізації жовчотеч становить для хірурга складне та важко вирішуване завдання. Головною причиною несприятливих результатів післяопераційної жовчотечі (ПЖ) є несвоєчасна її діагностика та корекція через відсутність чіткої клінічної картини захворювання та високоінформативних методів діагностики.
Матеріал і методи
Подано результати обстеження та лікування 165 пацієнтів з об’ємними утвореннями печінки на базі відділень ДУ «Інститут загальної та невідкладної хірургії ім. В.Т. Зайцева НАМНУ». Чоловіків було 106, жінок — 59. Вік — від 30 до 74 років. Пацієнти були розподілені на 2 групи: основну та групу порівняння. До групи порівняння увійшли 82 хворі з об’ємними утвореннями печінки, у яких були використані традиційні методи діагностики та хірургічного лікування. В основну групу увійшли 83 хворі з об’ємними утвореннями печінки, у яких застосовувалися оригінальні резекційні методи лікування з урахуванням ангіоархітектоніки та біліарної анатомії. Найбільш часто як в основній групі, так і в групі порівняння зустрічався метастатичний рак печінки — 32,5 і 35,4 % відповідно. Гемангіоми печінки стали причиною виконання резекцій у 19,3 % випадків у основній групі та в 18,3 % — у групі порівняння. Гепатоцелюлярний рак посів третє місце в основній патології досліджуваних груп, становлячи 14,4 % серед пацієнтів основної групи та 15,8 % — у групі порівняння. Паразитарні кісти печінки в 10,8 % випадків стали показанням для виконання резекції печінки в основній групі та в 13,4 % — у групі порівняння. У поодиноких випадках зустрічалися фібронодулярна гіперплазія, травматичне ураження, лімфосаркома та гепатоцелюлярна аденома.
Усього було виконано 165 резекцій печінки з приводу різних об’ємних утворень печінки. Обсяг операцій відрізнявся великою різноманітністю, проте в цілому серед них можна виділити 2 головних типи — економні та великі резекції. У групу економних резекцій ми включили сегментектомію, бісегментектомію, трисегментектомію, а також неанатомічні резекції печінки. До групи великої резекції віднесли операції з видаленням чотирьох та більше сегментів печінки. У цілому було виконано 32 (38,6 %) великі резекції печінки в основній групі та 29 (35,4%) — у групі порівняння. Економні резекції печінки становили 69,1 % в основній групі та 71,1 % — у групі порівняння. Неанатомічні резекції печінки виконані в досить великої частки пацієнтів як основної групи (28,2 %), так і групи порівняння (31,1 %).
Результати та обговорення
Клінічна картина післяопераційної жовчотечі в 68 (41,2 %) спостереженнях з обох груп дослідження була яскраво виражена, і в її основі було масивне надходження жовчі назовні по контрольних дренажах, у 51 випадку (30,9 %) визначали внутрішньочеревну жовчотечу та в 23 (13,9 %) жовчотеча була зовнішньо-внутрішною.
При наявності післяопераційної внутрішньоочеревинної жовчотечі в 54 хворих із 68 відзначали болі в черевній порожнині різної інтенсивності. При огляді звертала на себе увагу виражена блідість, сухість шкірних покривів, легка ейфорія, що швидко змінювалася глибокої апатією. Ці явища були пов’язані з рясною жовчотечою (від 500 мл та більше на добу). При пальпації в 82 % спостережень визначалася помірна болючість у правому підребер’ї та в проекції клубової ділянки. Болі в 52 % спостережень мали розлитий характер і тенденцію до поширення, особливо при жовчотечі з магістральних жовчних проток, й у 18 % випадків супроводжувалися появою захисного напруження. У 21 % спостережень ПЖ проявлялася втратою апетиту, а в 12 % — нудотою та блюванням.
Кардинальним симптомом ПЖ, як уже зазначено, було виділення жовчі через встановлені дренажі (n = 91). У 58 % хворих ПЖ починали спостерігатися в перші години після операції, в 42 % випадків відзначено пізній розвиток жовчотечі, що переважно спостерігали після оперативних втручань на печінці, їх джерелами були внутрішньопечінкові жовчні протоки (ВЖП) (цистобіліарні нориці), і навпаки, ранні ПЖ в переважній більшості випадків розвинулися після оперативних втручань на печінці з жовчовивідними шляхами, їх джерелом були магістральні жовчні протоки, ходи Люшка та неспроможність швів біліодигестивних анастомозів.
Тривала відсутність жовчі у дванадцятипалій кишці в подальшому призводить до порушення ферментативних процесів у травній системі, транслокації бактерій та розвитку септичних станів (табл. 1).
Тяжкість клінічного перебігу ПЖ насамперед залежала від темпу, кількості жовчотечі, а також від її тривалості. При тривалих та великих ПЖ у 18 % спостережень відзначали у хворих явища ахолії, що вимагало очищення втраченої жовчі та зворотне її введення в просвіт дванадцятипалої кишки по назогастродуоденальному зонду.
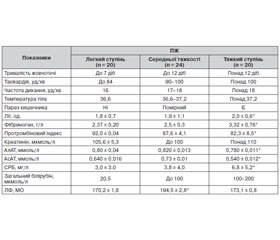
Показники ендогенної інтоксикації різного ступеня були виявлені в пацієнтів із середнім та тяжким ступенем жовчотечі (ЛІІ — 1,9 ± 1,1 од., СРБ — 3,8 ± 4,0 мг/л та ЛІІ — 2,0 ± 0,6 од., СРБ — 6,8 ± 5,2 мг/л відповідно). Вірогідне збільшення показників ендогенної інтоксикації при ПЖ збігалося в часі з першими клінічними проявами синдрому ахолії.
Паралельно у хворих з ПЖ тяжкого ступеня реєструвалося більш значне, ніж у хворих із ПЖ середньої тяжкості, підвищення активності АлАТ (0,820 ± 0,013 ммоль/л) та АсАТ (0,73 ± 0,01 ммоль/л) у сироватці крові. Це свідчило про компенсаторне збільшення метаболічної активності гепатоцитів за рахунок активації клітин непошкоджених зон ацинуса. У 5 % спостережень відзначали підвищення рівня ЛФ (194,5 ± 2,8 МО), що вказувало на порушення жовчовідтоку та холестазу.
У 12 спостереженнях проводили дослідження рівня СРБ сироватки крові, що в сукупності відбивав ступінь вираженості запально-інфекційного та деструктивного процесу в черевній порожнині при ПЖ.
Отже, клініко-лабораторно-біохімічні зміни відображають наслідки ПЖ, особливо вони інформативні при тяжкому ступені вираженості ПЖ.
Комплексне рентгенологічне дослідження органів грудної та черевної порожнини проведено 57 пацієнтам із ПЖ (34,5 %). Винятком є випадки, коли були безперечні ознаки зовнішньої жовчотечі, по дренажах визначалося відходження жовчі.
У процесі рентгенологічного дослідження були виявлені ряд ознак, що дозволили запідозрити наявність ПЖ. Так, при наявності білом у піддіафрагмальному просторі у 2 хворих із внутрішньочеревною ПЖ діагностували високе стояння правого купола діафрагми. Крім цього, при скупченні жовчі в підпечінковому просторі, а також при її затримці в залишкових порожнинах у 6 спостереженнях рентгенологічно визначали кілька газовмісних порожнин.
Слід зазначити, що комплексне рентгенологічне дослідження грудної та черевної порожнин при ПЖ допомогло лише виявити ряд симптомів, характерних для ПЖ. З огляду на недостатню інформативність рентгенологічного дослідження з метою більш тонкої та ранньої діагностики ПЖ, оцінки її тяжкості знадобилися застосування інших методів променевої діагностики.
Ультразвукове дослідження та магнітно-резонансна панкреатохолангіографія при післяопераційній жовчотечі є високоінформативними методами діагностики.
Основними симптомами «внутрішньочеревного неблагополуччя», що виявляються при УЗД у хворих з внутрішньочеревною жовчотечою, були:
— наявність вільної рідини (жовчі) в підпечінковому просторі;
— наявність вільної рідини в інших відділах черевної порожнини, насамперед по правому латеральному каналу, в малому тазу та між петлями кишечника;
— характер вільної рідини (жовч);
— можлива наявність дилатації тонкої кишки понад 3 см з іншими ознаками порушення пасажу по кишковому тракту (потовщення стінки, візуалізація кишкових складок, характер перистальтики);
— розширення діаметра гепатикохоледоха та внутрішньопечінкових проток;
— наявність включень (конкременти, газ) у просвіті жовчних протоків.
При ПЖ у 60 пацієнтів (36,4 %) на ультразвукових сканограмах визначали наявність вільної рідини, при цьому у 23 хворих вона розташовувалася навколо печінки та в малому тазу, у 19 — у піддіафрагмальних ділянках, каналах та міжкишкових проміжках.
При недостатній інформативності УЗД та при клінічній підозрі на наявність формування абсцесів у ранньому післяопераційному періоді в 24 спостереженнях вдавалися до КТ. При проведенні КТ виявляли наявність скупчення жовчі навколо печінки, рідину та газ у просвіті тонкої кишки, а також наявність гнійників розміром від 2 до 14 см у паренхімі печінки. У даний час як можлива альтернатива рентгенконтрастним дослідженням у діагностиці причин та джерела ПЖ у клінічній практиці ефективно використовується магнітно-резонансна томографія (МРТ) та МР холангіографія.
МРТ виконана 15 пацієнтам із ПЖ. Для візуалізації органів черевної порожнини необхідно було отримання T1 та Т2 типів зображень (Т1ВІ та Т2ВІ) з використанням циркулярно-поляризованої поверхневої котушки Body Array Сoil.
Для підтвердження наявності вільної рідини (випоту, жовчі), а також для проведення МР холангіопанкреатографії (ХПГ) використовували МР гідрографію (Т2ВІ). Для уточнення рівня ушкодження та рубцевої стриктури у всіх випадках ефективно був діагностований рівень пошкодження та протяжність стриктури за рахунок чіткої візуалізації проксимального й дистального відділів ВЖП.
Отже, на сьогодні УЗД та МРТ з ХПГ є високоінформативними методами діагностики ПЖ та їх причини. Проте не завжди УЗД можуть дати остаточну відповідь щодо наявності чи відсутності внутрішньочеревного ускладнення, а також локалізації та причини ПЖ. Крім цього, виникає необхідність при визначенні тактики лікування хворого приймати швидке рішення, у цих ситуаціях найбільш ефективним і високоінформативним методом дослідження є сучасні медичні технології. У даний час немає жодного сумніву в тому, що найбільш об’єктивним і вірогідним методом діагностики причин локалізації та джерела ПЖ, що дозволяє ефективно вибрати найбільш оптимальний метод лікування, є ЕРПХГ.
Перед виконанням ЕРХПГ пацієнту з ПЖ, як правило, проводили фіброгастродуоденоскопію (ФГДС). Для визначення рівня локалізації великого дуоденального сосочка (ВДС), а також діагностики супутніх захворювань, зокрема дисфункції сфінктера Одді (ДСО) як однієї з причин післяопераційної транзиторної біліарної гіпертензії та можливої ПЖ, у 57 спостереженнях хворим із ПЖ проводили фіброгастродуоденоскопію з подальшим проведенням ЕРПХГ. При цьому використовували дуоденоскоп з боковою оптикою. Перед проведенням ЕРХПГ проводили канюляцію ВДС, після чого проводили ЕРХПГ. При цьому у 24 спостереженнях (14,5 %) діагностували ендоскопічні ознаки дисфункції сфінктера Одді.
Важливою перевагою ЕРПХГ при ПЖ є те, що вона дозволяє визначити місце, характер та джерело ПЖ, а в ряді випадків і провести лікувальну маніпуляцію. Так, при наявності ПЖ, обумовленої травматичним пошкодженням, спостерігали виходження катетера за межі жовчовивідної системи.
ЕРПХГ, будучи високоінформативним методом діагностики ПЖ та їх причин, нерідко супроводжувалася ускладненнями. Так, у 2 спостереженнях встановили наявність панкреатиту, в одному мала місце кровотеча. В усіх ситуаціях комплексна консервативна терапія виявилася ефективною.
Відеолапароскопія на сьогодні є одним з провідних методів діагностики та лікування внутрішньочеревної жовчотечі. Відеолапароскопія виконана 59 хворим із ПЖ, у процесі проведення були виявлені такі ознаки ПЖ:
— наявність жовчі в підпечінковому просторі та в черевній порожнині, що розташовувалася і в інших відділах — по правому латеральному каналу, в малому тазу, у піддіафрагмальних просторах, між петлями кишечника;
— наявність ознак інфікування жовчі та розвиток перитоніту — мутна жовч, поява фібринових накладень на парієтальній та вісцеральній очеревині, гнійний характер випоту, дилатація тонкої кишки понад 3 см.
При відеолапароскопії у всіх 59 спостереженнях успішно була діагностована ПЖ, її джерело та причини. Під час проведення відеолапароскопії діагностували наявність витоку жовчі з жовчних проток у 13 спостереженнях. У 17 випадках жовчотеча була з кукси печінки та залишкової порожнини після ехінококектомії з печінки (n = 9). При цьому жовч накопичувалася в підпечінковому просторі або в над- і підпечінковому просторі.
Після виконання оперативних втручань у гепатобіліарній зоні внаслідок порушення іннервації великого дуоденального сосочка виникає дисфункція сфінктера Одді, що в ранньому післяопераційному періоді проявляється за біліарним та панкреатичним типом. Клінічним проявом є різного ступеня вираженості жовчотечі через встановлені дренажі, а також підвищення рівня ферментів (АлАТ, АсАТ) та больові відчуття.
ДСО сприяє порушенню відтоку жовчі в дистальні відділи, що проявляється помірним розширенням, а в ряді випадків і значним розширенням загальної жовчної протоки (ЗЖП), що в подальшому сприяє підвищенню тиску в просвіті жовчних проток та виникненню жовчотечі.
Найбільш інформативним методом діагностики ДСО як причини жовчотечі є УЗД, яке дозволяє виявити різного ступеня вираженості дилатацію загальної жовчної протоки в післяопераційному періоді. Розширення загальної жовчної протоки більше від 12 мм та головної панкреатичної протоки — понад 5 мм вважали об’єктивним УЗД-критерієм ДСО.
Ендоскопічними ознаками дисфункції сфінктера Одді були: 1) добре обумовлена або напружена поздовжня складка (інтрамуральна частина загальної жовчної протоки), іноді з’являється при розправленні дванадцятипалої кишки; 2) відсутність запальних змін у ВДС; 3) відсутність рубцевої тканини в ділянці великого сосочка дванадцятипалої кишки (ВС ДПК); 4) наявність жовчі в ДПК за відсутності видимого та регулярного надходження її на перистальтичній хвилі; 5) відносно рідко — санториноцеле; 6) можливість канюляції ВС ДПК стандартним катетером для ЕРПХГ та більш тривалий інтервал «провалу» катетера при просуванні в ЗЖП; 7) відносно рідко — біль при введенні контрастної речовини в ЗЖП; 8) збереження не менше від 50 % контрастної речовини в ЗЖП через 10–15 хв від моменту введення; 9) поява напруження поздовжньої складки при введенні контрастної речовини (при попередній нормальній картині); 10) відсутність розширення або рівномірне розширення жовчовивідних шляхів.
При проведенні ФГДС із ЕРПХГ в 58 спостереженнях після введення контрастної речовини в жовчні протоки виявляли появу напруження поздовжньої складки та відсутність розширення (n = 5) або рівномірного розширення (n = 3) жовчовивідних шляхів.
На підставі результатів ФГДС та УЗД в подальшому для визначення та отримання інформації про причину ПЖ, рівень та залученні калібру жовчної протоки виконували ЕРПХГ 24 пацієнтам. У 8 спостереженнях діагностували наявність ПЖ, обумовленої транзиторною біліарною гіпертензією внаслідок дисфункції сфінктера Одді, а в 4 спостереженнях будь-яких патологічних змін не виявляли.
Висновки
1. Проведене комплексне дослідження при ПЖ показало, що найбільш високоінформативним методом ранньої діагностики ПЖ, її джерела та причини є відеолапароскопія, УЗД, а також МРПХГ. Окреме місце відводиться діагностиці транзиторної біліарної гіпертензії, обумовленої дисфункцією сфінктера Одді та пострезекційною гіпертензією.
2. Для визначення предикторів розвитку біліарних ускладнень також провели однофакторний аналіз за 17 перед- і інтраопераційними факторами між групою хворих з біліарними ускладненнями та пацієнтами з благополучним перебігом післяопераційного періоду.
3. За результатами дослідження виявлено статистично вірогідний предиктор розвитку біліарних ускладнень — правосторонні великі резекції печінки, при яких слід проводити профілактику їх розвитку з урахуванням ангіоархітектоніки гепатобіліарної системи та варіантів будови жовчних шляхів печінки.

/57.jpg)