Резюме
Вступ. Причинами виникнення пролежневих трофічних виразок є ішемія та нейротрофічні зміни тканин, викликані їх тривалою хронічною компресією, постійним патологічним зволоженням та зсувом тканин, що детермінує виникнення локальної ішемії. Мета роботи: дослідити клінічні варіанти та гнійні ускладнення пролежнів у хворих на цукровий діабет (ЦД) 2-го типу з позицій наявності інсулінорезистентності (ІР) у контексті оптимізації комплексного лікування. Матеріали і методи. Загальну вибірку ретро- та проспективного аналізу становили результати комплексного лікування 112 пацієнтів. Наявність ЦД 2-го типу пiдтверджено в 37 пацієнтів, 27 пацієнтів iз пролежнями без ускладнень (І–ІІІ стадії) та ЦД становили І групу порівняння, iз пролежнями IV стадії — ІІ групу порівняння, інші 75 осiб — групу контролю. Результати. У хворих на ЦД 2-го типу (І група порівняння) спостерігалося вірогідно значуще зменшення НОМА-індексу функції β-клітин та збільшення НОМА-індексу ІР (8,31 ± 0,02, р < 0,01). У хворих на ЦД 2-го типу з наявністю ускладнених пролежнів (ІІ група порівняння) зареєстровано більш значне підвищення показників циркулюючого інсуліну (p2 < 0,01), НОМА-індексу ІР (p2 < 0,05) та значне зменшення НОМА-індексу функції β-клітин (р < 0,05). При проведенні кореляційного аналізу показникiв НОМА-ІР та концентрації елементів у крові кореляційний зв’язок був встановлений тільки у хворих на ЦД 2-го типу (І та ІІ групи порівняння): між показником НОМА-ІР та вмістом Mg2+ в еритроцитах виявлено негативний сильний кореляційний зв’язок (r = –0,72; Р < 0,01), між НОМА-ІР та концентрацією Zn2+ у сироватці крові — негативний зв’язок середньої сили (r = –0,66; p < 0,01) та між НОМА-ІР й рівнем Cr3+ у сироватці крові — негативний кореляційний (r = –0,69; p < 0,01). Висновки. Перевагою запропонованої класифікації пролежнів м’яких тканин та послідовності комплексного лікування є врахування особливостей патогенезу, морфогенезу та клінічного перебігу пролежнів з ускладненнями, які мають вплив на перебіг загоєння та потребують адекватних стратегій лікування гнійних ран — TIME і DOMINATE, що, на нашу думку, детермінує можливість впровадження в клінічну практику відділень паліативної допомоги, інших стаціонарних та амбулаторних закладів охорони здоров’я.
Введение. Причинами возникновения пролежневых трофических язв является ишемия и нейротрофические изменения тканей, вызванные их длительной хронической компрессией, постоянным патологическим увлажнением и смещением тканей, что детерминирует возникновение локальной ишемии. Цель работы: исследовать клинические варианты и гнойные осложнения пролежней у больных сахарным диабетом (СД) 2-го типа с позиций наличия инсулинорезистентности (ИР) в контексте оптимизации комплексного лечения. Материалы и методы. Общую выборку ретро- и проспективного анализа составляли результаты комплексного лечения 112 пациентов. Наличие СД 2-го типа подтверждено у 37 пациентов, 27 пациентов с пролежнями без осложнений (I–III стадии) и СД составляли І группу сравнения, с пролежнями IV стадии — II группу сравнения, остальные 75 человек — группу контроля. Результаты. У больных СД 2-го типа (I группа сравнения) наблюдалось достоверно значимое уменьшение НОМА-индекса функции β-клеток и увеличение НОМА-индекса ИР (8,31 ± 0,02, р < 0,01). У больных СД 2-го типа с наличием осложненных пролежней (II группа сравнения) констатировали более значительное повышение показателей циркулирующего инсулина (р2 < 0,01), НОМА-индекса ИР (p2 < 0,05) и значительное уменьшение НОМА-индекса функции β-клеток (р < 0,05). При проведении корреляционного анализа показателей НОМА-ИР и концентрации элементов в крови корреляционная связь была установлена только у больных СД 2-го типа (I и II группы сравнения): между показателем НОМА-ИР и содержанием Mg2+ в эритроцитах выявлена отрицательная сильная корреляционная связь (r = –0,72; р < 0,01), между НОМА-ИР и концентрацией Zn2+ в сыворотке крови — отрицательная связь средней силы (r = –0,66; р < 0,01) и между НОМА-ИР и уровнем Cr3+ в сыворотке крови — отрицательная корреляционная (r = –0,69; p < 0,01). Выводы. Преимуществом предложенной классификации пролежней мягких тканей и последовательности комплексного лечения является учет особенностей патогенеза, морфогенеза и клинического течения пролежней с осложнениями, которые влияют на течение заживления и требуют адекватных стратегий лечения гнойных ран — TIME и DOMINATE, что, по нашему мнению, детерминирует возможность внедрения в клиническую практику отделений паллиативной помощи, других стационарных и амбулаторных учреждений здравоохранения.
Background. The causes of decubitus ulcers include ischaemia and neurotrophic tissue changes induced by their chronic compression, continuous pathologic moisture and shift of tissues that determine local ishaemia. The aim of the article: to study clinical options and suppurative complications of decubitus ulcers in patients with type 2 diabetes mellitus (DM) in terms of insulin resistance (IR) in the context of combined treatment optimization. Materials and methods. Total sample of retro- and prospective analyses involved results of comprehensive treatment of 112 patients. Type 2 DM was diagnosed in 37 patients, I comparison group included 27 patients with decubitus ulcers without complications (I–III stages) and DM, with decubitus ulcers stage IV — II comparison group; and the control group included other 75 individuals. Results. The patients with type 2 DM (I comparison group) had considerable decrease in HOMA index of β-cell function and increased HOMA index of IR (8.31 ± 0.02, р < 0.01). Patients with type 2 DM with complicated decubitus ulcers (II comparison group) had more significant increase of circulating insulin indexes (p2 < 0.01), HOMA index of IR (p2 < 0.05), and considerable decrease on HOMA index of β-cell function (p2 < 0.05). The correlation analysis of HOMA-IR indicators and element concentration in the blood revealed the correlation only in patients with type 2 DM (I and II comparison groups): potent negative correlation (r = –0.72; p < 0.001) was revealed between the HOMA-IR and Mg2+ content in erythrocytes; intermediate negative correlation (r = –0.66; p < 0.01) — between HOMA-IR and Zn2+ concentration in the blood serum; and a negative one (r = –0.69; p < 0.01) — between HOMA-IR and Cr3+ level in the blood serum. Conclusions. The advantage of the proposed classification of decubitus ulcers of soft tissue and a sequence of comprehensive treatment is considering the features of pathogenesis, morphogenesis and clinical course of ulcers with complications that affect the course of healing and require appropriate strategies for the treatment of purulent wounds — TIME and DOMINATE, which, in our opinion, determines the possibility of the introduction into clinical practice of palliative care departments, other inpatient and outpatient health care facilities.
Статтю опубліковано на с. 72-77
Вступ
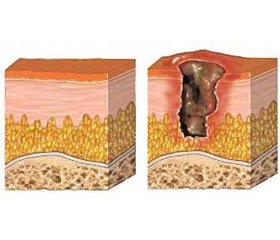
Як відомо, головними причинами пролежневих трофічних виразок є ішемія та нейротрофічні зміни тканин, спричинені їх тривалою хронічною компресією, постійним патологічним зволоженням та зсувом тканин, що детермінує виникнення локальної ішемії, нерідко в людей похилого віку на фоні атрофії підшкірної жирової клітковини та патології обміну речовин тощо [1, 2]. Незважаючи на проведення профілактичних заходів — декомпресії проблемних ділянок, періодичної зміни просторового положення тіла в поєднанні з обробкою зони пролежня і проведенням медикаментозної терапії, частота виникнення колікваційних некрозів та гнійних ускладнень залишається високою та становить 20–63 % [1, 3–5]. Ці ускладнення вимагають комплексного підходу до хірургічного лікування та нерідко повторних некр- та секвестрнекректомій [9, 12, 13]. Сучасну міжнародну класифікацію пролежнів було подано у спільних настановах щодо профілактики та лікування пролежнів Європейської експертної комісії з пролежнів. Стадії пролежнів визначаються, виходячи з уявлення, що прогресування відбувається в напрямку від стадії I до стадії III або IV, хоча на практиці так буває не завжди [12–15]. При першій стадії пролежня цілісність шкіри не порушена, але на ній є обмежена зона стійкого почервоніння (еритеми), поява такої інфільтрації зазвичай вказує на високий ризик прогресування пролежнів. Друга стадія характеризується частковою втратою товщі шкіри, виглядає як плоска відкрита виразка, що покрита кіркою, або як рана з вологим або сухим дном без ознак ураження більш глибоких тканин [7, 8]. Також може мати вигляд міхура, заповненого серозною або серозно-кров’янистою рідиною. Для третьої стадії пролежнів характерна повна втрата товщі шкіри — ураження всієї шкіри (дерми та підшкірної жирової тканини). Для четвертої — некротизація та абсцедування, можуть виникати гнійні запливи та/або некротичні маси, але останні не дають можливості побачити і верифікувати глибину ушкодження. Глибина залежить від анатомічних особливостей частини тіла, де вона розташована, зокрема, там, де немає підшкірної (жирової) клітковини, пролежні можуть бути неглибокими. Можливе поширення процесу на прилеглі сполучнотканинні структури, у тому числi розвиток остеомієліту [14].
Одним iз факторів, що зумовлюють негативні результати лікування пролежнів у хворих на цукровий діабет (ЦД), є не лише погане загоювання ран та висока вірогідність розвитку генералізованих гнійних ускладнень, але й фонова інсулінорезистентність (ІР) — патологічний стан, який характеризується зниженою відповіддю тканин на біологічну дію гормона, що проявляється зменшенням інсулінозалежного транспорту глюкози переважно в печінці, жировій тканині та скелетній мускулатурі та призводить до хронічної компенсаторної гіперінсулінемії. ІР та компенсаторна гіперінсулінемія лежать в основі патогенезу ЦД 2-го типу, призводять до швидкого розвитку пізніх ускладнень хвороби та формування раннього атеросклерозу вінцевих судин [1, 3, 5, 6]. У хворих на ЦД 2-го типу прогресування атеросклеротичного ураження коронарних судин відіграє провідну роль у патогенезі серцевої недостатності (СН) та розвитку небезпечних ускладнень, що призводять до високої смертності таких пацієнтів.
Для ЦД 2-го типу характерні специфічні фактори, такі як ІР та гіперінсулінемія, гіперглікемія, ендотеліальна дисфункція, порушення коагуляційних властивостей крові. Цей перелік порушень становить ланцюговий причинно-наслідковий процес, пусковим механізмом якого є формування і прогресування ІР.
Складність патогенезу та конфігурації гнійних вогнищ, наявність локального порушення мікроциркуляції детермінують актуальність прогнозування необхідності повторних хірургічних санацій (некректомій) i пошук нових, вдосконалених алгоритмів лікування та прогнозування ризику гнійних ускладнень пролежнів [2, 4, 6].
Мета дослідження. Дослідити клінічні варіанти та гнійні ускладнення пролежнів у хворих на цукровий діабет 2-го типу з позицій наявності інсулінорезистентності в контексті оптимізації комплексного лікування.
Матеріал і методи
Загальну вибірку ретро- та проспективного аналізу становили результати комплексного лікування 112 пацієнтів, віком 40–93 роки: 74 чоловіків та 48 жінок, які лікувалися стаціонарно у відділенні паліативної допомоги (ВПД) комунальної 4-ї міської клінічної лікарні м. Львова; перебіг захворювання в них характеризувався формуванням пролежнів м’яких тканин. Проведено проспективний аналіз 37 клінічних спостережень та ретроспективно проаналізовано медичні карти інших 75 стаціонарних хворих (група контролю) iз неускладненими та ускладненими пролежнями м’яких тканин, комплексно пролікованих консервативно та хірургічно. Наявність ЦД 2-го типу пiдтверджено в 37 пацієнтів, iз них — з вираженим колікваційним некрозом у ділянці пролежня — у 20 осіб, гнійними ускладненнями в ділянці пролежня — у семи хворих та періоститом/остеомієлітом прилеглих структур — у трьох. Таким чином, 27 пацієнтів iз пролежнями без ускладнень (І–ІІІ стадії) та ЦД становили І групу порівняння, iз пролежнями IV стадії — ІІ групу порівняння, інші особи — групу контролю.
Результати дослідження
У структурі фонової патології в загальній вибірці переважали: серцево-судинні захворювання (ішемічна хвороба серця (IХС), атеросклероз, порушення серцевого ритму, гіпертонічна хвороба) — 44 (39,29 %) випадки, неврологічна патологія (стан після порушення мозкового кровообігу, демієлінізуючі захворювання, неврити, нейропатії) — 42 (37,5 %), ожиріння — 14 (12,5 %), хронічне обструктивне захворювання легень — 8 (7,14 %), хронічні захворювання печінки та нирок — 5 (4,46 %), холелітіаз — 3 (2,68 %), цукровий діабет 1-го типу — 3 (2,68 %) та інші захворювання (хвороба Крона, туберкульоз, рак) — 7 (6,25 %) випадкiв. Усім пацієнтам проведено корекцію коморбідної патології, системну антибіотикотерапію та санацію ділянки пролежня антисептиками [9–11]. Основою профілактичних заходів були адекватний догляд, контроль і зниження рівня глюкози в крові, про що слід постійно пам’ятати як хворим, так і лікарям. Проведено декомпресію ділянки пролежня iз застосуванням стандартних спеціальних засобів для догляду — декомпресійних ортопедичних матраців та кругів. Прецизійно хірургічно вилучено ділянку колікваційного (вологого) некрозу шляхом його висічення en block у межах здорових тканин iз видаленням гною і некротичного детриту. Під візуальним та тактильним контролем поетапно інтраопераційно діагностовано, розкрито та сановано гнійні запливи з прецизійною поетапною некр-, а у п’яти осіб — секвестрнекректомією, утворену порожнину промито розчином перекису водню та водним розчином антисептика полівінілпіролідонйоду, чим також досягнуто повноцінну евакуацію гною та залишків некротичного детриту. Догляд та комплексне лікування проведено згідно iз сучасними стратегіями лікування гнійних ран — TIME і DOMINATE [10, 12, 19]. Стратегія DOMINATE у модифікованій послідовності включала: N (Nutrition) — адекватне нутритивне забезпечення iз застосуванням (за показаннями) парентерального харчування, анаболічних стероїдів [16]; О (Offloading) — розвантаження, декомпресію за допомогою стандартних ортопедичних засобів, що вдвічі зменшує вірогідність прогресування некробіозу порівняно з хворими, які не користуються засобами розвантаження (декомпресії); D (Debridement) — видалення нежиттєздатних тканин із рани, що включає некр- та секвестрнекректомію, пошук, розкриття та дренування гнійних запливів iз санацією від гною та некротичного детриту [19], при цьому ятрогенно під час некректомії також видаляються клітини в стані некро- та парабіозу [9, 13–15]; I (Infection) — найдоцільніше поєднання загальної антибіотикотерапії та місцевого застосування антисептиків та антибіотиків; T (Tissue management) — створення у рані відповідного середовища, проведення адекватного відтоку ексудату, що забезпечується комбінованим дренуванням і тампонадою [17–19]; E (Educations) — передбачає адекватний догляд, спостереження за динамікою ранового процесу пролежнів та корекцію локального венозного та лімфатичного стазу, коморбідної патології [13, 16, 18].
Нами запропоновано, впроваджено та застосовано модифікацію класифікації пролежнів м’яких тканин, згідно з якою стадія I (поверхневе (епідермальне) пошкодження) подiляється: на стадiї Іа — стійка гіперемія обмеженої ділянки шкіри (еритеми), що найчастіше знаходиться над виступаючою кісткою та Іb — поверхнева десквамація епідермісу з утворенням пухирців, наповнених серозно-геморагічним вмістом, мацерацією, локальними вогнищами десквамації епідермісу; стадія IІ (втрата товщини шкіри з формуванням пролежневої виразки): на ІІа — дно виразки з ознаками гранулювання і/або кіркування та ІІb — дно виразки з вираженими фібринозними нашаруваннями; стадія ІІІ (повна втрата товщини шкіри з формуванням некрозу м’яких тканин; у рані можна побачити некротизовану підшкірну жирову клітковину, некротичний детрит, але не видно і не відчуваються (при зондуванні чи пальцьовій ревізії) на дотик кістки, сухожилля чи м’язи): на ІІІа — формування обмеженого коагуляційного (сухого) некрозу та ІІІb — формування обмеженого колікваційного (вологого) некрозу без вираженого абсцедування; стадія IV (глибоке ураження тканин (візуально диференціюються елементи некротизованої клітковини i/або м’язи та/або сполучнотканинні структури) iз нагноєнням, абсцедуванням; часто зустрiчаються «кишені» й «тунелі», заповнені гноєм, некрозами та некротичним детритом; ураження тканин глибоке, можна побачити (або відчути на дотик при зондуванні чи пальцьовій ревізії) м’язи та/або сухожилля й кістки; характерна наявність фокальних «конгломератних» некрозів, навколо яких або з-під яких виділяється гній): на ІVа — формування абсцесу (флегмони) дна i/або стінок пролежня без (або з формуванням) гнійних запливів та ІVb — поширення процесу на прилеглі (сусідні) сполучнотканинні структури з формуванням узурувань, перихондриту, періоститу, остеомієліту тощо. У всіх випадках некрозів та нагноєння було проведено адекватну хірургічну санацію.
Об’єктивним критерієм оцінки ІР є індекс НОМА-ІР (the Homeostasis Model Assessment) [8]. Це результат ділення значень рівнів глюкози і інсуліну натщесерце на коефіцієнт 22,5. Норма становить < 2,77 відн.од. (що пiдтверджено в пацієнтів групи контролю). У хворих на ЦД 2-го типу (І група порівняння) спостерігалося вірогідно значуще зменшення НОМА-індексу функції β-клітин та збільшення НОМА-індексу ІР (8,31 ± 0,02, р1 < 0,01). У I групі порівняння вмiст глікованого гемоглобіну дорівнював 15,68 ± 0,29 %, рівень інсуліну — 23,82 ± 0,55 мкОД/мл, індекс НОМА — 8,31 ± 0,02 відн.од.
У пацієнтів ІІ групи порівняння спостерігали збільшення концентрації iмунореактивного iнсулiну, параметрів, що характеризують ІР. У хворих на ЦД 2-го типу з наявністю ускладнених пролежнів (ІІ група порівняння) зареєстровано більш значне підвищення показників циркулюючого інсуліну (28,810 ± 0,563 мкОД/мл, p2 < 0,01), НОМА-індексу ІР (12,510 ± 0,620, p2 < 0,05) та значне зменшення НОМА-індексу функції β-клітин (р < 0,05). Спостерiгалося більш значне підвищення показників циркулюючого інсуліну (28,810 ± 0,563 мкОД/мл, p2 < 0,01), НОМА-індексу ІР (12,510 ± 0,620, p2 < 0,05) та значне зменшення НОМА-індексу функції β-клітин (р < 0,05).
Виявлені нами зміни концентрації мікроелементів супроводжувалися порушенням параметрів ІР. При проведенні кореляційного аналізу показникiв НОМА-ІР та концентрації елементів у крові кореляційний зв’язок був встановлений тільки у хворих на ЦД 2-го типу (І та ІІ групи порівняння): між показником НОМА-ІР та вмістом Mg2+ в еритроцитах був виявлений негативний сильний кореляційний зв’язок (r = –0,72; р < 0,01), між НОМА-ІР та концентрацією Zn2+ у сироватці крові — негативний зв’язок середньої сили (r = –0,66; p < 0,01) та між НОМА-ІР i рівнем Cr3+ у сироватці крові — негативний кореляційний (r = –0,69; p < 0,01). Між показниками марганцю і міді в крові в пацієнтів iз ЦД 2-го типу та параметрами ІР кореляції виявлено не було. Досліджуючи аналогічні показники взаємозв’язку між концентрацією елементів у крові та параметрами ІР у пацієнтів iз ЦД 2-го типу ІІ групи порівняння та без вираженої кардіальної патології, ми побачили сильний негативний кореляційний зв’язок між концентрацією магнію в еритроцитах, вмістом цинку та хрому в сироватці крові та НОМА-ІР.
Некректомії/розкриття гнійних вогнищ здійснено в 78 хворих, iз них половина (34 випадки) — у хворих на ЦД. Таким чином, сумарна кількість первинних некректомій (включаючи розкриття гнійних вогнищ) у загальній вибірці хворих (на період перебування у ВПД, включаючи прогресування локального процесу) становила 78 спостережень (69,64 %) загальної вибірки, серед хворих на ЦД — 25 (91,89 % субвибірки сумарної кількості спостережень у групах порівняння), у групі контролю — 58,67 % субвибірки. У І групі порівняння вимушених повторних хірургічних санацій потребували 11 осіб — половина випадків субвибірки, у ІІ групі порівняння — у 8 осіб (2/3 клінічних спостережень субвибірки) (сумарно — 48,65 % субвибірки). У групі контролю (75 осіб) необхідність виконання повторних некректомій виникала у 20 % субвибірки (15 пацієнтів).
На тлі адекватного нутритивного забезпечення шляхом збалансованого харчування з достатнім вмістом амінокислот, вуглеводів, жирів, з корекцією порушень водно-електролітного обміну, парентеральним застосуванням амінолу, анаболічних стероїдів, вітамінотерапії проводили корекцію коморбідної патології, системну антибіотикотерапію та санацію ділянки пролежня антисептиками, здійснювали декомпресію ділянки пролежня за допомогою стандартних спеціальних засобів для догляду — декомпресійних ортопедичних матраців та кругів. При пролежнях з колікваційним некрозом та гнійними ускладненнями виконували прецизійну некректомію колікваційного (вологого) некрозу шляхом його висічення en block у межах здорових тканин [9, 11, 14] iз видаленням гною і некротичного детриту, розкриттям гнійної порожнини та запливів [18]. Під візуальним і тактильним контролем поетапно інтраопераційно діагностували, розкривали та санували гнійні запливи з прецизійною поетапною некр-, а при необхідності — секвестрнекректомією, порожнину маятникоподібно санували розчином перекису водню та водним розчином полівінілпіролідонйоду для остаточної евакуації гною та залишків некротичного детриту, антисептичної обробки порожнини. Накладали контрапертури та здійснювали наскрізне дренування утвореної порожнини гумовими випускниками, порожнину через основну рану та контрапертури [4, 6, 10] промивали перекисом водню та водним розчином полівінілпіролідонйоду [6, 7], чим досягали санацію та перевірку прохідності дренажів [6, 15, 16]. Виконували тампонаду основної рани марлевими тампонами, змоченими йоддицерином. У післяопераційному періоді згідно iз сучасними стратегіями лікування гнійних ран — TIME і DOMINATE [11–14] здійснювали промивання порожнини через контрапертури розчином антисептиків, щоденну заміну тампонів iз поєднанням антисептичних препаратів — діоксизолю, йоддицерину, димексиду та лідокаїну — та місцево застосовували мазевi пов’язки до повноцінного очищення та гранулювання рани [14–16]. Місцево для просочування тампонів і пов’язок використовували пропорційну суміш: 25 мл розчину діоксизолю, 25 мл розчину йоддицерину, 10 мл 30 % розчину димексиду, 4 мл 10 % лідокаїну у вигляді емульсії з необхідними антисептичними та анестезуючими властивостями. Суміш готували екстемпорально та зберігали в темному прохолодному місці для подальшої доперев’язочної емульгації та просочування перев’язочного матеріалу — стерильних марлевих тампонів, що накладали на рановий дефект (пролежень).
Обговорення
Стартову антибактеріальну терапію в більшості випадків здійснювали емпірично згідно з рекомендаціями сучасних стратегій комплексного лікування хронічних гнійних ран — TIME і DOMINATE, на підставі клінічних та епідеміологічних даних щодо домінуючих збудників, тяжкості інфекції, наявності й ступеня вираженості нефропатії, автономної нейропатії (змінюється моторика шлунково-кишкового тракту і всмоктування лікарського препарату), алергічних реакцій, попередньої антибіотикотерапії та її ефективності. Коригування терапії проводили за даними посіву з рани: якщо антибактеріальний засіб виявився неефективним, вносили корективи з урахуванням результатів посіву і призначали препарати, ефективні щодо всіх виділених мікроорганізмів [19].
Показанням для призначення антибіотика вважали наявність ознак інфекції: підвищення локальної температури, набряк, перифокальне запалення, зміну забарвлення, біль [2, 4, 8, 9]. Пацієнти з поверхневими виразковими дефектами без ознак інфікування не потребували системної антибактеріальної терапії. Тривалість антибіотикотерапії залежала від початкової тяжкості інфекції. Крім того, необгрунтоване призначення антибактеріальних засобів є однією з причин розвитку резистентності мікроорганізмів. При виборі антибіотика необхідно враховувати переважання бактеріальних асоціацій. З огляду на це призначали цефалоспорини II покоління (цефаклор, цефуроксим), лінкозаміди (лінкоміцин, кліндаміцин) у середньотерапевтичних дозах. Як альтернативу застосовували комбінації фторхінолонів (ципрофлоксацин, офлоксацин) iз лінкозамідами [8, 9], а також триметоприму/сульфаметоксазолу і фузидієвої кислоти. Одночасно з антибактеріальною терапією проводили хірургічне очищення гнійно-некротичного вогнища з резекцією уражених ділянок кістки. У 30 % випадків ідентифікували неклостридіальні анаероби, стрептококи тощо. Препаратами вибору були лінкозаміди в комбінації із фторхінолонами. Як альтернативна схема — комбінації лінкозамідів із цефалоспоринами III покоління (цефтазидим) [7, 19], а також застосування у вигляді монотерапії нового класу антибактеріальних засобів — оксазолідиндіонів (лінезолід). При альтернативних схемах призначали глікопептиди (ванкоміцин) у поєднанні з метронідазолом, як монотерапію — лінезолід [8, 9, 13, 16]. Можливе призначення карбапенемів (іміпенем/циластатин) у вигляді монотерапії.
У хворих на ЦД 2-го типу з ускладненими пролежнями (І та ІІ групи) спостерігали збільшення концентрації циркулюючого інсуліну в крові порівняно з контрольною групою. У пацієнтів iз ЦД 2-го типу виявляли достовірно значуще зменшення НОМА-індексу функції β-клітин та збільшення НОМА-індексу ІР порівняно з іншими групами. У хворих на ЦД 2-го типу з ІІ групи порівняння спостерігали помітне підвищення показників циркулюючого інсуліну, НОМА-індексу ІР та значне зменшення НОМА-індексу функції β-клітин порівняно з особами iз ЦД 2-го типу з І групи та з групою контролю. У хворих на ЦД 2-го типу з гнійними запливами та ІХС (та/або ожирінням) наявне найбільш виражене зростання показників НОМА-ІР та зменшення НОМА-індексу функції β-клітин. При проведенні кореляційного аналізу параметрiв НОМА-ІР та концентрації мікроелементів у крові пацієнтів iз ЦД 2-го типу ІІ групи порівняння був виявлений середньої сили негативний кореляційний зв’язок між концентрацією магнію в еритроцитах, вмістом цинку та хрому в сироватці крові та показниками НОМА-ІР.
Усім хворим на ЦД при наявності гнійних процесів подальшу корекцію глікемії здійснювали простим інсуліном. Критерієм переведення на пероральний прийом або відміни препарату було покращення загального стану хворого (нормалізація температури, зниження лейкоцитозу і швидкості осідання еритроцитів) та стану рани [7–10]. Показником ефективності догляду та лікування є формування чистої гранулюючої ранової поверхні з мінімальною ексудацією [9–12, 14, 19], що було нами констатовано в усіх клінічних спостереженнях, i/або з наявністю крайової епітелізації [14, 19] та/або формування кірки, що зареєстровано нами в 7 пацієнтів. Критерієм відміни антибіотикотерапії вважали зникнення місцевих і загальних (якщо вони були наявні) ознак запалення та появу грануляцій.
Висновки
1. Пролежні виникають внаслідок локальної ішемії i нейротрофічних змін тканин, спричинених їх хронічною компресією на фоні тривалого вимушеного положення хворого; системних та локальних розладів мікроциркуляції й інервації тканин, детермінованих основним захворюванням та гіподинамією.
2. У групах осіб iз пролежнями, хворих на ЦД 2-го типу, виявлено збільшення концентрації циркулюючого інсуліну в крові, вірогідно значуще зменшення НОМА-індексу функції β-клітин та збільшення НОМА-індексу ІР порівняно з іншими групами.
3. У хворих на ЦД 2-го типу з наявністю ускладнених пролежнів спостерігається помітне підвищення показників циркулюючого інсуліну, НОМА-індексу ІР та значне зменшення НОМА-індексу функції β-клітин порівняно з особами iз ЦД 2-го типу без гнійних запливів.
4. При проведенні кореляційного аналізу параметрiв НОМА-ІР та концентрації мікроелементів у крові пацієнтів iз ЦД 2-го типу, гнійними ускладненими пролежнями був виявлений середньої сили негативний кореляційний зв’язок між концентрацією магнію в еритроцитах, вмістом цинку та хрому в сироватці крові та показниками НОМА-ІР.
5. Відсутність грануляцій, патологічна ексудація з рани, наявність нежиттєздатних локусів і неприємного запаху свідчили про критичну патогенну колонізацію рани і водночас про необхідність призначення поєднаного лікування — загальної антибіотикотерапії та місцевого застосування антисептиків та антибіотиків, проведення хірургічної санації патологічної порожнини.
6. У групах порівняння (хворi на ЦД) повторних санацій потребували 48,65 % субвибірки, проте в групі контролю (75 осіб без ЦД) необхідність виконання таких повторних некректомій була значно меншою, виникала в 15 пацієнтів (20 % субвибірки).
7. Перевагою запропонованої нами класифікації пролежнів м’яких тканин та послідовності комплексної терапiї є врахування особливостей патогенезу, морфогенезу та клінічного перебігу пролежнів з ускладненнями, які мають вплив на перебіг загоєння та вимагають адекватних стратегій лікування гнійних ран — TIME і DOMINATE, що, на нашу думку, детермінує можливість впровадження в клінічну практику відділень паліативної допомоги, інших стаціонарних та амбулаторних закладів охорони здоров’я.
Список литературы
1. Risk profile characteristics associated with outcomes of hospital-acquired pressure ulcers: a retrospective review / J. Alderden, J.D. Whitney, S.M. Taylor [et al.] // Critical Care Nurse. — 2011. — Vol. 31, № 4. — P. 30-43.
2. The clinical efficacy of two semi-quantitative wound-swabbing techniques in identifying the causative organism(s) in infected cutaneous wounds / D.E. Angel, P. Lloyd, K. Carville, N. Santamaria // Int. Wound J. — 2011. — Vol. 8(2). — Р. 176-185.
3. Biglari B. A retrospective study on flap complications after pressure ulcer surgery in spinal cord-injured patients / B. Biglari, A. Büchler, T. Reitzel // Spinal Cord. — 2014. — Vol. 52, № 1. — Р. 80-83.
4. Cowan L.J. Prevalence of wet-to-dry dressings in wound care / L.J. Cowan, J. Stechmiller // Adv. Skin Wound care. — 2009. — Vol. 22(12). — Р. 567-573.
5. Cullen Gill E. An exploration of fourth-year under graduate nurses knowledge of and attitude towards pressure ulcer prevention / E. Cullen Gill, Z. Moore // J. Wound Care. — 2013. — № 22(11). — Р. 618-619.
6. Factors associated with pressure ulcer risk in spinal cord injury rehabilitation / G. DeJong, C.H. Hsieh, P. Brown [et al.] // American Journal of Physical Medicine & Rehabilitation. — 2014. — Vol. 93, № 11. — P. 971-986.
7. Survey of fungi and yeast in polymicrobial infections in chronic wounds / S.E. Dowd, J. Delton Hanson, E. Rees [et al.] // J. Wound Care. — 2011. — № 20(1). — Р. 40-47.
8. Factors associated with the development of pressure ulcers after spinal cord injury / V. Eslami, S. Saadat, R. Habibi [et al.] // Spinal Cord. — 2012. — Vol. 50, № 12. — P. 899-903.
9. Wound care outcomes and associated cost among patients treated in US outpatient wound centers: data from the US Wound Registry / C.E. Fife, M.J. Carter, D. Walker, B. Thomson // Wounds. — 2012. — Vol. 24(1). — Р. 10-17.
10. Factors in rehospitalisation for severe pressure ulcer care in spinal cord injury/disorders / B.L. Goodman, A. Schindler, M. Washington [et al.] // Journal of Wound Care. — 2014. — Vol. 23, № 4. — P. 165-172.
11. Support surfaces for pressure ulcer prevention / E. McInnes, A. Jammali-Blasi, S.E. Bell-Syer [et al.] // Cochrane Database Syst. Rev. — 2011. — Vol. 34, № 4. — D001735.
12. Moore Z.E. Dressings and topical agents for preventing pressure ulcers / Z.E. Moore, J. Webster // Cochrane Database Syst. Rev. — 2013. — Vol. 8. — CD009362.
13. Saladin L.K. Pressure ulcer prevalence and barriers to treatment after spinal cord injury: comparisons of four groups based on race-ethnicity / L.K. Saladin, J.S. Krause // NeuroRehabilitation — 2009. — Vol. 24, № 1. — P. 57-66.
14. Saunders L.L. Association of race, socioeconomic status, and health care access with pressure ulcers after spinal cord injury / L.L. Saunders, J.S. Krause, J. Acuna // Archives of Physical Medicine and Rehabilitation — 2012. — Vol. 93, № 6. — P. 972-977.
15. Prevalence, location, grade of pressure ulcers and association with specific patient characteristics in adult spinal cord injury patients during the hospital stay: a prospective cohort study / A. Scheel-Sailer, A. Wyss, C. Boldt [et al.] // Spinal Cord. — 2013. — Vol. 51, № 11. — P. 828-833.
16. Sibbald R.G. Increased bacterial burden and infection: the story of NERDS and STONES / R.G. Sibbald, K. Woo, E.A. Ayello // Adv. Skin Wound Care. — 2006. — № 19(8). — Р. 447-463.
17. Treadwell T. Site assessments: early steps on the journey toward outcomes / T. Treadwell, D.N. Keast // Wounds. — 2010. — Vol. 22. — Р.71-77.
18. Impact of pressure ulcers on outcomes in inpatient rehabilitation facilities / H. Wang, P. Niewczyk, M. Divita [et al.] // American Journal of Physical Medicine and Rehabilitation. — 2014. — Vol. 93, № 3. — P. 207-216.
19. Prospective, multicenter study of spinal cord stimulation for relief of Risk factors associated with pressure ulcer development in critically ill traumatic spinal cord injury patients / P. Wilczweski, D. Grimm, A. Gianakis [et al.] // J. Trauma. Nurs. — 2012. — Vol. 19, № 1. — P. 5-10.