Журнал «Здоровье ребенка» 5 (73) 2016
Вернуться к номеру
Імунологічні особливості перебігу хронічного гастродуоденіту в дітей на тлі лямбліозу
Авторы: Глушко К.Т., Кінаш М.І. - ДВНЗ «Тернопільський державний медичний університет імені І.Я. Горбачевського МОЗ України», м. Тернопіль, Україна; Кабакова А.Б., Шостак І.Й. - КУТОР «Тернопільська обласна дитяча клінічна лікарня», м. Тернопіль, Україна
Рубрики: Гастроэнтерология, Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
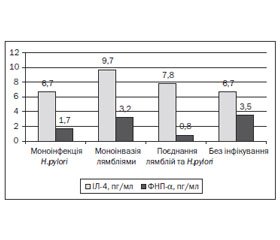
У статті проаналізовано імунологічні особливості перебігу хронічної гастродуоденальної патології в дітей на тлі лямбліозу. Мета дослідження: виділити характерні імунологічні критерії перебігу хронічної гастродуоденальної патології на тлі лямбліозу в дітей. Матеріали й методи. Обстеженi 54 дитини з ураженням слизової оболонки шлунка та дванадцятипалої кишки. Залежно від інвазування лямбліями усі діти були поділені на дві групи: І — 28 осіб з діагностованим лямбліозом, ІІ — 26 пацiєнтiв без інвазії. До групи контролю увійшли 24 практично здоровi дитини. Усім дітям проводили визначення концентрації iнтерлейкiну-4 (ІЛ-4) та фактора некрозу пухлини α (ФНП-α) у сироватці крові, паразитологічне дослідження калу. Результати. Інфікування H.pylori підтверджено в 18 (33,3 %) дітей. Частота інфікування H.pylori у хворих обох груп не відрізнялася: у І групі — 9 (32,1 ± 8,9 %), у ІІ — 9 (34,6 ± 9,5 %) випадків (р > 0,05). Установлено, що вміст ІЛ-4 у обстежених дітей (8,0 ± 0,5 пг/мл) був вищим за показники контрольної групи, тоді як рівень ФНП-α (2,7 ± 0,7 пг/мл) — не відрізнявся. У дітей iз супутнім лямбліозом виявлено вищу концентрацію ІЛ-4 (9,2 ± 0,9 пг/мл) порівняно з пацієнтами без інвазування (6,7 ± 0,3 пг/мл). На рівень ІЛ-4 впливало поєднання лямблій та H.pylori. Максимальні показники ІЛ-4 спостерігалися при моноінвазії лямбліями і були вірогідно вищими за такi при моноінфекції H.pylori, а при поєднанні інфікуванні паразитами з H.pylori вміст ІЛ-4 знижувався, тоді як рiвень ФНП-α не відрізнявся. Вища концентрація ФНП-α спостерігалася в дітей із гіперацидністю, вона також зростала із тривалістю хвороби.
В статье проанализированы иммунологические особенности течения хронической гастродуоденальной патологии у детей на фоне лямблиоза. Цель исследования: выделить характерные иммунологические критерии течения хронической гастродуоденальной патологии на фоне лямблиоза у детей. Материалы и методы. Обследованы 54 ребенка с поражением слизистой оболочки желудка и двенадцатиперстной кишки. В зависимости от инвазирования лямблиями все дети были разделены на две группы: I — 28 человек с диагностированным лямблиозом, II — 26 пациентов без инвазии. Группу контроля составили 24 практически здоровых ребенка. Всем детям проводили определение концентрации интерлейкина-4 (ИЛ-4) и фактора некроза опухоли α (ФНО-α) в сыворотке крови, паразитологическое исследование кала. Результаты. Инфицирование H.pylori подтверждено у 18 (33,3 %) детей. Частота инфицирования H.pylori у больных обеих групп не отличалась: в I группе — 9 (32,1 ± 8,9 %), во II — 9 (34,6 ± 9,5 %) случаев (р > 0,05). Установлено, что содержание ИЛ-4 у обследованных детей ((8,0 ± 0,5) пг/мл)
было выше показателей контрольной группы, тогда как уровень ФНО-α (2,7 ± 0,7 пг/мл) — не отличался. У детей с сопутствующим лямблиозом выявлена более высокая концентрация ИЛ-4 (9,2 ± 0,9 пг/мл) по сравнению с пациентами без инвазирования (6,7 ± 0,3 пг/мл). На уровень ИЛ-4 влияло сочетание лямблий и H.pylori. Максимальные показатели ИЛ-4 наблюдались при моноинвазии лямблиями и были достоверно выше, чем таковые при моноинфекции H.pylori, а при сочетании инфицирования паразитами с H.pylori содержание ИЛ-4 понижалось, тогда как уровень ФНО-α не отличался. Более высокая концентрация ФНО-α наблюдалась у детей с гиперацидностью, она также повышалась с продолжительностью болезни.
In the article, we have analyzed the immunological features of chronic gastroduodenal pathology in children with concomitant giardiasis. Objective: tо identify specific immunological criteria for chronic gastroduodenal pathology on the background of giardiasis in children. Materials and methods. The study involved 54 children with damage to the gastric and duodenal mucosa. Depending on giardia invasion, all children were divided into two groups: І — 28 persons with diagnosed giardiasis, ІІ — 26 patients without invasion. 24 apparently healthy children were included in the control group. In all children, we have evaluated the concentrations of interleukin-4 (IL-4) and tumor necrosis factor α (TNF-α) in the blood serum, performed stool parasitological research. Results. H.pylori infection has been confirmed in 18 (33.3 %) children. The incidence of H.pylori infection in patients of both groups did not differ: in group I — 9 (32.1 ± 8.9 %), in group II — 9 (34.6 ± 9.5 %) cases (p > 0.05). It was found that the content of IL-4 in the examined children (8.0 ± 0.5 pg/ml)
was higher compared with controls, whereas TNF-α level (2.7 ± 0.7 pg/ml) — did not differ. In children with concomitant giardiasis, we have found higher concentrations of IL-4 (9.2 ± 0.9 pg/ml) than in patients without invasion (6.7 ± 0.3 pg/ml). Combination of giardia and H.pylori affected the level of IL-4. Maximum values of IL-4 were observed in giardia monoinvasion and were significantly higher than those in H.pylori monoinfection, and when parasite invasion was combined with H.pylori, IL-4 content was decreased, while the level of TNF-α did not differ. Higher concentration of TNF-α was observed in children with increased levels of acidity, it also increased with duration of disease.
діти, хронічний гастродуоденіт, лямбліоз, iнтерлейкiн-4, фактор некрозу пухлини α.
дети, хронический гастродуоденит, лямблиоз, интерлейкин-4, фактор некроза опухоли α.
children, chronic gastroduodenitis, giardiasis, interleukin-4, tumor necrosis factor α.
Статтю опубліковано на с. 78-82
Вступ
Матеріали та методи
/79.jpg)
Результати дослідження
/80.jpg)
Обговорення
Висновки
1. Бекетова Г.В. Хронічний гастродуоденіт у дітей і підлітків: епідеміологія, етіологія, патогенез, діагностика (частина І) / Г.В. Бекетова // Дитячий лікар. — 2012. — № 6. — С. 20-24.
2. Бережная Н.М. Эозинофилы, базофилы и иммуноглобулин Е в противоопухолевой защите / Н.М. Бережная, В.Ф. Чехун, Р.И. Сепиашвили // Аллергология и иммунология. — 2005. — Т. 6, № 1. — С. 38-49.
3. Білоусов Ю.В. Гастроентерологія дитячого віку: підручник / Ю.В. Білоусов. — К.: СПД «Коляда О.П.», 2007. — 500 с.
4. Боброва В.І. Пріоритети призначення нітрофуранових препаратів при лікуванні хронічного гастродуоденіту у дітей / В.І. Боброва // Современная педиатрия. — 2013. — № 3. — С. 123-126.
5. Етіопатогенез гастриту типу В у дітей / Т.В. Сорокман, С.В. Сокольник, М.Г. Гінгуляк [та ін.] // Буковинський медичний вісник. — 2014. — № 2(70). — С. 153-156.
6. Крамарев С.А. Диагностика, лечение и профилактика лямблиоза / С.А. Крамарев // Здоровье Украины. — 2011. — № 2/17. — С. 19.
7. Лямблиоз и его сочетание с хеликобактериозом: обзор литературы и собственные данные / Н.Б. Губергриц, Е.Ю. Плотникова, С.В. Налетов [и др.] // Сучасна гастроентерологія. — 2012. — № 3(65). — С. 55-62.
8. Common coinfections of Giardia intestinalis and Helicobacter pylori in non-symptomatic Ugandan children / J. Ankarklev, E. Hestvik, M. Lebbad [et al.] // PLOS Neglected tropical diseases. — 2012. — Vol. 6, № 8. — P. 1780.
9. Cytokine expression in pediatric H.pylori infection / A.I. Lopes, A. Palha, M. Quiding-Jabrink [et al.] // Clinical and diagnostic laboratory immunology. — 2005. — Vol. 12, № 8. — P. 994-1002.
10. Gastrointestinal nematode infection is associated with variation in innate immune responsiveness [Електронний ресурс] / J.A. Jackson, J.D. Turner, M. Kamal [et al.] // Microbes and Infection. — 2006. — Vol. 8, № 2. — P. 487-492. — Режим доступу до журн.: http://www.ncbi.nlm.nih.gov/pubmed/16293435.
11. Helicobacter pylori, T cells and cytokines: the «dangerous liasions» / M.M. D’Elios, A. Amedei, M. Benagiano [et al.] // Immunology and medical microbiology. — 2005. — № 44. — Р. 113-119.

/79_2.jpg)
/80_2.jpg)