Резюме
Актуальність. Артеріальна гіпертензія (АГ) разом із дією інших додаткових факторів серцево-судинного ризику обумовлює зміни в стінці артерій, що виражається в потовщенні комплексу інтима-медіа (КІМ), головним чином за рахунок середньої оболонки — медії. Мета дослідження: вивчити особливості ремоделювання загальних сонних артерій у жінок з АГ за допомогою ультразвукової пошарової оцінки інтими і медії та визначити вплив на них додаткових факторів серцево-судинного ризику. Матеріали та методи. Обстежено 98 жінок з АГ I і II стадії 1-го і 2-го ступеня (основна група) та 42 здорові жінки (контрольна група). На апараті LOGIC PRO P5 у В-режимі вимірювали товщину КІМ, інтими, медії та діаметр загальних сонних артерій. Проведено добове моніторування артеріального тиску, допплерехокардіографію, оцінку індексу маси тіла, швидкості клубочкової фільтрації, ліпідограми, рівня креатиніну, глюкози плазми крові. Результати. При пошаровому скануванні стінки загальних сонних артерій у жінок з АГ порівняно з контрольною групою виявлено достовірне збільшення товщини КІМ (0,068 ± 0,009 см проти 0,052 ± 0,009 см, р < 0,001) переважно за рахунок шару медії (0,042 ± 0,008 проти 0,028 ± 0,009 см, р < 0,001). Товщина шару інтими в досліджуваних групах була статистично порівнянна (р > 0,05). Виявлений прямий кореляційний зв’язок товщини КІМ і медії з віком (r = +0,26; р < 0,001 і р = 0,56; р < 0,001), рівнем систолічного артеріального тиску (r = +0,30; р < 0,01 і r = +0,31; р < 0,01), глюкози (r = +0,37; р < 0,001 і r = +0,31, р < 0,01), з індексом маси тіла (r = +0,27; р < 0,01 і r = +0,22; р < 0,05) і обернений — зі швидкістю клубочкової фільтрації (r = –0,36; р < 0,001 і r = –0,41; р < +0001). Висновки. У жінок з АГ товщина КІМ на 30,8 %, а шару медії — на 33,4 % більша, ніж у контрольній групі (р < 0,001). Загальний внесок таких факторів, як рівень систолічного артеріального тиску, індекс маси тіла, швидкість клубочкової фільтрації, концентрація холестерину ліпопротеїнів низької щільності, глюкози, у прогресування потовщення КІМ становив 68 % і збігся з впливом на шар медії — 62 % на відміну від впливу на шар інтими, де їх внесок становив 26 %.
Актуальность. Артериальная гипертензия (АГ) вместе с действием других дополнительных факторов сердечно-сосудистого риска обусловливает изменения в стенке артерий, что выражается в утолщении комплекса интима-медиа (КИМ), главным образом за счет средней оболочки — медии. Цель исследования: изучить особенности ремоделирования общих сонных артерий у женщин с АГ с помощью ультразвуковой послойной оценки интимы и медии и определить влияние на них дополнительных факторов сердечно-сосудистого риска. Материалы и методы. Обследовано 98 женщин с АГ I и II стадии 1-й и 2-й степени (основная группа) и 42 здоровые женщины (контрольная группа). На аппарате LOGIC P5 PRO в В-режиме измеряли толщину КИМ, интимы, медии и диаметр общих сонных артерий. Проведены суточное мониторирование артериального давления, допплерэхокардиография, оценка индекса массы тела, скорости клубочковой фильтрации, липидограммы, уровня креатинина, глюкозы плазмы крови. Результаты. При послойном сканировании стенки общих сонных артерий у женщин с АГ в сравнении с контрольной группой выявлено достоверное увеличение толщины КИМ (0,068 ± 0,009 см против 0,052 ± 0,009 см, р < 0,001) преимущественно за счет слоя медии (0,042 ± 0,008 против 0,028 ± 0,009 см, р < 0,001). Толщина слоя интимы в исследуемых группах была статистически сопоставима (р > 0,05). Выявлена прямая корреляционная связь толщины КИМ и медии с возрастом (r = +0,26; р < 0,001 и r = +0,56; р < 0,001), уровнем систолического артериального давления (r = +0,30; р < 0,01 и r = +0,31; р < 0,01), глюкозы (r = +0,37; р < 0,001 и r = +0,31, р < 0,01), с индексом массы тела (r = +0,27; р < 0,01 и r = +0,22; р < 0,05) и обратная — со скоростью клубочковой фильтрации (r = –0,36; р < 0,001 и r = –0,41; р < 0,001). Заключение. У женщин с АГ толщина КИМ на 30,8 %, а слоя медии — на 33,4 % больше, чем в контрольной группе (р < 0,001). Общий вклад таких факторов, как уровень систолического артериального давления, индекс массы тела, скорость клубочковой фильтрации, концентрация холестерина липопротеинов низкой плотности, глюкозы, в прогрессирование утолщения КИМ составил 68 % и совпал с влиянием на слой медии — 62 % в отличие от влияния на слой интимы, где их вклад составил 26 %.
Background. Intima-media thickness (IMT) is an important risk factor for atherosclerotic process, as well as medial hypertrophy for hypertensive arterial remodeling. B-mode ultrasonography is a non-invasive, easily performed, reproducible, sensitive and is accepted as one of the best methods for evaluation of arterial wall structure. The aim of our study was to investigate remodeling of common carotid arteries (CCA) in hypertensive women using separate ultrasound evaluation of intima and media and to determine the impact on them of additional cardiovascular risk factors. Material and methods. 98 women with hypertension stage I–II, grade 1–2, aged 35 to 60 years, mean age — 48.6 ± 7.4 years, and 42 healthy female controls. IMT is defined as a double-line pattern visualized by echo 2D on both walls of the CCA in a longitudinal view. Intima (IT) and media thickness (MT) were measured layerwise, and also inner vessel diameter was calculated. Spearman correlation method and the impact of strength indicator (K2) were used for statistical analysis. Results. Significant increase in IMT, mainly due to the layer of media, was observed in women with hypertension. The mean value of IMT was 0.068 ± 0.009 cm, IT — 0.024 ± 0.005 cm, MT — 0.042 ± 0.008 cm, the inner vessel diameter — 0.580 ± 0.067 cm. In women with hypertension, IMT was by 30.8 % and media thickness — by 33.4 % higher than in control subjects (р < 0.001). A direct correlations were found between IMТ and the media thickness with age (r = +0.26; р < 0.001 and r = +0.56; р < 0.001), systolic blood pressure (r = +0.30; р < 0.01 and r = +0.31; р < 0.01), glucose level (r = +0.37; р < 0.001 and r = +0.31, р < 0.01), body mass index (r = 0.27; р < 0.01 and r = +0.22, р < 0.05), and inverse — with the glomerular filtration rate (r = –0.36; р < 0.001 and r = –0.41, p < 0.001). Conclusions. The multivariant analysis results show that the general impact of the systolic blood pressure, glomerular filtration rate, low-density lipoprotein cholesterol and glucose level on IMT progressive increase was 68 %, and was the same for media layer thickness — 62 %, unlike intima layer with magnitude of impact only of 26 %.
Статтю опубліковано на с. 64-70
Вступ
Артеріальна гіпертензія (АГ) є однією з актуальних проблем сучасної медицини і постійно привертає увагу дослідників через раннє ураження органів-мішеней і розвиток інвалідизуючих і фатальних серцево-судинних ускладнень [1, 2]. Порушення нейрогенної регуляції кровообігу є загальновизнаним фактором, що формує цілий комплекс стійких патологічних змін у серці та судинах при АГ [3]. У той же час доведено, що морфофункціональною основою ремоделювання судин при АГ є гіпертрофія медії в судинах м’язового та м’язово-еластичного типу. Остання теза є актуальною і тепер та відповідає сучасним медичним даним [4]. Активація симпатичної нервової системи разом із традиційною дією стресових чинників обумовлена також малорухомим способом життя, постійним вживанням висококалорійної їжі, що сприяє не лише підвищенню артеріального тиску (АТ), але й більш ранньому розвитку атеросклерозу в популяції [5]. Основним морфологічним субстратом ремоделювання судин у цьому разі є переважання потовщення інтими в судинах еластичного і м’язово-еластичного типу [6]. Ураження артеріальних судин при АГ досліджено в багатьох роботах, але майже у всіх них ключовим показником розвитку ремоделювання судин є вимірювання комплексу інтима-медіа (КІМ), при чому діагностичними величинами вважаються значення товщини стінки < 0,9 мм, потовщення КІМ — 0,9–1,3 мм, а критерієм бляшки — КІМ понад 1,3 мм [7–9]. Висока роздільна здатність сучасних ультразвукових апаратів надає можливість поглибленого дослідження судинної стінки, що полягає у вимірах шару інтими та медії окремо [10, 11]. Це дозволяє дослідити найранішні етапи ремоделювання судин без змін загальної величини КІМ, індивідуально оцінити переважаючий вплив атерогенезу або АГ на ремоделювання судин, підвищити якість вибору патогенетично доцільної антигіпертензивної терапії, а також динамічного спостереження за її впливом.
Останнім часом також недостатньо вивченими є питання взаємозв’язку між структурною перебудовою стінки сонних артерій та додатковими факторами серцево-судинного ризику у хворих на АГ [12–14].
Мета дослідження: вивчити особливості ремоделювання сонних артерій у жінок з артеріальною гіпертензією за допомогою ультразвукової пошарової оцінки інтими та медії та визначити вплив на них додаткових факторів серцево-судинного ризику.
Матеріали та методи
Дослідження базувалося на обстеженні 140 жінок, із них 98 хворих були з АГ I та II стадії 1-го та 2-го ступеня (основна група; із підвищенням АТ), низьким і помірним ризиком (середній вік жінок — 48,6 ± 7,4 року). Тривалість АГ становила від 2 до 16 років, у середньому — 6,0 ± 3,2 року. Артеріальна гіпертензія була діагностована відповідно до вимог чинних на час проведення дослідження нормативних документів: «Настанова та клінічний протокол надання медичної допомоги «Артеріальна гіпертензія» (2012) і рекомендацій Української асоціації кардіологів (2016).
Критеріями виключення з дослідження були: потовщення КІМ більше 0,9 мм та/або атеросклеротична бляшка в сонних артеріях; ознаки атеросклерозу артерій нижніх кінцівок; симптоматична (вторинна) АГ; гострі та хронічні захворювання серцевого м’яза, легенів, печінки, нирок у стадії декомпенсації і загострення; АГ ІІІ стадії і 3-го ступеня; наявність документованої ішемічної хвороби серця; цукровий діабет чи інша супутня хронічна патологія; вагітність; прийом замісної гормональної терапії, протизаплідних пероральних засобів, наявність внутрішньоматкових контрацептивів та патологічного клімактерія; шкідливі звички (паління). Чоловіки виключались із дослідження для досягнення однорідності вибірки і усунення статевих відмінностей показників судинного ремоделювання.
Контрольну групу становили 42 практично здорові жінки віком від 30 до 60 років (середній вік — 44,0 ± 8,3 року), без скарг і відхилень від норми при фізикальному обстеженні. У даної категорії осіб не було ознак захворювань серцево-судинної системи.
З метою оцінки структурних змін сонних артерій усім пацієнткам проводилося ультразвукове дуплексне сканування загальних сонних артерій (ЗСА) на апараті LOGIC P5 PRO (GE) лінійним датчиком у діапазоні частот 10–12 МГц, у В-режимі з ручним виміром КІМ, товщини інтими, товщини медії (вимірювали в декількох сегментах із повідомленням максимального значення) та внутрішнього діаметра судини. КІМ загальної сонної артерії вимірювали згідно зі стандартним протоколом: по задній щодо датчика стінці судини на відстані 10 мм від біфуркації перпендикулярно до осі судини. Шар інтими вимірювали від верхнього краю першої ехопозитивної лінії, що гістологічно відповідає границі розділу «просвіт судини — інтима», до верхнього краю другої ехонегативної лінії, що гістологічно відповідає початку границі медії. Шар медії вимірювали від нижнього краю інтими до верхнього краю адвентиції. Внутрішній діаметр судини відповідав відстані від внутрішнього краю поверхні задньої стінки до внутрішнього краю передньої стінки артерії.
На етапі включення в дослідження оцінювались також такі показники: динаміка АТ (за допомогою добового моніторування АТ), індекс маси тіла, основні морфологічні параметри серця (оцінені за методом допплерівської ехокардіографії), показники ліпідограми, рівень креатинину та глікемії, розрахування швідкості клубочкової фільтрації (за формулою MDRD).
Статистичний аналіз отриманих даних проводився за допомогою ПП Statistica 6.0. Для оцінки характеру розподілу кількісних показників у вибірках застосовували критерій Колмогорова — Смірнова і W-критерій Шапіро — Уїлкcа. Результати вважали статистично значущими при рівні р < 0,05. При описанні нормально розподілених даних вказували середнє арифметичне значення (М) ± стандартне відхилення (SD). Для з’ясування характеру та сили зв’язку між досліджуваними показниками проводили кореляційний і дисперсійний аналіз із розрахунком коефіцієнта кореляції Спірмена (R) і показника сили впливу (К2).
Результати
Середні значення товщини КІМ, інтими, медії та діаметру (см) у жінок основної та контрольної групи подано на рис. 1.
При пошаровому ультразвуковому скануванні стінки ЗСА в пацієнток основної групи порівняно з контрольною групою виявлено достовірне збільшення товщини КІМ, переважно за рахунок шару медії (р < 0,001), за відсутності статистично вірогідних змін товщини інтими (р > 0,05).
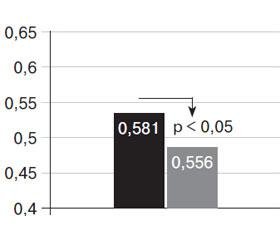
Внутрішній діаметр ЗСА в пацієнток основної групи достовірно перевищував цей показник у контрольній групі (0,580 ± 0,067 см проти 0,560 ± 0,048 см, р < 0,05), що може свідчити про структурну перебудову артерій і порушення їх еластичних властивостей, внаслідок чого вони стають більш дилатованими. Отже, за допомогою ультра–звукового дослідження стінки загальних сонних артерій виявлено, що в обох групах дослідження величина КІМ не досягнула патологічних значень — понад 0,90 мм згідно з міжнародними рекомендаціями, а зміни товщини судинної стінки відбувалися переважно за рахунок потовщення шару медії та збільшення внутрішнього діаметра ЗСА.
Для підтвердження провідної ролі АГ щодо гіпертрофії медії з основної групи було виділено підгрупу жінок, хворих на АГ (n = 55), зіставних із контрольною групою за основними факторами кардіометаболічного ризику. Зокрема, вік хворих становив 45,02 ± 5,61 року проти 44,40 ± 8,20 року; окружність талії — 78,10 ± 6,80 см проти 76,30 ± 8,20 см; індекс маси тіла — 28,21 ± 4,80 кг/м2 проти 26,02 ± 4,40 кг/м2; ЗХС — 4,80 ± 0,49 ммоль/л проти 4,78 ± 0,79 ммоль/л; холестерин ліпопротеїнів високої щільності (ХС ЛПВЩ) — 1,26 ± 0,29 ммоль/л проти 1,28 ± 0,49 ммоль/л; ХС ЛПНЩ — 3,25 ± 0,60 ммоль/л проти 3,12 ± 0,78 ммоль/л; тригліцериди — 1,11 ± 0,41 проти 1,09 ± 0,42 ммоль/л; глюкоза крові — 4,75 ± ± 0,49 ммоль/л проти 4,65 ± 0,59 ммоль/л; креатинін — 0,079 ± 0,010 ммоль/л проти 0,077 ± 0,010 ммоль/л; ШКФ — 96,9 ± 15,3 мл/хв/1,73 м2 проти 98,1 ± 19,0 мл/хв/1,73 м2 без достовірних міжгрупових відмінностей для всіх порівнянь.
Таким чином, у нашій вибірці хворі на АГ жінки були зіставні за основними показниками ліпідограми, глюкози, креатиніну крові та віком із жінками контрольної групи і відрізнялися від останніх тільки за товщиною КІМ і саме за рахунок шару медії (< 0,001). Тому ми можемо констатувати, що саме гіпертензія впливає в нашій вибірці жінок на ремоделювання стінки артерій переважно за рахунок потовщення шару медії.
Відомо, що розміри судинної стінки ЗСА залежать від віку людини. Відповідні кореляції в жінок контрольної групи становили: з КІМ (r = +0,58; р < 0,001), інтимою (r = +0,48; р < 0,001), медією (r = +0,54; р < 0,001) та діаметром (r = +0,58; р < 0,001), що може відображати процес фізіологічного старіння судин. В основній групі також виявлений прямий кореляційний зв’язок структурних складових судинної стінки ЗСА з віком: з КІМ (r = +0,26; р < 0,001), інтимою (r = +0,48; р < 0,001), медією (r = +0,56; р < 0,001) та діаметром (r = +0,40; р < 0,001), однак за середніми значеннями зростання цих показників спостерігалося прискорення темпів патологічного ремоделювання.
Для оцінки сили сумісного впливу АГ і віку на показники розмірів судинної стінки ЗСА був використаний двофакторний дисперсійний аналіз, який показав, що зміни товщини КІМ і шару медії на 30–32 % (К2 = 0,30 і К2 = 0,32; р < 0,001) обумовлені наявністю АГ і лише на 12–14 % (К2 = 0,14 і К2 = 0,12; р < 0,001) — віком (рис. 2).
Внесок АГ у зміни діаметра артерій був, навпаки, невеликим і становив 4,1 % (К2 = 0,041; р < 0,01). Достовірного впливу АГ на товщину інтими не відзначено (К2 = 0,007; р > 0,05), а потовщення інтими у хворих на АГ може бути обумовлене фізіологічним старінням судин (К2 = 0,035; р < 0,05) та іншими факторами.
Порівняння показників структури сонних артерій в основній і контрольній групах з урахуванням індексу маси тіла (ІМТ) показало, що в групі жінок, хворих на АГ, які мали нормальний ІМТ, комплекс інтима-медіа виявився достовірно товще (р < 0,01) саме за рахунок шару медії, ніж у жінок без АГ із нормальною масою тіла. Такі ж відмінності відзначались у групах пацієнток, які мали підвищений ІМТ (25 кг/м2 і вище): на тлі артеріальної гіпертензії КІМ і медіа були значно товще (р < 0,001), ніж у здорових жінок. Таким чином, у жінок основної групи, які мають надмірну вагу та ожиріння, структурна перебудова стінки артерій проявляється потовщенням КІМ, головним чином за рахунок шару медії. Причому наявність саме АГ більш істотно впливає на процес ремоделювання КІМ сонних артерій, ніж надмірна вага.
На рис. 3 подано дані двофакторного дисперсійного аналізу, за якими зміни товщини КІМ і шару медії на 26–29 % (К2 = 0,26 і К2 = 0,29; р < 0,001) обумовлені наявністю АГ і лише на 1,3–3,5 % (К2 = 0,035; р < 0,01 і К2 = 0,013; р < 0,01) — підвищеним ІМТ.
Збільшення діаметра судинної стінки, навпаки, здебільшого було пов’язане з наявністю надмірної ваги та ожиріння (К2 = 0,052; р < 0,01). Отже, можна відзначити, що вимірювання товщини шару медії дозволяє оцінити вплив метаболічного синдрому та ваги на ремоделювання судин.
За даними кореляційного аналізу, в основній групі виявлено обернений зв’язок ШКФ із товщиною КІМ (r = –0,36; р < 0,001) і шаром медії (r = –0,41; р < 0,001). Щодо шару інтими та діаметра ЗСА, то між ними і ШКФ усі кореляції виявилися недостовірними (p > 0,05). У здорових жінок достовірний зв’язок між ШКФ і структурними змінами судинної стінки не простежувався.
При аналізі показників вуглеводного обміну встановлено, що рівень глюкози відповідав нормативним значенням в обох групах дослідження і становив 4,65 ± 0,66 ммоль/л у контрольній групі та 4,91 ± 0,59 ммоль/л у жінок основної групи, але різниця між групами була статистично значущою (р < 0,05). У групі жінок, хворих на АГ, мав місце прямий кореляційний зв’язок рівня глюкози з товщиною КІМ (r = +0,37; р < 0,001), інтими (r = +0,27; р < 0,01) та медії (r = +0,31, р < 0,01). У контрольній групі між тими ж показниками значущої кореляції не виявлено.
Таким чином, як ми бачимо на рис. 3, у жінок основної групи виявлений кореляційний зв’язок комплексу інтима-медіа, шару медії та діаметра з індексом маси тіла, загальним холестерином, ХС ЛПНЩ, швидкістю клубочкової фільтрації, а товщини інтими — тільки з рівнем глюкози крові.
Потовщення медії в жінок основної групи асоціювалось зі збільшенням кінцевого діастолічного розміру і кінцевого діастолічного об’єму (r = +0,28; р < 0,01), кінцевого систолічного розміру і кінцевого систолічного об’єму (r = +0,33; р < 0,001), товщиною міжшлуночкової перетинки (r = +0,26; р < 0,01), товщиною задньої стінки (r = +0,31; р < 0,01) та індексом маси міокарда лівого шлуночка (ІММЛШ) (r = +0,33; р < 0,001), що вказує на більше значення гіпертрофії медії у формуванні раннього порушення розслаблення ЛШ та подальшого прогресування діастолічної дисфункції. За результатами порівняльного аналізу встановлено, що в групі жінок, хворих на АГ, які мали гіпертрофію ЛШ (ГЛШ), середні показники структури судинної стінки та діаметра були достовірно більші від показників в осіб із нормальною геометрією ЛШ: КІМ — на 11,1 %, інтими — на 8,3 %, медії — на 12,8 %, внутрішнього діаметра сонних артерій — на 7,2 % (р < 0,05). Ці залежності підтверджує достовірний кореляційний зв’язок ГЛШ із товщиною КІМ (r = +0,39; р < 0,001), медії (r = +0,31; р < 0,01), інтими (r = +0,27; р < 0,01) і діаметром судин (r = +0,32; р < 0,001). Таким чином, отримані результати свідчать про те, що ремоделювання лівого шлуночка в пацієнток із ГЛШ асоціюється з потовщенням стінки ЗСА, переважно за рахунок шару медії та збільшення діаметра.
Виявлені достовірні кореляційні зв’язки товщини КІМ і медії з рівнями систолічного артеріального тиску (САТ) (r = +0,30; р < 0,01 і r = +0,31; р < 0,01) та індексом часу САТ (r = +0,26; р < 0,01 і r = +0,26; р < 0,01), що підтверджує асоціацію ступеня АГ із судинним ремоделюванням. Тяжкість АГ знаходилась у прямому кореляційному зв’язку зі збільшенням діаметра судини (r = +0,22; р < 0,05) і потовщенням шару медії, але не інтими (r = +0,06; р > 0,05).
За даними багатофакторного дисперсійного аналізу, сукупний внесок цих факторів у зміни товщини КІМ становив 68 %. Зміни товщини шару медії в жінок, хворих на АГ, на 62 % були також обумовлені наявністю таких додаткових факторів серцево-судинного ризику, як вік, тривалість АГ, середній САТ, ІММЛШ, ХС ЛПНЩ, ШКФ і глюкоза крові.
Достовірні кореляційні зв’язки між шаром інтими та факторами ризику були наявні лише для показників ІММЛШ і рівня глюкози в крові, сукупний внесок яких у зміни інтими становив 26 %.
Обговорення
У закордонних виданнях зустрічаються поодинокі роботи, у яких є відомості про вимір шарів судинної стінки за допомогою ультразвукових сканерів із високою роздільною здатністю [8, 15].
Усі ці дослідження проводились за допомогою ультразвукового дуплексного сканування і були спрямовані на неінвазивне раннє виявлення атеросклерозу як основної патології, що впливає на серцево-судинну смертність у популяції [16, 17].
В Україні на сьогодні немає робіт, присвячених пошаровій оцінці інтими та медії, також немає і нормативних значень для цих параметрів, хоча можливості ультразвукових сканерів дозволяють вимірювати ці шари диференційовано. До останнього часу пропонувалося використовувати лише одне значення товщини КІМ (менше за 0,9 мм) для всіх категорій пацієнтів [18]. Існує дослідження, в якому розглядаються патоморфологічні особливості судинної стінки за різним перебігом АГ [19].
В нашому дослідженні вперше у жінок, хворих на АГ, детально вивчено перебудову судинної стінки ЗСА за допомогою методики пошарового ультразвукового сканування, що полягає у вимірах товщини інтими та медії окремо, що дозволило оцінити внесок гіпертензії в ремоделювання судин.
Робот, присвячених впливу додаткових факторів ризику на шар медії, в Україні та за кордоном немає. В основному дослідження направлені на вивчення впливу факторів ризику на товщину КІМ загалом [20].
У нашому дослідженні узагальнення результатів кореляційного аналізу показників розмірів стінки ЗСА і додаткових факторів серцево-судинного ризику в жінок, хворих на АГ, дозволило виділити основні з них. Зокрема, зміни товщини КІМ найбільше асоційовані зі старінням, тривалістю АГ, надмірною вагою, підвищенням САТ, ІММЛШ, рівня ХС ЛПНЩ, ШКФ і глюкози у крові.
Таким чином, у жінок основної групи з АГ виявлені кореляційні зв’язки КІМ і медії з додатковими факторами серцево-судинного ризику були схожі, а для інтими, навпаки, відрізнялися. Ці факти свідчать про те, що реалізація комплексного впливу багатьох додаткових факторів серцево-судинного ризику на формування потовщення КІМ у хворих на артеріальну гіпертензію відбувається саме через ремоделювання шару медії на відміну від хворих з атеросклеротичним ураженням судин.
Висновки
1. За даними ультразвукового дуплексного сканування, у жінок віком від 33 до 60 років з артеріальною гіпертензією І та ІІ стадії та морфологічною основою судинного ремоделювання на відміну від практично здорових жінок спостерігається збільшення товщини комплексу інтима-медіа від 0,050 до 0,068 см, переважно за рахунок потовщення шару медії від 0,030 до 0,042 см і збільшення внутрішнього діаметра артерій від 0,53 до 0,58 см за відсутності змін товщини шару інтими.
2. Установлено, що в жінок з есенціальною артеріальною гіпертензією і гіпертрофією лівого шлуночка середні показники структури судинної стінки сонних артерій та діаметра достовірно вищі від показників у жінок без гіпертрофії лівого шлуночка: комплекс інтима-медіа — на 11,1 %, шар інтими — на 8,3 %, шар медії — на 12,8 %, і перевищують такі ж показники в осіб із нормальною геометрією лівого шлуночка (р < 0,05).
3. За результатами багатофакторного дисперсійного аналізу, сукупний внесок таких факторів, як рівень систолічного артеріального тиску, індекс маси міокарда лівого шлуночка, швидкість клубочкової фільтрації, концентрація холестерину ліпопротеїнів низької щільності та глюкози, в прогресування потовщення комплексу інтима-медіа становить 68 % і збігається із впливом на шар медії — 62 % на відміну від інтими, де їх внесок становить 26 %.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Ковалева О.Н. Диагностическое значение определения комплекса интима-медиа для оценки особенностей ремоделирования и атеросклеротического поражения сосудов / О.Н. Ковалева, А.В. Демиденко // Практическая ангиология. — 2009. — № 1(20). — С. 33-41.
2. Питецька Н.І. Фокус на артеріальну гіпертензію у жінок з позиції кардіоваскулярного ризику / Н.І. Питецька, О.М. Ковальова // Український терапевтичний журнал. — 2012. — № 3-4. — С. 111-115.
3. Шайдюк О.Ю. Симпатическая активность и артериальная гипертония: возможности коррекции / О.Ю. Шайдюк, Е.О. Таратухин // Российский медицинский журнал. — 2013. — № 2(100). — С. 61-64.
4. Мельникова Л.В. Значение гемодинамических факторов в развитии ремоделирования сосудов мышечно-эластического типа при артериальной гипертензии / Л.В. Мельникова // Саратовский научно-медицинский журнал. — 2011. — Т. 7, № 1. — С. 76-79.
5. Функція ендотелію та товщина комплексу інтима-медіа у жінок з метаболічним синдромом на тлі полікістозу яєчників / [Мітченко О.І., Корнацька А.Г., Романов В.Ю., Сопко О.В.] // Український кардіологічний журнал. — 2013. — № 3. — С. 82-90.
6. Zanchetti A. Role of socio-economic factors, blood pressure measurement, and therapeutic strategies in hypertension / A. Zanchetti // J. Hypertens. — 2014. — Vol. 33. — P. 193-194.
7. Renna Nicolás F. Pathophysiology of vascular remodeling in hypertension / N.F. Renna, N. de las Heras, R.M. Miatello // Int. J. Hypertens. — 2013. — Vol. 4. — P. 36-42.
8. Skilton M.R. Carotid intima-media thickening: Comparison of new and established ultrasound and magnetic resonance imaging techniques / M.R. Skilton, L. Boussel, F. Bonnet // Athe–rosclerosis. — 2011. — Vol. 215. — Р. 405-410.
9. Ультразвуковое исследование брахиоцефальных артерий в клинической практике с позиций доказательной медицины / [Ярковая С.В., Сыволап В.В., Колесник М.Ю., Колесник Е.В.] // Запорожский медицинский журнал. — 2011. — Т. 13, № 3. — С. 69-73.
10. Joseph L. Hypertension primer. The essentials of high blood pressure. Basic science, population science, and clinical management / L. Joseph, Jr. Izzo. — [S. 1], 2012. — 593 p.
11. Common carotid intima-media thickness measurements in cardiovascular risk prediction: a meta-analysis / H.M. Den Ruijter, S.A. Peters, T.J. Anderson [et al.] // JAMA. — 2012. — Vol. 308(8). — P. 796-803.
12. Is there a differential impact of parity on blood pressure by age / J. Dratva, C. Schneider, C. Schindler [et al.] // J. Hypertens. — 2014. — Vol. 32. — P. 2146-2151.
13. Carotid ultrasound identifies high risk subclinical atherosclerosis in adults with low framingham risk scores / M.F. Eleid, S.J. Lester, T.L. Wiedenbeck [et al.] // J. Am. Soc. Echocardio–graphy. — 2010. — Vol. 23, № 8. — P. 802-808.
14. Naqvi T.Z. Carotid intima-media thickness and plaque in cardiovascular risk assessment / T.Z. Naqvi, M.S Lee // JACC Cardiovasc Imaging. — 2014. — Vol. 7(10). — P. 1025-1038.
15. Increased intima thickness of the radial artery in patients with coronary heart disease / W. Оsika, A. Myredal, Li Ming Gen [et al.] // Vascular Med. — 2009. — Vol. 15(1). — P. 33-37.
16. Милютина О.В. Возрастные особенности состояния общих сонных артерий у больных с изолированным течением артериальной гипертонии и хронической обструктивной болезнью легких и их сочетанием / О.В. Милютина, Е.Н. Чичерина // Российский кардиологический журнал. — 2010. — Т. 83, № 3. — С. 16-18.
17. Саджая Л.А. Возрастная динамика толщины комплекса интима-медиа у лиц пожилого и старческого возраста с артериальной гипертензией / Л.А. Саджая, Л.А. Тихонова, Л.И. Малинова // Саратовский науч.-мед. журн. — 2011. — Т. 7, № 3. — С. 611-614.
18. 2013ESH/ESC Guidelines for themanagement of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) [Електронний ресурс] // Eur. Heart. J. — 2013. — Режим доступу: DOI: 10.1093/eurheartj/eht.151.
19. Дановская Е.В. Морфометрические показатели толщины интимы-медии и диаметра сонных и бедренных артерий у умерших, страдавших артериальной гипертензией / Е.В. Дановская, Н.И. Яблучанский, Н.А. Ремнева // Вiсник Харкiвського нац. університету iм. В.Н. Каразiна. Сер. «Медицина». — 2007. — № 14(774). — С. 93-97.
20. Malinina Lidia I. Age dependent vascular remodeling in eldery patients with arterial hypertension / Lidia I. Malinina, Lilia A. Sadjaya, Lidia A. Tichonova // Rus. Open Med. J. — 2012. — Vol. 1. — P. 1-4.

/64-71/66-1.jpg)
/64-71/67-1.jpg)
/64-71/67-2.jpg)