Журнал «» 6 (50) 2016
Вернуться к номеру
Дайджест Конгресу Європейського товариства кардіологів — 2016, м. Рим (Італія) Частина 2
Рубрики: Кардиология
Разделы: Медицинские форумы
Версия для печати
Статтю опубліковано на с. 81-98
Огляд результатів найбільш важливих клінічних досліджень
Досягнення цільових рівнів ХС ЛПНЩ при гострому коронарному синдромі знижує ризик кардіоваскулярних подій краще, ніж стандартне лікування
Автор: Maria Vinall
Hobuhisa Hagivara, MD, Жіночий медичний університет, Токіо, Японія, зробив доповідь про результати дослідження Інституту серця Японії — рівень зниження ліпідів за допомогою пітавастатину й езетимібу при гострому коронарному синдромі (ГКС) (дослідження HIJ-PROPER), у якому було показано, що не було ніяких істотних переваг при додаванні езетимібу на фоні терапії пітавастатином у хворих із гострими коронарними синдромами. HIJ-PROPER — проспективне рандомізоване відкрите багатоцентрове дослідження із засліпленням кінцевих точок, яке проводилося з метою перевірки гіпотези про те, що зниження холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) до < 70 мг/дл за допомогою стандартної дози пітавастатину + езетимібу приведе до зменшення частоти розвитку серцево-судинних подій більшою мірою, ніж при застосуванні пітавастатину як монотерапії в пацієнтів із ГКС і дисліпідемією.
У дослідження були включені 1734 пацієнти (вік ≥ 20 років) з ГКС і дисліпідемією, які були госпіталізовані з інфарктом міокарда (ІМ) з елевацією сегмента ST і без неї або нестабільною стенокардією за 10 днів до рандомізації. Пацієнти, рандомізовані в групу комбінованої терапії, отримували 2 мг пітавастатину й 10 мг езетимібу як початкову дозу з орієнтацією на цільовий рівень ХС ЛПНЩ < 70 мг/дл, на той час як у групі монотерапії 2 мг пітавастатину цільовий рівень ХС ЛПНЩ становив 90–100 мг/дл (пацієнти, які вже отримували статини, припиняли їх прийом і переводились на 2 мг пітавастатину як початкову дозу). В обох групах добова доза пітава–статину була скоригована для досягнення відповідного цільового рівня ХС ЛПНЩ.
Композитна первинна кінцева точка включала смерть від усіх причин, фатальний інфаркт міокарда, нефатальний інсульт, нестабільну стенокардію, реваскуляризацію — черезшкірне коронарне втручання (ЧКВ) або аортокоронарне шунтування (АКШ). Вторинні кінцеві точки включали серцево-судинні події (нефатальний інфаркт міокарда, нефатальний інсульт, нестабільна стенокардія, викликана ішемією реваскуляризація — або ЧКВ, або АКШ), смерть від усіх причин, серцеву недостатність, вміст маркерів запалення й побічні ефекти (у тому числі поява нових злоякісних пухлин). Пацієнти спостерігалися протягом як мінімум 3 років. На момент початку дослідження середній вік учасників був 65,6 року, а середній індекс маси тіла становив 24,3 кг/м2; 75,5 % — чоловіки, 83,3 % були статинонаївними. Розподіл подій у ГКС: ІМ з елевацією сегмента ST (51,0 %), ІМ без елевації сегмента ST (10,5 %) і нестабільна стенокардія (38,5 %). Артеріальна гіпертензія була в 68 % хворих, а цукровий діабет — у 30 %. Середній рівень ХС ЛПНЩ при включенні в дослідження був 135 мг/дл (SD ± 30), середній рівень ситостеролу (маркер поглинання холестерину) — 2,50 мкг/мл. Реваскуляризація за допомогою ЧКВ була виконана в 94,5 % осіб.
У пацієнтів, які отримували пітавастатин та езетиміб протягом 1 року, порівняно з тими, хто отримував монотерапію пітавастатином, було досягнуто значно нижчий рівень ХС ЛПНЩ (67,5 мг/дл проти 87,2 мг/дл; P < 0,001), загального холестерину (142,7 мг/дл проти 165,3 мг/дл; P < 0,001), а також значення тригліцеридів (125,2 мг/дл проти 144,2 мг/дл; Р < 0,001). Проте зниження частоти розвитку комбінованої первинної точки протягом 3 років серед пацієнтів, які отримували інтенсивну холестеринознижуючу терапію комбінацією пітавастатну й езетимібу, достовірно не відрізнялося від зниження, досягнутого в групі монотерапії пітава–статином (32,8 проти 36,9 %; ВР 0,89; 95% ДІ від 0,76 до 1,04; P = 0,152).
Також не було ніяких істотних відмінностей між групами щодо вторинних кінцевих точок (серцево-судинної смерті, нефатального інфаркту міо–карда або нефатального інсульту) та безпечності терапії.
Також не виявлено ніяких відмінностей між обома терапевтичними підходами для основних попередньо визначених підгруп за віком, наявністю діабету, попередньою гіполіпідемічною терапією або медіаною початкового рівня ХС ЛПНЩ. Проте в пацієнтів із початково вищим рівнем ситостеролу (≥ 2,2 мкг/мл) при поєднанні пітава–статину й езетимібу зниження ризику розвитку ускладнень було більшим, ніж у групі монотерапії пітавастатином (ВР 0,71; 95% ДІ від 0,56 до 0,91; P = 0,006). З огляду на це професор Hagivara висловив думку, що ситостерол може бути потенційним терапевтичним маркером для лікування дисліпідемії у хворих із ГКС.
OPTICARE: дослідження ефекту додавання індивідуалізованого плану до стандартної кардіологічної реабілітації пацієнтів із ГКС
Автор: Maria Vinall
Ron T. Van Domburg, доктор медичних наук, Erasmus Medical Center, Роттердам, Нідерланди, подав результати дослідження OPTICARE, у якому були вивчені ефекти 2 альтернативних програм кардіологічної реабілітації (КР) для пацієнтів з недавнім гострим коронарним синдромом. Альтернативні методи лікування не покращили результати впливу на первинну кінцеву точку, оцінену за системою SCORE. Проте була помічена певна користь щодо рівня холестерину, статусу куріння, а також якості життя серед більш мотивованих пацієнтів. OPTICARE було одноцентровим відкритим багатопрофільним рандомізованим контрольованим дослідженням переваг додаткових заходів кардіологічної реабілітації у період до 1 року після її початку й упродовж подальшого 6-місячного спостереження. Метою було порівняння впливу 2 розширених програм КР, призначених для заохочення пацієнтів із ГКС щодо запровадження здорового способу життя, поряд із стандартною сучасною КР. Первинною кінцевою точкою була зміна рівня серцево-судинного ризику за шкалою SCORE через 18 місяців після рандомізації. На додаток до віку й статі шкала ризику SCORE містить 3 змінні параметри ризику: систолічний АТ, рівень загального холестерину й статус куріння. Вторинною кінцевою точкою була зміна параметрів якості життя, тривоги й щоденної фізичної активності. Було проведено аналіз за принципом наміру призначеного лікування (ITT) і аналіз лікування відповідно до протоколу (РР) (вважається, що останній враховує більш мотивованих пацієнтів). Дослідження включало дорослих пацієнтів із задокументованим ГКС. Не дозволялося включати хворих із серцевою недостатністю, фракцією викиду < 40 %, психологічними або когнітивними порушеннями, хронічними обструктивними захворюваннями легень, а також осіб із нирковою недостатністю. Відібрані пацієнти були випадковим чином розподілені на 1 із 3 режимів лікування: стандартна КР плюс 3 індивідуальні сесії фізичних тренувань (КР + ІФТ) та 3 групи сесій, що включали фітнес-тренування й консультування щодо способу життя (КР + Ф, n = 309); стандартна КР плюс 5–6 телефонних консультативних сесій із здорового способу життя (КР + T, n = 299) або стандартна КР (КР, n = 306). Середній вік учасників був 57 років; більшість із них були чоловіками. 75–81 % пацієнтів на початковому рівні мали попереднє черезшкірне коронарне втручання і 42–45 % були курцями до розвитку ГКС. Більшість пацієнтів отримували оптимальне лікування (наприклад, 70 % приймали інгібітори ангіотензинперетворюючого ферменту, 84 % — бета-блокатори, а 97 % — статини). Майже всі пацієнти (97 %) приймали аспірин, 86 % були призначені тієнопіридини. Рівень ризику за шкалою SCORE через 18 місяців суттєво не відрізнявся в усіх 3 групах лікування за результатами аналізу будь-якого типу — ITT або PP. Що стосується впливу на індивідуальні фактори серцевого ризику, що входять у шкалу SCORE, то відмічено, що на основі даних аналізу ITT програма КР + ІФТ порівняно з групами тільки КР або КР + T достовірно покращувала вплив на рівень загального холестерину (P < 0,001). Аналіз РР виявив: у групах КР + ІФТ і КР + T значно (P < 0,05) зменшилася частота куріння й знизився рівень загального холестерину (КР + ІФТ, P < 0,001; КР + T, P < 0,05), а також покращилися показники якості життя (КР + ІФТ, P = 0,004; CR + Т, Р = 0,04) порівняно з групою тільки КР. Відсоток пацієнтів із цільовим рівнем 6 із 9 факторів ризику через 18 місяців був значно більшим (P = 0,004) і рівень тривоги був нижчим у групі КР + ІФТ порівняно з групою тільки КР (аналіз PP). У дослідженні не було виявлено ніяких відмінностей за частотою розвитку серцево-судинних подій між різними групами протягом 18 місяців. Автори вважають, що жодна з досліджених розширених програм КР не забезпечила додаткових переваг порівняно зі стандартною КР щодо рівня ризику за шкалою SCORE, ймовірно, через те, що більшість пацієнтів уже досягли цільових рівнів для модифікованих факторів ризику шкали SCORE до рандомізації, яка відбулася через 6 тижнів після ГКС (тобто коли мав місце максимальний ефект дії). Аналіз PP показав переваги для обох альтернативних протоколів КР порівняно із застосуванням тільки стандартної КР.
Навіть помірне довгострокове зниження ХС ЛПНЩ і САТ може значно зменшити довічний ризик серцево-судинних захворювань
Автор: Maria Vinall
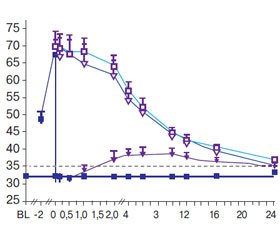
Brian A. Ference, доктор медичних наук, магістр філософії, відділ серцево-судинної медицини Державного університету Wayne, Детройт, штат Мічиган, США, навів дані, які показують, що втручання з навіть помірним зниженням холестерину ліпопротеїнів низької щільності й систолічного артеріального тиску (САТ) мають потенціал щодо зниження серцево-судинного (СС) ризику при довгостроковій експозиції. Мета даного дослідження із використанням 2 × 2 факторіального менделівського розподілу полягала в тому, щоб оцінити причинно-наслідковий зв’язок комбінованого впливу низького рівня ХС ЛПНЩ і САТ, пов’язаного з поліморфізмом генів, на ризик великих судинних подій (ВСП). У дослідження були включені загалом 102 773 чоловіки і жінки віком від 27 до 100 років, які увійшли в 14 проспективних когортних досліджень або обсерваційних досліджень із дизайном «випадок-конт–роль». Дослідники сконструювали генетичну шкалу ХС ЛПНЩ, засновану на поліморфізмі 46 генів, яка природним чином рандомізувала учасників дослідження на вищі або більш низькі рівні холестерину, і генетичну шкалу САТ, засновану на поліморфізмі 33 генів, що дозволила природно рандомізувати учасників на більш високі або низькі рівні САТ. Процедура менделівської рандомізації учасників дослідження на 4 групи подана на рис. 1.
Первинною кінцевою точкою був розвиток ВСП, що включала комбінацію виникнення первинної коронарної смерті, інфаркт міокарда, інсульт або реваскуляризацію внаслідок ішемії. Вторинні кінцеві точки включали основні коронарні події та ішемічну хворобу серця (ІХС). Середній вік пацієнтів становив 60,7 року; 57 % становили жінки. Середнє значення ХС ЛПНЩ було 3,4 ммоль, середній рівень холестерину не-ЛПНЩ був 4,0 ммоль, а середній рівень САТ — 126,5 мм рт.ст. (табл. 1). У цілому за 32 роки спостереження сталося 14 368 ВСП. В осіб із показниками ХС ЛПНЩ нижче від медіани його рівень був на 12,1 мг/дл (0,3 ммоль) нижче, і, відповідно, вони мали меншу частоту розвитку ВСП — на 22 % (ВШВСП 0,783; 95% ДІ від 0,755 до 0,812; P = 3,0 • 10–40). Після корекції на стандартне зниження виявилося, що зниження вмісту ХС ЛПНЩ на кожен ммоль/л було асоційоване із зниженням ризику розвитку серцево-судинних подій на 54 %. Це значно більше, ніж зменшення ризику серцево-судинних захворювань на 1 ммоль/л зниження ХС ЛПНЩ, що спостерігалося за даними метааналізу короткострокових досліджень зі статинами (Pdiff = 8,0 • 10–19) (Cholesterol Treatment Trialists’ Collaboration // Lancet. 2010). Подібно до цього тривалий вплив з метою зниження на 10 мм рт.ст. рівня САТ був пов’язаний із зменшенням ризику серцево-судинних захворювань на 44,7 %. Знову ж таки, ця величина була значно більшою, ніж зменшення серцево-судинного ризику на 20 % при зниженні САТ на 10 мм рт.ст. за даними метааналізу короткострокових досліджень із зниження АТ (Pdiff = 1,6 • 10–9) (Ettehad D. та ін. // Lancet. 2016). В осіб з обома рівнями генетичних шкал ХС ЛПНЩ та САТ нижче від середнього ризик розвитку ВСП був на 46 % меншим (рис. 2). Ці дані підтверджують, що обидва фактори — ХС ЛПНЩ та САТ — разом мають причинний і кумулятивний вплив на ризик розвитку серцево-судинних захворювань. Ефект тривалої дії більш низького вмісту ХС ЛПНЩ та низького САТ був однаковим для всіх серцево-судинних кінцевих точок і всіх підгруп, які досліджували, без ознак будь-якої істотної гетерогенності ефекту. Більша величина зниження серцево-судинного ризику, ніж та, що спостерігалася в дослідженнях із застосуванням фармакотерапії, найбільш ймовірно пояснюється впливом тривалої (довічної) різниці у величинах факторів ризику в цій когорті. Тому що їх ефект є мультиплікативним і накопичується протягом довгого часу. Отже, тривалий вплив комбінації навіть помірно нижчих рівнів ХС ЛПНЩ та САТ має потенціал щодо значного зменшення довічного ризику серцево-судинних захворювань навіть серед людей з очевидним нормальним рівнем холестерину та АТ.
ODYSSEY ESCAPE: алірокумаб знижує частоту аферезу ліпопротеїнів у пацієнтів з гетерозиготною сімейною гіперхолестеринемією
Автор: Toni Rizzo
Нелікована сімейна гіперхолестеринемія (СГХ) асоційована із значним підвищенням вмісту ХС ЛПНЩ і високим ризиком передчасної ішемічної хвороби серця (Ito M.K. et al. // J. Clin. Lipidol. 2011). Незважаючи на застосування ліпідознижуючої терапії, багато пацієнтів з СГХ не досягають цільових рівнів ХС ЛПНЩ (Huijgen R. et al. // PLoS One. 2010) і вимагають проведення аферезу ліпопротеїнів щотижня або через тиждень, що є дорогим, забирає багато часу та є інвазивною процедурою (Reiner Z. et al. // Eur. Heart J. 2011; Bays H.E. et al. // J. Clin. Lipidol. 2014). Аферез ліпопротеїнів різко зменшує вміст ХС ЛПНЩ на 50–75 %, що забезпечує зниження рівня ХС ЛПНЩ у середньому приблизно на 30 % за період між процедурами аферезу (Nordestgaard B.G. et al. // Eur. Heart J. 2013). Алірокумаб являє собою повністю людські моноклональні антитіла до PCSK9 і, як було показано, може зменшити рівні ХС ЛПНЩ до 62 % при використанні як у монотерапії, так і в комбінації із статинами, з іншою гіполіпідемічною терапією або без неї (Robinson J.G. et al. // N. Engl. J. Med. 2015). Дослідження ODYSSEY ESCAPE висвітлив Patrick M. Moriarty, доктор медичних наук з медичного центру Університету Канзасу, Канзас-Сіті, Канзас, США. Метою дослідження було оцінка впливу алірокумабу в дозі 150 мг кожні 2 тижні на частоту лікування аферезом ліпопротеїнів у хворих із гетерозиготною СГХ (ГСГХ) (Moriarty P.M. et al. // Eur. Heart J. 2016). Усього в дослідження були включені 62 пацієнти з ГСГХ, які лікувалися аферезом ліпопротеїнів щотижня або раз на два тижні в центрах у США або Німеччині. Хворі були рандомізовані на лікування алірокумабом 150 мг один раз на 2 тижні (n = 41) або плацебо (n = 21) протягом 18 тижнів. Пацієнти стабільно приймали ліпідознижуючу терапію, і їм постійно проводили процедуру аферезу ліпопротеїнів щотижня протягом ≥ 4 тижнів або кожні 2 тижні протягом ≥ 8 тижнів. Протягом перших 6 тижнів пацієнти залишалися на вже встановленому фіксованому графіку проведення аферезу. З 7-го до 18-го тижня процедуру аферезу проводили, тільки якщо вміст ХС ЛПНЩ був на < 30 % нижчим за початковий. Первинною кінцевою точкою була частота проведення процедури аферезу з 7-го до 18-го тижня, нормалізована на кількість запланованих на цей період процедур аферезу. Вторинні кінцеві точки включали ефект алірокумабу на інші ліпіди та безпеку й переносимість алірокумабу. Рандомізація корегувалася за частотою процедур аферезу (щотижня або через тиждень) і нормальним (< 30 мг/дл) або підвищеним (> 30 мг/дл) умістом ліпопротеїну(а). Початково частота аферезу була однаковою в обох групах. При рандомізації 46,3 % пацієнтів у групі алірокумабу та 61,9 % у групі плацебо приймали будь-який статин; 63,4 % у групі алірокумабу та 76,2 % у групі плацебо приймали іншу (не статини) гіполіпідемічну терапію. У групі алірокумабу з 7-го до 18-го тижня спостерігалося додаткове зниження на 75 % стандартизованої частоти процедур аферезу ліпопротеїнів порівняно з групою плацебо (медіанна оцінка різниці лікування за Ходжес — Леманн: 0,75; 95% ДІ від 0,67 до 0,83; P < 0,0001; рис. 1). Протягом цього періоду в 63,4 % пацієнтів, яких лікували алірокумабом, не було жодної процедури лікування аферезом і 92,7 % мали ≥ 50% зниження частоти виконання аферезу. У пацієнтів, які отримували алірокумаб, порівняно з групою плацебо спостерігалося достовірне зниження рівня ХС ЛПНЩ порівняно з початковим рівнем на 6-му (–53,7 % проти +1,6 %; P < 0,0001) і 18-му тижні (–42,5 % проти +3,9 %; P < 0,0001; рис. 2). На фоні терапії алірокумабом достовірно знижувався вміст аполіпопротеїну B та ХС не-ЛПВЩ порівняно з групою плацебо (р < 0,0001). Не виявлено достовірної різниці в зниженні вмісту ліпопротеїну(а) в групі алірокумабу та плацебо. Частота розвитку побічних ефектів у групах лікування була подібною: у група алірокумабу — 75,6 % і плацебо — 76,2 %. Отже, дослідження ODYSSEY ESCAPE продемонструвало, що лікування алірокумабом достовірно знижувало частоту аферезу ліпопротеїнів у хворих на ГСГХ, у яких не було досягнуто рекомендованих рівнів ХС ЛПНЩ до такої терапії. Лікування за допомогою алірокумабу в дозі 150 мг кожні 2 тижні може дозволити пацієнтам із ГСГХ припинити аферез ліпопротеїнів або зменшити його частоту. Через те що процедура аферезу є дорогою (у США — близько 2500 $ за сесію), вимагаю значного часу (4 години) і доступна тільки в деяких містах, використання інгібітору PCSK9 з метою зменшення потреби в аферезі в пацієнтів з ГСГХ є важливим кроком уперед у лікуванні цих пацієнтів із високим ризиком.
У дослідженні CE-МАRК 2 показано, що керована кардіо-МРТ-стратегія лікування знижує відсоток непотрібних ангіографій
Автор: Phil Vinall
John P. Greenwood, MB, ChB, доктор філософії, Загальний госпіталь Лідса, Сполучене Королівство, зробив доповідь, у якій показано, що обстеження пацієнтів з підозрою на ІХС із використанням магнітно-резонансної томографії серцево-судинної системи (кардіо-МРТ) або сцинтиграфічної оцінки перфузії міокарда за допомогою однофотонної емісійної комп’ютерної томографії (ОФЕКТ) привело до зменшення числа непотрібних інвазивних коронарних ангіографій порівняно з пацієнтами, лікованими за рекомендаціями Національного інституту клінічної майстерності (NICE) 2010 р. Попередні дослідження показали слабку кореляцію між аномальними результатами неінвазивного тестування та ймовірністю обструктивного захворювання коронарної артерії за даними селективної коронарографії (Patel M.R. et al. // Am. Heart J. 2014; Patel M.R. et al. // N. Engl. J. Med. 2010); при цьому використання передтестової моделі ймовірності ІХС може перебільшувати ризик її наявності, парадоксально збільшуючи ймовірність необхідності проведення інвазивної коронарографії (Fox К.А., McLean С. // Heart. 2010). У цьому новому дослідженні перевірили гіпотезу про те, що керована кардіо-МРТ-стратегія перевершує ефективність рекомендацій NICE та керованої результатами ОФЕКТ стратегії надання допомоги в зниженні необхідності проведення інвазивної ангіографії у хворих на ІХС. Це було рандомізоване дослідження в паралельних групах у пацієнтів віком ≥ 30 років з підозрою на стенокардію, які були придатні для реваскуляризації й мали передтестову ймовірність ІХС на рівні 10–90 %. Пацієнти з неангінальним болем у грудях або ті, яким уже були проведені процедури на серці, були виключені. Первинною кінцевою точкою була частота непотрібних процедур інвазивної коронароангіографії протягом 12 місяців, яка визначалася на основі нормальної (> 0,8) величини фракційного резерву потоку або нормальних показників кількісної коронарної ангіографії в усіх судинах ≥ 2,5 мм у діаметрі. Вторинними кінцевими точки були позитивні дані ангіографії та розвиток великих кардіальних подій (ГКС, серцево-судинна смерть, інфаркт міокарда, процедура незапланованої реваскуляризації та госпіталізація внаслідок серцево-судинних причин). Учасники були рандомізовані в групи ведення відповідно до результатів кардіо-МРТ (n = 481), ОФЕКТ (n = 481) або згідно з рекомендаціями NICE (n = 240) і відповідно були включені в аналіз (Rip–ley D.P. et al. // Am. Heart J. 2015). Пацієнти, включені в дослідження (середній вік 56,3 року; 46,9 % — жінки), мали істотний тягар серцево-судинних факторів ризику та скаржилися на біль у грудях як основний симптом. На початку середня передтестова ймовірність ІХС становила 49,5 % (23,8 %).
Через 12 місяців спостереження 22,0 % від усіх пацієнтів пройшли ангіографію (у групі NICE — 42,5 %, кардіо-МРТ — 17,7 %, ОФЕКТ — 16,2 %). Частота непотрібної ангіографії, за визначенням дослідження, була в групі NICE 28,8 %, кардіо-МРТ — 7,5 %, ОФЕКТ — 7,1 %. Скориговане відношення шансів непотрібної інвазивної ангіографії для керованої кардіо-МРТ-стратегії проти NICE-керованої медичної допомоги становило 0,21 (95% ДІ від 0,12 до 0,34; P < 0,001) і 1,27 для кардіо-МРТ проти ОФЕКТ (95% ДІ 0,79 до 2,03; P = 0,32). Позитивні показники ангіографії були у 12,1; 9,8 і 8,7 % у групах NICE, кардіо-МРТ та ОФЕКТ відповідно (P = 0,36). Після як мінімум однорічного періоду спостереження 36 (3,0 %) пацієнтів мали принаймні один випадок великих коронарних ускладнень (рис. 1), але не було ніякої різниці в частоті його виникнення між 3 групами. Отже, використання функціональної візуалізації першої лінії (кардіо-МРТ або ОФЕКТ) зменшує ймовірність непотрібних процедур ангіографії порівняно з керівними рекомендаціями стратегії NICE (ВШ 0,048; 95% ДІ від 0,023 до 0,10; P < 0,001) у пацієнтів із високою (61–90 %) передтестовою ймовірністю наявності ІХС. Професор Greenwood дійшов висновку, що в пацієнтів із підозрою на стенокардію проведення кардіо-МРТ-дослідження дає нижчу ймовірність проведення непотрібної ангіографії, ніж керований рекомендаціями NICE принцип ведення таких хворих. Не було виявлено істотної різниці між кардіо-МРТ і ОФЕКТ-керованими стратегіями, а також не було ніяких істотних відмінностей у частоті розвитку коронарних ускладнень протягом 12 місяців серед 3 стратегій, які порівнювали.
Позитронно-емісійна томографія є кращим інструментом візуалізації для діагностики ішемії міокарда: результати дослідження PACIFIC
Автор: Maria Vinall
Ibrahim Danad, доктор медичних наук, Медичний центр університету Ву, Амстердам, Нідерланди, доповів про останні результати дослідження PACIFIC, які показали, що позитронно-емісійна томографія (ПЕТ) є більш точною, ніж однофотонна емісійна комп’ютерна томографія (ОФЕКТ) або коронарна ангіографія на комп’ютерному томографі (КТКА), у діагностиці ішемічної хвороби серця (ІХС). Візуалізація коронарної перфузії під час стрес-навантаження із використанням магнітно-резонансної томографії, КТ або ПЕТ може точно виключити гемодинамічно значущий стеноз при ІХС (Takx R. et al. // Circ. Cardiovasc. Imaging. 2015). Поточна настанова Європейського товариства кардіологів для діагностики ІХС рекомендує використовувати анатомічну або функціональну візуалізацію серця або їх комбінацію (ESC Taskforce // Eur. Heart J. 2014). Основною метою дослідження PACIFIC було встановлення діагностичної точності КТКА, ОФЕКТ і ПЕТ при прямому порівняльному дослідженні для діагностики ІХС порівняно з функціональним резервом потоку (ФРП). Вторинна мета полягала в тому, щоб дослідити додаткове діагностичне значення гібридної візуалізації серця порівняно з візуалізацією за допомогою одного методу. У дослідження були включені стабільні пацієнти (вік > 40 років) з підозрою, але без абсолютних анамнестичних даних відносно ІХС, з проміжною передтестовою ймовірністю її наявності, нормальною функцією лівого шлуночка за даними ехокардіографії, у яких були згадані клінічні підстави для інвазивної коронарографії. PACIFIC — проспективне дослідження за участю 208 стабільних пацієнтів, яким було проведено інвазивну коронароангіографію з подальшим проведенням КТКА, ОФЕКТ і ПЕТ, а також деякі гібридні комбінації результатів ПЕТ і КТКА або КТКА і ОФЕКТ, направлені на об’єднання функціональних і анатомічних оцінок. Значимим було визнано стенотичне ураження артерій ≥ 50 %. Первинною кінцевою точкою дослідження було визначення гемодинамічно значимого стенозу в ≥ 1 коронарній артерії, який визначали на основі величини ФРП ≤ 0,80, або стенозу > 90 %, якщо значення ФРП було недостатнім. Для порівняння чутливості, специфічності й діагностичної точності типів візуалізації використовували тест McNemar. Середній вік пацієнтів був 58 років; 64 % становили чоловіки. Більше половини учасників мали сімейну історію ІХС (51 %), 48 % палили, 40 % мали гіперхолестеринемію, 46 % мали АГ. Використання медикаментозної терапії було високим: 87 % пацієнтів приймали аспірин, 77 % — статини і 64 % — бета-блокатори. Передтестова ймовірність ІХС була визначена як проміжна в 90 % пацієнтів. Коронарографія показала, що 44,2 % пацієнтів мали гемодинамічно значимий стеноз коронарних артерій. Порівняно з результатами коронарної ангіографії діагностична точність ПЕТ була значно кращою (85 %), ніж КТКА (74 %; р = 0,003) або ОФЕКТ (77 %; р = 0,02). Діагностичний точність не покращилась від гібридного використання КТКА/ОФЕКТ (76 %; P = NS) або КТКА/ПЕТ (84 %; P = NS), але це привело до збільшення хибнонегативних і зниження хибнопозитивних результатів для кожного окремого типу візуалізації (P < 0,001). Це було перше проспективне пряме порівняльне дослідження, у якому результати ПЕТ продемонстрували більш високу точність діагностики ішемії міокарда порівняно з ОФЕКТ або КТКА. Крім того, комбінована анатомічна й функціональна оцінка (гібридна візуалізація) не мала додаткового діагностичного значення й підвищувала ризик прийняття неправильних клінічних рішень.
ПРАГА-18: немає різниці в результатах лікування прасугрелем та тикагрелором у хворих на ГІМ, яких лікували за допомогою ЧКВ
Автор: Maria Vinall
Дослідження ПРАГА-18 (Motovska Z. et al. // Circulation. 2016) є прямим порівнянням ефективності прасугрелю й тикагрелору у хворих із гострим інфарктом міокарда (ГІМ), яких лікували за допомогою негайного або первинного ЧКВ-втручання. Результати дослідження ПРАГА-18 були подані доктором медичних наук Petr Widimsky з Карлового університету (Прага, Чеська Республіка). У своєму виступі він навів результати одномісячного спостереження й показав відсутність різниці між групами в результатах лікування. Дослідження було достроково припинене через подальшу недоцільність. ПРАГА-18 було сплановане як пряме порівняльне дослідження прасугрелю й тикагрелору у хворих або з ІМ з елевацією ST, або з високим ризиком ІМ без елевації ST, яким було проведено ЧКВ. Первинною кінцевою точкою була комбінація смерті, повторного інфаркту, інсульту, сильної кровотечі або термінової повторної реваскуляризації інфаркт-зв’язаної артерії протягом 7 днів (або при виписці, якщо вона відбулася раніше). Ключовою вторинною кінцевою точкою була комбінація серцево-судинної смерті, нефатального інфаркту міокарда або інсульту протягом 30 днів. У дослідження включали як літніх пацієнтів, так і пацієнтів з усіма класами за Killip (5 % хворих із класом III–IV за Killip) з ІМ з елевацією ST (ІМ без елевації ST з триваючою ішемією), яким була проведена ургентна коронарографія та запланована ЧКВ. Включені пацієнти (середній вік 62 роки; в основному чоловіки) відразу після того, як були доставлені в центри для ЧКВ, були рандомізовані на прийом або прасугрелю (n = 634; 60 мг перорально, а потім 10 мг/добу протягом 1 року (5 мг/добу, якщо > 75 років або < 60 кг)), або тикагрелору (n = 596; 180 мг перорально з наступним прийомом по 90 мг два рази на добу протягом 1 року). Через 7 днів не було ні–яких істотних відмінностей між гілками лікування за впливом на первинну кінцеву точку: смерть, повторний інфаркт, інсульт, сильна кровотеча й термінова повторна реваскуляризація (прасугрель — 4,0 % і тикагрелор — 4,1 %; ВШ 0,98; 95% ДІ від 0,55 до 1,73; P = 0,939). Результати лікування за впливом на вторинну кінцеву точку протягом 30 днів також істотно не відрізнялися (прасугрель — 2,7 %; тикагрелор — 2,5 %; ВШ 1,06; 95% ДІ від 0,53 до 2,15; P = 0,864). Більшість пацієнтів продовжували прийом даних препаратів після виписки до 30-го дня або до смерті (прасугрелю — 74 %; –тикагрелору — 64 %).
Також не було виявлено ніяких істотних відмінностей для будь-якого з інших заздалегідь визначених результатів протягом 7 днів (термінова повторна реваскуляризація цільової судини, серйозна кровотеча, що вимагала переливання крові або тривалого перебування в стаціонарі, рівень перфузії за шкалою TIMI-3 після первинного ЧКВ) або 30 днів (смертність від усіх причин, повторний інфаркт, інсульт/ТІА або явний тромбоз стента).
ENSURE-AF: едоксабан безпечний та має подібну до варфарину ефективність для проведення кардіоверсії при фібриляції передсердь
Автор: Mary Mosley
Результати найбільшого проспективного рандомізованого контрольованого дослідження антикоагулянтів у пацієнтів із фібриляцією передсердь (ФП), яким проведено електричну кардіоверсію, показали, що прямий пероральний антикоагулянт едоксабан був безпечний і мав такий же ефект на первинні кінцеві точки, як і стандартний підхід із застосуванням еноксапарину в поєднанні з антагоністом вітаміну К (АВК). Результати були подані Andreas Goette, доктором медичних наук, госпіталь Св. Вінсента в Падерборні і Університетська лікарня Магдебурга, Німеччина. Результати дослідження ENSURE-AF були одночасно опубліковані (Goette et al.) у журналі Lancet (2016). Дані із ретроспективного аналізу чотирьох нових пер–оральних антикоагулянтів (НПАК) з відмінним від АВК механізмом дії (Renda G. et al. // Am. J. Med. 2016) і дані рандомізованого дослідження X-VERT (Cappato R. et al. // Eur. Heart J. 2014) навели на думку, що НПАК можуть бути безпечною альтернативою АВК, рекомендованим в даний час, ефект яких пов’язаний із більшою варіабельністю в організмі хворого та між пацієнтами і вимагає моніторингу цільового діапазону INR. Відкрите міжнародне дослідження, фаза 3b, рандомізувало 2199 пацієнтів із ФП, яким заплановано проведення електричної кардіоверсії через ≥ 48 годин, але ≤ 12 місяців, яким призначали антикоагулянтну терапію едоксабаном 1 раз на день (як мінімум за 2 години до кардіоверсії) або комбінацією еноксапарину/варфарину (INR 2,0–3,0). Також були проведені три додаткові стратифікації: 1) кардіоверсія була керована за допомогою трансторакальної ехокардіографії (КТЕ) або кардіоверсія не керувалася даними ехокардіографії (не-КТЕ); 2) за попереднім прийомом антикоагулянтів; 3) за дозою едоксабану (60 мг один раз або 30 мг двічі на день). Більш низька доза едоксабану призначалася пацієнтам зі зниженою функцією нирок (кліренс креатиніну ≥ 15 мл/хв і ≤ 50 мл/хв), низькою масою тіла (≤ 60 кг) або тим, хто приймав потенційні інгібітори Р-глікопротеїну. Початкова характеристика хворих наведена в табл. 1. Середній вік становив 64 роки, більшість з них — чоловіки (66 %), і середній бал CHA2DS2-Vasc становив 2,6. Для обох гілок лікування кардіоверсія проводилась через 2 дні у підгрупі КТЕ і 23 дні в підгрупі не-КТЕ. Слід зазначити, що еноксапарин був використаний під час включення пацієнтів у дослідження, але його введення зупиняли, коли величина МНВ була > 2,0 і мали значення в терапевтичному діапазоні в 70,8 % хворих на варфарині. Оцінка ефективності за допомогою первинної комбінованої кінцевої точки, що включала інсульт, системну емболію, інфаркт міокарда та смертність від серцево-судинних причин на 56-й день після кардіоверсії, показала тенденцію в сторону зниження (0,5 % у групі едоксабану проти 1,0 % у групі еноксапарину/АВК; ВР 0,46, 95% ДІ від 0,12 до 1,43) частоти ішемічних подій у загальній групі, а також в обох підгрупах КТЕ (рис. 1). Основним результатом при оцінці безпеки була частота розвитку великих і клінічно значимих невеликих кровотеч на 31-й день після кардіоверсії. Результати показали, що було 16 таких подій у групі едоксабану й 11 подій у групі еноксапарину/ВКА, за частотою розвитку подій — 1,5 проти 1,0 % (ВШ 1,48; 95% ДІ від 0,64 до 3,55). Тяжкі кровотечі були нечастими, 3 і 5 подій (0,3 проти 0,5 %) у групі едоксабану та групі порівняння відповідно (ВШ 0,61; 95% ДІ від 0,09 до 3,13). Тяжкість кровотеч були подібною (3,0 проти 3,2 %; ВШ 0,93; 95% ДІ від 0,55 до 1,55). Вторинна комбінована точка клінічної ефективності включала інсульт, системну емболію, серцево-судинну смерть і сильну кровотечу. Спостерігалася також тенденція до кращого результату в групі едоксабану: 8 подій проти 16 у групі еноксапарину/АВК; частоти подій становила 0,7 % проти на 1,4 % (ВШ 0,50; 95% ДІ від 0,19 до 1,25). Функція нирок не впливала на результати. Отже, застосування едоксабану видається ефективною й безпечною альтернативою стандартній терапії еноксапарином/АВК для пацієнтів із фібриляцією передсердь, яким необхідна електрична кардіоверсія, і такий підхід може дозволити більш швидке виконання кардіоверсії після початку прийому пер–оральних антикоагулянтів.
Андексанет альфа знижує активність фактора Xa в пацієнтів із гострою тяжкою кровотечею в дослідженні ANNEXA-4
Автор: Phil Vinall
Stoart J. Connoly, співробітник Науково-дослідного інституту в галузі охорони здоров’я Університету Мак-Мастер, Гамільтон, Онтаріо, Канада, повідомив, що в дослідженні ANNEXA-4 (Connolly S.J. et al. // N. Engl. J. Med. 2016) рекомбінантний модифікований білок фактора Xa (фXa) — андексанет альфа — ефективно відновлював активність фXa в пацієнтів із гострою кровотечею протягом 18 годин з моменту прийому інгібітору фXa.
Андексанет альфа являє собою рекомбінантний модифікований людський фXа, який було розроблено як специфічний антидот прямих і непрямих інгібіторів фXa. У здорових добровольців продемонстровано високі ефективність та безпеку препарату в розблокування фХА (Mar F. et al. // Neurosurgery. 2016). Метою дослідження ANNEXA-4 було оцінити ефективність та безпечність препарату андексанет альфа в реверсії активності анти-фXa-препаратів та контролі гемостазу в пацієнтів із гострими тяжкими кровотечами. У дослідження включали пацієнтів, які прийняли інгібітор фХа протягом останніх 18 годин. Первинними кінцевими точками ефективності були зміни анти-фXa-активності та клінічно ефективний гемостаз через 12 годин. Кінцеві точки безпеки включали в себе загальну безпеку, частоту тромбоутворення, розвиток імунних реакцій та 30-денну смертність від усіх причин.
Тяжкою вважали загрозливу для життя кровотечу з порушенням гемодинаміки, критичну кровотечу в межах одного органа, кровотечу з падінням гемоглобіну > 2 г/дл або кровотечу, що призвела до зниження рівня гемоглобіну ≤ 8 г/дл у пацієнтів, у яких неможливо було оцінити вихідний рівень гемоглобіну. Усім пацієнтам вводили андексанет альфа внутрішньовенно (IV) болюсно, а потім — у вигляді 2-годинної інфузії, дозу підбирали індивідуально на основі визначення рівня фХа. Пацієнтам, які перебували на терапії апіксабаном або прийняли останню дозу ривароксабану понад 7 годин тому, призначали андексанет у вигляді IV 400 мг болюс плюс інфузія 480 мг з розрахунку 4 мг/хв. Пацієнтам, яких лікували еноксапарином, едоксабаном або які прийняли останню дозу ривароксабану ≤ 7 годин тому, препарат призначали у вигляді IV 800 мг болюс плюс інфузійно 960 мг з розрахунку 8 мг/хв. До кінцевої вибірки оцінки ефективності увійшли пацієнти (n = 47) із вихідним рівнем анти-фXa-активності ≥ 75 нг/мл (≥ 0,5 МО/мл для еноксапарину); усіх пацієнтів, яким було введено андексанет, включили в аналіз оцінки безпеки (n = 67).
Вибірку в дослідженні становили в основному чоловіки, представники білої раси, середній вік яких був 77 років. Середній час від початку кровотечі до болюсного введення андексанету становив 4,8 години (400 мг болюсно протягом 15 хвилин). У пацієнтів були як фібриляція передсердь, так і тромбоемболічні ускладнення. У цих пацієнтів були супутні серцево-судинні захворювання. Серед варіантів кровотеч спостерігалися кровотеча з шлунково-кишкового тракту (49 %), внутрішньочерепні (~42 %), а також інші кровотечі (9 %).
Після болюсного введення андексанету активність ривароксабану знизилася на 89 % анти-фXa (95% ДІ від 58 до 94), її вдалося пригнітити до моменту закінчення інфузії. Через 12 годин активність інгібітору залишалася пригніченою (69 % від вихідного рівня; рис. 1). Подібні результати спостерігалися й на фоні апіксабану (зниження на 93 %; 95% ДІ від 87 до 94; рис. 2). Клінічну ефективність гемо–стазу розцінили як чудову або добру в 79 % (95% ДІ від 64 до 89) пацієнтів. В усіх підгрупах відповідь на лікування була подібною.
Андексанет альфа виявився безпечним і добре переносився пацієнтами. Антикоагулянтні властивості відновилися в 27 % пацієнтів протягом 30 днів. Тромбоемболії виникли в чотирьох пацієнтів протягом 3 днів з моменту введення андексанету й у 12 пацієнтів протягом 30 днів, але прийом антикоагулянтів відновив лише 1 з цих пацієнтів до моменту виникнення тромбоемболічних ускладнень. За 30 днів було зафіксовано 10 смертельних випадків, з яких 6 були спричинені захворюваннями серцево-судинної системи.
І на завершення. Андексанет альфа швидко відновлював анти-фХа-активність і забезпечував ефективний гемостаз у 79 % хворих послідовно в усіх підгрупах пацієнтів. Частота тромбоемболій відповідала такій у пацієнтів високого ризику, до групи яких належали й учасники даного дослідження.
Інструмент прогнозування ризику для виявлення пацієнтів після неспровокованих венозних тромбозів, у яких обов’язкову антикоагулянтну терапію можна припинити, підтверджений результатами дослідження REVERSE II
Автор: Toni Rizzo
Венозна тромбоемболія (ВТЕ) — поширене потенційно загрозливе для життя явище. Пацієнти після значних ВТЕ повинні приймати антикоагулянти принаймні від 3 до 6 місяців. Після цього, рекомендують експерти, прийом антикоагулянтів можна припинити, якщо ризик рецидиву ВТЕ протягом 1 року на фоні їх відміни становить < 5 %. У пацієнтів зі спровокованими ВТЕ, спричиненими одним із великих перехідних факторів ризику, прийом антикоагулянтів слід припинити (ризик рецидиву ВТЕ становить < 3 % протягом 1 року). Залишалося невідомим, чи варто продовжувати прийом антикоагулянтів у пацієнтів із неспровокованими ВТЕ або ВТЕ, спровокованими одним із незначних перехідних факторів ризику. У рекомендаціях 2016 American College of Chest Physicians (ACCP) та 2014 European Society of Cardiology (ESC) припускалося, що пацієнтам із неспровокованими ВТЕ, у яких немає високого ризику кровотечі, антикоагулянти варто призначати пожиттєво (Kearon C. et al. // Chest. 2016; Konstantinides S. et al. // Eur. Heart J. 2014).
Орієнтуватися лише на індивідуальні предиктори недостатньо для того, щоб виявити пацієнтів групи високого ризику, які можуть припинити прийом антикоагулянтів. У дослідженні REVERSE І було розроблено клінічний протокол прийняття рішень (ППР) з використанням критеріїв HERDOO для прийняття рішення про необхідність припинити прийом антикоагулянтів у пацієнтів з неспровокованою ВТЕ (Rodger M.A. et al. // CMAJ. 2008). Дослідження показало, що продовжувати приймати антикоагулянти повинні всі чоловіки, на той час як жінки з оцінкою за шкалою HERDOO ≤ 1 можуть припинити прийом антикоагулянтів, що привело до формулювання мнемонічного Men Continue and HERDOO2 rule.
Дослідження REVERSE II, результати якого подав Marc A. Rodger, співробітник Оттавського госпіталю, Оттава, Канада, проводили, щоб проспективно оцінити положення ППР Men Continue and HERDOO2. У дослідження включили 2785 пацієнтів із неспровокованими масивними ВТЕ в 44 центрах. Протягом 5–12 місяців пацієнтів класифікували в групи низького ризику (жінки з ≤ 1 критерієм HERDOO; n = 631) або високого ризику (усі чоловіки і жінки з ≥ 2 критеріями HERDOO; n = 2148) з приводу рецидиву ВТЕ. Критерії HERDOO показані на рис. 1. Продовжити прийом антикоагулянтів рекомендували пацієнтам із високим ризиком, а припинити — пацієнтам низького ризику. Первинною кінцевою точкою був рецидив масивної ВТЕ через 12 місяців у жінок з низьким ризиком, які припинили прийом антикоагулянтів.
Через 12 місяців серед пацієнтів високого ризику 1802 продовжили прийом антикоагулянтів, а 323 припинили їх прийом (рис. 2). Серед пацієнтів високого ризику, які припинили приймати антикоагулянти, у 25 відбувся рецидив ВТЕ протягом 309 пацієнтів-років спостереження (8,1 %; 95% ДІ від 5,2 до 11,9) і у 28 осіб серед тих, хто продовжив приймати антикоагулянти, — протягом 1758 жінко-років (1,6 %; 95 % ДІ від 1,1 до 2,3). У групі низького ризику 31 жінка продовжила прийом антикоагулянтів (вибір пацієнта), а 591 жінка припинила їх прийом. У 17 жінок низького ризику, які припинили приймати антикоагулянти, виник рецидив масивної ВТЕ протягом 564 пацієнто-років спостереження (3,0 %; 95% ДІ від 1,8 до 4,8). У невеликій групі жінок низького ризику, які продовжували приймати антикоагулянти, жодного рецидиву ВТЕ не було.
Дослідження REVERSE II є найбільшим проспективним дослідженням когорти пацієнтів із неспровокованою ВТЕ серед тих, які коли-небудь проводилися. Це дослідження показало, що відміняти антикоагулянти в жінок низького ризику (з оцінкою 0 або 1 за шкалою HERDOO) безпечно щодо рецидивів ВТЕ. Близько 50 % жінок із неспровокованими ВТЕ можна позбавити проблем, пов’язаних із витратами та ризиками, що виникають на фоні довічного прийому антикоагулянтів. Автори дійшли висновку, що жінки з першим випадком неспровокованої ВТЕ і ≤ 1 критерію за шкалою HERDOO2 належать до групи низького ризику рецидиву ВТЕ й можуть безпечно припинити прийом антикоагулянтів після завершення короткострокового курсу лікування.
Спрощений алгоритм YEARS дозволяє зменшити частоту проведення комп’ютерної томографії в пацієнтів із підозрою на гостру легеневу емболію
Автор: Maria Vinall
Алгоритм, що в даний момент використовується з метою діагностики пацієнтів із підозрою на гостру легеневу емболію (ЛЕ), часто використовують неправильно, що призводить до невиправданих діагностичних процедур і неправильної діагностики. Тоm van der Hulle, співробітник Медичного центру Лейденського університету, Лейден, Нідерланди, повідомив, що спрощений протокол прийняття клінічного рішення, розроблений на основі Уельських правил алгоритму YEARS, призводить до значного зниження частоти використання –КТ-ангіопульмонографії (КТПГ).
Ведення пацієнтів із підозрою на ТЕЛА без шоку або гіпотензії починається з оцінки клінічної ймовірності ТЕЛА на основі Уельських правил або переглянутої Женевської шкали (Konstantinides S.V. et al. // Eur. Heart J. 2014). Пацієнтів з малоймовірною ЛЕ і низьким (< 500 нг/мл) значенням D-димеру не потрібно лікувати, на той час як пацієнтам із вірогідною ЛЕ або високим (≥ 500 нг/мл) D-димером слід проводити КТ з метою підтвердження ЛЕ. За допомогою цього алгоритму можна виключити ЛЕ приблизно в 30 % пацієнтів без необхідності додаткового проведення КТПГ. Незважаючи на можливість за допомогою цього алгоритму виключити наявність ЛЕ, у реальній клінічній практиці цього стандартного підходу дотримуються не завжди, ймовірно, через його складність (Newnham M. et al. // BMJ. 2013). У пацієнтів з ЛЕ, яких лікують не відповідно до їх стану, ризик розвитку тромбоемболічних ускладнень (P < 0,001) і невстановленої раптової смерті (P < 0,001) (Roy P.M. et al. // Ann Intern Med. 2006) достовірно вищий.
Алгоритм YEARS було розроблено з метою спрощення методології прийняття рішення та зменшення потреби в проведенні КТПГ. В алгоритмі використано 3 елементи вихідного протоколу Уельських правил (кровохаркання, ознаки тромбозу глибоких вен і «ймовірна ЛЕ») на додаток до визначення D-димеру й змінні порогові значення для D-димеру: оцінка 0 балів за YEARS + D-димер < 1000 або ≥ 1 за YEARS + D-димер < 500 дозволяє виключити ймовірність ЛE, на той час як 0 за YEARS + D-димер ≥ 1000 або ≥ 1 бал за YEARS + D-димер ≥ 500 вказують на необхідність проведення КТПГ з метою підтвердити ЛЕ (van Es J. et al. // J. Thromb. Haemost. 2015).
У це проспективне когортне дослідження було включено 3260 пацієнтів з клінікою та підозрою на ЛЕ у 12 академічних і неакадемічних лікарнях у Нідерландах. Первинною кінцевою точкою (безпеки) був рецидив венозної тромбоемболії протягом 3 місяців спостереження після негативної легеневої ангіографії. Вторинною кінцевою точкою (ефективність) була кількість пацієнтів, яким потрібно було провести КТПГ.
Середній вік пацієнтів становив 53 роки, 62 % з них становили жінки; 88 % пацієнтів спостерігалися амбулаторно. Загальна поширеність ЛЕ у всіх пацієнтів, у яких підозрювали емболію, становила 13,2 %.
Ризик ВТЕ у пацієнтів із підозрою на гостру ЛЕ та оцінкою 0 балів за YEARS і рівнем D-димеру < 1000; 0 балів за YEARS і рівнем D-димеру ≥ 1000 та негативним КТПГ; ≥ 1 бал за YEARS, рівнем D-димеру < 500; або ≥ 1 бал за YEARS, рівнем D-димеру ≥ 500 і негативним КТПГ (n = 2944, табл. 1) становив 0,61 % (95% ДІ від 0,36 до 0,96), а ризик фатальної ЛЕ був 0,20 % (95% ДІ від 0,07 до 0,44). Для пацієнтів, яких спостерігали без КТПГ (n = 1629), ризик розвитку ВТЕ був 0,43 %, а ризик летальної ЛЕ становив 0,12 %. У пацієнтів, яким виконали КТПГ (n = 1315), ризик ВТЕ був 0,84 %, а ризик фатальної ЛЕ був 0,30 %. КТПГ не була показана 48 % пацієнтів на основі результатів алгоритму YEARS. Порівняно зі стандартним алгоритмом завдяки цьому підходу абсолютне зниження частоти проведення КТПГ становило 14 %. Сильні сторони цього дослідження включають великий обсяг вибірки, велику кількість пацієнтів, яких включили в алгоритм, майже повне завершення періоду спостереження та незалежні одна від одної кінцеві точки; до обмежень належало те, що це дослідження не було рандомізованим контрольованим, у ньому також не проводили остаточку діагностику із підтвердженням справжньої частоти ЛЕ в пацієнтів, яким за даними цього алгоритму не виконували КТПГ.
Скринінг та агресивна профілактика в пацієнтів із мультифокальним атеросклерозом не покращує результати: дослідження AMERICA
Автор: Toni Rizzo
Поширеність і вплив на ризик безсимптомного мультифокального атеросклеротичного ураження артерій (МАУА) у пацієнтів з ішемічною хворобою серця (ІХС) високого ризику залишалися невідомими. Роль систематичного виявлення даної патології та її агресивного лікування також не оцінювали. Метою дослідження AMERICA, результати якого подав Jean-Phillipe Collet, співробітник Університетського госпіталю Pitié-Salpêtrière, Париж, Франція, було продемонструвати перевагу активного виявлення та лікування безсимптомного МАУА як доповнення до агресивної вторинної медикаментозної профілактики порівняно з консервативною стратегією ведення, що базується на активному виявленні МАУА і стандартній медикаментозній терапії.
У дослідження включили 521 пацієнта віком ≥ 18 років з ураженням 3 судин протягом ≤ 6 місяців або пацієнтів віком ≥ 75 років із гострим коронарним синдромом протягом < 1 місяця. Пацієнти були рандомізовані в групи активного (n = 263) або стандартного ведення (n = 258). Активна стратегія включала рутинний скринінг на предмет безсимптомного атеросклерозу з використанням ультразвукової допплерографії судин усього тіла в поєднанні з КТ-ангіографією або магнітно-резонансною томографією за наявності показань та показника гомілково-плечового індексу. У дослідженні кожні 6 місяців проводили вимірювання кліренсу креатиніну, рівня глюкози натще й холестерину ліпопротеїнів низької щільності. Пацієнти в групі агресивного ведення приймали інтенсивну медикаментозну терапію у складі подвійної антитромбоцитарної терапії, статинів у високих дозах, бета-блокаторів, інгібіторів ангіотензинперетворюючого ферменту, блокаторів рецепторів альдостерону в пацієнтів після інфаркту міокарда з фракцією викиду лівого шлуночка ≤ 40 %; усім пацієнтам призначали терапію, що допомагала відмовитися від куріння, та модифікацію способу життя. Пацієнтів у групі стандартної стратегії обстежували тільки за умови наявності симптомів і лікували згідно з існуючими стандартами медикаментозної терапії.
Первинною кінцевою точкою був час до появи першої події, або смерті від усіх причин, або будь-якої ішемічної події, що призвела до госпіталізації, або встановлення поліорганної недостатності (серцева недостатність, когнітивні порушення, порушення роботи нирок, фібриляція передсердь або шлуночкові аритмії, злоякісна гіпертензія). Основною вторинною кінцевою точкою була комбінація: смерть від усіх причин, ІМ, інсульт і реваскуляризація будь-якого виду. Основною кінцевою точкою безпеки була сильна кровотеча за TIMI.
Протягом 2-річного періоду спостереження не відзначалося жодних достовірних відмінностей у частоті первинної кінцевої точки між групами активного (47,4 %) та стандартного (46,9 %) ведення (ВР 1,03; 95% ДІ від 0,80 до 1,34).
Також не спостерігалося достовірної різниці за частотою вторинної кінцевої точки між групами активного (13,9 %) і стандартного (15,0 %) ведення (ВР 0,94; 95% ДІ від 0,58 до 1,50).
За частотою будь-якої з основних вторинних кінцевих точок, у тому числі й смерті від усіх причин, критичної ішемії кінцівок, реваскуляризації, черезшкірного коронарного втручання або аорто-коронарного шунтування, а також органної недостатності, достовірної різниці між групами активного проти стандартного спостереження також не виявили (P = НД для всіх).
За результатами аналізу заздалегідь визначених підгруп не виявили жодних достовірних відмінностей за частотою первинних кінцевих точок між варіантами спостереження в будь-який з підгруп. Жодних достовірних відмінностей між варіантами спостереження за частотою масивних кровотеч за TIMI (P = 0,73) не спостерігалося.
Безсимптомне МАУА виявили в 1 з 5 пацієнтів з ІХС, які відповідали критеріям даного дослідження. Рутинний скринінг не покращив жодної кінцевої точки з багатьох у даному невеликому за розміром вибірки дослідженні. Отримані результати не довели ефективність рутинного скринінгу безсимптомного мультифокального атеросклеротичного ураження артерій у пацієнтів, які належали до групи високого ризику у зв’язку з нещодавно перенесеним ГКС або наявністю ішемічної хвороби серця із багатосудинним ураженням, яким було призначено медикаментозну терапію з метою вторинної профілактики.
Нові препарати в лікуванні гострої серцевої недостатності
Автор: Phil Vinall
Milton Packer, співробітник Медичного центру Університету Бейлора, Даллас, штат Техас, США, у своєму виступі переглянув передумови проведення дослідження TRUE-AHF Ularitide [NCT01661634], розробленого з метою вивчення взаємозв’язку між кількістю вивільнення серцевого тропоніну, що призводить до погіршення перебігу серцевої недостатності (СН), та зростанням рівня серцево-судинної смертності.
Останніми роками нові дослідження препаратів перейшли до оцінки частоти погіршення перебігу СН у стаціонарі та смерті від усіх причин або СС-смертності як кінцевих точок. У близько 10–20 % пацієнтів перебіг СН погіршується протягом перших 7 днів після надходження до стаціонару (Torre-Amione G. et al. // J. Card. Fail. 2009; Weatherley D.B. et al. // Fundam. Clin. Pharmacol. 2009), що свідчить про невдачу попередньо призначеного лікування та означає нестабільність клінічного стану пацієнта, яка може впливати на прогноз як щодо даної госпіталізації, так і щодо перебігу захворювання в цілому. Однією з гіпотез, що пояснює це погіршення, є можливий зв’язок між викидом серцевого тропоніну при прогресуванні СН у стаціонарі і збільшенням СС-смертності (рис. 1).
У дослідженні TRUE-AHF Ularitide розглянули цю гіпотезу. Уларитид — це синтетичний аналог уродилатину, що зумовлює системну вазодилатацию та вазодилатацію судин нирок, діурез і натрійурез, а також інгібування ренін-ангіотензинової системи. Два невеликих дослідження, SIRIUS I та II, довели, що уларитид пов’язаний із позитивними гемодинамічними зрушеннями й покращенням симптомів СН. У дослідженні TRUE-AHF поставили на меті охарактеризувати переваги й ризики, пов’язані з прийомом уларитиду, у межах одного дослідження. Було обрано 2 спільні первинні кінцеві точки: покращення клінічного перебігу й профілактика погіршення стану в пацієнтів із СН у стаціонарі (короткострокова кінцева точка) та зниження рівня СС-смертності (довгострокова кінцева точка). Час від моменту надходження до стаціонару до початку прийому досліджуваного препарату становив усього 6 годин. У дослідженні завершили набір і рандомізували 2157 пацієнтів у групи уларитиду (15 нг/кг/хв) або плацебо. Дані будуть наведені на науковій сесії Американської асоціації серця в листопаді 2016 року.
Під час симпозіуму з питань нових лікарських препаратів для лікування гострої СН Marco Metra, доктор медицини, Університет Брешіа, Брешіа, Італія, повідомив, що серелаксин може покращити довгострокове виживання хворих із СН.
Серелаксин — рекомбінантна форма людського релаксину-2, тобто гормону, що бере участь в опосередкованих гемодинамічних змінах під час вагітності. Доклінічні та клінічні дослідження показали, що серелаксин діє шляхом цілого ряду механізмів покращення гемодинаміки на рівні судин, серця й нирок, чим забезпечує ефективне покращення кровообігу. Отже, цей препарат може стати ефективним засобом для лікування пацієнтів із СН. Крім того, він також може захистити серце, нирки й печінку від уражень, спричинених запаленням, оксидативним стресом, загибеллю клітин та фіброзом тканин, а також стимулювати ангіогенез (Diez J., Ruilope LM. // Eur. Heart J. Cardiovasc. Pharmacother. 2016).
У дослідженні RELAX-AHF призначення серелаксину при гострій СН було пов’язане зі зменшенням задишки й покращенням інших клінічних результатів, але при цьому препарат не знижував частоту повторних госпіталізацій (Teerlink J.R. et al. // Lancet. 2013). Серелаксин достовірно зменшив погіршення перебігу СН порівняно з плацебо (6,7 % проти 12,2 %; ВР 0,53; 95% ДІ від 0,36 до 0,79; p = 0,0016), а також знижував частоту СС-смерті (6,1 проти 9,6 %; ВР 0,63; 95% ДІ від 0,41 до 0,96; р = 028) і смерті від усіх причин (7,3 проти 11,3 %; ВР 0,63; 95% ДІ від 0,42 до 0,93; р = 0,02) –через 180 днів (Teerlink J.R. AHA 2012).
Крім того, у дослідженні RELAX-AHF зміни рівня маркерів пошкодження серця (за результатами високочутливого аналізу серцевого тропоніну Т), нирок (креатиніну й цистеїну-C), печінки (аспартаттрансамінази й аланінамінотрансферази), а також маркерів декомпенсації (N-кінцевий промозковий натрійуретичний пептид) на 2-й день спостереження й погіршення стану в пацієнтів із СН при госпіталізації були пов’язані з частотою 180-денної смертності. Терапія серелаксином привела до покращення профілю цих маркерів, зменшення ураження органів та знизила швидкість прогресування декомпенсації (Metra M. et al. // J. Am. Col. Cardiol. 2013). RELAX-AHF 2 [NCT01870778], дослідження ефективності, безпеки та переносимості терапії серелаксином на додаток до стандартної терапії при гострій СН, завершило набір пацієнтів і досі триває.
CXL-1427 — препарат другого поколінням донаторів нітроксильної групи (HNO), що являє собою нестабільний газ, для якого вплив на скоротливість серця вперше довели у 2003 році. Javed Butler, доктор медицини, MPH, MBA, Інститут серця, Університет Стоні Брук, Стоні Брук, штат Нью-Йорк, США, навів дані, які продемонстрували, що HNO, доставлений за допомогою нітроксильного пропрепарату CXL-1427, підвищує скоротливу здатність міокарда й судин, а також збільшує серцевий викид.
Аномальна робота кальцієвих каналів може привести до порушення роботи серця. Д-р Батлер зазначив, що HNO посилює активність внутрішньоклітинного Ca2+-циклічного протеїну, збільшуючи максимальну силу скорочення без зміни актоміозинової АТФазної активності. Він також має інотропний, лузитропний і возодилатуючий щодо міокарда ефекти, зокрема шляхом активації кальцієвої АТФази саркоплазматичного ретикулуму, не викликаючи при цьому тахікардії або збільшення споживання кисню.
У другій фазі дослідження з вибору оптимальних доз 6-годинне внутрішньовенне введення CXL-1427 (≥ 5 мкг/кг/хв) привело до значного (~5 мм рт.ст., р < 0,01) зниження середнього за часом тиску заклинювання в легеневих капілярах (ТЗЛК) у пацієнтів, госпіталізованих із приводу тяжкої СН. Максимальне зниження ТЗЛК на фоні CXL-1427 становило 4,8–6,9 мм рт.ст. в усіх групах лікування порівняно з 2,0 мм рт.ст. у групі плацебо. На фоні призначення досліджуваного препарату серцевий індекс та ударний об’єм збільшилися, на той час як середній рівень артеріального тиску знизився. Ніякого збільшення частоти серцевих скорочень на фоні CXL-1427 порівняно з плацебо не спостерігалося, також не зафіксовано жодного епізоду аритмії під час інфузії препарату. Також не спостерігалося ніяких змін рівнів циркулюючого натрійуретичного пептиду В-типу або маркерів функції нирок, а також не зафіксовано жодних токсичних реакцій при терапії CXL-1427, окрім випадкових епізодів головного болю під час інфузії (Mitrovic V. // Heart Failure 2016. London, UK).
Gerasimos Filippatos, доктор медицини, Університетський госпіталь Аттікон, Афіни, Греція, обговорив переваги й ризики призначення антагоністів рецепторів мінералокортикоїдів (АРМ) у хворих із СН.
Для АРМ доведено перевагу при лікуванні пацієнтів із симптомною СН зі зниженою фракцією викиду, але тільки 32,2 % пацієнтів у США, яким показані АРМ, дійсно їх приймають; це, як правило, пацієнти, які виписалися з лікарні. У попередніх дослідженнях повідомлялося, що АРМ спіронолактон у поєднанні з блокаторами ангіотензинпере–творюючого ферменту значною мірою знижує ризик розвитку як захворюваності, так і смертності в пацієнтів із тяжкою СН (Pitt B. et al. // N. Engl. J. Med. 1999). Проте результати досліджень продемонстрували зростання захворюваності й смертності, що пов’язані з гіперкаліємією, на фоні використання комбінації цих препаратів, особливо в пацієнтів із СН і порушенням функції нирок. В іншому дослідженні Pitt і його колеги повідомили про підвищений ризик погіршення функції нирок на фоні прийому іншого АРМ (еплеренону), що дало поштовх до пошуку нових, більш безпечних АРМ.
Фінеренон — це потужний нестероїдний селек–тивний АРМ, аналогічний за ефективністю до спіронолактону, але пов’язаний із меншою кількістю випадків гіперкаліємії й прогресування ниркової недостатності (Pitt B. et al. // Eur. Heart J. 2013). У дослідженні ARTS-HF [NCT01807221] фінеренон (10–20 мг) знижував рівень плазматичного N-термі–нального про-B-типу натрійуретичного пептиду на > 30 % (Filippatos G. et al. // Eur. Heart J. 2016).
Це розвідувальне дослідження, однак, показало, що частота комбінованої клінічної кінцевої точки, яка складалася зі смерті від усіх причин, СС госпіталізацій або викликів швидкої допомоги, була також нижче в групі фінеренону в дозі 10–20 мг (рис. 2). Ці результати слід підтвердити в інших, більш тривалих дослідженнях.
На додаток до нових АРМ вивчають і нові можливості використання старих АРМ. Досліджують призначення спіронолактону в пацієнтів із СН і збереженою фракцією викиду (ФВ ≥ 40 %).
Ідаруцизумаб, андексанет альфа й цирапарантаг відкривають нову еру терапії неантагоністами вітаміну К
Автор: Maria Vinall
Із розвитком препаратів оборотної дії стратегії лікування пацієнтів, які перебувають на терапії перо–ральними антикоагулянтами — неантагоністами вітаміну К (НОАК), швидко змінюються. Gregory Y.H. Lip, доктор медицини, співробітник Інституту серцево-судинної патології Університету Бірмінгема, міський госпіталь, Бірмінгем, Сполучене Королівство, повідомив, коли і як слід використовувати ці нові препарати.
Під час даного симпозіуму обговорювали три препарати: ідаруцизумаб, андексанет альфа і цирапарантаг. Ідаруцизумаб являє собою фрагмент антитіла, подібного до людського, що конкурентно й швидко зв’язує дабігатран та не має супутніх ефектів. Андексанет альфа — рекомбінантний білок, призначений для реверсії ефекту антикоагулянтів інгібувати прямий і непрямий фактора Ха (фXa). Цирапарантаг (PER977) являє собою невелику синтетичну молекулу, розроблену для цільового впливу на прямий тромбін і інгібітор фXa, а також низькомолекулярні гепарини. Ідаруцизумаб був схвалений FDA в США і Європейським агентством із лікарських засобів (EMA) в 2015 р. Андексанет альфа перебуває на стадії розгляду обома агентствами, на той час як дослідження цирапарантагу й досі тривають.
Кровотеча — це нерідкісне явище серед пацієнтів, які приймають НОАК, і хоча більшість кровотеч є незначними або мінімальними, більш серйозні кровотечі, такі як внутрішньочерепна й масивна шлунково-кишкова, іноді вимагають іншої, окрім кровозамісної, терапії. Рекомендації Європейського товариства кардіологів (ESC) 2016 р. пропонують конкретні дії для ведення активних кровотеч у пацієнтів із фібриляцією передсердь після використання антикоагулянтів (рис. 1) (Kirchhof P. et al. // Eur. Heart J. 2016). Призначення антидотів слід обмежити випадками, коли кровотеча супроводжується гемодинамічною нестабільністю, потрібно провести оперативне втручання, яке неможливо відкласти, або якщо кровотеча загрожує життю через її локалізацію (наприклад, внутрішньочерепні кровотечі). Ці антидоти працюють і забезпечують припинення дії НОАК, а отже, і змінюють правила гри та загальне уявлення.
Alexander Niesser, доктор медицини, співробітник Медичного університету Відня, Відень, Австрія, виконав огляд поточних даних щодо препарату ідаруцизумаб, що був затверджений у минулому році як антидот антикоагулянту дабігатрану. Препарат розпочинає свій вплив одразу ж і діє від 12 до 24 годин, після чого його можливо призначати повторно. Важливо те, що препарат не викликає ніякої імунної відповіді. Проміжний аналіз даних дослідження RE-VERSE AD за участі 90 пацієнтів із серйозними кровотечами або тих, які вимагали невідкладного оперативного втручання, показав, що ідаруцизумаб відключав антикоагулянтний вплив дабігатрану й відновлював гемо–стаз протягом декількох хвилин у переважної більшості пацієнтів (> 90 % пацієнтів) (Pollack C.V. Jr. et al. // N. Engl. J. Med. 2015). Локалізація кровотеч (у пацієнтів, яким не потрібно було проводити невідкладні хірургічні втручання) включала кровотечу із шлунково-кишкового тракту (39 %), внутрішньочерепні (35 %) кровотечі, пов’язані із травмами (18 %), або інші кровотечі (22 %). Показання для термінового оперативного втручання включали в себе переломи кісток, гострий холецистит або необхідність постановки катетера внаслідок гострої ниркової недостатності. Активність дабігатрану може бути перезапущена через 24 години після впливу ідаруцизумабу за умови, що стан пацієнта клінічно стабільний, а також вдалося провести адекватний гемостаз, крім того, пацієнтам можливо знову призначити ідаруцизумаб (Glund S. et al. // J. Am. Col. Cardiol. 2016). Рекомендована і єдина затверджена FDA/EMA доза, яка використовується для лікування літніх пацієнтів і осіб із порушеннями функції нирок, становить 5 г (рис. 2, 3) (Glund S. et al. // Clin. Pharmacokinet. 2016).
Перед введенням антидоту, такого як ідаруцизумаб, важливо визначити дозу НОАК і встановити, скільки минуло часу з моменту його останнього введення, оцінити функцію нирок і печінки, провести аналізи на наявність коагулопатії та використовувати однакові тести на антикоагулянтні реакції; також слід виконувати вимоги спеціальних протоколів ведення пацієнтів з помірною/тяжкою кровотечею/тих, яким необхідно ургентно виконати оперативне втручання, і пацієнтів із загрозливими для життя кровотечами/невідкладними хірургічними втручаннями. Незважаючи на те що залишаються певні невирішені питання, ідаруцизумаб є ефективним для відновлення коагуляції препаратом, що підходить для екстреного лікування кровотеч та не спричинює жодних ризиків.
Sven Wassman, доктор медицини, доктор філософії, кардіологічний центр ISAR, Мюнхен, Німеччина, зосередив свою увагу на розвитку сучасних відомостей про андексанет альфа і цирапарантаг (PER977). Андексанет альфа — рекомбінантний усічений фXa, що діє як каталітично неактивна приманка фXA для запобігання антикоагулянтним властивостям інгібіторів фXa. Взаємодії з іншими факторами згортання, окрім інгібітору шляху тканинного фактора, також виявлено не було, не встановлено активації імунної відповіді, а отже, цей препарат має інший механізм дії порівняно з ідаруцизумабом. Андексанет альфа, введений шляхом болюсних і болюс плюс інфузій, у здорових літніх людей значно (P < 0,05) знижував анти-фXa-активність апіксабану й ривароксабану порівняно з вихідними рівнями й плацебо в дослідженнях ANNEXA-A і ANNEXA-R (Siegal D.M. et al. // N. Engl. J. Med. 2015).
Активність апіксабану й ривароксабану значно знизилася протягом декількох хвилин після ін’єкції ударної дози андексанету альфа. Ця реверсія була закріплена за допомогою болюс плюс інфузії протягом 2 годин. Також вдалося швидко відновити покоління тромбіну. Жодних серйозних побічних ефектів у дослідженні не спостерігалося. У певній підгрупі учасників спостерігалося короткочасне підвищення рівня D-димеру й фрагментів протромбіну, але жодних тромботичних подій не відзначалося (Siegal D.M. et al. // N. Engl. J. Med. 2015). Усе ще триває 3b фаза дослідження, мета якої — оцінити здатність андексанету альфа протидіяти антикоагулянтному ефекту інгібіторів фXa у пацієнтів із тяжкою кровотечею (ANNEXA-4) [NCT02329327].
Цирапантаг — синтетичний пептид у вигляді малої молекули, призначений для реверсування активності пероральних прямих інгібіторів фXa і IІа, низькомолекулярних гепаринів, нефракціонованого гепарину й фондапаринуксу (Laulicht et al. AHA 2012). Цирапантаг конкурентно зв’язує НОАК, відновлюючи активність заблокованого фактора згортання крові. Це призвело до зменшення крововтрати в щурів, яким давали НОАК, та зумовило реверсію ефекту ривароксабану в краплі свіжої цільної людської крові ex vivo, проте не мало жодного впливу на антикоагулянтний ефект варфарину. Перебуває на стадії набору учасників фаза 2 дослідження висхідної дози препарату в здорових осіб, які прийняли разову дозу едоксабану 60 мг протягом 4 днів [NCT02207257].
Freek W.A. Verheugh, доктор медицини, Амстердам, Нідерланди, обговорював питання про те, чи зможе наявність специфічних антидотів змінити використання НОАК. Професор Verheugh вважає, що введення в практику цих препаратів мотивує лікарів, які в даний час неохоче призначають НОАК, призначати таку терапію частіше. Посилаючись на дані метааналізу 2012 року, він нагадав присутнім, що вже було доведено значне зниження частоти кровотеч зі смертельними наслідками (Ruff C.T. et al. // Lancet. 2014) на фоні призначення НОАК. Він вважає, що найбільш поширеним показанням до застосування антидотів буде необхідність проведення хірургічних втручань.
Розглядаючи кожен із 3 антидотів, він, у свою чергу, зазначив, що, на його думку, найбільш важливими з аспектів, пов’язаних із використанням ідаруцизумабу, є те, що це дуже специфічний препарат, з низьким ризиком алергічних (імунних) реакцій, для якого були продемонстровані безпечність та ефективність при лікуванні пацієнтів, яким необхідно було провести екстрене хірургічне втручання (Siegal D.M. et al. // N. Engl. J. Med. 2016). Андексанет альфа — неспецифічний блокатор Xa, що діє як приманка й зберігає високу спорідненість до всіх прямих інгібіторів фXa, а також до активованого шляхом введення низькомолекулярних гепаринів антитромбіну (Lu G. et al. // Nat Med. 2013). Професор Verheugh зазначив, що хоча дана концепція виглядає досить елегантно, нам все ж необхідно отримати додаткові дані. Професор Verheugh висловив значні сумніви щодо використання цирапантагу, у першу чергу через обмеженість даних про його механізм дії та клінічну ефективність. Він також зазначив, що на даний момент існують лише дані, які демонструють відновлення гемостазу в молодих (віком ≤ 45 років) здорових добровольців (Ansell J.E. et al. // N. Engl. J. Med. 2014).
З моменту їх впровадження в практику, майже 6 років тому, НОАК стійко замінили антагоністи вітаміну К у ряді клінічних ситуацій, але однією з проблем, з якими зіткнулися лікарі, стала відсутність специфічних препаратів зворотної дії для лікування тяжких ускладнень у вигляді кровотеч. На даний момент доступний один специфічний антидот дабігатрану, інші інгібітори зворотного фXа знаходяться в завершальній стадії розробки. Сукупність наявних на сьогодні доказів вказує на те, що ці препарати ефективні для швидкої реверсії антикоагулянтного ефекту НОАК. Чи покращать ці антидоти клінічні результати в пацієнтів із кровотечами, ще належить з’ясувати.
Переклад О. Торбас
Науковий редактор перекладу
проф. Ю. Сіренко

/81-98/83-1.jpg)
/81-98/83-2.jpg)
/81-98/84-1.jpg)
/81-98/85-1.jpg)
/81-98/86-1.jpg)
/81-98/86-2.jpg)
/81-98/89-2.jpg)
/81-98/89-1.jpg)
/81-98/90-1.jpg)
/81-98/91-1.jpg)
/81-98/91-2.jpg)
/81-98/92-1.jpg)
/81-98/94-1.jpg)
/81-98/95-1.jpg)
/81-98/96-1.jpg)