Журнал «Здоровье ребенка» Том 12, №1, 2017
Ювенильная системная склеродермия и экология (обзор литературы и собственные исследования)
Резюме
Наведено огляд даних літератури і результати власних досліджень, що стосуються ролі екології при ювенільній системній склеродермії (ССД). Розвиток ССД та темпи її прогресування в дитячому віці щільно пов’язані з несприятливими чинниками довкілля, зокрема зі ступенем забруднення неорганічними й органічними сполуками-полютантами атмосфери (солі тяжких металів, чадний газ, нітрати, кварц та інші продукти промислового виробництва), які підвищують активність матриксних металопротеїназ, викликають синтез прозапальних цитокінів і автоантитіл, змінюють ендотеліальну функцію судин та продукцію хемоатрактантних білків, колагену, фібронектину й біополімерів сполучної тканини, тим самим посилюючи процеси фіброзування, причому в східних регіонах України частота виникнення ювенільної ССД пов’язана з рівнем у повітрі, що вдихується, діоксиду вуглецю, 3,4-бензпирену і фенолу, а в питній воді — свинцю й літію, що в першу чергу визначає ураження легенів, серця та опорно-рухового апарату.
Представлены обзор данных литературы и результаты собственных исследований, касающихся роли экологии при ювенильной системной склеродермии (ССД). Развитие ССД и темпы ее прогрессирования в детском возрасте тесно связаны с неблагоприятными факторами внешней среды, в частности, со степенью загрязнения неорганическими и органическими соединениями-поллютантами атмосферы (соли тяжелых металлов, угарный газ, нитраты, кварц и другие продукты промышленного производства), которые повышают активность матриксных металлопротеиназ, вызывают синтез провоспалительных цитокинов и аутоантител, изменяют эндотелиальную функцию сосудов и продукцию хемоаттрактантных белков, коллагенов, фибронектина и биополимеров соединительной ткани, тем самым усиливая процессы фиброзирования, причем в восточных регионах Украины частота возникновения ювенильной ССД зависит от уровней во вдыхаемом воздухе диоксида углерода, 3,4-бензпирена и фенола, а в питьевой воде — свинца и лития, что в первую очередь определяет поражение легких, сердца и опорно-двигательного аппарата.
The paper deals with a literature review and the results of author’s research of ecology role in juvenile systemic sclerosis (SSc). The development of SSc and the rate of its progression in children is closely linked to the adverse environmental factors, in particular, to the degree of contamination of inorganic and organic compounds — pollutants in the atmosphere (heavy metals, carbon monoxide, nitrates, quartz and other industrial products), which increase matrix metalloproteinase activity, induce synthesis of proinflammatory cytokines and autoantibodies, modify vascular endothelial function and production of chemoattractant proteins, collagens, fibronectin and connective tissue biopolymers, thereby enhancing the fibrosing processes. In the Eastern Ukraine the prevalence of juvenile SSc depends on carbon dioxide levels, 3,4-benzopyrene and phenol in the inspired air, and lead and lithium in drinking water, which primarily impacts lungs, heart and musculoskeletal system diseases.
Ключевые слова
склеродермія системна; діти; екологія; перебіг; патогенез; огляд
склеродермия системная; дети; экология; течение; патогенез; обзор
systemic scleroderma; children; ecology; course; pathogenesis; review
Еще в 400 году до н.э. Гиппократ (~460–377 гг.
до н.э.) указывал на людей «с натянутой, сухой и плотной кожей без выделения пота». Подобное заболевание упоминается в трудах Орибасия (~320–403 гг. н.э.) и П. Эгинского (~625–690 гг. н.э.). В 1753 году итальянский врач из Неаполя К. Курцио представил наблюдение девочки по имени Патрия Гальера, которая страдала напряженностью вокруг рта с плотной холодной кожей на шее и других участках тела, а в 1842 году английский врач В.Д. Чаун впервые описал ребенка с клиническими висцеральными симптомами этого заболевания [4]. Так началась история изучения ювенильной системной склеродермии (ССД). В настоящее время 29 июня признано Международным днем склеродермии, который в Европе впервые отмечен в 2009 году.
ССД (системный склероз, склеродерма) относится к аутоиммунным ревматическим заболеваниям c выраженными расстройствами сосудистой микроциркуляции, фиброзированием кожи и внутренних органов, часто связанным с неблагоприятными факторами окружающей среды [15, 26, 38], которые определяют темпы прогрессирования заболевания и выживаемость больных детей [1]. Загрязнение атмосферы поллютантами способствует увеличению в таких регионах распространенности ССД [29], а в контексте клинических проявлений этого заболевания в первую очередь связь просматривается в отношении патологии кожи и легких [23].
Среди экономически развитых стран распространенность ССД составляет от 90 до 300 случаев на 1 млн населения [8]. За 20 лет имеет место тенденция увеличения смертности детей, страдающих ССД, что связывают именно с ухудшением экологической ситуации во многих промышленных регионах [17]. Негативные факторы окружающей среды в зонах проживания детей являются пусковым механизмом ювенильной ССД в 10–15 % случаев дебюта заболевания [45]. Экологическое загрязнение такими соединениями, как соли тяжелых металлов, угарный газ, двуокись кремния и серы, фенол, бензпирен, ароматические углеводороды, трихлорэтилен, кетоны, неорганические пестициды и многие другие, оказывает влияние на изменения и модуляцию эпигенетических детерминантов (рис. 1), приводящих не только к развитию ССД, но и к усилению темпов ее прогрессирования [14, 25, 41]. Фактором риска ССД у детей может быть постоянный респираторный контакт с эпоксидными смолами [10]. В этих случаях у детей налицо семейная предрасположенность к заболеванию [19].
/127-1.gif)
Как известно, уровни органических и неорганических ксенобиотиков в атмосферном воздухе городов (особенно с развитой промышленностью) намного выше, чем в сельских районах [37], что в первую очередь касается содержания 3,4-бензпирена [44]. Сейчас четко установлено неблагоприятное действие загрязнения окружающей среды на соединительную ткань и сосуды отходов производства строительных материалов, энергетики, металлургической и химической промышленности [9, 24]. Экзогенные ксенобиотики способствуют формированию эндотелиальной дисфункции сосудов, гиперагрегации тромбоцитов и эритроцитов с последующими выраженными нарушениями реологических свойств крови (рис. 2) [43]. Возникающая гипоксия ведет к стимуляции активности фиброгенных фибробластов, коллагена, фибронектина и молекул клеточной адгезии, замыкая тем самым при ССД порочный круг изменений реологического состояния крови [13].
/127-2.gif)
Ксенобиотики в окружающей среде зон проживания детей действуют на сосуды через арилзамещенные карбоновые рецепторы, что также доказано в экспериментах на мышах [16]. К экологическим факторам внешней среды (экологическим ядам), оказывающим влияние на развитие сосудистой и соединительнотканной патологии, относятся высокие концентрации в атмосфере бензола, кремния и ряда тяжелых металлов (например, свинца) [18]. Возникновению ССД способствует высокая степень загрязнения вдыхаемого воздуха полициклическими ароматическими углеводородами [11], угарным газом и диоксидами [9].
В качестве маркеров степени экологического загрязнения окружающей среды ксенобиотиками у детей отмечают выделение с мочой в высоких концентрациях бисфенолов и алкилфенолов [42]. Распространенность аутоиммунной патологии у детей, к которой относится ССД, тесно связана с газообразными составляющими нефтепродуктов, в частности, 2,5-диметилфураном, бутадиеном и бензолом [31], производными этиленгликоля [12], трихлорэтиленом и перхлорэтиленом [3]. Подобные негативные эффекты могут быть связаны с активацией ядерного фактора κВ опосредованно через усиление синтеза интерлейкина 8 и других провоспалительных цитокинов [39].
Центральным звеном фиброзирующего процесса при ССД под влиянием экологических факторов являются фибробласты и другие коллагенпродуцирующие клетки (например, гладкомышечные сосудистой стенки) с повышением синтеза ими коллагена І и ІІІ типов, фибронектина, биополимеров соединительной ткани (протеогликанов, гликопротеинов) [32], с гиперактивностью металлопротеиназы 3 и развитием антител к этому ферменту [30]. Определенную роль играет активизация системы тромбина вследствие сосудистых повреждений, что влечет за собой нарушения дифференцировки фибробластов [22].
Под воздействием высокого содержания многих неорганических и органических частиц в окружающей атмосфере происходит гиперпродукция в организме белка HSP47 и активация NADPH4-оксидазы, которые определяют стимуляцию фибробластов с чрезмерным синтезом коллагена I и IV типов, индуцированных трансформирующим фактором роста β1 [27, 35]. Кроме того, в детском возрасте экзогенное влияние окружающей среды на организм больных ССД во многом определяет повышенный синтез γ-интерферона, который через лимфоцитарный и моноцитарный хемоаттрактантные белки (I-TAC/CXCL11, CXCL4, CCL2) участвует в повреждениях кожи, мышц и легких, являясь маркером тяжелого течения заболевания [21, 35].
Среди факторов риска развития ССД особое значение отводится экзогенному влиянию на детей высоких концентраций вдыхаемого кварца (диоксида кремния) [34]. Воздействие на организм ребенка кварца является предиктором формирования противоядерных, противогистоновых и противотопоизомеразных антител [2, 6], а также антинейтрофильных цитоплазматических (направленных к миелопероксидазе и протеиназе 3) [5, 24]. В патогенетических построениях частицы экзогенного кварца через активацию матриксных металлопротеиназ 1 и 3 усиливают синтез транскрипционных факторов для провоспалительных цитокинов и некоторых факторов роста [20, 38].
Вначале происходит депозиция кремния на нормальных фибробластах, вызывая профиброзную экспрессию генов COL1A2, COL3A1, MIVIP1, TIMP3, CTGF с изменением количественного и качественного их состава [28, 40], изменяется баланс клеток с рецепцией CD152 и CD279 [33], при этом ключевыми посредниками фиброгенеза при кремнийиндуцированной ювенильной ССД являются факторы роста — трансформирующий β1 и тромбоцитарный D, а блокируют такое действие IκB-киназа и ингибитор BMS-345541 [7].
А теперь представим наши собственные данные. Ретроспективный анализ показал, что среди 26 обследованных детей, страдающих ССД, соотношение мальчиков и девочек было 1 : 6, а средний возраст их составил 13,30 ± 1,09 года. У 69,2 % от числа обследованных в сыворотке крови были обнаружены aScl70. По данным, представленным санитарно-гигиеническими станциями и региональными отделениями Государственного комитета по гидрометеорологии, контролю природной среды и экологической безопасности, интегральный уровень загрязнения атмосферы и питьевой воды в 17 городских и 17 сельских регионах Донецкой области соответственно составил 0,880 ± 0,068 о.е. и 0,870 ± 0,080 о.е., а в районах проживания больных детей — 0,960 ± 0,106 о.е. и 0,820 ± 0,056 о.е. (различия с областными показателями недостоверны). Параметры зон проживания обследованных пациентов и среднеобластных показателей в отношении выбросов промышленных отходов на одного человека за год и на площадь территории также мало отличались, соответственно составляя 1,50 ± 0,41 т и 0,80 ± 0,20 т, 0,90 ± 0,27 т3 и 0,50 ± 0,12 т3, хотя различия все-таки достигали 88 и 80 %.
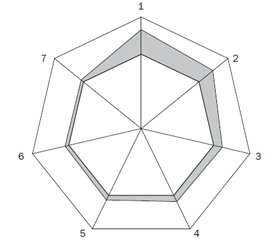
Как видно на рис. 3, регионы проживания больных детей имели большие концентрации в атмосфере диоксида углерода, 3,4-бензпирена и фенола, а в питьевой воде (рис. 4) — содержания свинца и лития. Многофакторный дисперсионный анализ Уилкоксона — Рао показал, что экологическое состояние региона влияет на интегральные клинические проявления ювенильной ССД. По результатам выполненного однофакторного дисперсионного анализа Брауна — Форсайта, высокая степень загрязнения атмосферы оказывает негативное воздействие на степень интерстициально-фиброзных изменений легких и повышение уровня давления в малом круге кровообращения, а плохое качество питьевой воды отрицательно сказывается на развитии патологии сердца (нарушения возбудимости миокарда, увеличение размеров камер, изменения клапанного аппарата). Показатели непараметрической корреляции Кендалла демонстрируют прямое соотношение с уровнями аммиака и свинца в питьевой воде тяжести поражения опорно-двигательного аппарата.
/128-1.gif)
Таким образом, как свидетельствуют данные литературы и результаты собственных исследований, развитие ССД и темпы ее прогрессирования в детском возрасте тесно связаны с неблагоприятными экологическими факторами, в частности, со степенью загрязнения неорганическими и органическими поллютантами окружающей атмосферы (соли тяжелых металлов, угарный газ, нитраты, кварц и другие продукты промышленного производства), которые повышают активность матриксных металлопротеиназ, вызывают синтез провоспалительных цитокинов и аутоантител, изменяют эндотелиальную функцию сосудов и продукцию хемоаттрактантных белков, коллагенов, фибронектина и биополимеров соединительной ткани, тем самым усиливая процессы фиброзирования, причем в восточных регионах Украины частота возникновения ювенильной ССД зависит от уровней во вдыхаемом воздухе диоксида углерода, 3,4-бензпирена и фенола, а в питьевой воде — свинца и лития, что в первую очередь определяет поражение легких, сердца и опорно-двигательного аппарата.
В заключение отметим, что современный этап развития детской ревматологии характеризуется сближением разных аспектов познания в совершенно новые, позволяющие взглянуть на тот или иной патологический процесс одновременно с разных сторон как на целостное явление. В итоге этот синтез реально приводит к невозможности разграничения классических дисциплин (морфологии, физиологии, биохимии, иммунологии), на которых сформировался в педиатрии раздел ревматологии. В контексте ССД можно в будущем добавить и экологию.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Barnes J, Mayes MD. Epidemiology of systemic sclerosis: incidence, prevalence, survival, risk factors, malignancy, and environmental triggers. Curr Opin Rheumatol. 2012;24(2):165-70. doi: 10.1097/BOR.0b013e32834ff2e8.
2. Bello S, Rinaldi A, Trabucco S, Serafino L, Bonali C, Lapadula G. Erasmus syndrome in a marble worker. Reumatismo. 2015;67(3):116-22. doi: 10.4081/reumatismo.2015.826.
3. Boverhof DR, Krieger SM, Hotchkiss JA, Stebbins KE, Thomas J, Woolhiser MR. Assessment of the immunotoxic potential of trichloroethylene and perchloroethylene in rats following exposure. J Immunotoxicol. 2012;20(11):95-8. doi: 10.3109/1547691X.2012.735275.inhalation
4. Capusan I. Scleroderma or scleroedema? Comments on the case published in 1753 by Dr. Carlo Curzio of Naples. G Ital Dermatol Minerva Dermatol. 1971;46(1):40-47.
5. Cartin-Ceba R, Kashiouris M, Plataki M, Kor DJ, Gajic O, Casey ET. Risk factors for development of acute kidney injury in critically ill patients: a systematic review and meta-analysis of observational studies. Crit Care Res Pract. 2012;20(12):691013. doi: 10.1155/2012/691013.
6. Chaouch N, Mjid M, Zarrouk M, et al. Erasmus’ syndrome with pseudo-tumour masses. Rev Mal Respir. 2011;28(7):924-7. doi: 10.1016/j.rmr.2011.06.003.
7. Charni Chaabane S, Coomans de Brachène A, Essaghir A, et al. PDGF-D expression is down-regulated by TGFβ in fibroblasts. PLoS One. 2014;9(10):108656. doi: 10.1371/journal.pone.0108656.
8. Chifflot H, Fautrel B, Sordet C. Incidence and prevalence of systemic sclerosis: a systematic literature review. Semin Arthr Rheum. 2013;37(4):223-35.
9. Corsaro GB, Gabusi V, Pilisi A. Health risk assessment in the metal scrap recycle: the case of Brescia. G Ital Med Lav Ergon. 2012;34(3):259-66.
10. Dospinescu P, Jones GT, Basu N. Environmental risk factors in systemic sclerosis. Curr Opin Rheumatol. 2013;25(2):179-83. doi: 10.1097/BOR.0b013e32835cfc2d.
11. Elie MR, Clausen CA, Geiger CL. Reduction of benzo[a]pyrene with acid-activated magnesium metal in ethanol: a possible application for environmental remediation. J Hazard Mater. 2012;15(2):77-85. doi: 10.1016/j.jhazmat.2011.11.089.
12. Estevez-Carmona MM, Melendez-Camargo E, Ortiz-Butron R, Pineda-Reynoso M, Franco-Colin M, Cano-Europa E. Hypothyroidism maintained reactive oxygen species-steady state in the kidney of rats intoxicated with ethylene glycol: effect related to an increase in the glutathione that maintains the redox environment. Toxicol Ind Health. 2012;4(4):75-8. doi: 10.1177/0748233712442710.
13. Fabri M, Krieg T. Pathogenesis of systemic sclerosis. Hautarzt. 2007;58(10):838-43.
14. Ghahramani N. Silica nephropathy. Int J Occup Environ Med. 2010;1(3):108-15.
15. Giacomelli R, Liakouli V, Berardicurti O, et al. Interstitial lung disease in systemic sclerosis: current and future treatment. Rheumatol Int. 2017;6(1):142-8. doi: 10.1007/s00296-016-3636-7.
16. Kerley-Hamilton JS, Trask HW, Ridley CJ, et al. Inherent and benzo[a]pyrene-induced differential aryl hydrocarbon receptor signaling greatly affects life span, atherosclerosis, cardiac gene expression, and body and heart growth in mice. Toxicol Sci. 2012;126(2):391-404. doi: 10.1093/toxsci/kfs002.
17. Kerneis S, Boëlle PY, Grais RF, et al. Mortality trends in systemic sclerosis in France and USA, 1980-1998: an age-period-cohort analysis. Eur J Epidemiol. 2010;25(1):55-61. doi: 10.1007/s10654-009-9403-2.
18. Kim H, Kim NH, Kang HJ, et al. Successful long-term use of imatinib mesylate in pediatric patients with sclerodermatous chronic GVHD. Pediatr Transplant. 2012;16(8):910-2. doi: 10.1111/petr.12004.
19. Kuo CF, Grainge MJ, Valdes AM, et al. Familial risk of Sjögren’s sndrome and Co-aggregation of autoimmune diseases in affected families: a nationwide population study. Arthritis Rheumatol. 2015;67(7):1904-12. doi: 10.1002/art.39127.
20. Lafyatis R, York M. Innate immunity and inflammation in systemic sclerosis. Curr Opin Rheumatol. 2009;21(6):617-22. doi: 10.1097/BOR.0b013e32832fd69e.
21. Liu X, Mayes MD, Tan FK, et al. Correlation of interferon-inducible chemokine plasma levels with disease severity in systemic sclerosis. Arthritis Rheum. 2013;65(1):226-35. doi: 10.1002/art.37742.
22. Ludwicka-Bradley A, Bogatkevich G, Silver RM. Thrombin-mediated cellular events in pulmonary fibrosis associated with systemic sclerosis (scleroderma). Clin Exp Rheumatol. 2014;22(3):38-46.
23. Magnant J, Diot E. Systemic sclerosis: epidemiology and environmental factors. Presse Med. 2006;35(12):1894-901.
24. Makol A, Reilly MJ, Rosenman KD. Prevalence of connective tissue disease in silicosis (1985-2006) — a report from the state of Michigan surveillance system for silicosis. Am J Ind Med. 2011;54(4):255-62. doi: 10.1002/ajim.20917.
25. Marie I, Gehanno JF. Environmental risk factors of systemic sclerosis. Semin Immunopathol. 2015;37(5):463-73. doi: 10.1007/s00281-015-0507-3.
26. Mora GF. Systemic sclerosis: environmental factors. J Rheumatol. 2009;36(11):2383-96. doi: 10.3899/jrheum.090207.
27. Morry J, Ngamcherdtrakul W, Gu S, et al. Dermal delivery of HSP47 siRNA with NOX4-modulating mesoporous silica-based nanoparticles for treating fibrosis. Biomaterials. 2015;66(10):41-52. doi: 10.1016/j.biomaterials.2015.07.005.
28. Murdaca G, Contatore M, Gulli R, Mandich P, Puppo F. Genetic factors and systemic sclerosis. Autoimmun Rev. 2016;15(5):427-32. doi: 10.1016/j.autrev.2016.01.016.
29. Nikpour M, Stevens WM, Herrick AL, Proudman SM. Epidemiology of systemic sclerosis. Best Pract Res Clin Rheumatol. 2010;24(6):857-69. doi: 10.1016/j.berh.2010.10.007.
30. Nishijima C, Hayakawa I, Matsushita T. Autoantibody against matrix metalloproteinase-3 in patients with systemic sclerosis. Clin Exp Immunol. 2014;138(2):357-63.
31. Phuong J, Kim S, Thomas R, Zhang L. Predicted toxicity of the biofuel candidate 2,5-dimethylfuran in environmental and biological systems. Environ Mol Mutagen. 2012;53(6):478-87. doi: 10.1002/em.21702.
32. Postlethhwaite AE, Shigemitsu H, Kanangat S. Cellular origins of fibroblasts: possible implications for organ fibrosis in systemic sclerosis. Curr Opin Rheumatol. 2014;16(6):733-8.
33. Rocha MC, Santos LM, Bagatin E, et al. Genetic polymorphisms and surface expression of CTLA-4 and PD-1 on T cells of silica-exposed workers. Int J Hyg Environ Health. 2012;215(6):562-9. doi: 10.1016/j.ijheh.2011.10.010.
34. Rubio-Rivas M, Moreno R, Corbella X. Occupational and environmental scleroderma. Systematic review and meta-analysis. Clin Rheumatol. 2017;14(1):223-9. doi: 10.1007/s10067-016-3533-1.
35. Vilela FA, Carneiro S, Ramos-e-Silva M. Treatment of morphea or localized scleroderma: review of the literature. J Drugs Dermatol. 2010;9(10):1213-9.
36. Volkmann ER, Tashkin DP, Roth MD, et al. Changes in plasma CXCL4 levels are associated with improvements in lung function in patients receiving immunosuppressive therapy for systemic sclerosis-related interstitial lung disease. Arthritis Res Ther. 2016;18(1):305-15. doi: 10.1186/s13075-016-1203-y.
37. Wang C, Li H, Yang R, et al. MicroRNA array analysis of microRNAs related to systemic scleroderma. Rheumatol Int. 2012;32(2):307-13. doi: 10.1007/s00296-010-1615-y.
38. Wei P, Yang Y, Guo X, et al. Identification of an association of TNFAIP3 polymorphisms with matrix metalloproteinase expression in fibroblasts in an integrative study of systemic sclerosis-associated genetic and environmental factors. Arthritis Rheumatol. 2016;68(3):749-60. doi: 10.1002/art.39476.
39. Wilson D, Zaqout M, Heo JH, Park EK, Oak CH, Ueno S. Nuclear factor-kappa B is not involved in titanium dioxide-induced inflammation. J UOEH. 2012;34(2):183-91.
40. Yang Y, Wei P, Guo X. Impact of age and autoantibody status on the gene expression of scleroderma fibroblasts in response to silica stimulation. Eur J Inflamm. 2013;11(3):631-9.
41. York MR. Novel insights on the role of the innate immune system in systemic sclerosis. Expert Rev Clin Immunol. 2011;7(4):481-9. doi: 10.1586/eci.11.40.
42. You L, Zhu X, Shrubsole MJ, et al. Renal function, bisphenol A, and alkylphenols: results from the National Health and Nutrition Examination Survey (NHANES 2003-2006). Environ Health Perspect. 2011;119(4):527-33. doi: 10.1289/ehp.1002572.
43. Zbinden G, Grimm L. Thrombogenic effects of xenobiotics. Arch Toxicol Suppl. 2005;8(1):131-41.
44. Zhang S, Zhang K, Jiang M, Zhao J. Hutchinson-Gilford progeria syndrome with scleroderma-like skin changes due to a homozygous missense LMNA mutation. J Eur Acad Dermatol Venereol. 2016;30(3):463-5. doi: 10.1111/jdv.12840.
45. Zulian F, Athreya BH, Laxer R, et al. Juvenile localized scleroderma: clinical and epidemiological features in 750 children. An international study. Rheumatology. 2016;45(5):614-20.

/127-1.gif)
/127-2.gif)
/128-1.gif)