Ювенільний дерматоміозит (ЮДМ) є тяжким прогресуючим системним захворюванням із переважним ураженням попереково-смугастої мускулатури, шкірних покривів і судин мікроциркуляторного русла, що посідає 3-тє місце за захворюваністю серед системних хвороб сполучної тканини. Поширеність ЮДМ досить невелика й становить близько 4 на 100 000 дітей до 17 років із коливаннями в різних етнічних групах, проте летальність сягає 1,5–5 % [1]. Дебютує ЮДМ найчастіше в дітей віком 4–10 років, дівчатка хворіють у 2 рази частіше, ніж хлопчики. Етіологія ЮДМ невідома. Є повідомлення про виявлення в м’язових волокнах хворих на ЮДМ вірусоподібних частинок, проте серологічними й вірусологічними методами вірусна етіологія захворювання не була підтверджена. В основі патогенезу ЮДМ лежить розвиток деструктивної васкулопатії судин дрібного калібру, у формуванні якої беруть активну участь Т-лімфоцити — хелпери 1, 2 і 17-го типу. Остаточно не уточненою залишається роль В-лімфоцитів у патогенезі ЮДМ, хоча часто спостерігається підвищення їх активованих фракцій.
Найбільше при ювенільному дерматоміозиті вражаються шкіра й скелетні м’язи. Ураження шкіри частіш за все має вигляд патогномонічних симптомів, важливішими серед яких є геліотропна еритема (пурпурно-червоний висип на повіках), симптом Готтрона (пурпурно-червона, з лушпинням, атрофічна еритема на розгинальній поверхні кистей над дрібними суглобами) та еритема на розгинальній поверхні кінцівок. Геліотропна еритема поєднується з мінливим протягом доби параорбітальним набряком, що формує класичний симптом «дерматоміозитних окулярів», маски або напівмаски. Ніс залишається блідим, губи набряклі. Зміни шкіри відрізняються значною стійкістю, синюшним відтінком. Висип може поширюватися на шию й груди (V-подібний), верхню частину спини й рук (симптом «шалі»), живіт. Часто на шкірі у хворих з’являються зміни за типом деревоподібного ліведо бордово-синюшного кольору в ділянці плечового поясу й проксимальних відділів кінцівок.
До проявів м’язових уражень, що притаманні ювенільному дерматоміозиту, відносять проксимальну м’язову слабкість (верхніх і нижніх кінцівок, тулуба), підвищення рівня креатинфосфокінази (КФК) і/або альдолази в сироватці крові, болі в м’язах при пальпації або спонтанні міалгії.
Проксимальна й загальна м’язова слабкість при ЮДМ у дитини часто спочатку проявляється зміною ходи, потім — зменшенням обсягу активних рухів до унеможливлення утримувати голову, дистонією, дисфагією, порушенням акту дихання. Можуть бути міалгії, чутливість м’язів при пальпації, їх ущільнення, а при деструкції м’язів при пальпації відчувається їх тістувата консистенція. У подальшому розвиваються м’язові атрофії.
Крім зазначених шкірних та м’язових уражень, критеріями діагнозу ЮДМ виступають також інші прояви ураження м’язів — міогенні зміни на електроміограмі (ЕМГ), виявлення міозит-специфічних антитіл, морфологічні зміни в м’язах, що відповідають запальній міопатії, а також недеструктивні артрит або артралгії, ознаки системного запалення. Останні при ЮДМ спостерігаються лише у випадках із високою активністю запального процесу.
Крім опорно-рухового апарату при ЮДМ уражаються й внутрішні органи, найчастіше серце та легені. Уперше патологія легенів при ЮДМ була описана в другій половині XIX століття. За локалізацію серед уражень органів дихання при ЮДМ відрізняють ураження верхніх дихальних шляхів (найчастіше гортані, що призводить до охриплості голосу), легенів (у вигляді інтерстиціальних уражень та легеневого васкуліту). Плеврит при ЮДМ описаний тільки на тлі тяжкого інтерстиціального ураження легенів.
Покращання можливостей інструментальної діагностики сприяло більш частому виявленню уражень органів дихання у хворих на ЮДМ. За даними аналізу клінічного реєстру відділення хвороб сполучної тканини в дітей ДУ «ІПАГ НАМНУ», серед 32 пацієнтів з ЮДМ лише у 8 випадках (25 %) спостерігались маніфестні клінічні прояви ураження органів дихання, тоді як у 29 хворих (90,6 %) відмічені рентгенологічні зміни [2]. За даними попередніх дослідників, у 30–60 % хворих на ЮДМ на тлі міопатичного синдрому описані бактеріальні пневмонії, у 7–8 % розвивається стійкий гіповентиляційний синдром та в 5–27 % має місце інтерстиціальне ураження легенів автоімунного генезу [3].
Клінічні ознаки ураження органів дихання при ЮДМ зазвичай неспецифічні й починаються із задишки та сухого кашлю при фізичному навантаженні. Фізикальні дані при інтерстиціальному ураженні легенів характеризуються стійким скороченням перкуторного тону над нижніми відділами легенів, можуть вислуховуватися мігруючі крепітуючі хрипи.
Морфологічно пневмоніт у хворих на ЮДМ характеризується продуктивними й склеротичними змінами міжальвеолярних перегородок, інфільтрацією їх лімфоїдними й плазматичними клітинами. Для легеневого васкуліту характерні зміни великих судин із клініко-рентгенологічною картиною інфаркту органа. Компонентом ураження судин є й розвиток легеневої гіпертензії.
Ускладнення ураження легенів при ЮДМ спостерігаються у вигляді спонтанного пневмотораксу, спонтанного пневмомедіастинуму [4].
Перебіг інтерстиціального ураження органів дихання при дерматоміозиті в 15,1 % хворих прогресуючий, часто з летальним кінцем (47,7–76 % при гострому інтерстиціальному ураженні легенів) [5]. Фатальні випадки внаслідок уражень органів дихання частіше зустрічаються при поліміозиті, ніж при дерматоміозиті [3].
Особлива форма інтерстиціального ураження легенів при дерматоміозиті — антисинтетазний синдром — зустрічається в дорослих хворих у кожному 5-му випадку й характеризується розвитком гострої легеневої недостатності за рестриктивним типом, що може передувати розвитку міопатичного синдрому. Причому 38 % пацієнтів позитивні за аJo1-антитілами [6].
На думку клініцистів, первинно-інтенсивне лікування знижує частоту прогресування уражень органів дихання при дерматоміозиті та його летальність [7].
Лікування інтерстиціальних пневмонітів при ЮДМ є складним завданням.
Сьогодні існують численні описи застосування пульс-терапії глюкокортикоїдами, введення внутрішньовенних імуноглобулінів, циклофосфаміду, циклоспорину, азатіоприну, мікофенолату мофетилу, інгібіторів кальційневрину в пацієнтів із гострим інтерстиціальним ураженням легенів при ЮДМ. Деяким хворим призначались також генно-інженерні препарати біологічної дії (ГІБТ): ритуксимаб та базиліксимаб [8–13].
Оскільки спроби використання лише повторної пульс-теапії глюкокортикоїдами були неуспішними, застосовують складні схеми їх комбінацій: глюкокортикоїди + внутрішньовенні імуноглобуліни + такролімус із переходом на ГІБТ; пульс-терапія глюкокортикоїдами з циклофосфамідом; надвисокі дози глюкокортикоїдів + циклофосфан чи цикло–спорин + внутрішньовенні імуноглобуліни, що дозволяли поодиноким пацієнтам із гострим інтерстиціальним ураженням легенів автоімунного генезу при ЮДМ вижити [14–18]. Проте всі автори відмічали високу летальність (більше ніж половина випадків) та обов’язкове прогресування ураження.
Ще у 2002 р. вперше Levinе опублікував інформацію про клінічно ефективне використання ритуксимабу при лікуванні дерматоміозиту у 2 дітей [19]. У 2011 р. Y. Chiu і співавт. описали лікування 12 дітей з ЮДМ, у яких використовувався цей препарат у дозі 375 мг/м2 1 раз на 4 тижні від 1 до 3 введень. Усі пацієнти до цього отримували без ефекту глюкокортикоїди та від 1 (метотрексат) до 6 базисних хворобомодифікуючих засобів протягом 1 міс. — 8 років [20]. У 2012 р. ритуксимаб був рекомендований для використання при ЮДМ у випадках, рефрактерних до терапії глюкокортикоїдами, цитостатичними засобами в поєднанні з введенням внутрішньовенних імуноглобулінів [21].
Н. Andersson та співавт. у 2015 р. опублікували ретроспективний аналіз, у якому вивчено перебіг дерматоміозиту в 112 дорослих пацієнтів, з яких у 34 % спостерігалось тяжке ураження легенів протягом попередніх 12 міс. Усі ці пацієнти отримували ритуксимаб. У третині випадків (32 %) відмічений летальний кінець, у третині (34 %) — істотне покращення показників зовнішнього дихання [22]. Інший аналіз даних літератури з 1980 по 2014 р. розглядав 45 випадків використання ритуксимабу в дорослих із дерматоміозитом при ураженні легенів у вигляді антисинтетазного синдрому, описується тільки 1 летальний кінець [23].
Наводимо наше спостереження випадку тяжкого перебігу ювенільного дерматоміозиту в дівчинки Н., 10 років. Точний час, з якого хворіє дитина, невідомий. Проте дівчинка згадувала, що не могла бігати на заняттях із фізкультури ще навесні 2015 р., влітку не могла їздити на велосипеді, коли відпочивали на морі, тоді ж з’явилися поширені висипання, які були розцінені як сонячна алергія.
Ознаки захворювання виявлені лікарем-педіатром активно в серпні 2015 р., коли дитині було 9 років, при визначенні обсягу фізичних навантажень на фізкультурі під час проведення проби Руф’є: дитина зовсім не могла присісти самостійно. Направлена до неврологічного відділення обласної клінічної лікарні (ОКЛ), де виявлені зміни на шкірі, підвищення КФК до 366 (норма 24–170), лактатдегідрогенази (ЛДГ) — 992 (норма 210–460), аланінамінотрансферази (АЛТ) — 295 Од/л, аспартатамінотрансферази (АСТ) — 580 Од/л, після чого дівчинка переведена до кардіоревматологічного відділення.
Там у вересні 2015 року вперше встановлений діагноз ЮДМ на підставі наявності міопатичного синдрому, патогномонічних уражень шкіри, ферментемії. Розпочата терапія глюкокортикоїдами — преднізолоном у дозі 1 мг/кг. У зв’язку з неефективністю терапії через 3 тижні дівчинка направлена в ДУ «ІПАГ НАМНУ». При першому надходженні в жовтні 2015 р. у дитини спостерігався тяжкий міо–патичний синдром (не може відірвати голову від подушки, самостійно не встає, не сідає, руки не підіймає, ноги не утримує, м’язи тотально зменшені в об’ємі, болючі при пальпації), дистонія, дисфагія (поперхування), геліотропна еритема, еритема над колінами, ліктьовими суглобами з ділянками деструкції, позитивний симптом Готтрона, специфічний гінгівіт, ліведо, артрити променезап’ясткових суглобів, контрактури в ліктьових суглобах, тахікардія 110–120 уд/хв, ослаблення серцевих тонів. У стаціонарі виявлене подальше підвищення ферментів міолізу (КФК 8194 Од/л, ЛДГ 3586 Од/л), зміни на ЕМГ (ознаки первинно-м’язового ураження, спонтанна активність волокон у всіх досліджуваних м’язах, зниження сили скорочення до 15 % від норми, значна поліфазія). Проведена заміна глюкокортикоїдного препарату (преднізолон на метилпреднізолон), підвищено дозу до 1,5 мг/кг, призначена базисна хворобомодифікуюча терапія (метотрексат 20 мг/тиждень). Метотрексат був обраний у зв’язку з наявністю ураження суглобів. Протягом місяця суттєвого клінічного ефекту від проведеної терапії відзначено не було, зберігався високий рівень КФК (до 8000 ОД/л) та ЛДГ (до 3500 Од/л, у тому числі відмічене підвищення її серцевої фракції), у зв’язку з чим 01–03.12.15 проведена пульс-терапія глюкокортикоїдами. Ефект відмічався частковий: тенденція до зниження міолізу (зменшення активності КФК, ЛДГ), збереження міопатичного синдрому. З огляду на неефективність терапії, імунологічні особливості (підвищення відносного вмісту B-лімфоцитів до 57,95 % (абс. число 3865/мкл) 17.12.15 проведена ГІБТ (ритуксимаб 400 мг), для повторного введення препарату дитина тимчасово переведена в ОКЛ м. Кропивницького (повторне введення ритуксимабу проведене 04.01.16).
У січні 2016 року відмічено певне покращання стану дитини, мінімальне наростання обсягу активних рухів, нормалізація КФК (43 Од/л), суттєве зниження ЛДГ (954 Од/л), проте відмічене зростання рівня трансаміназ (АЛТ 385 Од/л, АСТ 210 Од/л). Протягом місяця дитина перебувала вдома. Продовжувала отримувати весь час 48 мг/добу медролу та 20 мг/тиждень метотрексату, курантил, ніфедипін, нейромідин, трентал, омепразол. Рекомендації з лікувальної фізкультури (ЛФК) виконувала частково. На планову госпіталізацію 27.01.2016 не з’явилась. Викликана активно.
Госпіталізована у ДУ «ІПАГ НАМНУ» каретою швидкої допомоги в супроводі медичного персоналу 17.02.16 у тяжкому стані. Тяжкість стану була обумовлена наявністю дорсалгій, вираженого інтоксикаційного та больового синдрому, пов’язаного з гнійним панарицієм дистальної фаланги ІІ пальця лівої кисті, гіпертермією 38,5 °С. Гіпертермія відмічена батьками протягом попередніх 3 діб, зміни пальця — після уколу голкою за 5 днів до госпіталізації, болі в спині дитина відмічала вже протягом попередніх 2 тижнів. При фізикальному огляді виявлені тотальні нашарування на слизових порожнини рота, провідні вологі хрипи в легенях, тахікардія, тяжкий міопатичний синдром (не може відірвати голову від подушки, самостійно не встає, не може підняти кінцівки, руки не підіймає, м’язи тотально зменшені в об’ємі, болючі при пальпації). Шкіра суха на дотик, атрофована, геліотропна еритема. Обличчя місяцеподібне — ознаки гіперкортицизму.
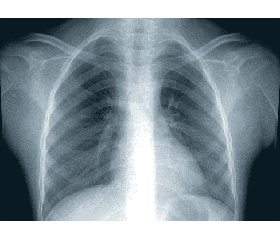
При дообстеженні виключено компресію тіл хребців (системний остеопороз), інфільтративних змін у паренхімі легенів не було, виявлено наростання ЛДГ (1320 Од/л). Проведена рентгенографія органів грудної клітки (ОГК) (рис. 1–3).
У той же день проведено оперативне втручання (розкриття панарицію), розпочата антибактеріальна (лінкоміцин, тієнам), антимікотична (флюконазол, ністатин), місцева терапія, введено внутрішньовенні імуноглобуліни (0,4 г/кг на добу № 3), метотрексат тимчасово відмінений у зв’язку з наявністю тяжкого гнійно-бактеріального процесу. Стан дівчинки протягом тижня покращився, післяопераційна ранка затягнулась первинним натягом та епітелізувалась через 10 днів.
Міопатичний синдром зберігався (самостійно не вставала, кінцівки без опори не утримувала), проте в даний період було відмічено подальше підвищення рівня ЛДГ, трансаміназ, тому в дитини виключались вірусні гепатити, досліджені фракції ЛДГ. На підставі отриманих результатів (див. про це нижче) зміни розцінені як медикаментозне ураження печінки, загальна терапія редукована, підсилена гепатопротекторами, глюкокортикоїдна терапія збережена в дозі 1,5 мг/кг (загалом у той час дитина отримувала її впродовж 6 міс.), виконане повторне введення внутрішньовенних імуноглобулінів через 4 тижні. Вирішено тимчасово утриматися від відновлення базисної хворобомодифікуючої терапії цитостатичними засобами та препаратами біологічної дії (вміст В-лімфоцитів у периферичній крові був низький).
У березні 2016 року спостерігалось деяке збільшення обсягу активних рухів (дівчина самостійно ходила, могла сісти, але не встати), постійно проводилась ЛФК з інструкторами. Видимі слизові були чисті, шкірні симптоми мінімальні, відмічався ліведоподібний рисунок на нижніх кінцівках, постійно зберігалась тахікардія (94–104 уд/хв). Артеріальний тиск утримувався в межах 100/60–90/50 мм рт.ст.
Із 21.03.16 р. у дівчинки відновились дорсалгії. Оглянута ортопедом, проведені заміри для виготовлення корсету. У зв’язку із затримкою виготовлення корсету рекомендовано обмежити обсяг активних рухів (постільний режим), розпочате вимушене зниження дози глюкокортикоїдів, поруч із цим дівчинка продовжувала отримувати вітамін D3 4 тис. МО та препарати кальцію, вирішувалось питання про призначення бісфосфонатів. Останні не були призначені у зв’язку з печінковими ураженнями.
Від обмеження рухів з метою запобігання компресії хребців дитина самостійно відмовилась, продовжувала потроху ходити, виходила на вулицю. При щоденних оглядах аускультативних змін у легенях не було. Дихання завжди було помірно послаблене в нижніх відділах, що розглядалось як асоційована з міопатичним синдромом гіповентиляція. Дихальну гімнастику виконувала частково.
Прийняте рішення про відновлення базисної хворобомодифікуючої терапії із заміною метотрексату на азатіоприн у зв’язку з гіпертрансаміназемією, здебільшого за рахунок аланінамінотрансферази (АЛТ 431 Од/л, АСТ 73 Од/л).
Після зниження дози глюкокортикоїдів із 48 до 40 мг метилпреднізолону на добу та одержання протягом 1 тижня азатіоприну (не досягнута терапевтично значна концентрація при повному виведенні метотрексату, який дитина не отримувала вже 6 тижнів) відмічене погіршення загального стану.
28–29.03.16 р. уперше з’явились скарги на задишку при мінімальному фізичному навантаженні (пройшла коридором), виключено наростання серцевої недостатності (виконано ехокардіографію (ЕхоКГ), електрокардіографію (ЕКГ)), від проведення рентгенологічного дослідження ОГК мати відмовилась.
31.03.16 р. — поява міалгій, наростання задишки в спокої до 40/хв, поява периферичного ціанозу при відсутності аускультативних шумів у легенях. Призначення антибактеріальної терапії призвело до погіршення стану.
Рентгенологічне дослідження ОГК проведене 01.04.16 (рис. 8), виявлене наростання затемнення, що в сукупності з клінічними змінами (задишка переважала над аускультативною симптоматикою, зберігалась нормальна температура тіла, відсутні катаральні явища, відмічалось короткострокове покращання після введення додатково 40 мг солу-медролу) свідчило про інтерстиціальний характер ураження легенів. Відзначене ураження органів дихання розцінене як пульмоніт (прояви легеневого ураження при ЮДМ).
/142-1.gif)
Водночас спостережене наростання змін із боку серця (відмічено зміщення правої межі, збільшення печінки — виступає до +2 см). Проводилась диференціальна діагностика з іншими інтерстиціальними ураженнями легенів (хламідіоз, мікоплазмова інфекція), виключались бактеріальні інфекції (прокальцитонін був у межах нормальних значень), зроблено посів мокротиння/слини. Призначена киснетерапія. Продовжувала отримувати антибіотики (цефтриаксон замінений на ципрофлоксацин + азитроміцин). Проведена повторна пульс-терапія глюкокортикоїдами, виконано повторне — з інтервалом у 3 тижні — введення внутрішньовенних імуноглобулінів (400 мг/кг). Затримане введення циклофосфаміду у зв’язку з очікуванням результатів прокальцитоніну, низьким вмістом лімфоцитів (300–900 в 1 мкл). Відмічалось деяке покращення (зникнення ціанозу, зниження ступеня дихальної недостатності (ДН) (частота дихання 26–30/хв), розмірів печінки).
08.04.16 стан короткочасно погіршився — відмічена гіпертермія з ознобом, повторне рентгенологічне дослідження ОГК — наростали затемнення.
Оскільки рентгенографія проводилась з інтервалом в 1 тиждень, а перше погіршення відмічалось 04.04.16, час виникнення зазначених змін уточнити було складно. Посів мокротиння/слини — грибкова флора, скудний ріст. Проведена корекція антибактеріальної терапії (таргоцид), призначені протигрибкові препарати (віфенд) внутрішньовенно.
Загальний стан дитини залишався тяжким. Свідомість була збережена, дівчинка відповідала окремими словами. Положення в ліжку було вимушене, самостійно змінювати позу дитина була не в змозі. Наростали дорсалгії. Знаходилась на постійній оксигенотерапії через маску.
Короткочасно відмічені в легенях мігруючі тріскучі звучні хрипи в нижніх відділах. Частота дихання коливалася протягом тижня — 26–50/хв.
Сатурація О2 — від 51 (під час їжі, хвилювання) до 96. Зберігалася тахікардія, ЧСС 100–120 уд/хв.
09.04.16 відмічене розширення меж серця, посилення акценту ІІ тону над легеневою артерією.
14.04.16 у зв’язку з різким зниженням сатурації, сомнолентністю дитина була переведена на штучну вентиляцію легенів (ШВЛ), підвищена добова доза глюкокортикоїдів до 200 мг, проведена заміна антибіотиків, повторне введення довенних імуноглобулінів. Стан дитини залишався тяжким. Сатурацію О2 утримувала в межах 80–88 при інгаляції 70% киснем.
18.04.16 частота самостійних дихань під час короткочасної дезінтубації становила 32–40/хв. При санації інтубаційної трубки — виділення слизове, незначне. ЧСС 132/хв. АТ 90/60 мм рт.ст. Відмічене наростання набряку обличчя, геліотропної еритеми на повіках, кінцівках, пальмарної еритеми, множинні петехії в місцях здавлювання кінцівок при проведенні медичних маніпуляцій, поява «руки механіка» (рис. 13).
При аускультації легенів — подих спереду проводиться в усі відділи, вислуховувались звучні провідні хрипи через інтубаційну трубку на видиху. Вміст промивних вод геморагічний. 15 годин — різке погіршення стану, неефективна санація інтубаційної трубки, двічі реінтубована, падіння сатурації до 8, проводилася серцево-легенева реанімація.
19.04.16 під час блювання спостерігалось виділення детриту легеневої тканини. З огляду на наявність інтерстиціального ураження легенів з деструкцією легенів та ДН ІІІ ст. у дитини з ювенільним дерматоміозитом, недостатню ефективність високих доз глюкокортикоїдів, виключення на той момент інфекційної природи процесу рекомендоване за життєвими показаннями відновлення базисної терапії згідно зі стандартами EULAR (2014). Проведена інфузія циклофосфаміду.
20.04.16 стан дитини стабільно тяжкий. Сатурацію О2 утримувала на ШВЛ 95 %. Відмічене зменшення набряків обличчя та шкірних проявів захворювання, посилення рухів у верхніх кінцівках.
21.04.16 о 12.45 після перевертання розвинувся закритий пневмоторакс, з приводу якого проведена пункція та дренування за Бюлау. Продовжувала отримувати 125 мг солу-медролу, антибіотики, протигрибкові засоби, ко-тримоксазол для профілактики пневмоцистної пневмонії, силденафіл та симптоматичну терапію.
23.04.16 відмічена субфебрильна температура тіла, підвищення тиску до 160/100 мм рт.ст.
24.04.16 — пароксизмальна надшлуночкова тахікардія (ЧСС 265/хв), купірована введенням кордарону.
25.04.16 відмічений фебрилітет на фоні різкого падіння вмісту лейкоцитів (600/мкл), поява нових вогнищ затемнення при рентгенологічному дослідженні, посилена антибактеріальна терапія, призначені колонієстимулюючі фактори.
26.04.16 о 14:20 у зв’язку зі зниженням сатурації O2 дитина реінтубована, розпочаті реанімаційні дії, о 15:00 за негайними показаннями проведена трахео–скопія. Візуалізована велика кількість фіброзного білого сухого секрету, трахеоскопія припинена у зв’язку з необхідністю продовження ШВЛ. 22:00 — погіршення стану, відсутність реакції зіниць, брадикардія до 30 уд/хв. Проводилась інтенсивна терапія.
27.04.16 о 05:50 електромонітор зафіксував зупинку серця, реанімаційні заходи без ефекту. О 06:35 зареєстрована смерть.
Проведені обстеження
— Загальний аналіз крові (табл. 1).
— Біохімічне дослідження крові (табл. 2). ЛДГ-ізоензими від 11.03.16 — 955 Од/л, ЛДГ-1 — 25,2 % (16–32); ЛДГ-2 — 50,8 % (29–42), ЛДГ-3 — 8,8 % (17–26,2), ЛДГ-4 — 3,1 % (5,9–12,3), ЛДГ-5 — 12,1 % (3,2–17,3).
— Кальцій — 2,73 ммоль/л (2,2–2,75), фосфор — 0,94 ммоль/л.
— Група крові: О(І) Rh(+) позит.
— Глікозильований гемоглобін від 19.03.16: 5,61 % (4,8–5,9), тиреотропний гормон 2,1 мМО/л (0,17–4,05), Т4 вільний 19,3 пмоль/л (11,5–23).
— Коагулограма (табл. 3).
— Прокальцитонін 0,06 (норма ↓0,1) від 04.04.16.
— Імунологічне дослідження від 18.02.16: IgG 6,5 г/л, IgA 1,99 г/л, IgM 0,25 г/л, у динаміці від 12.04.16: IgG 9,6 г/л, IgA 1,0 г/л, IgM 0,15 г/л. ЦІК 0,018 г/л (норма < 0,025), у динаміці від 12.04.16: ЦІК 0,018. ANA — позитивні 1+. У динаміці від 12.04.16: ANA — позитивні.
— Антифосфоліпідні антитіла від 18.02.16: антикардіоліпінові aCL Ig/IgM 2 GPL (норма < 10 GPL); антифосфатидилсеринові aPS Ig/IgM 2 Од/мл (норма < 10 Од/мл); антифосфатидил-етаноламінові aPE Ig /IgM 9,2 Од/мл (норма < 12 ОД/мл); у динаміці від 12.04.16: антикардіоліпінові aCL Ig/IgM 7,0 GPL (норма < 10 GPL); антифосфатидилсеринові aPS Ig/IgM 2 Од/мл (норма < 10 Од/млl); антифосфатидил-етаноламінові aPE Ig /IgM 7,4 Од/мл (норма < 12 Од/мл). Аналіз на антитіла до Jo1, Mi2 не зроблено у зв’язку з відсутністю коштів.
— Субпопуляції лімфоцитів від 18.02.16: лейкоцити 5526 в 1 мкл (4700–8000), лімфоцити 22,91 % (норма 35–55), 1266 в 1 мкл (1100–5900); Т-лімфоцити (CD3+) 88,6 % (55–75), 1122 в 1 мкл (700–4200); Т-хелпери (CD3+ CD4+) 32,64 % (30–55), 413 в 1 мкл (300–1800), Т-цитотоксики (CD3+ CD8+) 56,30 % (12–30), 713 в 1 мкл (300–1800); співвідношення Тх/Тц 0,58 % (1,0–2,5); В-лімфоцити (СD19+) 2,19 (10–25), 28 в 1 мкл (200–1600); NK-лімфоцити (CD3-CD 16+ 56+) 4,55 % (5–17), 58 в 1 мкл (90–900).
— Субпопуляції лімфоцитів від 12.04.16: лейкоцити 11 882 в 1 мкл (4700–8000), лімфоцити 2,94 % (норма 35–55), 349 в 1 мкл (1100–5900); Т-лімфоцити (CD3+) 84,3 % (55–75), 294 в 1 мкл (700–4200); Т-хелпери (CD3+ CD4+) 28,26 % (30–55), 99 в 1 мкл (300–1800), Т-цитотоксики (CD3+ CD8+) 56,46 % (12–30), 197 в 1 мкл (200–700); співвідношення Тх/Тц
0,50 % (1,0–2,5); В-лімфоцити (СD 19+) 3,83 (10–25), 13 в 1 мкл (200–1600); NK-лімфоцити (CD3-CD 16+ 56+) 6,43 % (5–17), 22 в 1 мкл (90–900).
— Посів крові на стерильність від 18.02.16: росту не виявлено.
— 23.03.16: поверхневий антиген вірусу гепатиту В (HBSAG) — не виявлено, AB HCV — не виявлено.
— Загальний аналіз сечі (табл. 4).
— Добова сеча за 22.02.16: білок 1 г/л, глюкоза 2,8 ммоль/л, У динаміці за 24.03.16: білок не виявлено, глюкоза 28 ммоль/л.
— Дослідження екскрементів: реакція Грегерсена — негативна, я/г не виявлені , н/ж +++ , ж/к — відсутні, у динаміці без негативних змін.
— Бактеріологічне дослідження слизових ротоглотки: Str.viridans — поодинокий ріст, Neisser subflava — поодинокі колонії.
— Бактеріологічне дослідження слизових ротоглотки від 11.04.16: Str.agalactiae — помірний ріст.
— Бактеріологічне дослідження мокроти від 05.04.16: St.aureus — поодинокі колонії, Str.agalactiae — помірна кількість, гриби роду Кандида — помірний ріст.
— Бактеріологічне дослідження мокроти від 12.04.16: St.epidermidis — помірний ріст, Enterob.aurag. — поодинокі колонії, St.agalactiae — поодинокі колонії, гриби роду Кандида — низький ріст.
— ЕКГ від 18.02.16: 1. Синусовий ритм. ЧСС 102. 2. Вертикальне положення електричної осі серця: 84 градусів. 3. Виражене порушення фази реполяризації міокарда.
— ЕКГ від 29.03.16: 1. Синусова тахікардія. ЧСС 132. 2. Відхилення електричної осі серця вправо: 97 градусів 3. Обмінні зміни в міокарді.
— ЕКГ від 05.04.16: синусова тахікардія. Вертикальне положення осі серця. Обмінні зміни в міокарді.
— ЕКГ від 19.04.16: на фоні синусового ритму періоди ектопічного ритму. Дихальна аритмія. Вертикальне положення осі серця. Реєструються суправентрикулярні екстрасистоли. Порушення провідності по правій ніжці пучка Гіса. Помірні зміни в міокарді.
— ЕКГ від 25.04.16: синусова тахікардія. Відхилення електричної осі серця вправо. Вольтаж ЕКГ знижений. Обмінні зміни в міокарді.
— Рентгенографія ІІ пальця лівої кисті: патології не виявлено.
— Рентгенографія ОГК від 17.02.16: легеневі поля без видимих вогнищевих та інфільтративних тканин. У прикореневих зонах потовщені стінки бронхів. Корні легенів структурні. Куполи діафрагми рівні, чіткі. Рідина в плевральних порожнинах не виявляється. Границі серця не розширені.
— Рентгенографія ОГК від 08.04.16: легеневий рисунок посилений в обох легенях і має розлитий характер. Нижня частка правої легені зниженої прозорості. Межі серця розширені. Виражений остеопороз кісток.
— Рентгенографія ОГК від 12.04.16: поля легенів затемнені, насилу проглядається легеневий рисунок. Порівняно із знімком від 08.04.16 у нижній частці справа видно легеневий рисунок. В обох легенях легеневий рисунок має розлитий характер, синуси вільні. Границі серця збільшені вліво.
— ЕхоКГ від 29.03.16: праві відділи серця не збільшені. У порожнині серця виявляється додаткова хорда. Лівий шлуночок: кінцево-діастолічний об’єм 43 мл, кінцево-систолічний об’єм 15 мл, ударний об’єм 28 мл, індекс ударного об’єму 24 мл/м2, індекс маси міокарда 64 гр/м2, фракція викиду (ФВ) 66 %, ССп 36 %, ЧСС 120 уд/хв у спокої. Форма руху мітрального клапана (МК) М-подібна. Відношення аортального отвору (АО) до лівого передсердя дорівнює 1. Відмічається пролапс МК (ПМК) І ст., гемодинамічно незначний. При допплер-ЕхоКГ на легеневій артерії (ЛА) максимальний градієнт тиску 8,7 мм рт.ст., відмічається зменшення часу прискорення 85 мс, на клапані ЛА незначний зворотний відтік, на АО максимальний градієнт тиску 7,3 мм рт.ст., показники кровотоку на МК, трикуспідальному клапані, АО в межах норми. Кровотік у черевній аорті пульсуючий. Висновок: ПМК І ст., гемодинамічно незначний. У динаміці ФВ 60 %, 08.04.16 — 66 %, дилатації порожнин не спостерігається, рідини в перикарді не візуалізовано, відмічена рідина в підпечінковому просторі.
— УЗД черевної порожнини від 01.04.16: печінка збільшена в розмірах: передньозадній розмір правої частки 138 мм, лівої частки — 58 мм, контури рівні, чіткі, ехогенність паренхіми помірно рівномірно підвищена, судинний рисунок збіднений, звукопровідність збережена. Портальна вена 5,2 мм, без особливостей. Жовчний міхур овальної форми, не збільшений у розмірах: 65 × 23 мм, стінка ущільнена, не потовщена, вміст анехогенний. Підшлункова залоза візуалізується частково: головка 26 мм, тіло 16 мм, збільшена в розмірах, ехогенність тканини помірно нерівномірно підвищена, структура однорідна. Селезінка не збільшена в розмірах: 104 × 46 мм, структура без особливостей. Права нирка розташована типово, овальної форми, контур рівний, чіткий, розміри 84 × 37 мм, паренхіма 14 мм, ехогенність паренхіми звичайна, кортикомедулярна диференціація шарів згладжена, чашково-мискова система (ЧМС) помірно ущільнена. Кровотік при енергетичному допплерівському картуванні (ЕКД) простежується до капсули нирки. Ліва нирка розташована типово, овальної форми, контур рівний, чіткий, розміри 86 × 43 мм, паренхіма 14 мм, ехогенність паренхіми звичайна, кортикомедулярна диференціація шарів згладжена, ЧМС без особливостей. Кровотік при ЕДК простежується до капсули нирки. Сечовий міхур оглянутий при наповненні 201 см3, розташований типово, правильної форми, вміст анехогенний, додаткових включень не містить, товщина стінки 3,4 мм, не потовщена, контур рівний, чіткий. Вільна рідина в черевній порожнині, малому тазу та плевральних порожнинах не візуалізується. Висновок: ультразвукові ознаки дифузних змін паренхіми печінки, реактивні зміни тканини підшлункової залози, помірна гепатомегалія, дифузні зміни паренхіми нирок.
— Висновок: УЗД органів черевної порожнини, УЗД надниркових залоз, УЗД щитоподібної залози, ЕхоКГ, рентгенівське дослідження грудного та попереково-крижового відділів хребта, органів грудної клітки — видані на руки.
Консультації спеціалістів: невролога, окуліста, дерматолога, лор-лікаря, хірурга, гінеколога, психолога.
Проведене лікування: медрол 48 мг на добу, з 22.03.16 по 27.03.16 — 44 мг, з 28.03.16 по 13.04.16 — 40 мг на добу р.о. Введено депо-медрол 40 мг (01.04.16 та 03.04.16). Солу-медрол у дозі 500 мг/добу (04–06.04.16). З 14.04 переведена на солу-медрол: 14.04.16 — 200 мг, 15.04.16 — 150 мг, із 17.04.16 — 125 мг, 19.04.16 — 200 мг, 20.04.16 — 150 мг, з 22.04.16 — 125 мг. Азатіоприн 75 мг/д з 21.03.16 по 02.04.16 р. Ендоксан 700 мг в/в — 19.04.16. Антибактеріальна терапія (тієнам — 17–22.02.16, лінкоміцин — 17–25.02.16, азитроміцин — 07–10.04.16, цефтриаксон — 31.03–04.04.16, левофлоксацин — 04–09.04.16, таргоцид — 09.04–13.04.16, авелокс — 14–18.04.16, бісептол — 19–22.04.16, гепацеф — 22–27.04.16, з 25.04.16 доданий амікацин). Протигрибкова терапія (флюконазол, віфенд, дифлюкан). Внутрішньовенний імуноглобулін (октагам по 150 мл з 11.04.16 № 4). 26.04.16 введено теваграстим 175 мкг в/в. Кальцій-Д3 нікомед, вігантол, рибоксин, антраль, квамател, біогая, альмагель, віагра, верошпірон, трентал, розкриття гнійника ІІ пальця лівої руки, ЛФК, масаж кінцівок, дренуючий масаж грудної клітки. Ніфедипін 2,5–5 мг 3 р/д, 05–13.04.16 — силденафіл.
Заключний клінічний діагноз
Основний
Ювенільний дерматоміозит, підгострий перебіг, міопатичний криз, активність ІІІ ст., ФН ІІІ ст. (ураження м’язів, шкіри, легенів, серця, печінки, нирок). ССН ІІ А, ДН ІІІ (М 33.0).
Ускладнення
Легеневе серце. Пароксизмальна надшлуночкова тахікардія. Вторинна лейкопенія.
Системний остеопороз (не виключені множинні компресійні переломи тіл хребців). Панарицій ІІ пальця лівої руки. Афтозний стоматит.
Супутній
Хронічний тонзиліт, декомпенсована форма.
Від проведення автопсії мати відмовилась.
Висновки
Незважаючи на проведене інтенсивне лікування дитини з ювенільним дерматоміозитом, що включало глюкокортикостероїди, базисні хворобомодифікуючі засоби, препарати ГІБТ та супровідну терапію в повному обсязі, не вдалося зупинити прогресування хвороби.
Ювенільний дерматоміозит є вкрай тяжким захворюванням з непередбачуваним перебігом. Ураження легенів при ювенільному дерматоміозиті є одним з найтяжчих проявів захворювання. Необхідні подальші дослідження для уточнення чинників несприятливого прогнозу та тактики його лікування. На сьогодні час триває проспективне дослідження, ініційоване Педіатричною ревматологічною міжнародною дослідницькою організацією (PRINTO), присвячене порівняльній оцінці ефективності комплексної терапії ювенільного дерматоміозиту з включенням різних базисних хворобомодифікуючих засобів. Потребують суттєвого удосконалення й державні стандарти терапії ювенільного дерматоміозиту.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
/144-1.gif)
/144-2.gif)

/141-1.gif)
/142-1.gif)
/143-1.gif)
/146-1.gif)
/147-1.gif)