Резюме
Актуальність. Бойові поранення кінцівок, кількість яких стрімко зросла з 2014 року, часто ускладнюються розвитком хірургічної інфекції. Сучасною тенденцією є зростання частки неферментуючих грамнегативних паличок серед етіологічних чинників госпітальних хірургічних інфекційних ускладнень. Мета дослідження: обґрунтувати вибір раціональної антибактеріальної терапії та профілактики спричиненої цими мікроорганізмами госпітальної хірургічної інфекції поранень кінцівок. Матеріали та методи. У трьох військово-медичних клінічних центрах (міста Київ, Львів, Вінниця) проведено аналіз результатів бактеріологічних досліджень бойових поранень. Аналіз стійкості до антибіотиків та профілів резистентності проводили відповідно до рекомендацій EUCAST та національних рекомендацій з інфекційного контролю. Порівняння резистентності до окремих препаратів проводили за критерієм Пірсона χ2. Результати. Проаналізовано результати 326 бактеріологічних обстежень, з яких отримано дані про 378 мікроорганізмів. Частка паличок роду Acinetobacter та роду Pseudomonas сягає 40 % серед усього спектра контамінант бойових поранень кінцівок. За станом чутливості до різних хіміотерапевтичних препаратів більшість ізолятів належить до полірезистентних або штамів із розширеною резистентністю. Рекомендації з антибактеріальної терапії госпітальних хірургічних інфекцій, до яких входить монотерапія карбапенемами та комбінації з включенням цефалоспоринів та фторхінолонів, будуть неефективні. До тигецикліну, колістину B та фосфоміцину виявляє стійкість менше від 25 % ізолятів P.aeruginosa та Acinetobacter spp. Виявлено штами з однаковими комбінаціями детермінант стійкості, такі штами виявляються навіть у географічно віддалених госпіталях. Висновки. Полірезистентність мікроорганізмів, факти об’єднання штамів в однакові фенотипи резистентності, що виявляються в різних госпіталях, вказують на те, що сучасні бойові поранення контамінуються спорідненими клональними популяціями, які мають єдине госпітальне джерело походження. Розробляти заходи антибактеріальної терапії потрібно в масштабах усього лікувально-евакуаційного ланцюга, без урахування локальних особливостей резистентності.
Актуальность. Боевые ранения конечностей, количество которых стремительно возросло с 2014 года, часто осложняются развитием хирургической инфекции. Современной тенденцией является рост доли неферментирующих грамотрицательных палочек среди этиологических факторов госпитальных хирургических инфекционных осложнений. Цель исследования: обосновать выбор рациональной антибактериальной терапии и профилактики вызванной этими микроорганизмами госпитальной хирургической инфекции ранений конечностей. Материалы и методы. В трех военно-медицинских клинических центрах (города Киев, Львов, Винница) проведен анализ результатов бактериологических исследований боевых ранений. Анализ устойчивости к антибиотикам и профилей резистентности проводили в соответствии с рекомендациями EUCAST и национальными рекомендациями по инфекционному контролю. Сравнение резистентности к отдельным препаратам проводили по критерию Пирсона χ2. Результаты. Проанализированы результаты 326 бактериологических исследований, из которых получены данные о 378 микроорганизмах. На долю палочек рода Acinetobacter и рода Pseudomonas приходится 40 % среди всего спектра контаминант боевых ранений конечностей. По состоянию чувствительности к различным химиотерапевтическим препаратам большинство изолятов относится к полирезистентным или штаммам с расширенной резистентностью. Рекомендации по антибактериальной терапии госпитальных хирургических инфекций, в которые входит монотерапия карбапенемами и комбинации с включением цефалоспоринов и фторхинолонов, будут неэффективны. К тигециклину, колистину B и фосфомицину проявляет устойчивость менее 25 % изолятов P.aeruginosa и Acinetobacter spp. Выявлены штаммы с одинаковыми комбинациями детерминант устойчивости, такие штаммы выделяются даже в географически отдаленных госпиталях. Выводы. Полирезистентность у микроорганизмов, факты объединения штаммов в одинаковые фенотипы резистентности, выделяемые в разных госпиталях, указывают на то, что современные боевые ранения контаминируются родственными клональными популяциями, имеющими единый госпитальный источник происхождения. Разрабатывать мероприятия антибактериальной терапии нужно в масштабах всей лечебно-эвакуационной цепи, без учета локальных особенностей резистентности.
Background. The number of battle wounds of the extremities has grown rapidly since 2014. They are often complicated by surgical infection. The growth of non-fermenting Gram-negative bacilli among the etiological factors of nosocomial surgical infectious complications is the current trend. The purpose of research is to justify the selection of rational antibiotic therapy and prevention of nosocomial infections of combat wounds of the extremities caused by these microorganisms. Materials and methods. In three military medical clinical centers (Kyiv, Lviv, Vinnytsia), the results of bacteriological studies of combat wounds were analyzed. Analysis of antibiotic resistance and resistance profiles were performed in accordance with the EUCAST recommendations and national guidelines for infection control. Comparison of resistance to individual drugs was performed by Pearson χ2. Results. Three hundred twenty six results of bacteriological studies contained data about 378 microorganisms. The incidence of genus Acinetobacter and Pseudomonas was 40 % among entire number of contaminants of combat wounds. According to resistance to antibiotics, most strains were multidrug-resistant or strains with enhanced resistance. Recommendations for antibiotic therapy of nosocomial surgical infections that include monotherapy with carbapenems and combinations contained cephalosporins and fluoroquinolones are ineffective. No more than 25 % of isolated P.aeruginosa and Acinetobacter spp. were resistant to tigecycline, colistin B and fosfomycin. Analysis revealed strains with the identical combinations of resistance determinants, such strains were isolated even in geographically dispersed hospitals. Conclusions. The multidrug resistance of microorganisms, as well as facts that strains with the identical combination of resistant phenotypes allocated in different hospitals, both indicate that modern combat wounds are contaminated by clonal populations, which have a single source of hospital origin. The measures of antibiotic therapy have to be developed for the entire evacuation chain, without taking into account local resistance in each hospital.
Вступ
Є істотні відмінності в спектрі мікроорганізмів, що виділяються з ран, при різних військових конфліктах [1]. Результати мікробіологічного моніторингу мікрофлори ран є важливими для оцінки ефективності існуючої тактики лікувальної допомоги. З початком АТО у 2014 році перед військовими лікарями постав новий виклик — бойові травми. Це зазвичай тяжкі поранення, що характеризуються зоною некрозу, а також неминучим первинним мікробним забрудненням. Лікарі зробили спостереження, що значна кількість таких поранень після прибуття постраждалих на кінцевий етап лікування мають ознаки хірургічної інфекції. Подібні спостереження були й при інших військових конфліктах. Під час військових операцій США в Іраку та Афганістані реєстрували інфекційні ускладнення, викликані полірезистентними мікроорганізмами, а саме комплексом Acinetobacter baumannii-calcoaceticus [2]. Тенденцією сьогодення в хірургічних стаціонарах України є зростання частки неферментуючих грамнегативних паличок серед етіологічних чинників госпітальних інфекційних ускладнень [3]. Усе це спонукало провести аналіз етіологічної ролі A.baumannii та P.aeruginosa в розвитку хірургічної інфекції бойових (вогнепальних та мінно-вибухових) поранень кінцівок за період 2014–2015 рр. у різних військово-медичних клінічних центрах (ВМКЦ).
Мета роботи: обґрунтувати вибір раціональної антибактеріальної терапії та профілактики спричиненої цими мікроорганізмами госпітальної хірургічної інфекції бойових поранень кінцівок.
Матеріали та методи
У трьох військово-медичних клінічних центрах (міста Київ, Львів, Вінниця) проведено аналіз результатів бактеріологічних досліджень бойових (вогнепальних та мінно-вибухових) поранень кінцівок. Для дослідження відібрали результати посівів ран, що локалізовані на кінцівках (без зв’язку з грудною або черевною порожниною) у періоди липень — листопад 2014 року та лютий — березень 2015 р. До уваги не брали штами, що виділялись повторно. Антибактеріальні засоби для аналізу чутливості кожного виділеного штаму мікроорганізму були відібрані згідно з Наказом МОЗ України № 167 та з урахуванням госпітальної політики із застосування антибіотиків. Розподіл штамів, що спричиняють розвиток нозокоміальних інфекцій, на полірезистентні (multidrug-resistant (MDR)) та штами з розширеною резистентністю (extensively drug-resistant (ХDR)) провели відповідно до пропозицій EUCAST [4]. Профілі резистентності досліджених штамів отримували відповідно до Наказу МОЗ України № 236 «Про організацію контролю та профілактики післяопераційних гнійно-запальних інфекцій, спричинених мікроорганізмами, резистентними до дії антимікробних препаратів». За критерієм Пірсона χ2 проводили порівняння часток штамів, резистентних до окремих препаратів, між різними ВМКЦ.
Результати
Проаналізовано результати 326 бактеріологічних обстежень, що відповідали умовам дослідження. Для аналізу були доступні дані про ідентифікацію та антибіотикограми 378 мікроорганізмів. У бактеріологічних дослідженнях, проведених у Головному військово-медичному клінічному центрі (ГВМКЦ), м. Київ, із числа 191 виділеної культури 78,5 % становили грамнегативні палички, 21 % — грампозитивні коки. Частота виділення Pseudomonas spp. становила 26,7 %, Acinetobacter spp. — 9,42 %. Серед 72 культур, що були виділені від поранених у Військово-медичному клінічному центрі Західного регіону (ВМКЦ ЗР), м. Львів, 8 випадків становили P.aeruginosa та п’ять — A.baumannii. 117 культур були отримані у Військово-медичному клінічному центрі Центрального регіону (ВМКЦ ЦР), м. Вінниця. З числа виділених культур 65 % становили грамнегативні палички, 22,2 % — грампозитивні коки, решта (12,8 %) — грампозитивні палички. За частотою наявності в позитивних висівах домінували грамнегативні неферментуючі палички (58 %), які в 45,3 % випадків належали до роду Acinetobacter, а у 12,8 % випадків — до роду Pseudomonas. Співвідношення різних мікроорганізмів у спектрі ранових контамінант без урахування географічної різниці наведене на рис. 1.
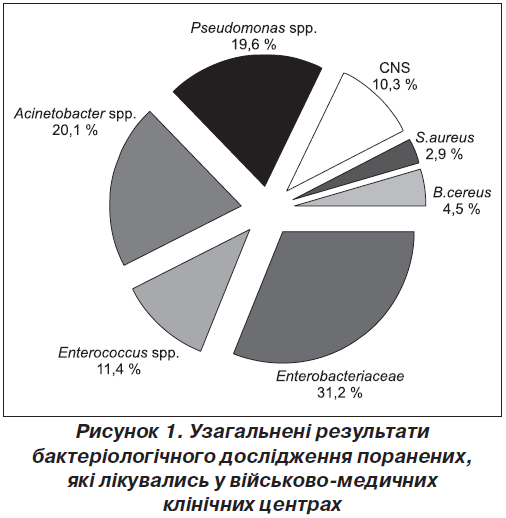
Представники родини Enterobactericeae становлять третину від усіх мікроорганізмів, за ними розташувались мікроорганізми роду Acinetobacter — 20,1 %, а представники роду Pseudomonas зустрічались у 19,6 % випадків. Слід врахувати, що за своїми фенотиповими властивостями ці роди об’єднуються мікробіологами в єдину групу неферментуючих грамнегативних паличок. Отже, частка грамнегативних паличок роду Acinetobacter та роду Pseudomonas сягає майже 40 % по всіх госпіталях і виявляється найбільшою.
У такій ситуації особливого значення набувають дані про чутливість представників цієї численної групи до антибактеріальних препаратів. Результати проведеного вивчення антибіотикорезистентності виділених з поранень штамів P.aeruginosa наведені на рис. 2.
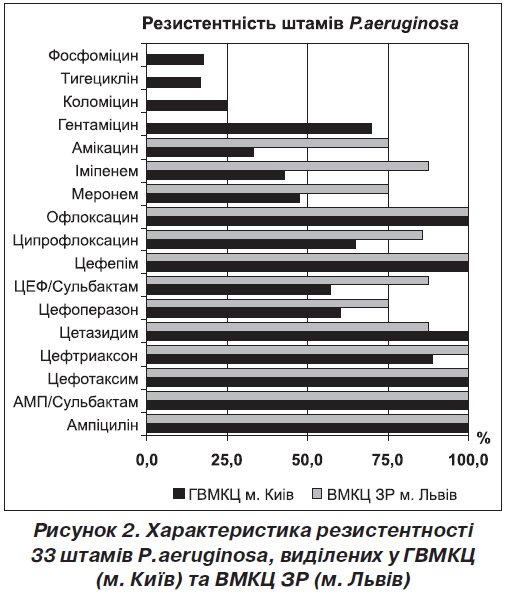
Найвищою резистентністю до антибіотиків характеризувались штами P.aeruginosa. Непокоїть той факт, що до препаратів, які в межах своїх класів відрізняються наявністю антипсевдомонадної активності, стійкість виявляло близько 75 % штамів незалежно від того, у якому лікувальному закладі вони були виділені. Рівень резистентності штамів P.aeruginosa щодо карбапенемів становив від 46 до 87,5 %. Частота виявлення резистентних штамів P.aeruginosa до іміпенему та меропенему в хірургічних стаціонарах Києва у 2008 році становила 14,2 ± 2,4 % і 15,3 ± 2,0 % відповідно [5]. У 2010 році резистентність P.aeruginosa до карбапенемів в окремих країнах світу сягала 50 % [6]. Національними дослідженнями встановлено високий рівень поширення метало-β-лактамаз серед штамів P.aeruginosa [7]. Втрата активності цієї групи препаратів безпосередньо пов’язується з їх широким застосуванням [8]. Значимою була різниця в частоті виділення іміпенемрезистентних штамів P.aeruginosa між ГВМКЦ (м. Київ) та рештою госпіталів (р ˂ 0,05 ), а токож у частоті виділення меропенемрезистентних штамів між ГВМКЦ (м. Київ) та ВМКЦ ЦР (м. Вінниця) (р ˂ 0,05). Встановлена низька активність фторхінолонів, що вказує на необхідність перегляду їх ролі в боротьбі з P.aeruginosa. Це можна пояснити тривалим застосуванням цих хіміопрепаратів, що, як доведено, стимулює розвиток резистентності в псевдомонад [9]. Стійкість P.aeruginosa до амікацину мала локальні розбіжності між ГВМКЦ (33 % стійких штамів) та госпіталями Вінниці та Львова — 89 та 75 % відповідно (р ˂ 0,05). Виявлені штами з перехресною чутливістю до гентаміцину й амікацину. Слід визнати неефективність цефалоспоринів та їх захищених форм у боротьбі з псевдомонадами. Препаратами, стійкість до яких виявляє менше ніж 25 % ізолятів P.aeruginosa, виявились тигециклін, колістин B та фосфоміцин.
Ізоляти Acinetobacter завдяки наявності кількох механізмів резистентності, що реалізуються різними шляхами, виявили стійкість до більшості протестованих антибіотиків [10, 11]. Тривалий час карбапенеми визнавались основними засобами в боротьбі з акінетобактеріями. Дослідження MYSTIC у 2000 році показало чутливість акінетобактерій до карбапенемів на рівні 97–100 % [12]. Проте за останні роки в межах України ця ситуація прогресивно погіршувтабалась, частка резистентних штамів сягнула 80–90 % [3]. Сьогодні за рахунок поширення β-лактамаз карбапенеми втрачають ефективність. Частка карбапенемрезистентних штамів серед Acinetobacter spp. становила від 71 до 100 %. Але встановлена різниця в локальній чутливості штамів Acinetobacter spp. до обох карбапенемів між ВМКЦ ЦР (м. Вінниця) та ГВМКЦ (м. Київ) (р ˂ 0,05). На щастя, не всі представники цього класу антибіотиків піддаються впливу механізмів резистентності, про що свідчить відчутно вищий рівень чутливості до іміпенему у ГВМКЦ.
Здатність Acinetobacter spp. продукувати β-лакта-мази різних типів та поєднувати різні варіанти резистентності, обумовленої лактамазами, у межах одного штаму привела до повної втрати значення цефалоспоринів. Виділені ізоляти демонстрували різноманітні поєднання чутливості/резистентності до гентаміцину та амікацину. Високий рівень чутливості акінетобактерій встановлено до препаратів, що містять у своєму складі інгібітори лактамаз. Ефективність цих антибіотиків прирівнюється до такої в карбапенемів та поліміксину, а реалізується вона за рахунок сульбактаму [13].
Усі виділені штами Acinetobacter spp. були чутливими до тигецикліну й колістину. Абсолютно рекомендованим для боротьби з неферментуючими грамнегативними бактеріями на сьогодні є коломіцин. Частка стійких штамів по всіх ВМКЦ не перевищувала 25 %, тобто порогу, рекомендованого Наказом МОЗ України № 236.
Відповідно до пропозицій EUCAST провели розподіл штамів, що спричиняють розвиток нозокоміальних інфекцій, на три типи профілів. Штами, що виявили резистентність хоча б до одного антибіотика з трьох різних груп, віднесено до полірезистентних (MDR). Штами, що виявили чутливість тільки до 1 чи 2 окремих препаратів із рекомендованого переліку, віднесено до штамів із розширеною резистентністю (ХDR) [4].
Неферментуючі грамнегативні палички з розширеною резистентністю виявлялись у всіх госпіталях. Найбільшу кількість таких бактерій виявлено серед псевдомонад у ВМКЦ ЦР (м. Вінниця) та ВМКЦ ЗР (м. Львів). Штамів P.aeruginosa з фенотипом nMDR зовсім не виявлено у львівському госпіталі. Усі штами акінетобактерій, що виділені у ВМКЦ ЦР, належали до полірезистентних або штамів із розширеною резистентністю. Серед A.baumannii, що були виділені в Києві та Львові, лише близько третини виявляли чутливість до більшості хіміотерапевтичних препаратів. При статистичному порівнянні частки грамнегативних паличок, віднесених до MDR або ХDR, між різними госпіталями значимої різниці не встановлено (χ2 ˃ 0,05). Це дає підстави стверджувати, що у всіх ВМКЦ, незалежно від їх географічного розташування, поранення кінцівок колонізуються переважно полірезистентними штамами.
Аналіз профілів антибіотикорезистентності дає змогу проаналізувати інформацію про поширення резистентності й розробити належні заходи щодо контролю та стримування поширення цього явища. Саме деталізація профілів резистентності дає змогу визначати наявність епідеміологічно пов’язаних між собою штамів мікроорганізмів та стверджувати, що вони походять зі спільного джерела. При побудові профілів підбирали антибіотики, до яких бактерії виявили гетерогенну чутливість, а резистентність має різні генетичні механізми. Сформований для типування мікроорганізмів профіль резистентності виглядав так: Q — цефотаксим, W — цефоперазон, U — цефоперазон/сульбактам, I — ампіцилін/клавуланат, E — меронем, R — іміпенем, T — амікацин, Y — ципрофлоксацин, O — коломіцин. У табл. 1 наводяться профілі резистентності, що об’єднали по кілька штамів, виділених із ран у різних ВМКЦ.

Серед виділених штамів P.aeruginosa виявлені такі, що мали стійкість одночасно до 5–9 антибіотиків. Одночасно спостерігалась резистентність до двох та більше антибіотиків у різних комбінаціях. Найчастіше поєднувалась стійкість до протипсевдомонадних цефалоспоринів, їх захищених форм, фторхінолонів та карбапенемів. З епідеміологічного погляду привертає увагу факт виділення штамів P.aeruginosa з однаковими поєднаннями детермінант стійкості в географічно віддалених ВМКЦ. Серед 25 штамів A.baumannii, отриманих у ВМКЦ ЦР (м. Вінниця), 24 групувались у п’ять різних профілів резистентності.
В один із них входило 12 штамів. Як і у випадку з псевдомонадами, для A.baumannii виявлені два профілі, ідентичні між різними госпіталями. Комбінації стійкості до окремих хіміотерапевтичних препаратів були аналогічними до таких у псевдомонад.
Обговорення
У всіх госпіталях найчастіше з ран кінцівок виділяються грамнегативні палички. Проте у ГВМКЦ м. Києва та ВМКЦ м. Львова панують різні види ентеробактерій, а у ВМКЦ м. Вінниці — грамнегативні неферментуючі палички, зокрема акінетобактерії. Імовірно, що ці відмінності відображають особливості мікроекології кожного з лікувальних закладів.
Слід визнати, що існуючі рекомендації з антибактеріальної терапії госпітальних хірургічних інфекцій, до яких входить монотерапія карбапенемами та комбінації з включенням цефалоспоринів та фторхінолонів, у більшості випадків продовжать стимулювати антибіотикорезистентність. Препаратами, стійкість до яких виявляє менше ніж 25 % ізолятів P.aeruginosa та Acinetobacter spp., є тигециклін, колістин B та фосфоміцин.
За своїми ознаками та ступенем охоплення даний моніторинг є спрямованим, а отримана інформація є індикатором стану антибіотикорезистентності в усій популяції поранених з вогнепальними та мінно-вибуховими ушкодженнями в цілому. Встановлено, що за станом чутливості до різних класів хіміотерапевтичних препаратів більшість неферментуючих гранегативних паличок належить до полірезистентних або штамів із розширеною резистентністю. Найбільше штамів із розширеною резистентністю виділяється у ВМКЦ ЦР (м. Вінниця) та ВМКЦ ЗР (м. Львів). Серед P.aeruginosa та A.baumannii виділені групи штамів, що за комбінаціями детермінант стійкості об’єднуються в однакові фенотипи. Зіставлення цих фенотипів виявило, що штами, однакові за комбінаціями детермінант стійкості, виявляються далеко поза межами одного лікувального закладу. Слід наголосити, що виділення однакових за фенотипом резистентності штамів реєструється від поранених з однаковою хірургічною патологією та з одного й того ж клінічного матеріалу.
Поранені, включені до обстеження, проходили етапне лікування в ланцюзі медичної допомоги, що створений медичною службою Збройних сил України. На своєму шляху вони перебували на одних етапах евакуації та переміщались на одному евакуаційному транспортному засобі (операційно-реанімаційному літаку). Переміщення зі Сходу України на відстань понад 1000 км відбувалось менше ніж за три доби. Факти передачі резистентних бактерій з одного міста до іншого встановлені і в інших країнах [14]. Виявлення маркерів поліантибіотикорезистентності є одним з епідеміологічних критеріїв госпітального походження ізолятів. Разом це аргумент на користь того, щоб розглядати таке засилля ран антибіотикорезистентними мікроорганізмами як результат нозокоміальної трансмісії.
Висновки
1. Ефективними препаратами щодо неферментуючих грамнегативних паличок є тигециклін, колістин B та фосфоміцин. Стійкість до них виявляє менше від 25 % ізолятів P.aeruginosa та Acinetobacter spp.
2. Епідеміологічні характеристики обстеженого контингенту, наявність полірезистентності ранових ізолятів, встановлення фактів об’єднання декількох штамів у однакові фенотипи резистентності, що виявляються у географічно віддалених госпіталях, вказують на те, що сучасні бойові поранення контамінуються спорідненими клональними популяціями, які мають єдине джерело походження, найбільш ймовірно, госпітальне.
3. Виявлення серед ранових ізолятів кількох клональних популяцій, що мають єдине джерело походження, дає підстави розробляти заходи антибактеріальної терапії та профілактики в масштабах усього лікувально-евакуаційного ланцюга, а не зосереджувати увагу лише на локальних особливостях резистентності в межах окремих військових госпіталів.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Hutley E.J. Infection in wounds of conflict — old lessons and new challenges / E.J. Hutley, A.D. Green // JR. Army. Med. Corps. — 2009. — Vol. 155, № 4. — P. 315-319.
2. Pathogens present in acute mangled extremities from Afghanistan and subsequent pathogen recovery / T.E. Wallum, H.C. Yun, E.A. Rini [et al.] // Mil. Med. — 2015. — Vol. 180, № 1. — P. 97-103.
3. Сучасні підходи до вибору антибіотикотерапії шпитальної хірургічної інфекції, яка спричинена Acinetobacter baumannii / О.М. Нестеренко, Ю.В. Щербина, І.М. Бойцун [та ін.] // Клінічна анестезіологія та інтенсивна терапія. — 2015. — № 2(6). — С. 28-37.
4. European committee on antimicrobial susceptibility testing (EUCAST). EUCAST disk diffusion test methodology. — Mode of access: at: WWW.URL: www.eucast.org/ast_of_bacteria/disk_diffusion_methodology/(updated 26 Januay, 2015). — Last access: 2015. — Title from the screen.
5. Салманов А.Г. Антибіотикорезистентність нозокоміальних штамів Pseudomonas aeruginosa в хірургічних стаціонарах України в 2008 році / А.Г. Салманов, В.Ф. Марієвський, С.І. Доан // Шпитальна хірургія. — 2010. — № 3. — C. 86-89.
6. Epidemiology and characteristics of metallo-β-lactamase-producing Pseudomonas aeruginosa / D.J. Hong, I.K. Bae, I.H. Jang [et al.] // Infect. Chemother. — 2015. — Vol. 47, № 2. — P. 81-97.
7. Розповсюдженість карбапенемрезистентних штамів Pseudomonas aeruginosa — продуцентів метало-β-лактамаз / К.М. Нестерук, І.Є. Соколова, О.В. Братусь // Вісник Дніпропетровського університету. Біологія. Медицина. — 2011. — Вип. 2, т. 1. — С. 95-100.
8. A systematic review and meta-analyses show that carbapenem use and medical devices are the leading risk factors for carbapenem-resistant Pseudomonas aeruginosa / A.F. Voor, J.A. Severin, E. M. Lesaffre [et al.] // Antimicrob. Agents Chemother. — 2014. — Vol. 58, № 5. — 2626-2637.
9. Pseudomonas aeruginosa, Staphylococcus aureus, and fluoroquinolone use / C. MacDougall, E. Spencer, S.E. Harpe [et al.] // Emerg. Infect. Dis. — 2005. — Vol. 11, № 8. — P. 1197-1210.
10. Acinetobacter baumannii: emergence of a successful pathogen / A.Y. Peleg, H. Seifert, D.L Paterson // Clin. Microbiol. Rev. — 2008. — Vol. 21. — P. 538-582.
11. Kempf M. Emergence of resistance to carbapenems in Acinetobacter baumannii in Europe: clinical impact and therapeutic options / M. Kempf, J.M. Rolain // The International Journal of Antimicrobial Agents. — 2012. — Vol. 39, № 2. — P.105-114.
12. Turner P.J. MYSTIC (Meropenem Yearly Susceptibility Test Information Collection): a global overview / P.J. urner // J. Antimicrob. Chemother. — 2000. — Vol. 46 (Suppl. T2). — P. 9-23.
13. Molecular mechanisms of sulbactam antibacterial activity and resistance determinants in Acinetobacter baumannii / W.F. Penwell, A.B. Shapiro, R.A. Giacobbe [et al.] // Antimicrob. Agents Chemother. — 2015. — Vol. 59. — P. 1680-1689.
14. Recovery of multidrug-resistant bacteria from combat personnel evacuated from Iraq and Afghanistan at a single military treatment facility / C.K. Murray, H.C. Yun, M.E. Griffith [et al.] // Mil. Med. — 2009. — Vol. 174, № 6. — P. 598-604.