Резюме
В огляді надано класифікацію преканцерозів шлунка, подану в консенсусі «Management of precancerous conditions and lesions in the stomach» (2012), згідно з якою ця патологія розподіляється на передракові стани (атрофічний гастрит і кишкова метаплазія) і передракові зміни (дисплазія слизової шлунка). Хронічний атрофічний гастрит і кишкова метаплазія вважаються передраковими станами, оскільки вони становлять фон, на якому розвиваються дисплазія й аденокарцинома шлунка кишкового типу. Передракова зміна — шлункова дисплазія, що становить собою передостанній етап послідовності шлункового канцерогенезу, визначається як гістологічно однозначно пухлинний епітелій без ознак інвазії та, таким чином, є прямо передраковим пухлинним ураженням. Відмічено, що загалом ризик розвитку раку шлунка занадто малий, щоб виправдати ендоскопічне спостереження у всіх пацієнтів з атрофічним гастритом і кишковою метаплазією. Таким чином, для цієї категорії пацієнтів необхідно визначити додаткові фактори ризику для прогресування захворювання в рак шлунка, що було подано в «Кіотському глобальному консенсусі з Helicobacter pylori-асоційованого гастриту» (2015). Визначено, що факторами ризику розвитку раку шлунка є внутрішньошлунковий розподіл, ступінь кишкової метаплазії, наявність сімейного анамнезу раку шлунка, підтип кишкової метаплазії. Для класифікації хронічного гастриту використовується Сіднейська система (Х’юстонський перегляд), а також класифікація за типом метаплазії (неметапластичний, метапластичний, невизначений типи атрофії). Для встановлення поширеності та ступеня атрофічного гастриту і кишкової метаплазії використовують три методи: ендоскопічний, гістологічний і серологічний. Ступінь атрофії слизової шлунка визначають гістологічно. Класифікації вираженості атрофії з позицій ендоскопічного дослідження на сьогодні не існує. Кишкова метаплазія виявляється в різних відділах шлунка і розташовується мультифокально (в антральному відділі, уздовж малої кривизни шлунка, дифузно). За даними дослідників, наявність кишкової метаплазії на малій кривизні тіла шлунка має найсильнішу асоціацію з ризиком розвитку раку. Можливості діагностики атрофії і кишкової метаплазії слизової шлунка розрізняються при використанні різних видів ендоскопічних апаратів. Ендоскопія в білому світлі не дозволяє надійно діагностувати передракові стани і зміни шлунка, тоді як відеоендоскопія з режимами збільшення і вузькосмугової візуалізації (NBI), за даними дослідників, значно покращує діагностику даної патології. В основі діагностики зі збільшенням лежить верифікація двох основних структур: архітектоніки субепітеліальної мікроваскулярної сітки та мікроструктури поверхні слизової, що має різну картину в тілі й антральному відділі шлунка. Але на сьогодні не існує загальноприйнятої класифікації змін цих структур при різних патологічних станах. Наведено низку класифікацій змін при ендоскопії з режимами NBI і оптичним збільшенням: за К. Yagi (2002), M. Dinis-Ribeiro (2003), G.K. Anagnostopoulos et al. (2007), T. Tahara (2009), P. Pimentel-Nunes, M. Dinis-Ribeiro (2012). Відмічено, що проблема полягає в тому, що NBI зі збільшенням практично неможливо застосувати в повсякденній клінічній практиці, метод вимагає певного рівня знань і типу ендоскопа, доступних тільки в деяких центрах, а також застосування седації для максимальної ефективності дослідження.
В обзоре предоставлена классификация преканцерозов желудка, предложенная в консенсусе «Management of precancerous conditions and lesions in the stomach» (2012), согласно которой они разделяются на предраковые состояния (атрофический гастрит и кишечная метаплазия) и предраковые изменения (дисплазия слизистой желудка). Хронический атрофический гастрит и кишечная метаплазия считаются предраковыми состояниями, так как они составляют фон, на котором развиваются дисплазия и аденокарцинома желудка кишечного типа. Предраковое изменение — желудочная дисплазия, представляющая собой предпоследний этап последовательности желудочного канцерогенеза, определяется как гистологически однозначно опухолевый эпителий без признаков инвазии и, таким образом, является прямо предраковым опухолевым поражением. Отмечено, что в целом риск развития рака желудка слишком мал, чтобы оправдать эндоскопическое наблюдение у всех пациентов с атрофическим гастритом и кишечной метаплазией. Таким образом, для этой категории пациентов необходимо определить дополнительные факторы риска для прогрессирования заболевания в рак желудка, что было представлено в «Киотском глобальном консенсусе по Helicobacter pylori-ассоциированному гастриту» (2015). Определено, что факторами риска развития рака желудка является внутрижелудочное распределение и степень кишечной метаплазии, наличие семейного анамнеза рака желудка, подтип кишечной метаплазии. Для классификации хронического гастрита используется Сиднейская система (Хьюстонский пересмотр), а также классификация по типу метаплазии (неметапластический, метапластический, неопределенный типы атрофии). Для установления распространенности и степени атрофического гастрита и кишечной метаплазии используется три метода: эндоскопический, гистологический и серологический. Степень атрофии слизистой желудка определяют гистологически. Классификации выраженности атрофии с позиций эндоскопического исследования в настоящее время не существует. Кишечная метаплазия развивается в разных отделах желудка и располагается мультифокально (в антральном отделе, вдоль малой кривизны желудка, диффузно). По данным исследователей, наличие кишечной метаплазии на малой кривизне тела желудка имеет сильную ассоциацию с риском развития рака. Возможности диагностики атрофии и кишечной метаплазии желудка различаются при использовании различных видов эндоскопических аппаратов. Эндоскопия в белом свете не позволяет надежно диагностировать предраковые состояния и изменения желудка, в то время как видеоэндоскопия с режимами увеличения и узкоспектральной визуализации (NBI), по данным исследователей, значительно улучшает диагностику данной патологии. В основе диагностики с увеличением лежит верификация двух основных структур: архитектоники субэпителиальной микроваскулярной сети и микроструктуры поверхности слизистой, которая имеет разную картину в теле и антральном отделе желудка. Но на сегодняшний день не существует общепринятой классификации изменений этих структур при различных патологических состояниях. Приведен ряд классификаций изменений при эндоскопии с режимами NBI и оптическим увеличением: по К. Yagi (2002), M. Dinis-Ribeiro (2003), G.K. Anagnostopoulos et al. (2007), T. Tahara (2009), P. Pimentel-Nunes, M. Dinis-Ribeiro (2012). Отмечено, что проблема состоит в том, что NBI с увеличением практически невозможно применить в повседневной клинической практике, метод требует определенного уровня знаний и типа эндоскопа, доступных только в некоторых центрах, а также применения седации для максимальной эффективности исследования.
The review shows the classification of precancerous stomach pathology, proposed in the Consensus Management of precancerous conditions and lesions in the stomach (MAPS) (2012), according to which they are divided into precancerous lesions (atrophic gastritis and intestinal metaplasia) and precancerous changes (stomach mucosa dysplasia). Chronic atrophic gastritis and intestinal metaplasia are considered precancerous conditions, as they are the background for development of dysplasia and gastric adenocarcinoma of intestinal type. Precancerous changes is gastric dysplasia and is the penultimate stage of gastric carcinogenesis sequence and is defined as histologically clear tumor epithelium without signs of infection, and thus is a direct tumor precancerous lesions. It is noted that, in general, the risk of stomach cancer is too small to justify by endoscopic observation in all the patients with atrophic gastritis and intestinal metaplasia. Thus, it is necessary to define additional risk factors for stomach cancer progression in that it is presented in the Kyoto global consensus on Helicobacter pylori-associated gastritis (2015) for this category of patients. It was determined that stomach cancer risk factors are the intragastric distribution and the extent of intestinal metaplasia, presence of a family history of gastric cancer, the definition of subtypes of intestinal metaplasia. Sydney system is used for chronic gastritis classification (Houston review), as well as classification by metaplasia type (non-metaplastic, metaplastic atrophy of uncertain type). There are three methods to determine the prevalence and extent of atrophic gastritis and intestinal metaplasia used: endoscopic, histological and serological. The atrophy severity of the gastric mucosa is determined histologically. Classification of atrophy severity by endoscopic parameters does not currently exist. Intestinal metaplasia developed in different parts of the stomach and is multifocal (in the antrum, along the small curvature of the stomach diffusely). According to the researchers’ data, the presence of the intestinal metaplasia on the lesser curvature of the stomach has a strong association with cancer risk. The different kinds of endoscopic devices allow diagnostically diffentiate atrophy and intestinal metaplasia of the stomach. Endoscopy white light can’t reliably diagnose stomach precancerous changes, while videoendoscopy with magnifications and narrow band imaging (NBI), according to researchers’ data, significantly improves the diagnosis of this disease. The basis of diagnosis is increasing verification of two main structures: the architectonic subepithelial microvascular network microstructure and mucosal surface, which has a different pattern in the body and antral stomach. But to date there is no common classification of changes to these structures in various pathological changes. There are a large number of classifications of changes in endoscopy with NBI mode and optical zoom: Yagi (2002), M. Dinis-Ribeiro (2003), G.K. Anagnostopoulos et al. (2007), T. Tahara (2009), P. Pimentel-Nunes, M. Dinis-Ribeiro (2012). It is noted that the problem is that NBI with zoom is practically impossible to use in daily clinical practice, the method requires a certain level of knowledge and endoscope type, available only in several centers, as well as the use of sedation for maximum effective inspection.
Рак шлунка (РШ) залишається серйозною проблемою у всьому світі. РШ кишкового типу розвивається через каскад чітко визначених і підтримуваних механізмів: запалення — метаплазія — дисплазія — рак, відомий як каскад Correa [1]. Це багатоступінчастий каскад шлункового канцерогенезу, де процес може розвинутися з нормальної слизової оболонки (СО) через хронічний неатрофічний гастрит (ХГ), атрофічний гастрит (АГ) і кишкову метаплазію (КМ) до дисплазії та раку. Ця модель була багаторазово підтверджена в різних дослідженнях [2–6].
Згідно з консенсусом «Management of precancerous conditions and lesions in the stomach (MAPS)» (2012), в шлунку (Ш), як і в других органах, серед преканцерозів розрізняють передракові стани і передракові зміни. До перших належать захворювання, що обумовлюють значне збільшення ризику виникнення раку, до других — морфологічні зміни тканини, в якій рак може виникнути з більшою вірогідністю, ніж у нормальній тканині [6].
Наявність атрофії СО Ш і КМ пов’язана з високим ризиком розвитку РШ, оскільки вони становлять фон, на якому розвиваються дисплазія й аденокарцинома Ш кишкового типу. Таким чином, хронічний АГ і КМ вважаються передраковими станами [5, 6].
Хронічний АГ повинен бути діагностований і оцінений на підставі наявності клітин, характерних для хронічного запалення, у тому числі лімфоцитів і плазматичних клітин, що інфільтрують власну пластинку СО з її розширенням, і зникнення нормальних залоз [5, 6]. У тілі/дні шлунка це пов’язано з втратою спеціалізованих клітин і, отже, зниженням секреторної функції Ш. За положеннями консенсусу MAPS, необхідною є оцінка тяжкості втрати залоз/атрофії. Загалом зміни слизової в Ш повинні бути описані з урахуванням тяжкості і поширення будь-якого передракового стану/ураження.
КМ — це прижиттєвий патологічний процес заміщення шлункового епітелію на кишечний. Кишкова метаплазія може бути класифікована як повна (тонкокишкова, або тип I) або неповна (тонко-товстокишкова, або тип IIA/II, і товстокишкова, або тип IIB/III) [6–8]. Питання доцільності визначення підтипів КМ є складним і суперечливим [6–10].
Передракова зміна — шлункова дисплазія, що становить собою передостанній етап послідовності шлункового канцерогенезу, визначається як гістологічно однозначно пухлинний епітелій без ознак інвазії і, таким чином, є прямо передраковим пухлинним ураженням [1, 6]. Вона характеризується клітинною атипією, що віддзеркалює ненормальну диференціацію та дезорганізовану архітектоніку залоз. Коректний діагноз і ступінь дисплазії мають вирішальне значення, оскільки вони визначають як ризик злоякісної трансформації, так і ризик метахронного РШ. За даними літератури, темпи прогресування РШ із дисплазії сильно варіюють — від 0 до 73 % на рік. Ці розбіжності в даних, ймовірно, можна пояснити різними факторами, такими як відмінності в дизайні досліджень і досліджуваних популяціях, а також відмінності у визначеннях і оцінці шлункової дисплазії [6, 10].
Рівень прогресування в рак у пацієнтів з АГ і КМ, відповідно, варіює від 0 до 1,8 % і 0 до 10 % на рік. Взагалі ризик розвитку РШ занадто малий, щоб виправдати ендоскопічне спостереження у всіх пацієнтів з АГ і КМ. Таким чином, для цієї категорії пацієнтів необхідно визначити додаткові фактори ризику для прогресування в РШ, що було подано дослідниками в «Кіотському глобальному консенсусі з Helicobacter pylori-асоційованого гастриту» (2015):
— по-перше, фактором ризику для РШ були визначені внутрішньошлунковий розподіл і ступінь КМ; отже, зміни слизової в Ш повинні бути описані з урахуванням тяжкості і поширення будь-якого передракового стану/ураження;
— по-друге, люди із сімейним анамнезом РШ мають підвищений ризик розвитку передракових станів/уражень і РШ; ризик АГ у цих людей приблизно в сім разів вищий порівняно з контрольною групою;
— по-третє, як фактор ризику РШ були розглянуті підтипи КМ; у кількох дослідженнях неповна КМ (III тип) була пов’язана з підвищеним ризиком розвитку РШ, однак ці спостереження не були підтверджені в інших дослідженнях [11, 12].
Для встановлення поширеності та ступеня АГ і КМ використовуються три методи: ендоскопічний, гістологічний і серологічний. У країнах Азії, на відміну від більшості країн світу, наявність і поширеність передракових станів/уражень Ш частіше всього визначають ендоскопічно [13, 14].
Було розроблено кілька схем класифікацій хронічного гастриту і передракових змін.
Для оцінки поширеності ураження та тяжкості АГ і КМ використовуються:
— Сіднейська система із проведенням біопсій;
— класифікації OLGA і OLGIM, що також можуть визначити ризик розвитку РШ;
— серологічні методи визначення пепсиногену, гастрину й антитіл до H. pylori [10–12, 16].
Із кількох сучасних класифікацій ХГ Сіднейська система (Х’юстонський перегляд) залишається основною робочою; вона об’єднує топографічну, морфологічну й етіологічну інформацію і призначена для класифікації гастриту як за формою, так і за стадією.
З нових міжнародних класифікацій можна використовувати запропоновані неметапластичний і метапластичний типи атрофії, поняття про невизначену атрофію. Якщо є КМ, про невизначеність атрофії не може йтись: за даними більшості дослідників, якщо є КМ, то буде й атрофія СО Ш. Неметапластичний тип характеризується втратою залоз, що супроводжується фіброзом або фібромускулярною проліферацією власно пластинки СО. За метапластичним типом атрофії заміщується епітелій залоз клітинами, що не властиві або всьому органу (КМ), або його функціонально-морфологічному відділу (пілорична метаплазія у фундальному відділі) [6, 10, 15]. Однак більшість класифікацій, як і раніше, важко використовувати в клінічній практиці, і при застосуванні в них є недоліки — суттєві розбіжності оцінки різними патологами і навіть одним і тим же патологом.
За консенсусом MAPS, запальні зміни, обмежені антральним відділом, без атрофії залоз і/або КМ, визначаються як дифузний антральний гастрит, тоді як атрофія залоз і/або КМ, що розташовані мультифокально, у тому числі по малій кривизні тіла Ш і в дні Ш, визначаються як мультифокальний АГ. Цей вид гастриту може бути описаний як поширений [6].
У 1966 році Takemoto описав появу «атрофічної перехідної зони» в пацієнтів із гастритом (рис. 1), і ця зона згодом стала відома як ендоскопічна атрофічна межа [13, 16, 17]. Ендоскопічна атрофічна межа є також і кордоном між територіями пілоричних і фундальних залоз, який ендоскопічно розпізнається за відмінностями в кольорі та висоті СО Ш. Існуючий поверхневий гастрит може перебільшувати різницю в кольорі та рівні СО, таким чином сприяючи більш легкому розпізнаванню атрофічної межі. А також, відповідно до результатів прицільної біопсії, взятої перпендикулярно з краю ендоскопічної атрофічної межі, це може бути межа гістологічної атрофії і неатрофії. Іншими словами, ендоскопічна атрофічна межа може бути кордоном як типів залоз, так і атрофії. Як додатковий метод застосовується селективне зрошення СО конго червоним, результати якого свідчать про те, що це також може бути фізіологічна межа.
/87.jpg)
В 1969 р. Kimura і Takemoto на основі вищевказаного запропонували класифікацію ендоскопічної атрофічної межі, що на сьогодні має широке застосування в Японії і подана наступним чином [16–18]: C (close) позначає закритий, чітко локалізований тип гастриту і O (open) вказує на відкритий, поширений тип гастриту. Кожен тип атрофії також градується: ступінь 0 — видима атрофія відсутня, ступінь 1 (C-І) — закрита атрофія, обмежена антральним відділом, ступінь 2 (C-ІІ) — закрита атрофія, обмежена антральним відділом і малою кривизною в дистальному відділі тіла шлунка, ступінь 3 (C-ІІІ) — закрита атрофія, що включає антральний відділ і малу кривизну проксимального відділу тіла шлунка, ступінь 4 (О-І) — відкрита атрофія з атрофічною межею між малою кривизною і передньою стінкою, ступінь 5 (О-ІІ) — відкрита атрофія з атрофічною межею посеред антрального відділу і ступінь 6 (О-ІІІ) — відкрита атрофія, що поширюється з межею між антральною стінкою і великою кривизною [18].
T. Takao зі співавт. (2011) пропонують спрощений варіант опису ендоскопічної поширеності атрофії СО Ш: відсутність атрофії, закритий тип АГ (тобто обмеженої антральним відділом), відкритий (тобто поширений) тип АГ [14]. На жаль, вищевказана класифікація не знайшла широкого застосування в більшості країн світу, у тому числі в Украіні.
За даними H. Hun зі співавт. (2013), дослідження біопсійного мапування Ш дало змогу припустити, що хронічний АГ спочатку розвивається в антральному відділі, розширюючись в основному проксимально (пілорокардіальне розширення) по малій кривизні, причому в деяких випадках зустрічається в кардії, розширюючись дистально (біполярне розширення). Швидкість розширення АГ є більшою по малій кривизні, ніж по великій [13].
На сьогодні основним методом діагностики наявності та ступеня атрофії СО Ш вважають гістологічне дослідження. Морфологічно атрофію вважають легкою при втраті менше 30 % залоз, помірною — 30–60 %, тяжкою — більше 60 % [10, 15]. Загальноприйнятої класифікації вираженості атрофії з позицій ендоскопічного дослідження тепер не існує.
АГ, як правило, має дифузний характер, тоді як КМ розташовується мультифокально. Було визначено дві форми поширеної КМ.
1. При її розташуванні в так званому шлунковому каналі Вальдейєра (magenstrasse, «шлункова доріжка» Вальдейєра — це складки СО шлунка, що йдуть уздовж малої кривизни, по яким просувається їжа, яка надходить зі стравоходу) або перехідних зонах КМ знаходиться на малій кривизні від кардії до воротаря і особливо часто зустрічається в перехідних зонах — від кардії до тіла і від тіла до антрального відділу. Наявність КM на малій кривизні тіла Ш має найсильнішу асоціацію з ризиком розвитку раку.
2. При дифузному поширенні СО Ш дифузно заміщена СО кишкового типу, за винятком своду Ш [6, 11, 12].
Вищевказані топографічні моделі розподілу КМ підвищують ризик розвитку РШ.
КМ може бути класифікована за типом як товстокишкова і тонкокишкова, за формою — як повна або неповна [6].
При виявленні КМ рекомендується:
1) визначити її поширеність, оскільки розвиток карциноми прямо пропорційний поширеності КМ;
2) уточнити її тип (товстокишкова, тонкокишкова) і форму (повна, неповна);
3) визначити ознаки прогресування, оскільки на фоні неповної (товстокишкової) метаплазії набагато частіше розвивається неоплазія Ш [5, 6, 15].
За Аруїном обсяг (поширеність) КМ у Ш оцінюють як слабо виражений (КМ займає до 5 % площі поверхні СО), помірний (до 20 %), виражений (понад 20 %) [10, 19].
Можливості ендоскопічної діагностики передракових змін/станів шлунка
На сьогодні ендоскопія є основним методом діагностики передракових станів/змін і раку шлунка [5, 6, 13–16].
За даними дослідників, загальноприйнята ендоскопія в білому світлі не дозволяє надійно діагностувати хелікобактерний гастрит, атрофію СО або КМ, тобто точно диференціювати і діагностувати передпухлинні стани Ш, отже, біопсія залишається обов’язковою процедурою, що дозволяє судити про гістоморфологічну структуру СО Ш згідно із Сіднейською класифікацією [6, 11, 13].
Діагностику передракових станів/уражень Ш покращує ендоскопія з високою роздільною здатністю, зі збільшенням, із режимом вузькосмугової візуалізації [5, 6].
Ендоскопія з високою роздільною здатністю (high resolution endoscopy) відрізняється від звичайного електронного збільшення, що веде до втрати чіткості картини, і характеризується можливістю деталізації й підвищенням чіткості зображення.
Але, як наведено в консенсусі MAPS, існують суперечливі докази ефективності застосування ендоскопів із високою роздільною здатністю. Деякі дослідження демонструють низьку точність у діагностиці запалення СО Ш, слабо вираженої атрофії та метаплазії, зокрема в пацієнтів до 50 років. Крім низької точності, ендоскопічні знахідки асоціюються з низькою відтворюваністю. Проте ендоскопія зі збільшенням і високою роздільною здатністю перевершує стандартну ендоскопію і дозволяє з великою точністю діагностувати хелікобактерний гастрит, КМ і дисплазію [5, 6].
Вузькосмугова візуалізація (з англ. Narrow band imaging — NBI) — це дослідження у вузькому спектрі, що суттєво доповнює можливості звичайного ендоскопічного дослідження. Ендоскопи з функцією NBI обладнані спеціальними оптичними фільтрами, які звужують спектр світла, яким освітлюється СО, що посилює контрастність рисунка капілярів і ямкового рисунка гирл залоз. Отримані зображення дають можливість під час ендоскопічного дослідження глибоко вивчати мікроструктуру СО, виявляти дрібні вогнища КМ, дисплазії, атипії епітелію, що слабо візуалізуються при застосуванні звичайного освітлення [13, 15, 20–23].
Застосування високої роздільної здатності, збільшення та вузькосмугової візуалізації дозволяє виконувати точну біопсію з одночасним зменшенням кількості біоптатів. Ця техніка вимагає від ендоскопіста лише перемикати оптичні фільтри, щоб змінити зображення зі звичайного на NBI, дозволяючи деталізувати архітектоніку поверхні без застосування барвника, а також дає можливість одночасного дослідження мережі капілярів та збірних судин.
Але, незважаючи на те, що низкою досліджень [5, 6, 14] було встановлено, що застосування ендоскопії з функцією NBI має добру чутливість і специфічність у діагностиці уражень Ш, існують певні проблеми в оцінці NBI-зображень СО шлунка. Не проведене дослідження, що б включало повний спектр уражень шлунка. Не існує угоди щодо того, що певну ендоскопічну картину (рисунок) при NBI можна пов’язати з передраковими ураженнями шлунка. Також визначення NBI-ознак відрізнялося між дослідниками.
Системи класифікації зображень при NBI варіювали від дослідження до дослідження, не було ніякої зовнішньої перевірки, і рідко оцінювалася відтворюваність цих даних. Не прийнято єдиної узгодженої класифікації NBІ-ознак патології шлунка на відміну від стравоходу і товстої кишки, стосовно яких ми маємо певні класифікації і консенсуси з визначенням NBІ-ознак при різних патологічних станах цих відділів шлунково-кишкового тракту [6, 13, 21].
Важливе місце в діагностиці передракових станів і уражень Ш також займає хромоскопія з використанням розчинів індигокарміну, оцтової кислоти та інших барвників. Застосування цієї методики, за даними більшості дослідників, значно підвищує ефективність діагностики [6, 22]. Tanaka зі співавт. повідомляють про те, що результати покращуються при одночасному використанні індигокарміну з оцтовою кислотою, ніж при використанні індигокарміну [22].
Нормальна картина СО шлунка при ендоскопії з режимами NBI і оптичного збільшення
В основі діагностики при ендоскопії зі збільшенням лежить верифікація двох основних структур: 1) субепітеліальної архітектоніки мікроваскулярної сітки (MV) та мікроструктури поверхні слизової (MS). Застосування ендоскопії з функцією огляду у вузькосмуговому спектрі світла (NBI) посилює контрастність картини, що дозволяє більш чітко ідентифікувати ці структури. У режимі білого світла можливо визначити тільки мікроструктуру поверхні СО, тоді як у режимі NBI можливо уточнити як будову мікросудин, так і мікроструктуру СО. При дослідженні Ш режим NBI застосовують тільки зі збільшенням зображення [20–26].
Ендоскопічна картина СО Ш, а саме MV, у нормі при дослідженні з оптичним збільшенням ділиться на 2 типи: для тіла та антрального відділу шлунка [20–26].
Для нормальної СО тіла Ш характерним є рисунок капілярної субепітеліальної мережі (subepithelial capillary network — SECN) у вигляді бджолиного стільника (honeycomb-like SECN) із рисунком збірних венул (collecting venules — CV) у вигляді морських зірок. У режимі NBI субепітеліальна капілярна сітка та збірні венули стають чітко видимими (рис. 4, 5) [27].
В антральному відділі субепітеліальна капілярна сітка має будову coil-shaped SECN, що можна перекласти як «маюча форму котушки». Ямки мають лінійну або ретикулярну форму; збірні венули в антральному відділі візуалізуються рідко, тому що анатомічно вони розташовані в більш глибоких шарах власної пластинки СОШ, ніж у тілі (рис. 6).
Класифікації змін при ендоскопії з NBI і оптичним збільшенням
За останні роки було запропоновано низку класифікацій ендоскопічних змін СО Ш при застосуванні ендоскопів із високою роздільною здатністю, збільшенням, NBI-режимом, які базувались на співвідношенні ендоскопічного рисунка з гістологічними діагнозами: за К. Yagi (2002), M. Dinis-Ribeiro з співавт. (2003), G.K. Anagnostopoulos з співавт. (2007), Т. Тahara та співавт. (2009), P. Pimentel-Nunes та M. Dinis-Ribero (2012). В основу більшості класифікацій лягло визначення нормальної СО Ш, Helicobacter рylori-асоційованого гастриту й атрофії Ш [25–30].
Ендоскопічна семіотика передракових станів/ушкоджень шлунка
При виконанні ендоскопії в білому світлі загальноприйнятими ендоскопічними ознаками атрофії СО Ш є: відсутність або згладженість складок, просвічування крупних і дрібних судин, капілярної сітки; вогнищеве заглиблення СО Ш білуватого забарвлення; чергування незначно потоншеної СО Ш із невеликими полями западання сіро-білуватого забарвлення різноманітної конфігурації [15, 16]. При вогнищевому АГ слизова має дрібноплямистий вид: на рожевому тлі збереженої СО видно округлої або неправильної форми сірувато-білуваті ділянки атрофії (виглядають як запалі або втягнуті). На тлі атрофії слизової можуть бути вогнища гіперплазії. Відсутність складок і наявність видимих судин в СО Ш вказують на виражену атрофію, але з відносно низькою чутливістю.
При ендоскопії зі збільшенням до ознак атрофії СО Ш відносять зникнення субепітеліальної мікроваскулярної сітки та самих ямок із формуванням безладно розташованих збірних венул [15, 23, 28].
При ендоскопії в білому світлі КМ Ш виглядає як білуваті бляшки, що помірно виступають над рівнем СО. При використанні ендоскопії високої чіткості може візуалізуватись ворсинчаста поверхня у вогнищах КМ, навіть без збільшення.
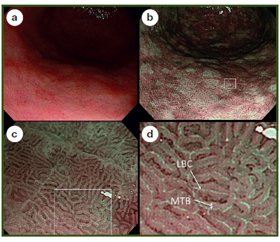
N. Uedo та співавт. показали, що при застосуванні NBI зі збільшенням відмінною ознакою КМ є так звані блакитні гребні (Light blue crests — LBS), що є добрим індикатором гістологічно підтвердженої КМ [31]. Блакитні гребні — це чітко видимі світло-блакитні лінії, розташовані на гребні поверхні епітелію (або звивини), що виявляються при ендоскопії зі збільшенням та NBI (рис. 6). Припускають, що візуалізація LBS пов’язана з рефлексією світла від війчастих структур на поверхні КМ [25, 27].
При вивченні літератури нам зустрілись 2 роботи про можливе визначення типів КМ за допомогою сучасних ендоскопічних методів (Dinis-Ribero М. зі співавт. (2003), Яковенко В. (2013)) [15, 30].
Так, M. Dinis-Ribero зі співавт. (2003) серед 10 підгруп ямкового рисунка (округлі дрібні (ІА), округлі і циліндричні дрібні (ІВ), округлі крупні (ІС), округлі крупні з прямою пітою (ІD), неправильні блакитні знаки (ІІА), блакитні округлі і тубулярні піти (ІІВ), блакитні ворсини (ІІС), блакитні малі піти (ІІD)) вважає, що ІІА і ІІВ більш часто асоціюються з повною КМ, а ІІС і ІІD — з неповною КМ [30].
Зі свого боку, В. Яковенко пропонує власну класифікацію ямкового рисунка поверхні СО Ш (без зазначення відділу Ш), згідно з якою крапковий тип ямкового рисунка відповідає незміненому епітелію, поздовжній — атрофії, ворсинчастий — повній КМ, сітчастий — неповній КМ, нечіткий — дисплазії [15].
Таким чином, застосування сучасних ендоскопічних методів діагностики (відеоендоскопія з високою роздільною здатністю, із режимами збільшення і вузькосмугової візуалізації) дозволяє з високою вірогідністю діагностувати передракові стани шлунка (атрофічний гастрит, кишкову метаплазію), виконувати надточний забір тканини (прецизийна біопсія). Але адекватна оцінка стану СО Ш за допомогою кожного з цих методів вимагає високої кваліфікації лікаря-ендоскопіста, подовжує час ендоскопічних процедур, що збільшує навантаження на відділення ендоскопії. З огляду на всі ці міркування, ендоскопія зі збільшенням і хромоскопія не можуть бути рекомендовані для повсюдного рутинного застосування, вони повинні проводитися в центрах, що мають досвід з їх проведення. За думкою спеціалістів, перш ніж ця технологія буде схвалена, повинна бути прийнята проста система класифікації з незалежною валідацією у великих проспективних багатоцентрових дослідженнях.
Інформація про вклад кожного автора: Ю.М. Степанов — концепція і дизайн огляду; О.В. Сімонова — збір і аналіз літературного матеріалу стосовно ендоскопічної діагностики передракових станів шлунка; Л.М. Мосійчук — аналіз матеріалу стосовно консенсусів із ведення передракових станів/змін шлунка, класифікацій хронічного гастриту, методів його діагностики.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Correa P. A human model of gastric carcinogenesis / P. Correa // Cancer Res. — 1988. — № 48. — P. 3554-3560.
2. Захараш М.П. NBI і ендоскопія з високим збільшенням: сучасні можливості ендоскопічної діагностики / М.П. Захараш, В.О. Яковенко, О.Г. Курик // Український журнал малоінвазивної та ендоскопічної хірургії. — 2009. — № 4. — С. 12-15.
3. Захараш М.П. Скринінг передракових змін і раку шлунка: Метод. рекоменд. / М.П. Захараш, В.Д. Парій, В.О. Яковенко та ін. — Київ, 2009. — 33 с.
4. Котелевец С.М. Морфофункциональные сопоставления при развитии кишечной метаплазии в слизистой оболочке желудка / С.М. Котелевец // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2007. — С. 80-83.
5. Никишаев В.И. Ведение пациентов с предраковыми состояниями и повреждениями в желудке: Клинические рекомендации / В.И. Никишаев, Н.А. Болотских, И.Н. Тумак // Укр. журнал малоінвазивної та ендоскопічної хірургії. — 2013. — № 1(17). — С. 25-50.
6. Management of precancerous conditions and lesions in the stomach (MAPS). Guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP), and the Sociedade Portuguesa de Endoscopia Digestiva (SPED). Guideline / M. Dinis-Ribeiro, M. Areia, A.C. de Vries et al. // Endoscopy. — 2012. — 44(01). — P. 74-94.
7. Olmez S. The prevalence of gastric intestinal metaplasia and distribution of Helicobacter pylori infection, atrophy, dysplasia, and cancer in its subtypes / S. Olmez, M. Aslan, R. Erten // Gastroenterology research and practice. — 2015. — Vol. 2015. — Article ID 434039. — 6 p.
8. Walker M.M. Intestinal Metaplasia and Dysplasia in the Stomach — Diagnostic Difficulties and Clinical Consequences / M.M. Walker // http:// www.bdiap.org/Git/4Walker.htm
9. Folow-up of intestinal metaplasia in the stomach: when, how and why / A. Zullo, C. Hassan, A. Romiti et al. // World Journal of Gastrointestinal oncology. — 2012. — № 4(3). — P. 30-36.
10. Курик О.Г. Хронічний гастрит і передракові зміни слизової оболонки шлунка: морфологічні аспекти / О.Г. Курик, Г.А. Соловйова, В.О. Яковенко // Сучасна гастроентерологія. — 2009. — № 4(48). — С. 88-93.
11. Ткач С.М. Современные подходы к классификации, диагностике и ведению больных с хроническим гастритом в свете международного Киотского консенсуса / С.М. Ткач // Сучасна гастроентерологія. — 2016. — № 1(87). — С. 110-116.
12. Kyoto global consensus report on Helicobacter pylori gastritis / K. Sugano, J. Tack, E.J. Kuipers et al. // Gut. — 2015. — № 64. — P. 1353-1367.
13. Hun H., Uedo N. What have we accomplished in endoscopic image analysis for atrophic gastritis / H. Hun, N. Uedo // The Korean Journal of Helicobacter and Upper Gastrointestinal research. — 2013. — 13(1). — P. 6-19.
14. Multifaceted assessment of chronic gastritis: a study of correlations between serological, endoscopic, and histological diagnostics / T. Takao, T. Ishikawa, T. Ando et al. // Gastroenterology Research and Practice. — 2011. — Vol. 11. — P. 631-637.
15. Яковенко В.О. Ендоскопічна і морфологічна діагностика, малоінвазивне лікування передракових змін слизової оболонки шлунка / В.О. Яковенко, М.П. Захараш, О.Г. Курик. — Вінниця: ФОП Каштелянов О.І., 2013. — 136 с.
16. Takemoto T. Endoscopic diagnosis of chronic gastritis / T. Takemoto // Diagnosis Ann. Treatment. — 1966. — № 54. — P. 1274-1285.
17. Kimura K. An endoscopic recognition of the atrophic border and its significance in chronic gastritis / K. Kimura, T. Takemoto // Endoscopy. — 1969. — № 1. — P. 87-97.
18. Endoscopic gastric atrophy is strongly associated with gastric cancer development after Helicobacter pylori eradication / O. Toyoshima, Y. Yamaji, S. Matsumoto et al. // Surgical endoscopy. — 2016. — DOI: 10.1007/s00464-016-5211-4.
19. Аруин Л.И. Морфологическая диагностика болезней желудка и кишечника / Л.И. Аруин, Л.Л. Капуллер, В.А. Исаков. — М.: Триада-Х, 1998. — 496 с.
20. Advanced endoscopic imaging: European Society of Gastrointestinal Endoscopy (ESGE) Technology Review / J.E. East, J.L. Vleugels, P. Roelandt et al. // Endoscopy. — 2016. — № 48. — P. 1029-1045.
21. Magnifying endoscopy simple diagnostic algorithm for early gastric cancer (MESDA-G) / M. Muto, K. Yao, M. Kaise et al. // Digestive endoscopy. — 2016. — № 28. — P. 379-393.
22. Tanaka K. Surface pattern classification by enhanced magnification endoscopy for identifying early gastric cancers / Tanaka K.,Toyoda H., Kadowaki S. // Gastrointest. Endosc. — 2008. — № 67. — Р. 430-437.
23. Коэн Д. Атлас эндоскопии пищеварительного тракта: возможности высокого разрешения и изображения в узком световом спектре / Под. ред Дж. Коэна; пер. с англ. под ред. А.А. Будзинского. — М.: Логосфера, 2012. — 360 с.
24. High-resolution magnification endoscopy can reliably identify normal gastric mucosa, Helicobacter pylori-associated gastritis, and gastric atrophy / G.K. Anagnostopoulos, K. Yao, P. Kaye et al. // Endoscopy — 2007. — Vol. 39. — Р. 1-6.
25. A multicenter validation of an endoscopic classification with narrow band imaging for gastric precancerous and cancerous lesions / P. Pimentel-Nunes, M. Dinis-Ribeiro, J.B. Soares et al. // Endoscopy. — 2012. — № 44. — P. 236-246.
26. Yao K. A New Diagnostic VS Classification System Produced by Magnification Endoscopy Plus Narrow-Band Imaging in the Stomach: Microvascular Architecture and Microsurface Structure / K. Yao, A. Iwashita, T. Matsui // New Challenges in Gastrointestinal Endoscopy. — 2008. — Р. 169-176.
27. Update on narrow band imaging in disorders of the upper gastrointestinal tract / R. Singh, S.Y. Lee, N. Vijay, P. Sharma, N. Uedo // Digestive Endoscopy. — 2014. — № 26. — Р. 144-153.
28. Yagi K. Characteristic endoscopic and magnified endoscopic findings in the normal stomach without Helicobacter pylori infection / K. Yagi, A. Nakamura, A. Sekine // Journal of Gastroenterology and Hepatology. — 2002. — Vol. 17, 1. — Р. 39-45.
29. Tahara T. Gastric mucosal pattern by using magnifying narrow-band imaging endoscopy clearly distinqushes histological and serological severity of chronic gastritis / T. Tahara, T. Shibata, M. Nakamura // Gastrointest. Endoscopy. — 2009. — № 70. — P. 246-253.
30. Dinis-Ribeiro M. Magnification chromoendoscopy for the diagnosis of gastric intestinal metaplasia and dysplasia / M. Dinis-Ribeiro, A. da Costa-Pereira, C. Lopes // Gastroentest. Endoscopy. — 2003. — № 57(4). — P. 498-504.
31. Uedo N. A new method of diagnosing gastric intestinal metaplasia: narrow band imaging with magnifying endoscopy / N. Uedo, R. Ishihara, H. Lishi et al. // Endoscopy. — 2006. — Vol. 38. — Р. 819-824.

/87.jpg)
/88_2.jpg)
/90.jpg)
/91.jpg)