Резюме
Мета: оцінити метаболічні ефекти генеричного препарату телмісартан (Хіпотел виробництва компанії «Кусум Фарм», Україна) як монотерапії або в комбінації з S-амлодипіном (Семлопін виробництва компанії «Кусум Фарм», Україна) у пацієнтів із м’якою та помірною артеріальною гіпертензією (АГ). Матеріали та методи. У дослідження було включено 40 пацієнтів із м’якою та помірною АГ. Після семиденного періоду відміни всіх медикаментозних засобів пацієнти проходили початкове обстеження та розподіл на групи методом сліпих конвертів залежно від призначеної антигіпертензивної терапії. У кінці періоду відміни оцінювали повторно критерії включення в дослідження. Якщо пацієнт відповідав критеріям включення й не мав критеріїв виключення, то відбувалася рандомізація пацієнта. Призначали Хіпотел у дозі 40–80 мг один раз на добу протягом 2 тижнів. При недосягненні цільового рівня артеріального тиску (АТ) менше від 140/90 мм рт.ст. додавали Семлопін 2,5–5 мг один раз на добу ще протягом 1 місяця. Якщо не було досягнення цільового рівня АТ, додавали гідрохлортіазид у дозі 12,5 мг один раз на добу. Термін спостереження становив 6 місяців. Пацієнтам було проведено на початку та в кінці дослідження добове моніторування АТ, визначення глюкози, інсуліну крові, визначено рівень НОМА, ліпідний спектр крові, біохімічне дослідження крові, загальний аналіз крові та сечі. Результати. Середній вік хворих становив 55,85 ± 2,09 року. Середня маса тіла становила 87,30 ± 2,77 кг. Середній індекс маси тіла — 29,41 ± 0,63 кг/м2. Середні цифри офісного систолічного (САТ) та діастолічного (ДАТ) АТ на початку дослідження становили 155,88 ± 1,63 мм рт.ст. та 92,60 ± 1,43 мм рт.ст. відповідно. Середня офісна частота серцевих скорочень (ЧСС) — 71,40 ± 1,29 уд/хв. Середні рівні АТ при амбулаторному моніторуванні становили для САТ 139,37 ± 1,49 мм рт.ст., для ДАТ — 82,47 ± 1,84 мм рт.ст. Середня добова ЧСС — 71,38 ± 1,32 уд/хв. Хіпотел 40–80 мг у нашому дослідженні як монотерапія або в комбінації із Семлопіном та/або гідрохлортіазидом мав нейтральний ефект на інсулінову чутливість та рівень глюкози й інсуліну крові протягом 24 тижнів лікування. Не спостерігалося негативного впливу лікування на рівень ліпідного спектра крові. У підгрупі пацієнтів без інсулінорезистентності відмічалось достовірне зменшення центрального АТ, а індекс аугментації (АІх) мав тенденцію до зменшення. У підгрупі пацієнтів із інсулінорезистентністю спостерігалось виражене та достовірне зменшення як центрального АТ, так і індексу аугментації. Центральний САТ (цСАТ) пов’язаний із пружно-еластичними властивостями артерій, показниками офісного АТ та ступенем його зниження, ступенем гіпертрофії лівого шлуночка, показниками системного запалення та еректильної функції в чоловіків. Метаболічні показники крові були пов’язані з показниками жорсткості артерій, цСАТ, офісним САТ, ступенем зниження пульсового АТ при добовому моніторуванні. Ступінь зниження НОМА корелював з АІх у кінці лікування (r = –0,451, р = 0,018); швидкістю клубочкової фільтрації після лікування (r = –0,362, р = 0,042); ступенем зниження пульсового АТ при добовому моніторуванні (r = –0,484, р = 0,004). Ступінь зниження НОМА залежав від зниження рівня інсуліну крові, що корелював із ступенем зниження пульсового АТ при добовому моніторуванні (r = –0,485, р = 0,004). Рівень глюкози крові до лікування корелював із офісним САТ після лікування (r = 0,439, р = 0,005); рівень глюкози після лікування корелював з рівнем офісного САТ після лікування (r = 0,357, р = 0,03). Ступінь зниження рівня глюкози корелював з цСАТ на початку лікування (r = –0,445, р = 0,018); з рівнем офісного ДАТ через 4 тижні лікування (r = 0,461, р = 0,004); зі ступенем зниження центрального САТ (r = 0,559, р = 0,002). Чим більш значно знижувався рівень глюкози крові в кінці дослідження, тим більшим був ступінь зниження цСАТ у кінці лікування. Висновок. Телмісартан у монотерапії або в комбінації з S-амлодипіном у підгрупі пацієнтів без інсулінорезистентності сприяв достовірному зменшенню центрального АТ, а індекс аугментації мав тенденцію до зменшення. У підгрупі пацієнтів із інсулінорезистентністю спостерігалось виражене та достовірне зменшення як центрального АТ, так і індексу аугментації. Глюкоза, інсулін крові та НОМА були пов’язані з показниками жорсткості артерій, центральним САТ, офісним САТ, ступенем зниження пульсового АТ при добовому моніторуванні.
Цель: оценить метаболические эффекты генерического препарата телмисартан (Хипотел производства компании «Кусум Фарм», Украина) в качестве монотерапии или в комбинации с S-амлодипином (Семлопин производства компании «Кусум Фарм», Украина) у пациентов с мягкой и умеренной артериальной гипертензией (АГ). Материалы и методы. В исследование было включено 40 пациентов с мягкой и умеренной АГ. После семидневного периода отмены всех медикаментозных средств пациенты проходили первоначальное обследование и деление на группы методом слепых конвертов в зависимости от назначенной антигипертензивной терапии. В конце периода отмены оценивали повторно критерии включения в исследование. Если пациент отвечал критериям включения и не имел критериев исключения, то происходила рандомизация пациента. Назначали Хипотел в дозе 40–80 мг один раз в сутки в течение 2 недель. При недостижении целевого уровня артериального давления (АД) меньше 140/90 мм рт.ст. добавляли Семлопин 2,5–5 мг один раз в сутки еще в течение 1 месяца. Если не было достижения целевого уровня АД, добавляли гидрохлортиазид в дозе 12,5 мг один раз в сутки. Срок наблюдения составил 6 месяцев. Пациентам было проведено в начале и в конце исследования суточное мониторирование АД, определение глюкозы, инсулина крови, определен уровень НОМА, липидный спектр крови, выполнено биохимическое исследование крови, общий анализ крови и мочи. Результаты. Средний возраст больных составил 55,85 ± 2,09 года. Средняя масса тела составляла 87,30 ± 2,77 кг. Средний индекс массы тела — 29,41 ± 0,63 кг/м2. Средние цифры офисного систолического (САД) и диастолического (ДАД) АД в начале исследования составили 155,88 ± 1,63 мм рт.ст. и 92,60 ± 1,43 мм рт.ст. соответственно. Средняя офисная частота сердечных сокращений (ЧСС) — 71,40 ± 1,29 уд/мин. Средние уровни АД при амбулаторном мониторировании составляли для САД 139,37 ± 1,49 мм рт.ст., для ДАД — 82,47 ± 1,84 мм рт.ст. Средняя суточная ЧСС — 71,38 ± 1,32 уд/мин. Хипотел 40–80 мг в нашем исследовании в качестве монотерапии или в комбинации с Семлопином и/или гидрохлортиазидом имел нейтральный эффект на инсулиновую чувствительность и уровень глюкозы и инсулина крови в течение 24 недель лечения. Не наблюдалось негативного влияния лечения на уровень липидного спектра крови. В подгруппе пациентов без инсулинорезистентности отмечалось достоверное уменьшение центрального АД, а индекс аугментации (АІх) имел тенденцию к уменьшению. В подгруппе пациентов с инсулинорезистентностью наблюдалось выраженное и достоверное уменьшение как центрального АД, так и индекса аугментации. Центральное САД (цСАД) связано с упруго-эластичными свойствами артерий, показателями офисного АД и степени его снижения, степенью гипертрофии левого желудочка, показателями системного воспаления и эректильной функции у мужчин. Метаболические показатели крови были связаны с показателями жесткости артерий, цСАД, офисным САД, степенью снижения пульсового АД при суточном мониторировании. Степень снижения НОМА коррелировала с АІх в конце лечения (r = –0,451, р = 0,018), скоростью клубочковой фильтрации после лечения (r = –0,362, р = 0,042), степенью снижения пульсового АД при суточном мониторировании (r = –0,484, р = 0,004). Степень снижения НОМА зависела от снижения уровня инсулина крови, коррелировала со степенью снижения пульсового АД при суточном мониторировании (r = –0,485, р = 0,004). Уровень глюкозы крови до лечения коррелирует с офисным САД после лечения (r = 0,439, р = 0,005), уровень глюкозы после лечения коррелировал с уровнем офисного САД после лечения (r = 0,357, р = 0,03). Степень снижения уровня глюкозы коррелировала с цСАД в начале лечения (r = –0,445, р = 0,018), уровнем офисного диастолического АД через 4 недели лечения (r = 0,461, р = 0,004), степенью снижения цСАД (r = 0,559, р = 0,002). Чем более значительно снижался уровень глюкозы крови в конце исследования, тем больше была степень снижения цСАД в конце лечения. Выводы. Телмисартан в монотерапии или в комбинации с S-амлодипином в подгруппе пациентов без инсулинорезистентности способствовал достоверному уменьшению центрального АД, а индекс аугментации имел тенденцию к уменьшению. В подгруппе пациентов с инсулинорезистентностью наблюдалось выраженное и достоверное уменьшение как центрального АД, так и индекса аугментации. Глюкоза, инсулин крови и НОМА были связаны с показателями жесткости артерий, центральным САД, офисным САД, степенью снижения пульсового АД при суточном мониторировании.
The purpose of the study: to evaluate the metabolic effects of a generic drug telmisartan (Hypotel manufactured by Kusum Pharm, Ukraine) in monotherapy or in combination with S-amlodipine (Samlopin manufactured by Kusum Pharm, Ukraine) in patients with mild to moderate hypertension. Materials and methods. The study included 40 patients with mild to moderate hypertension. After a seven-day period of withdrawal of all medications, all patients underwent initial examination and distribution into the groups using blinding method, depending on the prescribed antihypertensive therapy. At the end of the withdrawal period, inclusion criteria were evaluated again. If patients met inclusion criteria and had no exclusion criteria, the patient’s randomization was performed. Hypotel was administered at a dose of 40–80 mg once daily for 2 weeks. If failure to reach target blood pressure (BP) less than 140/90 mmHg occurred, Samlopin 2.5–5 mg once a day was added for 1 more month. If target blood pressure was not achieved, hydrochlorothiazide 12.5 mg once daily was added. Follow-up duration was 6 months. At the beginning and at the end of the study, patients underwent 24-hour BP monitoring, evaluation of glucose, insulin blood levels, НОМА, blood lipids, biochemical blood test, common blood and urine tests. Results. The average age of patients was 55.85 ± 2.09 years. The average body weight was 87.30 ± 2.77 kg. Average body mass index — 29.41 ± 0.63 kg/m2. Average office systolic (SBP) and diastolic BP (DBP) at baseline were 155.88 ± 1.63 mmHg and 92.60 ± 1.43 mmHg, respectively. The average office heart rate (HR) — 71.40 ± 1.29 bpm. Mean blood pressure during ambulatory monitoring was 139.37 ± 1.49 mmHg for SBP, 82.47 ± 1.84 mmHg — for DBP. Average daily HR — 71.38 ± 1.32 bpm. Hypotel 40–80 mg in our study as monotherapy or in combination with Samlopin and/or hydrochlorothiazide have a neutral effect on insulin sensitivity, glucose and insulin blood levels within 24 weeks of treatment. There was no negative impact of treatment on the level of blood lipids. In the subgroup of patients without insulin resistance, there was noted a significant reduction in central BP, and augmentation index (АІх) tended to decrease. In the subgroup of patients with insulin resistance, we observed a significant reduction in both central BP and augmentation index. Central SBP (cSBP) is associated with elastic properties of the arteries, blood pressure indices and the degree of its decline, degree of left ventricular hypertrophy, indicators of systemic inflammation and erectile function in men. Metabolic blood parameters were associated with values of arterial stiffness, cSBP, office SBP, the degree of pulse pressure (PP) reduction in daily monitoring. The degree of HOMA reduction correlated with АІх growth at the end of the treatment (r = –0.451, p = 0.018); glomerular filtration rate after the treatment (r = –0.362, p = 0.042); the degree of PP reduction in 24-hour blood pressure monitoring (r = –0.484, p = 0.004). The degree of HOMA reduction depended on lowering blood levels of insulin, which correlated with the degree of PP reduction in daily monitoring (r = –0.485, p = 0.004). Blood glucose level before the treatment correlated with office SBP after the treatment (r = 0.439, p = 0.005); glucose levels after the treatment correlated with the level of office SBP after the treatment (r = 0.357, p = 0.03). The degree of glucose reduction correlated with cSBP at baseline (r = –0.445, p = 0.018); with the level of office DBP after 4 weeks of treatment (r = 0.461, p = 0.004); with the degree of cSBP reduction (r = 0.559, p = 0.002). The more significantly blood glucose decreased at the end of the study, the greater was the degree of cSBP reduction at the end of treatment. Conclusion. Telmisartan as monotherapy or in combination with S-amlodipine in the subgroup of patients without insulin resistance contributed to the significant reduction in central blood pressure, and augmentation index tended to decrease. In the subgroup of patients with insulin resistance, we observed a significant reduction in both central blood pressure and augmentation index. Glucose, blood insulin and HOMA were associated with indicators of arterial stiffness, central SBP, office SBP, the degree of PP reduction in daily monitoring.
Вступ
Різні антигіпертензивні препарати можуть по-різному впливати на ризик розвитку серцево-судинних захворювань та ускладнень. Доведено, що на фоні терапії різними антигіпертензивними препаратами частота розвитку цукрового діабету (ЦД) може значно варіювати. В останні роки з’явились дані, що ставлять під сумнів прямий антидіабетогенний ефект інгібіторів ангіотензинперетворювального ферменту (АПФ) (результати дослідження DREAM). Метааналіз досліджень з використанням блокаторів рецепторів ангіотензину (АТ) II показав, що частота розвитку нових випадків ЦД порівняно з використанням інших антигіпертензивних препаратів була в середньому на 20 % нижчою [18, 19]. У дослідженні VALUE використання блокатора АТ II порівняно з антагоністом кальцію зменшувало розвиток ЦД на 23 % (Elliott W.G., 2007) [17]. Вважається, що окрім блокади ренін-ангіотензинової системи додаткову роль у запобіганні розвитку ЦД може відігравати часткова активація РРАR-гамма-рецепторів деякими блокаторами рецепторів АТ II. Експериментальні дані доводять, що найбільший ступінь активації рецептора виявлено в телмісартану (Benson S.C. et al., 2004) [6].
Порівняно з іншими БРА, присутніми на ринку України й світу, телмісартан має кілька унікальних властивостей, що вигідно його відрізняють від інших препаратів. По-перше, афінітет телмісартану до рецепторів ангіотензину II першого типу надзвичайно високий, а ступінь дисоціації дуже низький, що забезпечує більш повну й ефективну блокаду рецептора. Телмісартан серед інших БРА має один з найбільш тривалих періодів напіввиведення — понад 24 години. Крім того, телмісартан має дуже високий ступінь проникнення в тканини, а також найбільший серед БРА обсяг розподілу у внутрішньому середовищі організму. У поєднанні з високою переносимістю й безпекою ці показники становлять основу для більш ефективного порівняно з іншими препаратами контролю артеріального тиску, а також блокади ренін-ангіотензинової системи в тканинах. Іншим важливим механізмом впливу БРА на метаболічний стан, незалежним від антигіпертензивного ефекту, є їх здатність зв’язуватися з PPAR-γ. Доведено, що серед відомих БРА телмісартан має найбільший активуючий вплив на PPAR-γ — у 20 разів більший, ніж кандесартан, ірбесартан, олмесартан, а так само лозартан і його активний метаболіт [3, 8, 24, 30, 31].
На сьогодні виявлені особливості взаємодії телмісартану з PPAR-γ дозволяють говорити про часткову або селективну активацію рецептора під впливом препарату. Так, під дією телмісартану спостерігаються всі метаболічні ефекти активації PPAR-γ. У той же час не спостерігається специфічних ускладнень або побічних ефектів, характерних для глітазонів: затримки рідини в організмі, збільшення маси тіла та збільшення відкладання жиру в підшкірній клітковині [16, 25].
За допомогою блокади рецепторів ангіотензину II першого типу телмісартан зменшує прояви артеріальної гіпертензії (АГ), клітинної проліферації, запалення, а також оксидативного стресу. З іншого боку, унаслідок активації PPAR-γ телмісартан зменшує прояви інсулінорезистентності, дисліпідемії, системного запалення, проліферації клітин, а можливо, й оксидативного стресу. Зазначені шляхи впливу телмісартану результуются в гальмування процесу атерогенезу. Отже, використання такого препарату з подвійним механізмом дії, як телмісартан, буде особливо ефективним у хворих із високим ризиком серцево-судинних захворювань і метаболічних порушень [9, 18, 19].
Численні клінічні дослідження доводять позитивні метаболічні ефекти телмісартану. Так, телмісартан 80 мг мав позитивний вплив на інсулінову чутливість порівняно з валсартаном 160 мг у пацієнтів з ожирінням, АГ та порушеною толерантністю до глюкози протягом 19 тижнів спостереження, при цьому вага тіла та показники ліпідного спектра не змінилися на кінець спостереження [4, 13, 35, 36]. Однорічне дослідження в пацієнтів із цукровим діабетом 2-го типу, які лікувалися телмісартаном або епросартаном, показало, що телмісартан покращував ліпідний профіль крові, не впливаючи на рівень глікемії та інсулінову чутливість [21, 44]. В указаному дослідженні використовувалась доза телмісартану 40 мг на добу, тому телмісартан, як частковий агоніст PPAR-гамма-рецепторів, не чинив повного впливу на показники інсулінової чутливості. Телмісартан мав позитивний вплив на рівень загального холестерину та ліпопротеїнів низької щільності порівняно з ніфедипіном GITS у пацієнтів із цукровим діабетом та м’якою артеріальною гіпертензією протягом 12 місяців лікування [14]. Крім того, у німецькому дослідженні в пацієнтів з АГ та ЦД 2-го типу під дією телмісартану зменшилася концентрація глюкози й тригліцеридів плазми крові після 6 місяців лікування [34, 42].
Такі дані сприяють розробці нових засад для вибору лікування інсулінорезистентності та артеріальної гіпертензії у зв’язку з терапевтичним ефектом телмісартану в пацієнтів з інсулінорезистентністю та пов’язаними з нею метаболічними й серцево-судинними захворюваннями.
Ще один препарат, що успішно використовується в лікуванні артеріальної гіпертензії, — це амлодипін. Амлодипін продемонстрував високу ефективність та позитивно впливав на прогноз у хворих із високим ризиком серцево-судинних ускладнень. Новим напрямком у фармакології є виділення ізомерів із рацемічної суміші. Амлодипін є рацемічною сполукою, що складається із рівних за пропорціями ізомерів (S і R). Показано, що S-амлодипін у 1000 разів сильніше зв’язується з дигідропіридиновими рецепторами, має антиангінальні та судинорозширювальні властивості. S-амлодипін має більшу фармакологічну активність та більш тривалий період напіввиведення (до 49,5 год). У дослідженні SESA, присвяченому вивченню ефективності та безпечності S-амлодипіну, показана висока ефективність такої форми в дозі 2,5 та 5 мг. У частини хворих спостерігалися набряки при лікуванні рацемічним амлодипіном, але після переводу їх на S-амлодипін у 98,7 % набряки суттєво зменшилися. Особливістю S-амлодипіну є можливість застосування менших доз з таким же клінічним ефектом без побічних реакцій [38].
Метою нашого дослідження було оцінити метаболічні ефекти генеричного препарату телмісартан (Хіпотел виробництва компанії «Кусум Фарм», Україна) як монотерапії або в комбінації з S-амлодипіном (Семлопін виробництва компанії «Кусум Фарм», Україна) у пацієнтів із м’якою та помірною артеріальною гіпертензією.
Матеріали та методи
У дослідження було включено 40 пацієнтів із м’якою та помірною АГ (середній рівень офісного систолічного (САТ)/діастолічного (ДАТ) артеріального тиску — 155,88/92,60 ± 1,63/1,43 мм рт.ст.), ЧСС — 71,40 ± 1,29 уд/хв. Середній вік хворих становив 55,85 ± 2,09 (26–74) року.
Критерії включення в дослідження:
— чоловіки та жінки віком від 18 до 75 років;
— м’яка та помірна есенціальна артеріальна гіпертензія згідно з класифікацією ВООЗ 1999 року (Міжнародного товариства з вивчення артеріальної гіпертензії) та Українського товариства кардіологів за умови, що в кінці семиденного періоду відміни всіх антигіпертензивних препаратів були такі середні значення артеріального тиску, виміряного в першій половині дня в положенні сидячи: офісний САТ ≥ 140 мм рт.ст., але < 180 мм рт.ст., ДАТ ≥ 90 мм рт.ст., але < 110 мм рт.ст.;
— відсутність критеріїв виключення.
Критеріями виключення були: ангіоневротичний набряк в анамнезі, гіперкаліємія (> 5,5 ммоль/л) або гіпокаліємія (< 3,5 ммоль/л), гостра серцева недостатність, порушення серцевого ритму (хронічна фібриляція передсердь, часта екстрасистолічна аритмія, шлуночкова або надшлуночкова тахікардія, тахікардія (ЧСС понад 100 уд/хв), порушення атріовентрикулярної провідності, або синусова брадикардія, або синдром слабкості синусового вузла, наявність вад серця, вагітність або лактація, злоякісний перебіг артеріальної гіпертензії, вторинна артеріальна гіпертензія, виражена артеріальна гіпотонія (САТ нижче від 90 мм рт.ст.), бронхіальна астма, декомпенсовані захворювання печінки (рівень аспартатамінотрансферази (АСТ), аланінамінотрансферази (АЛТ) вище від верхньої границі норми у 3 рази), гостра або хронічна ниркова недостатність (розрахункова EPI-CKD < 30 мл/хв), серцева недостатність II і вище функціонального класу (згідно з Нью-Йоркською класифікацією), інфаркт міокарда в анамнезі строком менше ніж 6 місяців до моменту включення в дослідження. гостре порушення мозкового кровообігу в анамнезі, наявність стенокардії напруження ІІІ–IV функціонального класу або вазоспастичної стенокардії, інфекційні та онкологічні захворювання, стани, що супроводжуються ендогенною депресією (чи наявністю депресивних станів у сім’ї), цукровий діабет, ожиріння ІМТ > 40 кг/м2, виражені захворювання периферичних судин, синдром Рейно, стан після хірургічного втручання (менше від одного місяця), прийом стероїдних та нестероїдних протизапальних засобів, контрацептивів, значні психічні розлади, неможливість відмінити попередню антигіпертензивну терапію, участь в іншому дослідженні.
Після семиденного періоду відміни всіх медикаментозних засобів пацієнти проходили початкове обстеження та розподіл на групи методом сліпих конвертів залежно від призначеної антигіпертензивної терапії. У кінці періоду відміни оцінювали повторно критерії включення в дослідження. Якщо пацієнт відповідав критеріям включення і не мав критеріїв виключення, то відбувалася рандомізація пацієнта за схемою, наведеною на рис. 1.
/72-1.gif)
Усім пацієнтам на початку та в кінці лікування проводили такі дослідження: вимірювання маси тіла та зросту, розрахунок індексу маси тіла (ІМТ). Діагноз надлишкової ваги тіла або ожиріння встановлювали відповідно до критеріїв ВООЗ (1997). Надлишкову вагу тіла встановлювали при значенні ІМТ від 25 до 29,9 кг/м2, ожиріння I ступеня — ІМТ від 30 до 34,9 кг/м2, ожиріння II ступеня — ІМТ від 35 до 39,9 кг/м2, ожиріння III ступеня — ІМТ більше ніж 40,0 кг/м2, проводили вимірювання офісного САТ, ДАТ та ЧСС, добове моніторування АТ (ДМАТ), визначення швидкості поширення пульсової хвилі по артеріях еластичного (ШППХе) та м’язового (ШППХм) типів, визначення центрального САТ (цСАТ), біохімічне дослідження крові (визначення рівнів калію, натрію, креатиніну, сечової кислоти, АЛТ, АСТ, білірубіну, С-реактивного протеїну (СРП), глюкози, інсуліну, розрахунок індексу НОМА), визначали ліпідний обмін, що включав визначення вмісту загального холестерину (ХС), тригліцеридів, холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ), холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ), холестерину ліпопротеїнів дуже низької щільності (ХС ЛПДНЩ), індекс атерогенності (ІА).
Вимірювання офісного САТ та ДАТ проводили на початку дослідження, після семиденної (у разі необхідності) відміни усіх антигіпертензивних препаратів та в кінці лікування. Вимірювали АТ у положенні сидячи тричі з інтервалом 1–2 хвилини. ЧСС визначали після другого вимірювання.
Індекс маси тіла визначали за формулою:
ІМТ = маса тіла/(ріст)2, кг/м2.
Методика добового моніторування артеріального тиску. ДМАТ проводили за допомогою апаратів АВРМ-04М (фірма «Медітек», Угорщина). При цьому вивчали такі показники: середньодобовий, денний, нічний систолічний АТ, середньодобовий, денний, нічний діастолічний АТ, ЧСС. При аналізі ДМАТ для САТ і ДАТ розраховували індекс часу (ІЧ), що характеризує часове перевантаження тиском протягом доби та визначається як відсоток вимірів АТ, що перевищують 140/90 мм рт.ст. вдень і 120/80 мм рт.ст. вночі. Також визначали індекс навантаження тиском, що є площею між кривою підвищеного АТ та лінією границі норми, а також індекс варіабельності, який обчислювали як стандартне відхилення величини АТ. Крім того, за допомогою програмного забезпечення вираховували добовий індекс (ДІ) — процент зниження нічного АТ порівняно з денним. Моніторування проводили в такому режимі: у денний час — кожні 15 хвилин, вночі (з 22:00 до 6:00) — кожні 30 хвилин. Хворі вели звичайний спосіб життя, мали побутові фізичні й психоемоційні навантаження.
Індекс часу (навантаження тиском) розраховували як відсоток вимірів, що перевищують нормальні показники. Індекс часу для систолічного АТ вважається нормальним до 20 %, а для діастолічного АТ — до 15 % (White, 1989). Динаміка індексу навантаження тиском дає змогу оцінити адекватність лікування.
При оцінці добового ритму АТ нормальним вважається зменшення АТ вночі під час сну на 10–20 % порівняно з денним періодом. Ступінь нічного зниження САТ та ДАТ, або добовий індекс, розраховували за формулою (окремо для САТ та ДАТ):
ДІ = (серАТд – серАТн) • 100 % / серАТд,
де серАТд — середньоденний АТ (САТ чи ДАТ), –серАТн — середньонічний АТ (САТ чи ДАТ).
Оцінка добового ритму АТ:
а) нормальне зниження АТ вночі (dipper) — 10–20 %;
б) недостатнє зниження (non-dipper) — 0–10 %;
в) підвищений ступінь нічного зниження (hyper-dipper) — понад 20 %;
г) стійке підвищення АТ вночі (night-peaker) — нічний АТ більший від денного.
Доведено, що підвищений АТ протягом ночі супроводжується більшим ураженням органів-мішеней (гіпертрофія міокарда, серцева недостатність, гломерулосклероз та ниркова недостатність, ретинопатія тощо). Тривалі спостереження показали, що хворі з порушеним добовим ритмом АТ (non-dipper), особливо жінки, мають достовірно більший ризик виникнення серцево-судинних ускладнень.
Варіабельність АТ є важливою детермінантою ураження органів-мішеней. Крім того, існують непрямі докази, що збільшення варіабельності АТ несприятливо впливає на число серцево-судинних ускладнень та смертність. Варіабельність САТ та ДАТ розраховували як стандартне відхилення від середнього значення, тобто як коефіцієнт варіабельності середньої величини САТ і ДАТ за добу, день, ніч.
Біохімічні аналізи виконувалися в сертифікованій в Україні лабораторії «Сінево». Визначали рівень креатиніну, електролітів (калію та натрію), АЛТ, АСТ, глюкози, інсуліну крові, розрахунковий індекс НОМА, загального ХС, тригліцеридів, ХС ліпопротеїдів високої щільності, ХС ліпопротеїдів низької щільності, ХС ліпопротеїдів дуже низької щільності сироватки крові. Кліренс креатиніну, що відображає швидкість клубочкової фільтрації (ШКФ), розраховували за формулою EPI-CKD.
Важливість вивчення пружно-еластичних властивостей артерій була показана в дослідженні SHEP (Systolic Hypertension in the Elderly Program) (1991), у якому було виявлено позитивний зв’язок між підвищеним рівнем САТ та збільшенням ризику виникнення несприятливих серцево-судинних подій, навіть якщо ДАТ був нормальним або зниженим. При цьому зниження САТ під впливом антигіпертензивної терапії приводило до зменшення смертності від усіх серцево-судинних подій, включаючи фатальний інсульт та інфаркт міокарда [15]. Незважаючи на велику кількість методів дослідження пружно-еластичних властивостей артерій, тільки прямі методи, основані на визначенні ШППХ, відзначаються достатньою точністю, відтворюваністю, не потребують складних діагностичних процедур та математичних розрахунків та можуть бути використані для обстеження великої кількості хворих. Визначення ШППХ для виявлення жорсткості артерій як ураження органа-мішені у хворих з ізольованою систолічною гіпертензією похилого віку було включене в перелік методів дослідження для виявлення субклінічних уражень органів-мішеней у рекомендаціях Європейського товариства з гіпертензії і Європейського товариства кардіологів у 2007 році [32, 33]. У вищезгаданих рекомендаціях говориться, що визначення ШППХ дозволяє виконати повну неінвазивну оцінку жорсткості артерій, є точною та простою у виконанні технікою. Також було зазначено, що результати цього дослідження можуть мати значення для прогнозування загальної смертності, серцево-судинної захворюваності, коронарних подій та інсультів у хворих на гіпертонічну хворобу без ускладнень. Визначено, що значення ШППХ понад 12 м/с вважається надійним критерієм ураження судин у хворих на гіпертонічну хворобу середнього віку.
Найбільшими прогностичними факторами контролю за ефективністю антигіпертензивної терапії на сьогодні вважаються показники центрального ПАТ (цПАТ) і цСАТ. Як показали клінічні дослідження, саме цСАТ та цПАТ більшою мірою визначають прогноз, ніж АТ, виміряний на плечовій артерії [33]. Так, у дослідженні CAFÉ (Conduit Artery Function Evaluation) рівень цПАТ незалежно від інших факторів ризику асоціювався з гіршим перебігом [32]. Аналіз відмінностей між групами, у яких виникли серцево-судинні ускладнення або ж не виникли, у дослідженні SHS (Strong Heart Study) продемонстрував, що цПАТ > 50 мм рт.ст., але не ПАТ, виміряний на плечовій артерії, був незалежним предиктором виникнення кардіоваскулярних подій [32, 33]. Супутні захворювання (ішемічна хвороба серця, цукровий діабет, синдром обструктивного апное) та стани (дисліпідемія, куріння) супроводжуються збільшеним центральним АТ (цАТ). Окрім судинних ускладнень, цПАТ і цСАТ асоціюються з ураженням органів-мішеней (гіпертрофією лівого шлуночка (ЛШ), товщиною комплексу інтима-медія, діастолічною дисфункцією лівого шлуночка, збільшенням розміру лівого передсердя (ЛП)) та прогресуванням атеросклерозу.
ШППХ та центральний АТ визначалися на апараті Sphygmocor-PVx (AtCor Medical Pty Ltd, Австралія), з’єднаному із персональним комп’ютером, що дозволяє проводити аналіз форми пульсової хвилі та визначати ШППХе та ШППХм. П’єзодатчики встановлювали на загальній правій артерії, на стегновій артерії та радіальній артерії правого передпліччя під візуальним (на моніторі) та автоматичним конт–ролем якості, що здійснювався при відповідній програмі приладу. Час запізнювання пульсової хвилі та швидкість поширення пульсової хвилі, центральний АТ визначалися автоматично за допомогою програмного забезпечення приладу після введення величини відстані між датчиками, що вимірювалася сантиметровою смужкою. Для оцінки пружно-еластичних властивостей артерій еластичного типу ШППХ визначали на сегменті «сонна артерія — стегнова артерія», для оцінки пружно-еластичних властивостей артерій м’язового типу — на сегменті «сонна артерія — радіальна артерія». Окрім ШППХ, визначали також центральний АТ за допомогою програмного забезпечення приладу на основі артеріального тиску на плечовій артерії та форми отриманої пульсової хвилі у висхідній аорті (формула визначена виробником, проведена стандартизація при інтрааортальному вимірюванні артеріального тиску).
За даними літератури, проведення аналізу пульсової хвилі в пацієнтів із різними факторами ризику виявило, що незалежно від рівня АТ індекс аугментації (АІх) підвищується з віком у пацієнтів із цукровим діабетом першого типу та гіперхолестеролемією [35, 36, 15]. У багатьох клінічних проспективних дослідженнях (ASCOT, SEARCH, FIELD та інших) вивчалося прогностичне значення АІх. Виявилося, що збільшення величини індексу на 10 % супроводжується збільшенням ризику виникнення серцево-судинних подій у 1,28 раза незалежно від інших факторів [37]. При цьому в пацієнтів із кінцевою стадією ниркової недостатності вплив індексу приросту на прогноз не залежав від величини ШППХ.
У гіпертензивних пацієнтів навіть без інших ознак кардіоваскулярних захворювань ШППХ виявилася предиктором розвитку несприятливих подій, тобто була класичним фактором ризику, незалежним від інших. При цьому особливо поганим є прогноз у пацієнтів із величиною ШППX понад 12 та 20 м/с. У хворих із нирковою недостатністю, як відомо, дуже високий ризик виникнення серцево-судинних подій та загальної смерті. При цьому в дослідженнях виявилося, що зменшення ШППХ по артеріях еластичного типу в обстежених хворих на 1 м/с під впливом терапії приводило до зменшення загальної смертності на 29 % [43].
Отже, вивчення впливу антигіпертензивної терапії на центральний АТ та пружно-еластичні властивості артерій є перспективним напрямком дослідження, що дозволить розробити підходи до вибору лікування АГ та максимально врахувати індивідуальний ризик пацієнта.
Ми оцінювали вплив терапії на показники еректильної функції в чоловіків за допомогою анкети МІЕД (міжнародний індекс еректильної дисфункції). Оцінювали наявність еректильної дисфункції (ЕД), задоволення від статевого акту, вираженість оргазму, наявність бажання (лібідо), загальне задоволення. Під еректильною дисфункцією розуміють хронічну неспроможність досягати ерекції та/або підтримувати її для здійснення статевого акту. АГ є фактором, що сприяє виникненню або поглибленню ЕД. За даними переважної більшості спостережень, відносний ризик ЕД при наявності АГ підвищується в 1,3–6,9 раза. У дослідженні у 2130 чоловіків із АГ вивчали поширеність ЕД та встановили, що 45,8 % чоловіків із АГ мали ЕД. У дослідженні M. Doumas зі співавт. зіставляли поширеність ЕД у гіпертензивних та нормотензивних чоловіків та встановили, що поширеність ЕД у чоловіків із АГ була 35,2 %, а в нормотензивних чоловіків — 14,1 % [12].
Ми оцінювали вплив терапії на ефективність, переносимість та прихильність пацієнтів до лікування.
Усі перераховані вище клінічні, лабораторні та функціонально-діагностичні обстеження проводили на початку дослідження та в кінці періоду лікування.
Клінічну ефективність лікування оцінювали шляхом порівняння динаміки клініко-лабораторних та функціонально-діагностичних показників у хворих на початку та в кінці лікування.
Статистичну обробку результатів проводили після створення баз даних у системах Microsoft Excel. Усі статистичні розрахунки проводили за допомогою програми SPSS 21. Достовірність різниці середніх між групами визначалася методом незалежного t-тесту для середніх. Порівняння динаміки показників на етапах лікування проводили за допомогою парного двовибіркового t-тесту для середніх. Кореляційний аналіз проводили після визначення характеру розподілу за Spearman.
Результати
Середній вік хворих становив 55,85 ± 2,09 року. Середня маса тіла становила 87,30 ± 2,77 кг. Середній ІМТ — 29,41 ± 0,63 кг/м2. Середні рівні офісного САТ та ДАТ на початку дослідження становили 155,9 ± 1,63 мм рт.ст. та 92,60 ± 1,43 мм рт.ст. відповідно. Середня офісна ЧСС — 71,40 ± 1,29 уд/хв. Середні рівні АТ при амбулаторному моніторуванні становили для САТ 139,37 ± 1,49 мм рт.ст., для ДАТ — 82,47 ± 1,84 мм рт.ст. Середня добова ЧСС — 71,38 ± 1,32 уд/хв. Основні клініко-демографічні показники пацієнтів наведені в табл. 1.
При аналізі структури призначення терапії виявлено, що на початку 95 % приймали монотерапію у вигляді Хіпотелу (телмісартану) 40 або 80 мг один раз на добу. Через 24 тижні 35 % пацієнтів залишилися на монотерапії, інші 65 % приймали подвійну комбіновану терапію Хіпотелом (телмісартаном) 40–80 мг із Семлопіном (S-амлодипіном) 2,5–5 мг або потрійну — з додаванням гідрохлортіазиду 12,5 мг один раз на добу.
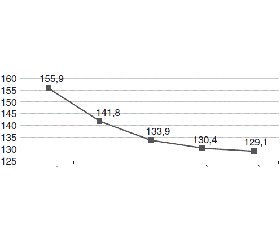
На фоні терапії Хіпотелом у загальній групі зниження офісного АТ на етапах 14 днів, 4 тижні, 8 тижнів та 24 тижні становило 14,0/7,7 мм рт.ст., 22,0/10,7 мм рт.ст., 25,5/13,5 мм рт.ст., 26,8/12,3 мм рт.ст. відповідно (р < 0,05) для усіх значень. Дані наведені на рис. 2.
Нами відмічено значне та достовірне зниження АТ при добовому моніторуванні як за весь період, так і за денний та нічний періоди. Так, зниження артеріального тиску при добовому моніторуванні на фоні прийому Хіпотелу через 24 тижні лікування становило за весь період 15,7/9,3 мм рт.ст., за денний період — 15,3/9,2 мм рт.ст., за нічний період — 15,4/8,7 мм рт.ст. (р < 0,05) для усіх значень. ЧСС достовірно не змінилася: за весь період ЧСС зменшилася на 1,55 уд/хв, за денний період — на 1,4 уд/хв, за нічний період — на 1 уд/хв.
При аналізі впливу Хіпотелу на показники ліпідного спектра крові через 6 місяців як при монотерапії, так і в комбінації із Семлопіном нами не відмічено достовірної різниці в показниках. Дані наведені в табл. 2.
При аналізі впливу Хіпотелу на показники вуглеводного обміну крові через 6 місяців як при монотерапії, так і в комбінації з Семлопіном нами не відмічено достовірної різниці в показниках. Дані наведені в табл. 3.
/75-1.gif)
Ми спробували визначити фактори, що можуть бути пов’язані з рівнем глюкози, інсуліну та НОМА і ступенем їх зниження в загальній групі обстежених. Кореляційний аналіз проводили за Spearman. Так, ступінь зниження НОМА обернено корелював з показником жорсткості судин — індексом аугментації в кінці лікування (r = –0,451, р = 0,018); ШКФ після лікування (r = –0,362, р = 0,042); ступенем зниження пульсового АТ при добовому моніторуванні (r = –0,484, р = 0,004). Чим вищими були показники жорсткості судин та чим менше знижувався пульсовий АТ при добовому моніторуванні, тим менше знижувався показник інсулінорезистентності НОМА. Причому ступінь зниження НОМА залежав від зниження рівня інсуліну крові, що обернено корелював із ступенем зниження пульсового АТ при добовому моніторуванні (r = –0,485, р = 0,004). Рівень глюкози крові до лікування корелював з офісним САТ після лікування (r = 0,439, р = 0,005); рівень глюкози після лікування корелював з рівнем офісного САТ після лікування (r = 0,357, р = 0,03). Ступінь зниження рівня глюкози обернено корелював з центральним САТ на початку лікування (r = –0,445, р = 0,018); прямо корелював з рівнем офісного ДАТ через 4 тижні лікування (r = 0,461, р = 0,004); прямо корелював зі ступенем зниження цСАТ (r = 0,559, р = 0,002). Чим вищим був цСАТ на початку лікування, тим менше знижувався рівень глюкози. Чим більш виражено знижувався ДАТ через 4 тижні лікування, тим більше знижувався рівень глюкози крові в кінці лікування. Чим більш значно знижувався рівень глюкози крові в кінці дослідження, тим більшим був ступінь зниження цСАТ у кінці лікування.
Отже, з метаболічними показниками крові були пов’язані показники жорсткості артерій, центральний САТ, рівень офісного САТ та ступінь зниження пульсового АТ при добовому моніторуванні.
Ми проаналізували зміни вуглеводного обміну крові залежно від рівня НОМА, що характеризує наявність інсулінорезистентності в пацієнтів. За критерій інсулінорезистентності за рівнем НОМА вважали понад 2,77 ум.од. Нами не відмічено достовірної різниці в динаміці показників у підгрупах на фоні лікування. Однак групи відрізнялись між собою за початковими та кінцевими показниками інсуліну крові і як наслідок — рівнем НОМА. Дані наведені в табл. 4.
Пацієнти з інсулінорезистентністю були дещо старшими за віком та мали більш тривалий перебіг АГ. Пацієнти без інсулінорезистентності в нашому спостереженні мали ознаки активації хронічного запалення (рівень СРП у крові > 3 мг/л): достовірно більший рівень СРП — 4,03 ± 0,69 мг/л порівняно з підгрупою пацієнтів без інсулінорезистентності, у яких рівень СРП становив 1,90 ± 0,14 мг/л (р < 0,05 між підгрупами на початку та в кінці лікування), але достовірної динаміки показників запалення в процесі лікування нами відмічено не було. Також пацієнти з рівнем НОМА < 2,77 ум.од. мали початково більший ризик розвитку серцево-судинних подій за шкалою SCORE — 4,38 ± 1,12 ум.од. порівняно з пацієнтами з рівнем НОМА ≥ 2,77 ум.од. — 3,00 ± 0,52 ум.од. Індекс маси міокарда лівого шлуночка (ІММЛШ) мав тенденцію до зменшення в обох підгрупах, але достовірно не відрізнявся, швидше за все, у зв’язку з малою кількістю пацієнтів у підгрупах. ШКФ також достовірно не відрізнялась у процесі лікування між підгрупами. Дані наведені в табл. 5.
/76.gif)
При аналізі пружно-еластичних властивостей артерій та центрального АТ у цілому по групі виявлено достовірне зменшення центрального АТ та індексу аугментації. У підгрупі пацієнтів без інсулінорезистентності відмічалось достовірне зменшення цАТ, а індекс аугментації мав тенденцію до зменшення. У підгрупі пацієнтів з інсулінорезистентністю відмічено виражене та достовірне зменшення як цАТ, так і індексу аугментації. ШППХ по артеріях еластичного та м’язового типів мала тенденцію до зменшення, але, ймовірно, через невелику кількість пацієнтів не зазнала достовірних змін. Дані наведено в табл. 6.
При аналізі ліпідного спектра крові у підгрупах нами не відмічено достовірних змін за жодним показником. Тобто як у загальній групі, так і в пацієнтів з наявною або відсутньою інсулінорезистентністю достовірних змін ліпідного спектра крові ми не спостерігали. Дані наведені в табл. 7.
Аналізуючи вплив терапії Хіпотелом або його комбінацією із Семлопіном на показники еректильної функції в чоловіків, ми відмітили достовірне покращення еректильної функції за такими показниками, як оргазм, задоволення від статевого акту, підвищення лібідо та загальне задоволення. У пацієнтів без інсулінорезистентності достовірними були зміни показника задоволення статевим актом, а інші показники мали тенденцію до покращення (відсутність статистично значущої достовірності пов’язана з малою кількістю пацієнтів у підгрупі). Водночас у підгрупі пацієнтів з інсулінорезистентістю достовірних змін виявлено не було, хоча всі показники мали тенденцію до покращання. Отже, у нашому дослідженні пацієнти без виражених метаболічних порушень показали кращі результати на фоні лікування Хіпотелом та його комбінацією із Семлопіном. Дані наведені в табл. 8.
/77-1.gif)
Ми спробували визначити фактори, що можуть бути пов’язані з центральним САТ і ступенем його зниження в загальній групі обстежених. Кореляційний аналіз проводили за Spearman. Дані наведені в табл. 9. З табл. 9 видно, що на початку дослідження цАТ достовірно корелював із рівнем офісного САТ та офісного ДАТ у кінці лікування, чим вищими були показники офісного САТ та ДАТ, тим вищим був і центральний АТ. Ступінь зниження центрального САТ обернено корелював із рівнем ШППХе на початку лікування та індексом приросту в кінці лікування. ШППХе більшою мірою характеризує саме еластичні властивості стінки артерій та залежить від тиску розтягування. Чим вищими були ШППХе та АІх, тим менше знижувався центральний САТ у кінці лікування. Тобто чим більш жорсткими були судини, тим гірше знижувався центральний САТ. Центральний САТ у кінці дослідження корелював зі ступенем зниження офісного АТ та ЧСС. Чим більш виражено знижувався офісний САТ, ДАТ та ЧСС, тим більш виражено знижувався центральний САТ у кінці дослідження.
/78-1.gif)
Нами виявлені прямі кореляційні зв’язки між показниками ЕхоКГ та центральним САТ: так, розмір лівого передсердя, товщина міжшлуночкової перегородки (МШП), задньої стінки (ЗС), розмір аорти прямо корелювали з рівнем центрального САТ у кінці дослідження. Тобто чим більшими були показники ЕхоКГ, тим менше знижувався центральний САТ. Чим більшою була гіпертрофія лівого шлуночка (вищим був ІММЛШ) як на початку, так і в кінці дослідження, тим менше знижувався центральний САТ у кінці дослідження.
Ступінь зниження центрального САТ обернено корелював із рівнем СРП як на початку, так і в кінці дослідження. Чим вищим був показник запалення (СРП), тим менше знижувався центральний САТ. Також чим вищим був рівень за шкалою SCORE (оцінка сумарного серцево-судинного ризику) в кінці дослідження, тим вищим був центральний САТ на початку дослідження. У кінці дослідження цСАТ достовірно корелював з офісним ДАТ в кінці, еректильною функцією та лібідо на початку дослідження. Чим кращими були показники еректильної функції в чоловіків на початку дослідження, тим більш виражено знижувався центральний САТ.
Отже, показники центрального САТ були пов’язані з пружно-еластичними властивостями артерій, показниками офісного АТ та ступенем його зниження, показниками ЕхоКГ, ступенем гіпертрофії лівого шлуночка, показниками системного запалення та показниками еректильної функції в чоловіків.
Обговорення
Дане дослідження показало, що при прийомі 40–80 мг телмісартану як монотерапії або в комбінації з S-амлодипіном 2,5–5 мг ефективно знижувався АТ як при офісному вимірюванні, так і при добовому моніторуванні. Так, телмісартан у нашому дослідженні як монотерапія або в комбінації з S-амлодипіном та/або гідрохлортіазидом мав нейтральний ефект на інсулінову чутливість та рівень глюкози та інсуліну крові протягом 24 тижнів лікування. Не спостерігалося негативного впливу й на рівень ліпідного спектра крові.
При аналізі пружно-еластичних властивостей артерій та центрального АТ у цілому по групі виявлено достовірне зменшення центрального АТ та індексу аугментації. У підгрупі пацієнтів без інсулінорезистентності відмічалось достовірне зменшення центрального АТ, а індекс аугментації мав тенденцію до зменшення. У підгрупі пацієнтів з інсулінорезистентністю відмічено виражене та достовірне зменшення як центрального АТ, так і індексу аугментації. ШППХ по артеріях еластичного та м’язового типів мала тенденцію до зменшення, але, ймовірно, через невелику кількість пацієнтів не мала достовірних змін.
Показники центрального САТ були пов’язані з пружно-еластичними властивостями артерій, показниками офісного АТ та ступенем його зниження, ступенем гіпертрофії лівого шлуночка, показниками системного запалення та показниками еректильної функції у чоловіків. Метаболічні показники крові були пов’язані з показниками жорсткості артерій, центрального САТ, офісного САТ та ступенем зниження пульсового АТ при добовому моніторуванні.
Ми відмітили достовірне покращення еректильної функції в чоловіків на фоні терапії телмісартаном як у вигляді монотерапії, так і в комбінації з амлодипіном за такими показниками, як оргазм, задоволення статевим актом, підвищення лібідо та загальне задоволення. У пацієнтів без інсулінорезистентності достовірними були зміни показника задоволення статевим актом, а інші показники мали тенденцію до покращання. У підгрупі пацієнтів з інсулінорезистентістю достовірних змін виявлено не було, хоча всі показники мали тенденцію до покращання. Отже, у нашому дослідженні пацієнти без виражених метаболічних порушень показали кращі результати на фоні лікування Хіпотелом та його комбінацією із Семлопіном.
За даними інших досліджень, телмісартан мав позитивний вплив на інсулінову чутливість порівняно з валсартаном 160 мг у пацієнтів з ожирінням, АГ та порушеною толерантністю до глюкози протягом 19 тижнів спостереження, при цьому вага тіла та показники ліпідного спектра не змінилися на кінець спостереження [10, 11]. Однорічне дослідження в пацієнтів із цукровим діабетом 2-го типу, які лікувалися телмісартаном або епросартаном, показало, що телмісартан покращував ліпідний профіль крові, не впливаючи на рівень глікемії та інсулінову чутливість [50]. В указаному дослідженні використовувалась доза телмісартану 40 мг на добу, тому телмісартан як частковий агоніст PPAR-гамма-рецепторів не чинив повного впливу на показники інсулінової чутливості. Телмісартан мав позитивний вплив на рівень загального холестерину та ліпопротеїнів низької щільності порівняно з нифедипіном GITS у пацієнтів з цукровим діабетом 2-го типу та м’якою артеріальною гіпертензією протягом 12 місяців лікування [45–47]. Крім того, у німецькому дослідженні в пацієнтів з АГ та ЦД 2-го типу під дією телмісартану зменшилася концентрація глюкози та тригліцеридів плазми крові після 6 місяців лікування [5, 7].
Такі дані сприяють розробці нових підстав для вибору лікування інсулінорезистентності та артеріальної гіпертензії та можуть вплинути на початок нових досліджень у вивченні терапевтичного ефекту телмісартану в пацієнтів з інсулінорезистентністю та пов’язаними з нею метаболічними й серцево-судинними захворюваннями.
Рівень глюкози натще використовується як стандартний тест для діагностики ЦД 2-го типу, а також як маркер серцево-судинної захворюваності [22]. В осіб без ЦД з рівнем глюкози натще ≥ 5,6 ммоль/л, але < 7,0 ммоль/л підвищений ризик серцево-судинних ускладнень [23]. Використаний у нашому дослідженні індекс НОМА, як показник інсуліно-–резистентності, є простою сурогатною формою більш складного еуглікемічного клемп-тесту [3, 36]. Показник НОМА був предиктором розвитку ЦД в Mexico City Diabetes Study [20, 22, 29].
Наведемо дані декількох досліджень, проведених з агоністами PPAR-гамма-рецепторів у пацієнтів без ЦД. В одному з досліджень 24 пацієнтам з АГ без ЦД (середній ІМТ 30 кг/м2) призначали розиглітазон як доповнення до будь-якої антигіпертензивної терапії (окрім інгібіторів АПФ) протягом 12 тижнів. У результаті зменшився рівень інсуліну плазми натще, але не відбулося зменшення глюкози натще [26–28]. У 8-тижневому плацебо-контрольованому дослідженні 50 пацієнтів із метаболічним синдромом відповідно до критеріїв АТР III та без ЦД було рандомізовано в групу, що приймала 4 мг/добу рози–глітазону порівняно з групою плацебо. Виявилось, що розиглітазон зменшував рівень інсуліну плазми натще на 40 %, а індекс НОМА — на 45 % порівняно з плацебо [46, 48, 49]. У нашому дослідженні зниження цих показників було дещо меншим. Це можна пояснити тим, що телмісартан — тільки частковий агоніст PPAR-гамма-рецепорів на відміну від розиглітазону. Такий ефект забезпечує йому кращу переносимість та меншу кількість побічних ефектів порівняно з глітазонами, що викликають затримку рідини в організмі, периферичні набряки та можуть сприяти підвищенню артеріального тиску [1, 2].
Думка про те, що інгібітори АПФ покращують інсулінову чутливість та зменшують ризик виникнення цукрового діабету 2-го типу, пов’язана з теорією, що ренін-ангіотензинова система відіграє провідну роль у патогенезі інсулінорезистентності [15, 23]. Запобігання негативним метаболічним ефектам ангіотензину II у більшості випадків береться до уваги, коли говорять про потенційний антидіабетичний ефект інгібіторів АПФ. Однак дані недавніх досліджень доводять, що позитивний метаболічний ефект інгібіторів АПФ не пов’язаний із впливом на ренін-ангіотензинову систему. Інгібітори АПФ, можливо, покращують глюкозний метаболізм через кінінову систему [41].
Метаболічний синдром чітко пов’язаний з інсулінорезистентністю [40, 41]. Артеріальна гіпертензія та дисліпідемія — це фактори, що підвищують ризик серцево-судинних захворювань та ЦД 2-го типу. АГ зустрічається в 2 рази частіше в пацієнтів із ЦД порівняно з пацієнтами без ЦД. 75 % серцево-судинних захворювань у пацієнтів з ЦД супроводжуються АГ. Раціональний початок лікування пацієнтів з АГ та інсулінорезистентністю може запобігати виникненню ЦД 2-го типу та серцево-судинним захворюванням. Особливі властивості телмісартану як часткового агоніста PPAR-гамма-рецепторів свідчать на користь гіпотези, що телмісартан може запобігати виникненню цукрового діабету та серцево-судинних захворювань у пацієнтів з артеріальною гіпертензією [39].
Отже, наше дослідження продемонструвало метаболічну нейтральність щодо показників глюкози, інсуліну, ліпідного спектра крові та позитивний вплив Хіпотелу як монотерапії або в комбінації із Семлопіном на показники офісного та добового артеріального тиску протягом 24 тижнів лікування.
Висновки
1. Хіпотел 40–80 мг у нашому дослідженні як монотерапія або в комбінації із Семлопіном та/або гідрохлортіазидом мав нейтральний ефект на інсулінову чутливість та рівень глюкози й інсуліну крові протягом 24 тижнів лікування.
2. Не спостерігалося негативного впливу лікування на рівень ліпідного спектра крові.
3. У підгрупі пацієнтів без інсулінорезистентності відмічалось достовірне зменшення центрального АТ, а індекс аугментації мав тенденцію до зменшення. У підгрупі пацієнтів з інсулінорезистентністю спостерігалось виражене та достовірне зменшення як центрального АТ, так і індексу аугментації.
4. Центральний САТ пов’язаний із пружно-еластичними властивостями артерій, показниками офісного АТ та ступенем його зниження, ступенем гіпертрофії лівого шлуночка, показниками системного запалення та показниками еректильної функції в чоловіків.
5. Метаболічні показники крові були пов’язані з показниками жорсткості артерій, центральним САТ, офісним САТ, ступенем зниження пульсового АТ при добовому моніторуванні.
6. Телмісартан у монотерапії або комбінації з S-амлодипіном мав тенденцію до покращення пружно-еластичних властивостей артерій.
7. Покращення еректильної функції в чоловіків на фоні терапії телмісартаном як у вигляді монотерапії, так і в комбінації з S-амлодипіном спостерігалось за такими показниками, як оргазм, задоволення статевим актом, підвищення лібідо та загальне задоволення.
8. У пацієнтів без інсулінорезистентності достовірними були зміни показника задоволення статевим актом, а інші показники мали тенденцію до покращання. У підгрупі пацієнтів з інсулінорезистентістю достовірних змін виявлено не було, хоча всі показники мали тенденцію до покращання.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Сіренко Ю.М., Рековець О.Л. Антигипертензивная эффективность и безопасность телмисартана (микардиса) при артериальной гипертензии: первые результаты проспективного многоцентрового исследования в Украине // Український кардіологічний журнал — 2003. — № 5. — С. 43-50.
2. Сіренко Ю.М., Рековець О.Л. Лікування артеріальної гіпертензії та метаболічних порушень: значення подвійного ефекту телмісартану для профілактики розвитку цукрового діабету // Ліки України. — 2005. — № 4. — С. 1-7.
3. Alexasnder C.M., Landsman P.B., Teutsch S.M., Haffner S.M. NCEP-Defined Metabolic Syndrome, Diabetes, and Prevalence of Coronary Heart Disease Among NHANES III Participants Age 50 Years and Older // Diabetes. — 2003. — Vol. 52. — P. 1210-1214.
4. Bakris G. Comparison of telmisartan vs. valsartan in the treatment of mild to moderate hypertension using ambulatory blood pressure monitoring // J. Clin. Hypertens. — 2002. — Vol. 4, –Suppl 1. — P. 26-31.
5. Barnett A.H. Preventing renal complications in diabetic patients: the Diabetics Exposed to Telmisartan And enalaprIL (DETAIL) study //Acta Diabetol. — 2005 — Vol. 42, Suppl 1. — S42-49.
6. Benson S.C., Pershadsingh H.A., Ho C.I., Chittiboina A. et al. Identification of telmisartan as a unique angiotensin II receptor antagonist with selective PPAR-γ-modulating activity // Hypertension. — 2004. — Vol. 43. — P. 1-10.
7. Böger R.H., Schwedhelm E., Maas R., Quispe-Bravo S., Skamira C. ADMA and oxidative stress may relate to the progression of renal disease: rationale and design of the VIVALDI study // Vasc. Med. — 2005. — Vol. 10, Suppl. 1. — S97-102.
8. Celi F.S., Shuldiner A.R. The role of peroxisome proliferator-activated receptor gamma in diabetes and obesity // Curr. Diab. Rep. — 2002. — Vol. 2. — P. 179-185.
9. Chen K., Chen J., Li D., Zhang X., Mehta J.L. Angiotensin II regulation of collagen type I expression in cardiac fibroblasts: modulation by PPAR-gamma ligand pioglitazone // Hypertension. — 2004. — Vol. 44. — P. 655-661.
10. Chrysant S.G., Chrysant G.S. and Desai A. Current status of angiotensin receptor blockers for the treatment of cardiovascular diseases: focus on telmisartan // Journal of Human Hypertension. — 2005. — Vol. 1. — P. 1-11.
11. Delles C., Raff U., Mimran A. at al. Effects of telmisartan and ramipril on adiponectin and blood pressure in patients with type 2 diabetes (TRENDY) // Am. J. Hypertens. — 2008. — Vol. 21(12). — P. 1330-1336.
12. Doumas M., Tsakiris A., Douma S. et al. Factors affecting the increased prevalence of erectile dysfunction in Greek hypertensive compared with normotensive subjects // J. Androl. — 2006. — Vol. 27(3). — P. 469-477.
13. Galle J., Schwedhelm E., Pinnetti S., Böger R.H., Wanner C.; VIVALDI investigators. Antiproteinuric effects of angiotensin receptor blockers: telmisartan versus valsartan in hypertensive patients with type 2 diabetes mellitus and overt nephropathy // Nephrol. Dial. Transplant. — 2008. — Vol. 23(10). — P. 3174-3183.
14. Gosse P., Schumacher H. Effect of telmisartan vs. ramipril on «dipping» status and blood pressure variability: pooled analysis of the PRISMA studies // Hypertens Res. — 2014. — Vol. 37(2). — P. 151-157.
15. da Cunha V., Tham D.M., Martin-McNulty B., Deng G., Ho J.J., Wilson D.W., Rutledge J.C., Vergona R., Sullivan M.E., Wang Y.X. Enalapril attenuates angiotensin II-induced atherosclerosis and vascular inflammation // Atherosclerosis. — 2005. — Vol. 178. — P. 9-17.
16. Doggrell S.A. Telmisartan — killing two birds with one stone // Expert Opin. Pharmacother. — 2004. — Vol. 5. — P. 2397-2400.
17. Elliott W.J., Meyer P.M. Incident diabetes in clinical trials of antihypertensive drugs: a network meta-analysis // Lancet. — 2007. — Vol. 369. — P. 201-207.
18. Genolet R., Wahli W., Michalik L. PPARs as drug targets to modulate inflammatory responses? // Curr. Drug Targets Inflamm. Allergy. — 2004. — Vol. 3. — P. 361-375
19. Guan Y. Peroxisome proliferator-activated receptor family and its relationship to renal complications of the metabolic syndrome // J. Am. Soc. Nephrol. — 2004. — Vol. 15. — P. 2801-2815.
20. Haffner S.M., Kennedy E., Gonzales C., Stem M.P., Miettienen H. A prospective analysis of the HOMA model: the Mexico City Diabetes Study // Diabetes Care. — 1996. — Vol. 19. — P. 1138-1141.
21. Honjo S., Nichi Y., Wada Y. et al. Possible beneficial effect of telmisartan on glycemic control in diabetic subjects // Diabetes Care. — 2005. — Vol. 28. — Р. 498.
22. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group // Lancet. — 1998. — Vol. 352. — P. 837-853.
23. Karin A.M. Jandeleit-Dahn, Christos Tikellis, Christopher M. Reid et al. Why blockade of the rennin-angiotensin system reduced the incidence of new-onset diabetes // Journal of Hypertension. — 2005. — Vol. 23. — P. 463-473.
24. Kawamura T., Yoshida K., Sugawara A., Nagasaka M., Mori N., Takeuchi K., Kohzuki M. Regulation of skeletal muscle peroxisome proliferator-activated receptor gamma expression by exercise and angiotensin-converting enzyme inhibition in fructose-fed hypertensive rats // Hypertens. Res. — 2004. — Vol. 27. — P. 61-70.
25. Kintscher U., Lyon C.J., Law R.E. Angiotensin II, PPAR-gamma and atherosclerosis // Front Biosci. — 2004. — Vol. 01. — P. 359-369.
26. Kota B.P., Huang T.H., Roufogalis B.D. An overview on biological mechanisms of PPARs // Pharmacol. Res. — 2005. — Vol. 51. — P. 85-94.
27. Lind L., Berne C., Lithell H. Prevalence of insulin resistance in essential hypertension // J. Hypertens. — 1995. — Vol. 13. — P. 1457-1462.
28. Makino H., Haneda M., Babazono T. еt al. INNOVATION Study Group. Microalbuminuria reduction with telmisartan in normotensive and hypertensive Japanese patients with type 2 diabetes: a post-hoc analysis of The Incipient to Overt: Angiotensin II Blocker, Telmisartan, Investigation on Type 2 Diabetic Nephropathy (INNOVATION) study // Hypertens Res. — 2008. — Vol. 31(4). — P. 657-664.
29. Manolis A.J., Reid J.L., de Zeeuw D., Murphy M.B., Seewaldt-Becker E., Köster J., ARAMIS Study Group. Angiotensin II receptor antagonist telmisartan in isolated systolic hypertension (ARAMIS) study: efficacy and safety of telmisartan 20, 40 or 80 mg versus hydrochlorothiazide 12.5 mg or placebo // J. Hypertens. — 2004. — Vol. 22(5) — P. 1033-1037.
30. Mancia G., Facchetti R., Bombelli M. еt al. Relationship of Office, Home, and Ambulatory Blood Pressure to Blood Glucose and Lipid Variables in the PAMELA Population // Hypertension. — 2005. — Vol. 45. — P. 1072.
31. Mancia G., Bombelli M., Corrao G. еt al. Metabolic Syndrome in the Pressioni Arteriose Monitorate E Loro Associazioni (PAMELA) Study // Hypertension. — 2007. — Vol. 49. — P. 40.
32. Mancia G., De Backer G., Dominiczak A. et al. 2007 Guidelines for the Management of arterial hypertension. The task force for the management of arterial hypertension of the European Society of Hypertension and of the European Society of Cardio–logy // J. Hypertension. — 2007. — Vol. 25. — P. 1105-1187.
33. Mancia G., Laurent S., Agabiti-Rosei E. et al. Reapparaisal of European guidelines on hypertension management: a European Society of Hypertension Task Force document // J. Hypertens. — 2009. — Vol. 27. — P. 2121-2158.
34. Michel M.C., Bohner H., Koster J. et al. Safety of telmisartan in patients with arterial hypertension: an open-label observational study // Drug Safety. — 2004. — Vol. 27. — Р. 335-344.
35. Miura Y., Yamamoto N., Tsunekawa S. et al. Replacement of valsartan and candesartan by telmisartan in hypertensive patients with type 2 diabetes: Metabolic and antiatherogenic consequences // Diabetes Care. — 2005. — Vol. 28. — Р. 757-758.
36. National Institutes of Health: Third Report of the National Cholesterol Education Program Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). — Washington, DC, US Govt. Printing Office, 2001 (NIH publ. no. 01-3670).
37. Ogawa H., Soejima H., Matsui K. еt al.; ATTEMPT-CVD investigators. A trial of telmisartan prevention of cardiovascular diseases (ATTEMPT-CVD): Biomarker study //Eur. J. Prev. Cardiol. — 2016. — Vol. 23(9). — P. 913-921.
38. Park C.G., Ahn T.H., Cho E.J. at al. Comparison of the Efficacy and Safety of Fixed-dose S-Amlodipine/Telmisartan and Telmisartan in Hypertensive Patients Inadequately Controlled with Telmisartan: A Randomized, Double-blind, Multicenter Study // Clin. Ther. — 2016. — Vol. 38(10). — P. 2185-2194.
39. Patel A.B., Kostis J.B., Wilson A.C., Shea M.L., Pressel S.L., Davis B.R. Long-term fatal outcomes in subjects with stroke or transient ischemic attack: fourteen-year follow-up of the systolic hypertension in the elderly program // Stroke. — 2008 — Vol. 39(4). — P. 1084-1089.
40. Pershadsingh H.A., Kurtz T.W. Insulin-sentizing effects of telmisartan: Implications for treatimg insulin-resistans hypertension and cardiovascular disease // Diabetes Care. — 2004. — Vol. 27. — P. 1015.
41. Reaven G.M., Lithell H., Landsberg L. Hypertension and associated metabolic abnormalities: the role of insulin resistance and the sympathoadrenal system // N. Engl. J. Med. — 1996. — Vol. 334. — P. 374-381.
42. Rippin J., Bain S.C., Barnett A.H. Rationale and design of diabetics exposed to telmisartan and enalapril (DETAIL) study // J Diabetes Complications. — 2002. — Vol. 16. — P. 195-200.
43. Rosano G.M., Vitale C., Castiglioni C. et al. Comparative effect of telmisartan and losartan on glucose metabolism in hypertensive patients with the metabolic syndrome // Circulation. — 2004. — Vol. 110, Suppl. 17. — Р. 606 (abstr. 2818).
44. Schupp M., Jance J., Clasen R. et al. Angiotensin type I receptor blockers induce proliferator-activated receptor-γ acti–vity // Circulation. — 2004. — Vol. 109. — Р. 2054-2057.
45. Kurtz T.W., Pravenec M. Antidiabetic mechanisms of ACE inhibitors and AII receptor antagonists: beyong the rennin-angiotensin system // Journal of Hypertension. — 2004. — Vol. 22. — Р. 1-9.
46. Kurtz T.W. Treating the metabolic syndrome: telmisartan as a peroxisome proliferator-activated receptor-gamma activator // Acta Diabetologica. — 2005. — Vol. 42. — S9-S16.
47. UK Prospective Diabetes Study Group. Tight blood pressure control and risk of macrovascular and microvascular complications in type 2 diabetes: UKPDS 38 // Br. Med. J. — 1998. — Vol. 317. — P. 703.
48. Velliquette R.A., Ernsberger P. Contrasting metabolic effects of antihypertensive agents // J. Pharmacol. Exp. Ther. — 2003. — Vol. 307. — P. 1104-1111.
49. Wang T.D., Chen W.J., Lin J.W. et al. Effects of rosiglitazone on endothelial function, C-reactive protein, and components of the metabolic syndrome in nondiabetic patients with the metabolic syndrome // Am. J. Cardiol. — 2004. — Vol. 93. — P. 362-365.
50. Young J.H., Klag M.J., Muntner P., Whyte J.L., Pahor M., Coresh J. Blood pressure and decline in kidney function: findings from the Systolic Hypertension in the Elderly Program (SHEP) // J. Am. Soc. Nephrol. — 2002. — Vol. 13(11). — P. 2776-2782.

/72-1.gif)
/74-1.gif)
/75-1.gif)
/76.gif)
/77-1.gif)
/78-1.gif)