Вступ
Гнійно-некротичні ураження нижніх кінцівок належать до одних з найчастіших хірургічних ускладнень цукрового діабету (ЦД), результати лікування яких не можна визнати задовільними. Синдром діабетичної стопи (СДС) спостерігається у 10–30 % хворих на ЦД і зумовлений розвитком остеоартропатії, ангіопатії та полінейропатії [1]. Прогноз у цієї категорії хворих несприятливий внаслідок високої частоти розвитку інфікованих виразок з подальшими ампутаціями кінцівок та інвалідизацією.
Трофічні виразки, інфекції і невропатична остео–артропатія Шарко — найсерйозніші ускладнення ЦД, які часто призводять до гангрени та ампутації нижніх кінцівок. Отже, СДС є однією з основних причин госпіталізації хворих на ЦД, знижує якість життя і супроводжується істотними економічними витратами.
Приблизно 50 % нетравматичних великих ампутацій у людей із ЦД передують діабетичні виразки стопи [1]. Навіть при успішному лікуванні трофічних виразок частота рецидивів становить 66 %. Понад 50 % пацієнтів з ампутаціями зазнають контралатеральної ампутації впродовж чотирьох років [3, 4].
Декілька великомасштабних досліджень із самооцінки якості життя пацієнтів показали, що втрата кінцівки більш негативно впливає на якість життя, ніж будь-яке інше ускладнення ЦД, у тому числі термінальна стадія ниркової недостатності або сліпота [5, 6]. Економічні витрати, пов’язані з ЦД, догляд за ногами (у т.ч. і після ампутації) становлять найбільшу категорію медичних витрат, пов’язаних із ЦД [6].
У розвинутих країнах виразково-некротичні процеси спостерігаються у 5–10 % хворих на ЦД. Загалом це становить близько 1 % хворих (число ампутацій у 15 разів більше, ніж у загальній популяції) [7].
Розробляються стратегії профілактики та управління, але їх реалізація залишається складною. Бар’єрами на цьому шляху є недостатній доступ до первинної медико-санітарної допомоги, переконання пацієнта і відсутність прихильності до медичної допомоги, затримки у визнанні наявності СДС, обмежені ресурси охорони здоров’я і практична гетерогенність фахівців [8]. Пізня діагностика, неадекватне лікування, а також відсутність чіткої системи міждисциплінарної допомоги призводять до високого числа необґрунтованих ампутацій у хворих на ЦД.
Причинами утворення хронічних виразок у пацієнтів із ЦД вважають травму, нейропатію, хронічну артеріальну або венозну недостатність нижніх кінцівок, системні захворювання сполучної тканини, ліпоїдний некробіоз, васкуліти, емболії, мікози, піодермії, дефіцит вітаміну В12 [9].
Умовами формування хронічної виразки є повторні травмування, класичним прикладом чого розглядається нейропатична виразка стопи у хворих на ЦД, ішемія (нейроішемічна та ішемічна форми СДС), наявність персистуючої хронічної місцевої інфекції, надлишкова продукція протеаз у рані та знижена активність факторів росту [7].
Мета дослідження: здійснити аналіз причин розвитку синдрому діабетичної стопи і негативних результатів лікування в амбулаторних умовах.
Матеріали та методи
Аналіз причин розвитку і негативних результатів лікування проведено у 142 хворих на ЦД із виразковими дефектами стоп, які звернулися в поліклініку Броварської центральної районної лікарні у період 2011–2016 рр. і перебували під спостереженням до січня 2016 року. Серед обстежених із ЦД 1-го типу було 28 хворих (20,1 %), ЦД 2-го типу — 110 хворих (79,9 %); жінки становили 38 % (53), чоловіки — 62 % (87). Критерієм включення в дослідження була наявність СДС. Тривалість спостереження становила від одного до восьми років і в середньому дорівнювала 5,2 ± 1,9 року. Використовували карту спостереження з детальною оцінкою анамнезу захворювання, способу життя, наявності шкідливих звичок та інших ускладнень ЦД.
Загальноклінічні дослідження включали загальні аналізи крові та сечі, розгорнутий біохімічний аналіз крові з використанням стандартних методів лабораторної діагностики. Стан компенсації вуглеводного обміну оцінювали за рівнем глікованого гемоглобіну (HbA1c) і глікемії натще. Здійснювали оцінку вмісту загального холестерину, холестерину ліпопротеїнів низької щільності, холестерину ліпопротеїнів високої щільності, тригліцеридів. Для оцінки згортальної системи крові визначали показники активного часткового тромбопластинового часу, протромбіновий індекс. Для об’єктивізації невропатичних скарг пацієнтів із СДС використовували шкали: Total Symptom Score (загальний симптоматичний рахунок, TSS) і візуальну аналогову шкалу (ВАШ). TSS містить оцінку в балах чотирьох симптомів: стріляючого болю, печії, парестезії та оніміння в ділянці стоп або гомілок (позитивні нейропатичні чутливі симптоми). Оцінка за TSS перебувала в межах від 0 (симптомів немає) до 14,78 бала (всі симптоми, що зберігаються практично постійно). За ВАШ маємо можливість оцінити больові відчуття пацієнта. Оцінку за цією шкалою проводили вимірюванням віддалі сантиметровою лінійкою з лівого краю до правого і виставляли бали больової симптоматики. За шкалою нейропатичних симптомів (Neuropathy Symptomatic Score — NSS) визначали наявність таких симптомів нейропатії, як поколювання, печія, ниючий біль, оніміння, судоми, гіперестезії.
Для оцінки ступеня сенсорного дефіциту використовували клінічні неврологічні тести, відображені в Neuropathy Disability Score (NDS) (Young M., 1993). Тактильна чутливість визначалася за допомогою 10 г монофіламенту. Тестування проводили в трьох загальноприйнятих зонах стопи.
Вібраційну чутливість оцінювали з допомогою градуйованого камертона, що вібрує з частотою 128 Гц. Камертон встановлювали в проекції верхівки I пальця, медіальної поверхні I плюснефалангового суглоба або медіальної кісточки. Результат вказували в октавах (8/8) та здійснювали інтерпретацію під шкалу NDS. Показники 6/8 і більше розцінювали як норму, менше 6/8 — свідчили про зниження вібраційної чутливості. Отримані дані заносили до шкали NDS.
Температурну чутливість оцінювали за здатністю пацієнта розрізняти дотик холодної і теплої частин спеціального приладу. Больову чутливість враховували за допомогою уколу неврологічною голкою в проекціях першого і п’ятого плюснефалангових суглобів і на підошовній поверхні великого пальця. Згідно зі шкалою NDS також проводили оцінку ахіллового рефлексу за стандартною методикою.
Інтерпретацію даних за шкалою NDS здійснювали згідно з рекомендаціями дослідницької групи Neurodiab при Європейській асоціації з вивчення ЦД. Діагноз полінейропатії не встановлювали, якщо сума балів була до 2; якщо сума балів — від 3 до 5, то це відповідає легкому ступеню сенсорних розладів, від 6 до 8 — середньому ступеню, а від 9 або 10 — тяжкому ступеню.
Оцінку стану магістрального кровотоку в нижніх кінцівках проводили за допомогою ультразвукової допплерографії Hitachi EUB-5500 (лінійним датчиком EUP-L54MA 13–6 МГц). Частота ультразвукового сигналу датчика становила 7,5 МГц. Оцінку кісточково-плечового індексу вираховували як відношення величини систолічного артеріального тиску (САТ) в артеріях нижньої кінцівки до величини САТ на плечовій артерії. Показник КПІ 0,98 і вище розглядався як норма; 0,70–0,97 — легкий ступінь ішемії; 0,40–0,69 — помірна ішемія; менше 0,4 — тяжка ішемія (Donnelly R. et al., 2000; Bowker J., Pfeifer M., 2001; TASC II, 2007). Оцінку виразкових дефектів проводили за методом, запропонованим W. His та ін. у 1993 році. Виразкові дефекти у пацієнтів також вимірювалися за даними площі ураження. Глибину виразкового дефекту визначали візуально та шляхом його зондування. Оцінювали наявність і характер перебігу інфекційного процесу (гострий, хронічний; легкий, середньої тяжкості та тяжкий перебіг).
Для об’єднання досліджуваних параметрів (наявність виразки, глибина виразки, наявність інфекції, ішемії кінцівки) була вибрана Техаська класифікація виразкових дефектів, запропонована L.A. Lavaery та ін. у 1996 році.
Результати дослідження
Упродовж періоду спостереження летальні випадки зареєстровані у 17 хворих, ампутації нижніх кінцівок з причини ЦД зазнало 19 пацієнтів. Ампутації пальців виконані у 61 % випадків, у межах стопи — у 15 % осіб, 6 % пацієнтів прооперовані на рівні гомілки та в 18 % випадків здійснена ампутація на рівні стегна (рис. 1). Найбільший ризик ампутації пов’язаний із деформацією стопи (відносний ризик = 4,92; p = 0,01). Показник комплементарності пацієнта менше 6 балів збільшує ризик у 2,3 раза (р = 0,03), наявність ампутації або виразки в анамнезі супроводжується збільшенням ризику в 1,9 і 1,7 раза відповідно (р = 0,04 і р = 0,002).
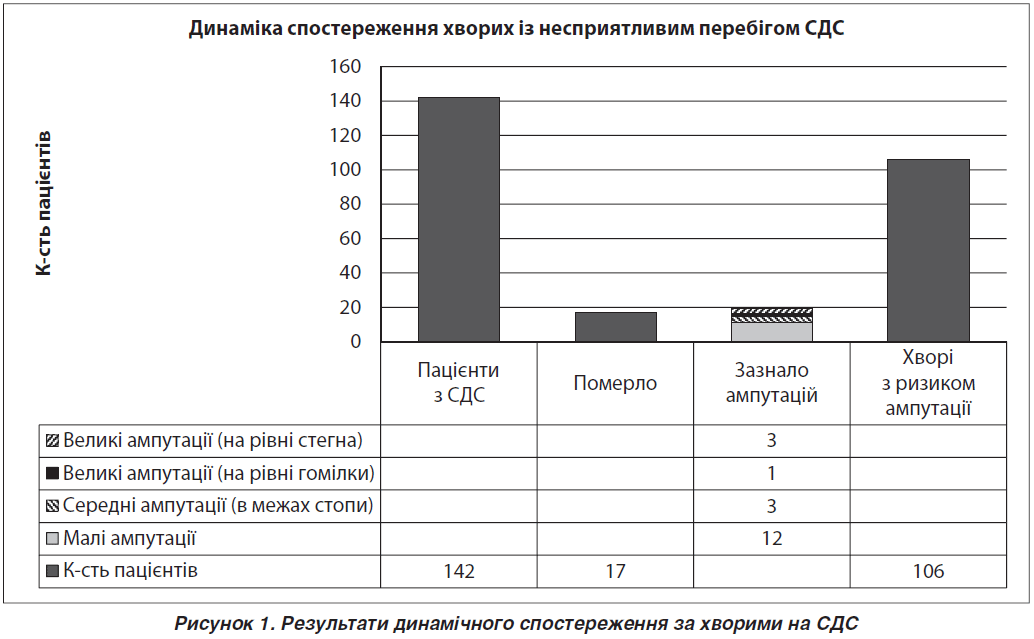
У переважного числа хворих при надходженні до стаціонару з приводу СДС відзначалася декомпенсація ЦД (середній рівень HbA1c — 9,47 ± 1,82 %), порушення ліпідного обміну (табл. 1). Із 142 хворих, включених у дослідження, лише 19 (13,4 %) отримували гіполіпідемічні препарати. Заслуговує на увагу факт наявності шкідливих звичок, які б могли вплинути на виникнення хронічних ускладнень ЦД, у тому числі СДС, у значної частини обстежених. Аналіз шкідливих звичок у хворих показав, що алкоголем зловживали 36 (25,4 %) пацієнтів. В обстеженій групі пацієнтів було 97 (68,3 %) хворих, які курили.
Обговорення
При аналізі поширеності провідних чинників ризику розвитку виразкових дефектів нами встановлено, що сенсомоторний дефіцит спостерігався у більшості обстежених пацієнтів. Ступінь вираженості неврологічного дефіциту за шкалою NDS в обстежених пацієнтів відповідав середньому ступеню (середній бал — 6,41 ± 1,06). Ці факти свідчать про те, що вже за одним чинником ризику у вигляді сенсомоторної нейропатії більшість обстежених пацієнтів мали високу вірогідність рецидиву СДС і появи нових виразкових дефектів. Однак на момент виявлення виразки зазвичай у пацієнтів було поєднання сенсомоторної нейропатії з іншими чинниками ризику — деформацією стоп, наявністю виразок і/або ампутацій в анамнезі.
Проведене нами дослідження показало, що ризик рецидивування виразок на ногах і ампутації кінцівок у людей із ЦД зменшується при навчанні пацієнтів, що підкреслює важливість рутинної профілактики, якісної медичної допомоги, з досягненням адекватного глікемічного контролю, цільових значень ліпідного спектра крові, артеріального тиску. Це значно поліпшує віддалений прогноз захворювання (зменшення рецидивування виразкових дефектів стоп).
Тому доцільно виділити групу ризику стосовно несприятливого перебігу СДС із ризиком ампутації, до якої належать хворі з глибокими виразковими дефектами.
Висновки
У більшості хворих на ЦД при надходженні до стаціонару з приводу СДС відзначається тривала декомпенсація вуглеводного обміну, порушення ліпідного метаболізму і супутня серцево-судинна патологія.
На момент виявлення виразки у більшості пацієнтів спостерігається поєднання сенсомоторної нейропатії з іншими чинниками ризику — деформацією стоп, наявністю виразок і/або ампутацій в анамнезі. Розвиток пізніх ускладнень ЦД, таких як полінейропатія, макроангіопатія і дегенеративні зміни опорно-рухової системи, в сукупності з низкою зовнішніх (травма, інфекція) і внутрішніх факторів (низька комплаєнтність хворого) призводять до формування тієї чи іншої форми синдрому діабетичної стопи.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Iraj B., Khorvash F., Ebneshahidi A., Askari G. Prevention of diabetic foot ulcer // Int. J. Prev. Med. — 2013. — Vol. 4. — P. 373-376.
2. Shahbazian H., Yazdanpanah L., Latifi S.M. Risk assessment of patients with diabetes for foot ulcer saccording to risk classification consensus of International Working Group on Diabetic Foot (IWGDF) // Pak. J. Med. Sci. — 2013. — Vol. 29. — P. 730-734.
3. Shaw J.E., Sicree R.A., Zimmet P.Z. Global estimates of the prevalence of diabetes for 2010 and 2030 // Diabetes Res. Clin. Pract. — 2010. — Vol. 87. — P. 4-14.
4. Aalaa M., Malazy O.T., Sanjari M. et al. Nurses’ role in diabetic foot prevention and care; a review // J. Diabetes Metab. Disord. — 2012. — Vol. 11. — P. 24.
5. Alavi A., Sibbald R.G., Mayer D. et al. Diabetic foot ulcers: Part II. Management // J. Am. Acad. Dermatol. — 2014. — Vol. 70(21); quiz 21.e1-2124.
6. Cavanagh P.R., Lipsky B.A., Bradbury A.W., Botek G. Treatment for diabetic foot ulcers // Lancet. — 2005. — Vol. 366. — P. 1725-1735.
7. Nather A., Bee C.S., Huak C.Y. et al. Epidemiology of diabetic foot problems and predictive factors for limbloss // J. Diabetes Complications. — 2008. — Vol. 22. — P. 77-82.
8. Bakri F.G., Allan A.H., Khader Y.S. et al. Prevalence of Diabetic Foot Ulcer and its Associated Risk Factor samong Diabetic Patientsin Jordan // J. Med. J. — 2012. — Vol. 46. — P. 118-125.
9. Bortoletto M.S., de Andrade S.M., Matsuo T. et al. Risk factors for foot ulcers a cross sectional survey from a primary care setting in Brazil // Prim. Care Diabetes. — 2014. — Vol. 8. — P. 71-76.
10. Waaijman R., de Haart M., Arts M.L. et al. Risk factors for plantar foot ulcer recurrence in neuropathic diabetic patients // Diabetes Care. — 2014. — Vol. 37. — P. 1697-1705.
11. Monteiro-Soares M., Boyko E.J., Ribeiro J. et al. Predictive factors for diabetic foot ulce ration: a systematic review // Diabetes Metab. Res. Rev. — 2012. — Vol. 28. — P. 574-600.