Резюме
Актуальність. Уроджений гіпотиреоз (УГ), як найбільш поширена спадкова патологія щитоподібної залози (ЩЗ), накладає серйозний соціальний, економічний та психологічний тягар як на сім’ю, у якій народилася хвора дитина, так і на суспільство. Мета дослідження — встановити частоту та виявити клінічні особливості різних форм УГ у дітей. Матеріали та методи. Проаналізовано медичну документацію 22 хворих на УГ (14 дівчаток, 8 хлопчиків) віком від одного місяця до шести років (основна група) та 20 здорових дітей відповідного віку з оцінкою їх фізичного й нервово-психічного розвитку. Усім дітям проводилися ультразвукове дослідження ділянки шиї, визначення тиреотропного гормона (ТТГ), вільного тироксину (вТ4), тиреоглобуліну, антитіл до тиреоглобуліну, непряма ларингоскопія. Клінічні ознаки УГ в періоді новонародженості оцінювалися в балах за шкалою Апгар. Статистичний аналіз даних проводився з використанням програми Statistica 6.0. Результати. Дистопія ЩЗ діагностована в 59,1 %, зокрема: в під’язикову ділянку (5 випадків), корінь язика (2), підщелепну ділянку (2), яремну ямку (1), не уточнено (2). Стан атиреозу не встановлено. У типовому місці ЩЗ візуалізувалася в трьох пацієнтів. Медіана ТТГ на першому етапі скринінгу в дітей основної групи становила 38 мОд/л (24,2–122,4 мОд/л), у групі порівняння — 2,03 мОд/л (1,7–2,6 мОд/л). Рівень вТ4 коливався від 0,49 до 14,7 пмоль/л, у середньому становив 2,37 пмоль/л. У третини дітей із УГ встановлено відставання в емоційному розвитку, супутню соматичну патологію, у 13,6 % дітей були виявлені уроджені вади розвитку інших органів (гідронефроз, подвоєння нирок, двосторонні пахові грижі). У 40,9 % хворих з УГ родичі страждали від захворювань ЩЗ. Висновки. Серед різних форм УГ найчастіше трапляється дистопія ЩЗ (59,1 %). Вірогідних відмінностей у рівнях ТТГ і вТ4 у дітей із дистопією ЩЗ і дітей із типово розташованою залозою не виявлено. Кількість клінічних ознак не залежала від віку дитини на момент встановлення діагнозу та форми гіпотиреозу. У дітей з УГ встановлено запізніле формування рухових навичок, емоційних реакцій, компонентів пізнавальної діяльності. Більше ніж третина дітей з уродженим гіпотиреозом мають супутню соматичну патологію.
Актуальность. Врожденный гипотиреоз (ВГ), как наиболее распространенная наследственная патология щитовидной железы (ЩЖ), накладывает серьезный социальный, экономический и психологический
груз как на семью, где родился больной ребенок, так и на общество. Цель исследования — установить частоту и выявить клинические особенности различных форм врожденного гипотиреоза у детей. Материалы и методы. Проанализирована медицинская документация 22 больных с ВГ (14 девочек, 8 мальчиков) в возрасте от одного месяца до шести лет (основная группа) и 20 здоровых детей соответствующего возраста с оценкой их физического и нервно-психического развития. Всем детям проводились ультразвуковое исследование области шеи, определение тиреотропного гормона (ТТГ), свободного тироксина (свТ4), тиреоглобулина, антител к тиреоглобулину, непрямая ларингоскопия. Клинические признаки ВГ в периоде новорожденности оценивались в баллах по шкале Апгар. Статистический анализ данных проводился с использованием программы Statistica 6.0. Результаты. Дистопия ЩЖ диагностирована у 59,1 %, в том числе: в подъязычную область (5 случаев), корень языка (2), подчелюстную область (2), яремную ямку (1), не уточнено (2). Состояние атиреоза не установлено. В типичном месте ЩЖ визуализировалась у трех пациентов. Медиана ТТГ на первом этапе скрининга у детей основной группы составила 38 мЕд/л (24,2–122,4 мЕд/л), в группе сравнения — 2,03 мЕд/л (1,7–2,6 мЕд/л). Уровень свТ4 колебался от 0,49 до 14,7 пмоль/л, в среднем 2,37 пмоль/л. У трети детей с ВГ установлены отставание эмоционального развития, сопутствующая соматическая патология, у 13,6 % детей были обнаружены врожденные пороки развития других органов (гидронефроз, удвоение почек, двусторонние паховые грыжи). У 40,9 % больных с ВГ родственники страдали заболеваниями ЩЖ. Выводы. Среди различных форм ВГ чаще всего встречается дистопия ЩЖ (59,1 %). Достоверных различий в уровнях ТТГ и свТ4 у детей с дистопией ЩЖ и детей с типично расположенной ЩЖ не обнаружено. Количество клинических признаков не зависело от возраста ребенка на момент постановки диагноза и формы гипотиреоза и варьировало от их отсутствия до наличия одновременно семи симптомов. У детей с врожденным гипотиреозом установлено запоздалое формирование двигательных навыков, эмоциональных реакций, компонентов познавательной деятельности. Более трети детей с врожденным гипотиреозом имеют сопутствующую соматическую патологию.
Background. Congenital hypothyroidism (CH) as the most common hereditary thyroid pathology is a serious social, economic and psychological burden for a family, where the sick child was born, as well as for the society. The purpose of our study was to evaluate the disease incidence and to detect the clinical features of various forms of congenital hypothyroidism in children. Materials and methods. Twenty two medical records of patients with CH (14 girls, 8 boys) aged 1 month to 6 years (experimental group) and 20 healthy children of the correspondent age were analyzed, and the further assessment of their physical and neuropsychological development was conducted. All children underwent the ultrasound examination of the neck region, indirect laryngoscopy; thyroid-stimulating hormone (TSH), thyroglobulin antibodies, free thyroxine (fT4), thyroglobulin tests were also performed. Clinical signs of CH in the neonatal period were estimated according to the Apgar scores. Statistical analysis was performed with the aid of the Statistica 6.0 program. Results. The thyroid dystopia was diagnosed in 59.1 % of cases, in particular: in the hyoid area (5), the root of the tongue (2), submandibular area (2), jugular fossa (1), unspecified (2). The median of TSH in the first stage of screening in children of the main group was 38 mU/l (24.2–122.4 mU/l), in the comparison group — 2.03 mU/l (1.7–2.6 mU/l). The fT4 level ranged from 0.49 to 14.7 pmol/l, on average — 2.37 pmol/l. The number of clinical signs was not dependent on the age neither on the form of hypothyroidism at the moment of diagnosis. With age, children’s development increasingly lags behind those of correspondent age contributing to further development of fine motor delay. In 40.9 % of patients with CH, the relatives suffered from thyroid disease. Conclusions. The thyroid dystopia is the most common among various forms of congenital hypothyroidism (59.1 %). The reliable differences in TSH and fT4 levels were not found in children with thyroid dystopia and those with typically located thyroid gland. The number of clinical signs was not dependent on the age neither on the form of hypothyroidism at the moment of diagnosis and varied from their absolute absence to presence of seven symptoms at the same time. A delayed formation of motor skills, emotional reactions, the components of cognitive activity was observed in children with congenital hypothyroidism. More than one-third of children with congenital hypothyroidism have concomitant somatic pathology. The predominant lesions of any organs and systems and dependence of the nature of comorbidity on the etiology of congenital hypothyroidism were not observed. In 13.6 % of children, the congenital malformations of other organs were found, mainly in patients with congenital hypothyroidism caused by thyroid dystopia.
Вступ
Уроджений гіпотиреоз (УГ), як найбільш поширена спадкова патологія щитоподібної залози (ЩЗ), накладає серйозний соціальний, економічний та психологічний тягар як на сім’ю, у якій народилася хвора дитина, так і на суспільство [1]. Це тяжке ендокринне захворювання дитячого віку зумовлене зниженням функції ЩЗ у результаті дефіциту тирео–їдних гормонів або периферичною резистентністю до них в організмі дитини [2].
У регіонах зобної ендемії істотно підвищується ризик народження дітей з УГ порівняно із загальними показниками в популяції. Дефіцит тиреоїдних гормонів призводить до уповільнення розвитку мозку, зменшення кількості нейронів і гліальних клітин, зниження вмісту мієліну, зниження щільності аксонів і синапсів, що впливає на психомоторний, мовленнєвий та інтелектуальний розвиток дитини [3].
Вважається, що УГ — найчастіша причина затримки розумового розвитку. Якщо хворобу вчасно не діагностувати, викликані нею порушення стають необоротними. Фатальним змінам у нервовій і кістковій системах, затримці росту й розвитку дитини можна запобігти лише своєчасним призначенням замісної терапії тиреоїдними гормонами [4].
Частота УГ коливається від 1 випадку на 4000–5000 немовлят у Європі й Північній Америці до 1 випадку на 6000–7000 новонароджених у Японії [5–8]. За статистичними даними МОЗ України, поширеність гіпотиреозу в дітей не перевищує 0,035 %. Однак відносно невисокий показник може бути пояснений низьким рівнем діагностики даного патологічного стану внаслідок варіабельності й низької специфічності його симптомів.
Термін «уроджений гіпотиреоз» у даний час використовується для позначення гіпотиреозу будь-якого генезу, що маніфестує й діагностується при народженні. З метою ранньої діагностики УГ у багатьох країнах світу проводиться неонатальний скринінг [9]. Початковим пріоритетом неонатального скринінгу на УГ є виявлення всіх форм первинного гіпотиреозу. Найбільш чутливим тестом для визначення первинного гіпотиреозу є визначення концентрації тиреотропного гормона (ТТГ). Особлива увага приділяється відбору спеціальних категорій новонароджених із підвищеним ризиком УГ: недоношені новонароджені діти; діти з низькою й дуже низькою масою тіла при народженні; хворі діти з недоношених новонароджених, які знаходяться в неонатальних відділеннях інтенсивної терапії; багаторазові пологи (зокрема, одностатеві близнюки).
В основі більшості випадків (70–85 %) УГ лежать уроджені аномалії розвитку ЩЗ, значно рідше (5–20 %) — дисгормоногенез (уроджені дефекти біосинтезу гормонів включають порушення захвату, органіфікації, зв’язування йоду, зміни активності дейодиназ і аномалії синтезу, накопичення та вивільнення тиреоглобуліну (ТГ)) [9].
Виділяють такі форми уродженої аномалії ЩЗ: відсутність функціонуючої тканини ЩЗ в організмі (атиреоз, агенезія); атипово розташована ЩЗ (ектопія, дистопія); недорозвинення й зменшення розмірів ЩЗ (гіпоплазія). Частота різних форм дисгенезії ЩЗ може варіювати (ектопія — від 45 до 62 %, агенезія — від 13 до 35 %, гіпоплазія — від 2 до 5 %) [10]. При використанні декількох методів діагностики (визначення рівня ТТГ, ТГ, ультра–звукове дослідження (УЗД) ЩЗ, сцинтиграфія ЩЗ) частота виявлення різних форм змінюється, а саме: ектопія — 17–25 %, агенезія — 45–56 %, гіпоплазія — 15–20 %. У літературі описані ексклюзивні випадки ектопії тиреоїдної тканини в місця, віддалені від шляху міграції ЩЗ, зокрема інтракардіально, субдіафрагмально, у стінку дванадцятипалої кишки, ворота печінки, жовчний міхур [11]. У цих випадках можна припустити аномальну міграцію або гетеротопічне диференціювання незрілих ендодермальних клітин. Біохімічним маркером наявності тиреоїдної тканини в організмі є ТГ [12]. Його концентрація в сироватці крові хворих із первинним УГ вказує на наявність тканини ЩЗ і ступінь її активності.
Мета дослідження — встановити частоту та виявити клінічні особливості різних форм уродженого гіпотиреозу в дітей.
Матеріали та методи
Проаналізовано медичну документацію 22 хворих на УГ (14 дівчаток, 8 хлопчиків) віком від 1 до 14 років (основна група). Для порівняння проаналізовано результати обстеження 20 дітей віком від 1 місяця до 6 років з оцінкою їх фізичного й нервово-психічного розвитку. Критерії відбору осіб для дослідження включали: встановлений раніше діагноз первинного УГ за програмою неонатального скринінгу, проживання на території Чернівецької області, вік 1–14 років.
УЗД ділянки шиї проводилося в режимі реального часу на стаціонарному сканері Siemens Sonoline 450, укомплектованому лінійним датчиком частотою 7,5 МГц з визначенням локалізації, розмірів, структури й ехогенності тиреоїдної тканини. Визначення ТТГ (референтний інтервал: 0,4–4,5 мОд/л), вільного тироксину (вТ4) (референтний інтервал: 9,14–23,8 пмоль/л), антитіл до тиреоглобуліну (референтний інтервал: 0–34 мМО/л) у сироватці крові проводилося на імунохімічному аналізаторі Axsym® (Abbott Diagnostic Division, США). Рівень тиреоглобуліну визначався методом імуноферментного аналізу за допомогою наборів Orgentic Тg (Німеччина) (референтний інтервал: 0,0–40,0 нг/мл). З метою визначення локалізації дистопічно розташованої ЩЗ діти оглядалися оториноларингологом із проведенням непрямої ларингоскопії. Для визначення різних форм УГ користувалися такими критеріями: дистопія — визначення в нетипових місцях ЩЗ методом УЗД, рівень ТГ крові > 0 нг/мл; атиреоз/агенезія — ЩЗ не визначається при УЗД, ТГ крові — 0 нг/мл; гіпоплазія — визначається ЩЗ зменшених розмірів у типовому місці при УЗД, ТГ крові > 0 нг/мл; дисгормоногенез — визначення ЩЗ нормальних або збільшених розмірів у типовому місці при УЗД, ТГ крові > 0 нг/мл.
Клінічні ознаки УГ у періоді новонародженості оцінювалися в балах за шкалою Апгар, що включала 10 ознак: набряк обличчя (2 бали), запори (2 бали), пупкова грижа (2 бали), блідість шкіри (1 бал), жовтяниця понад 3 тижні (1 бал), м’язова слабкість (1 бал), збільшення язика (1 бал), відкрите мале тім’ячко (1 бал), маса тіла при народженні понад 3500 г (1 бал), вагітність понад 40 тижнів (1 бал).
Нервово-психічний розвиток дітей оцінювали таким чином: на першому році життя за допомогою скринінгової кількісно-якісної методики (Журба Л.Т., Мастюкова О.М., 1981), що містить 10 показників (голосові реакції, сенсорні та сенсорно-моторні реакції, безумовні рефлекси, наявність асиметричного шийного тонічного рефлексу, ланцюгових симетричних рефлексів, стан м’язового тонусу, черепно-мозкових нервів, малі аномалії
розвитку, наявність патологічних рухів, комуніка–тивність), у віці від одного до трьох років викорис–товували методичні рекомендації для оцінки психомоторного розвитку дітей раннього віку (Пана–сюк А.Ю., Бударева Л.А., 1984).
Статистичний аналіз даних проводився з вико–ристанням програми Statistica 6.0. Для опису виборок розраховували медіану, верхній і нижній квартилі. Порівняння значень показників у двох вибірках проводили за допомогою критерію Манна — Уїтні. Для аналізу залежності між показниками розраховували коефіцієнт кореляції Спірмена й оцінювали його статистичну значимість (р < 0,05).
Результати
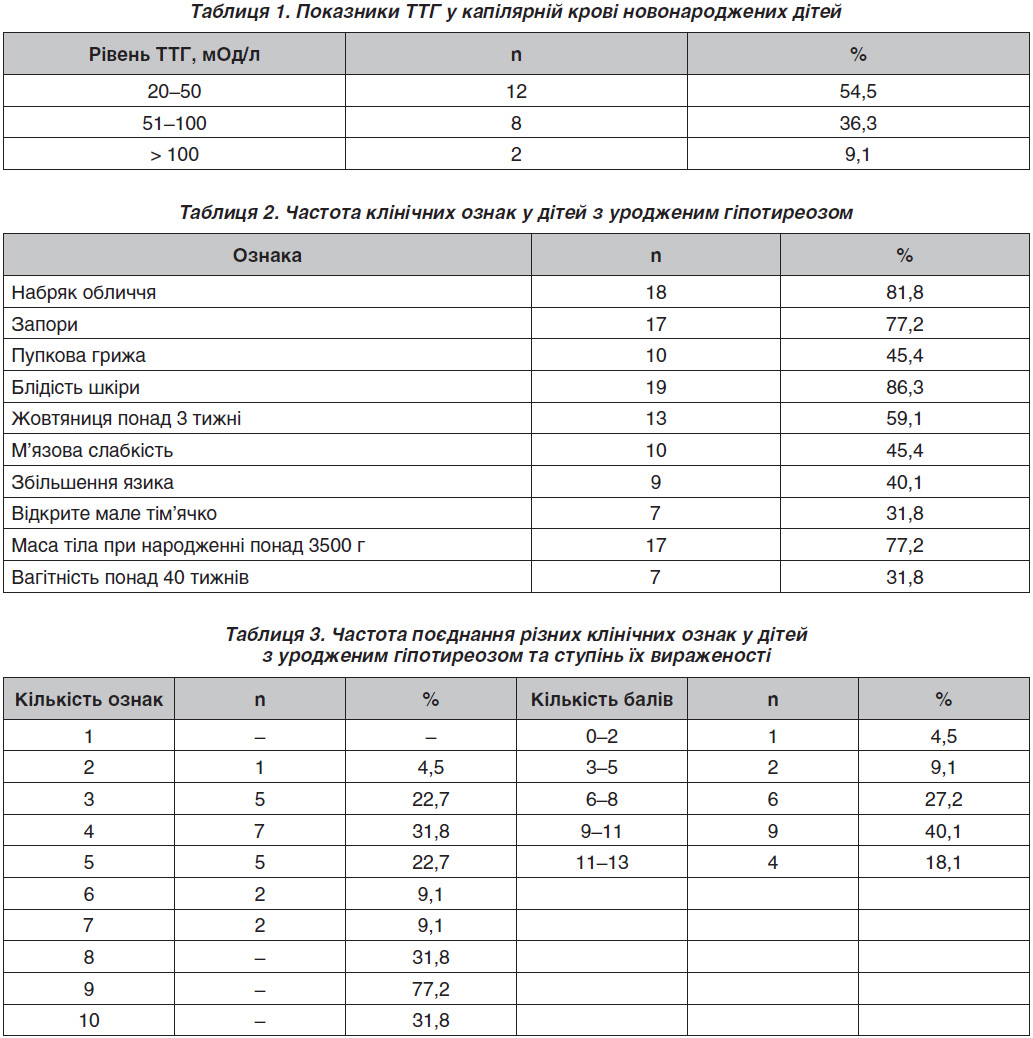
Серед 22 хворих дистопія ЩЗ діагностована в 59,1 %, зокрема: в під’язикову ділянку (5 випадків), корінь язика (2), підщелепну ділянку (2), яремну ямку (1), не уточнено (2). Наявність ЩЗ у нетиповому місці без визначення іншої локалізації підтверджувалася підвищеним рівнем ТГ. Стану атиреозу (повна відсутність функціонуючої тканини ЩЗ) не встановлено. У типовому місці ЩЗ візуалізувалася в трьох пацієнтів: в одного ЩЗ розташована в типовому місці, однак її об’єм збільшений, а рівень ТГ підвищений, що вказує на можливий дисгормоногенез, у шести дітей об’єм ЩЗ зменшений, що було розцінено нами як гіпоплазія ЩЗ.
Показники ТТГ у капілярній крові новонароджених дітей наведені в табл. 1. Медіана ТТГ на першому етапі скринінгу в дітей основної групи становила 38 мОд/л (24,2–122,4 мОд/л), у групі порівняння — 2,03 мОд/л (1,7–2,6 мОд/л). Рівень вТ4 коливався від 0,49 до 14,7 пмоль/л, у середньому — 2,37 пмоль/л. Вірогідних відмінностей у рівнях ТТГ і вТ4 у дітей із дистопією ЩЗ і у дітей із типово розташованою ЩЗ не виявлено.
Клінічні симптоми на момент встановлення діагнозу УГ змінювалися від їх відсутності до наявності одночасно семи симптомів (табл. 2, 3).
Кількість клінічних ознак не залежала від віку дитини на момент встановлення діагнозу та форми гіпотиреозу.
Аналізуючи розвиток статомоторних функцій, виявили, що з віком діти все більше відставали за термінами розвитку, що впливало надалі на затримку розвитку дрібної моторики. У третини дітей з УГ встановлено відставання в емоційному розвитку. Такі сенсорні реакції, як зорова фіксація, слухове зосередження, типові для цього віку, викликалися непостійно в кожної четвертої дитини з УГ. Уже в перші 3 місяці життя запізнювалося формування емоційних симптомокомплексів і способів взаємодії з дорослими.
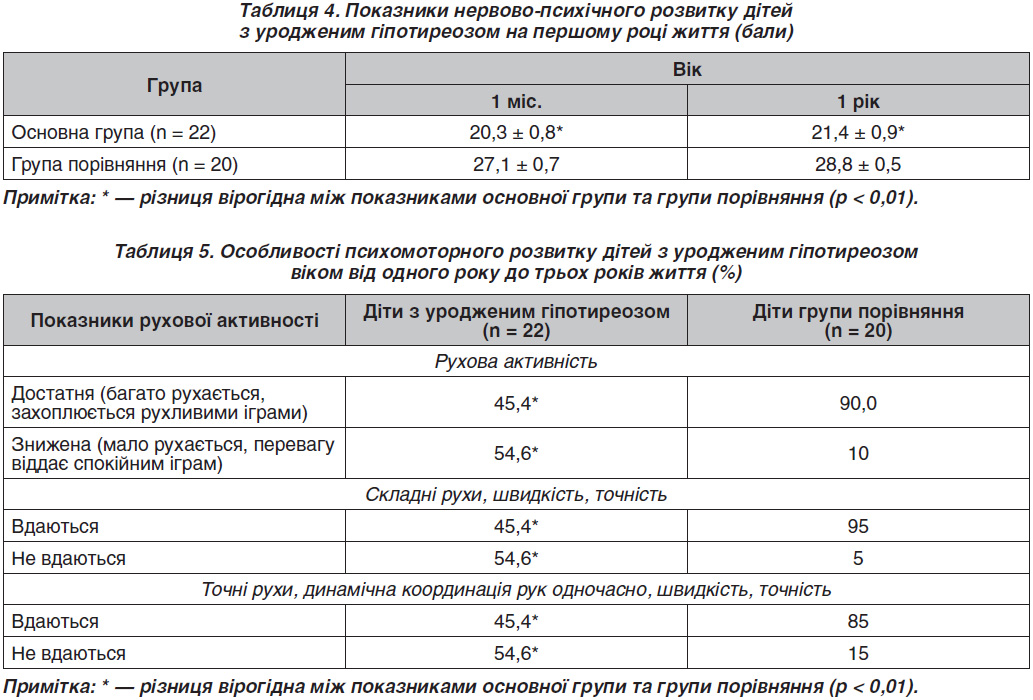
На першому році життя середні показники кількісної оцінки нервово-психічного розвитку дітей з УГ були істотно нижчими порівняно з конт–ролем (середня сума балів 20,3 ± 0,8 проти 27,1 ± 0,7
у групі порівняння, табл. 4). У дітей із високим рівнем ТТГ при народженні (> 50 мОд/л) реєструвалися нижчі показники психічного розвитку в такі вікові періоди (19,6 ± 0,2 бала). У двох дітей із показником ТТТ понад 100 мОД/л визначено затримку нервово-психічного розвитку (18,8 ± 0,2 бала). Лише 54,5 % дітей основної групи на першому році життя мали нормальний рівень нервово-психічного розвитку.
Відзначено затримку передмовленнєвого розвитку: поява гуління (з 5–6 місяців) спостерігалося лише в 7 (31,8 %) дітей із УГ, на той час як у групі порівняння цей показник спостерігався в 85 % дітей. Лепет характеризувався одноманітними звуковими поєднаннями. До 10 місяців життя діти з УГ не вимовляли слова, в 1 рік таких дітей було 81,6 %. Лише двоє дітей із УГ мали у своєму активному словнику 2–3 слова. Фразове мовлення з двох слів з’явилося до 1,5 року в 9,1 % дітей, на той час як формування фразового мовлення спостерігалося в 95 % дітей групи порівняння (р < 0,001). В усіх дітей з УГ зазначалося запізнювання всіх етапів становлення мовленнєвої функції, у них була відсутня інтонація прохання й питання в звукопоєднаннях, слабко виражена інтонаційно-мелодична імітація фрази.
Більше половини дітей з УГ відрізнялися пасивністю, малорухомістю (табл. 5). Лише 45,4 % дітей могли здійснювати одночасно статичну й динамічну координацію рук.
Більше третини дітей з УГ мали супутню соматичну патологію, у тому числі зі сторони сечовидільної системи — у 7 хворих, дигестивної — у 8 осіб, імунної — у 4 осіб, дихальної — у 3 осіб, серцево-судинної — у 5 осіб, ендокринної — у 2 осіб. Переважаючого ураження будь-яких органів і систем, а також залежності характеру супутньої патології від етіології УГ не відзначено. У 13,6 % дітей були виявлені уроджені вади розвитку інших органів (гідронефроз, подвоєння нирок, двосторонні пахові грижі), в основному у хворих на УГ, зумовлений дистонією ЩЗ. Це узгоджується з результатами інших досліджень, у яких показано, що серед пацієнтів із дисгенезією ЩЗ частота уроджених вад інших органів становить від 5 до 16 % [13, 14].
Обговорення
У науковій медичній літературі відзначається висока частота кіст ЩЗ. При цьому передбачається зв’язок їх походження з персистенцією щитопід’язикової протоки, кістозною дегенерацією кластерів фолікулярних клітин, що відокремилися від диcгенетичної ЩЗ і завершили міграцію до місця звичайного положення ЩЗ [11, 15]. У нашому дослідженні встановлено 2 випадки (9,1%) брахіогенних кіст шиї в поєднанні з дистопією ЩЗ.
При аналізі генеалогічного анамнезу виявлено, що у 40,9 % хворих із УГ родичі страждали від захворювань ЩЗ, переважно це особи жіночої статі, зокрема матері. Серед більш віддалених родичів (другого, третього, четвертого ступенів спорідненості) від патології ЩЗ також частіше страждали жінки (65 %). Однак у цьому дослідженні враховувалися тільки анамнестичні дані. Для більш точної оцінки сімейної складової щодо захворювань ЩЗ, мікроаномалій розвитку ЩЗ потрібні додаткові обстеження.
Отже, застосування комплексного діагностичного підходу, що включає УЗД ділянки шиї, визначення рівня тиреоглобуліну крові, дозволяє надійно диференціювати основні форми уродженого гіпотиреозу.
Висновки
1. Серед різних форм уродженого гіпотиреозу найчастіше трапляється дистопія щитоподібної залози (59,1 %).
2. Вірогідних відмінностей у рівнях ТТГ і вТ4 у дітей із дистопією щитоподібної залози й дітей із типово розташованою щитоподібною залозою не виявлено.
3. Кількість клінічних ознак не залежала від віку дитини на момент встановлення діагнозу й форми гіпотиреозу та змінювалася від їх відсутності до наявності одночасно семи симптомів.
4. У дітей із уродженим гіпотиреозом встановлено запізніле формування рухових навичок, емоційних реакцій, компонентів пізнавальної діяльності.
5. Більше третини дітей із уродженим гіпотирео–зом мають супутню соматичну патологію. Переважаючого ураження будь-яких органів і систем, а також залежності характеру супутньої патології від етіології уродженого гіпотиреозу не відзначено. У 13,6 % дітей виявлені уроджені вади розвитку інших органів, в основному у хворих на уроджений гіпотиреоз, зумовлений дистопією щитоподібної залози.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Каминский А.В. Проблема йодного дефицита в Украине: профилактика у детей, беременных и взрослых // А.В. Каминский, А.Н. Коваленко, Е.В. Теплая // Международный эндокринологический журнал. — 2011. — № 6(38). — С. 18-22.
2. Бруно Де Бенуа, Швец О.В. Устранение дефицита йода — одна из ключевых задач здравоохранения // Международный эндокринологический журнал. — 2011. — № 6(38). — С. 9-17.
3. Pardo Campos M.L. Cognitive profiles of patients with early detected and treated congenital hypothyroidism / M.L. Pardo Campos, M. Musso, A. Keselman // Arch. Argent. Pediatr. — 2017. — Vol. 115(1). — С.12-17.
4. Жуков А.О. Вызванные дефицитом йода задержка психического развития и синдром дефицита внимания / А.О. Жуков // Журнал неврологии и психиатрии. — 2007. — № 6. — С. 4-16.
5. Ford G. Screening for congenital hypothyroidism: a worldwide view of strategies / G. Ford, S.H. LaFranchi // Best Pract. Res Clin. Endocrinol. Metab. — 2014. — Vol. 28(2). — P. 175-187.
6. Loeber J.G. Neonatal screening in Europe; the situation in 2004 / J.G. Loeber // Journal of Inherited Metabolic Diseases. — 2007. — Vol. 30. — P. 430-438.
7. Bastug O. Thyroid status of iodine deficient newborn infants living in central region of Turkey: a pilot study / O. Bastug, L. Korkmaz, H. Halis [et al.] // World J. Pediatr. — 2017. — Vol. 14. — P. 34.
8. Parks J.S. The impact of transient hypothyroidism on the increasing rate of congenital hypothyroidism in the United States / J.S. Parks, M. Lin, S.D. Grosse [et al.] // Pediatrics. — 2010. — Vol. 125. — P. 54-63.
9. Hopfner S., Koehler N., Hopfner B., Rauterberg E.W. Neonatal screening for congenital hypothyroidism in Germany. The development of concerned children in retrospect analysis using the federal state «Hessen» / S. Hopfner, N. Koehler, B. Hopfner, E.W. Rauterberg // Klin. Pediatr. — 2007. — Vol. 219, № 4. — P. 206-211.
10. Насирова У.Ф. Влияние дефицита йода на состояние щитовидной железы и нервно-психическое развитие детей с неонатальным транзиторным гипотиреозом / У.Ф. Насирова // Проблемы эндокринологии. — 2006. — № 5. — С. 15-17.
11. Fagman H. Morphogenetics of early thyroid development / H. Fagman, M. Nilsson // Mol. Endocrinol. — 2011. — Vol. 46. — P. 33-42.
12. Zimmermann M.B. Thyroglobulin is a sensitive measure of both deficient and excess iodine intakes in children and indicates no adverse effects on thyroid function in the UIC range of 100-299 µg/L: a UNICEF/ICCIDD study group report / M.B. Zimmermann I. Aeberli, M. Andersson [et al] // J. Clin. Endocrinol. Metab. — 2013. — Vol. 98. — P. 1271-1280.
13. Kollati Y. Hypothyroidism: Facts, Facets and Therapy / Y. Kollati, R.R. Ambati, P.N. Reddy [et al.] // Curr. Pharm. Des. — 2017. — Vol. 6. — P. 23.
14. Rastogi M.V. Congenital hypothyroidism / M.V. Rastogi, S.H. LaFranchi // Orphanet J. Rare Dis. — 2010. — Vol. 5. — P. 17.
15. Peiris A.N. Psychiatric manifestations of thyroid disease / A.N. Peiris, E. Oh, S. Diaz // J. South Med. — 2007. — Vol. 100, № 8. — P. 773-774.