Резюме
Актуальність. Збільшення тривалості життя пацієнтів із травмою хребта та спинного мозку (ТХСМ) привернуло увагу до пізніх ускладнень ТХСМ, зокрема до остеопорозу. Мета дослідження — оцінити структурно-функціональний стан та показники метаболізму кісткової тканини в пацієнтів із ТХСМ через 5 та більше років після травми. Матеріали та методи. Були обстежені 73 особи (38 чоловіків та 35 жінок) з тетра- або параплегією внаслідок ТХСМ та 57 практично здорових осіб. Ультразвукову денситометрію п’яткової кістки проводили за допомогою кількісного кісткового ультрасонометра Sahara (Hologic Inc., model 04874, 2008). Визначення маркерів ремоделювання кісткової тканини та вітаміну D у периферичній крові виконували за допомогою електрохемілюмінесцентного методу. Результати. Індекс міцності кісткової тканини був вірогідно нижчим у пацієнтів із ТХСМ порівняно з даними контрольної групи і становив 51,4 ± 11,8 % і 98,5 ± 16,6 % (p < 0,05) у чоловіків та 50,1 ± 9,8 % і 92,9 ± 11,1 % (p < 0,05) у жінок. Через 2 роки динаміка втрати кісткової маси була вірогідно більшою в пацієнтів із ТХСМ, ніж в осіб контрольної групи, і становила 16,5 ± 2,4 % та 2,5 ± 0,9 % відповідно (p < 0,05). Зареєстровані вірогідно вищі показники метаболізму кісткової тканини в пацієнтів із ТХСМ порівняно з референтними значеннями для української популяції. Висновки. ТХСМ призводить до формування вторинного остеопорозу. У пізньому посттравматичному періоді процеси руйнування кісткової тканини уповільнюються, але залишаються вищими, ніж у популяції в цілому, що в поєднанні з низьким рівнем вітаміну D та відсутністю осьового навантаження призводить до продовження втрати кісткової маси.
Актуальность. Увеличение продолжительности жизни пациентов с травмой позвоночника и спинного мозга (ТПСМ) привлекло внимание к поздним осложнениям ТПСМ, в частности к остеопорозу. Цель исследования — оценить структурно-функциональное состояние и показатели метаболизма костной ткани у пациентов с ТПСМ через 5 и более лет после травмы. Материалы и методы. Было обследовано 73 человека (38 мужчин и 35 женщин) с тетра- или параплегией вследствие ТПСМ и 57 практически здоровых лиц. Ультразвуковую денситометрию пяточной кости проводили с помощью количественного костного ультрасонометра Sahara (Hologic Inc., model 04874, 2008). Определение маркеров ремоделирования костной ткани и витамина D в периферической крови выполняли с помощью электрохемилюминисцентного метода. Результаты. Структурно-функциональное состояние костной ткани у пациентов с ТПСМ достоверно хуже по сравнению с данными контрольной группы. Индекс прочности костной ткани составил 51,4 ± 11,8 % и 98,5 ± 16,6 % (p < 0,05) у мужчин и 50,1 ± 9,8 % и 92 9 ± 11,1 % (p < 0,05) у женщин. Через 2 года динамика потери костной массы была достоверно хуже у пациентов с ТПСМ, чем у лиц контрольной группы, и составила 16,5 ± 2,4 % и 2,5 ± 0,9 % соответственно (p < 0,05). Зарегистрированы достоверно более высокие показатели маркеров метаболизма костной ткани у пациентов с ТПСМ по сравнению с референтними значениями для украинской популяции. Выводы. ТПСМ приводит к формированию вторичного остеопороза. В позднем посттравматическом периоде процессы разрушения костной ткани замедляются, но остаются выше, чем в популяции в целом, что в сочетании с низким уровнем витамина D и отсутствием осевой нагрузки приводит к продолжению потери костной массы.
Background. The increased life expectancy of persons with complete spinal cord injury brings into focus the late complications of spinal cord injuries (SCI) including osteoporosis. Purpose of the study was to evaluate the bone mineral status and bone turnover markers in patients with chronic spinal cord injury of 5 years and over. Materials and methods. Seventy-three subjects who suffered from complete spinal cord injury with tetra- or paraplegia and 57 healthy persons were examined. Bone status was determined by ultrasound (US) densitometry of the calcaneal bone using quantitative ultrasonometer Sahara (Hologic Inc., model 04874, 2008). Bone turnover markers in the peripheral blood (osteocalcin, procollagen type 1 propeptide (P1NP), collagen type 1 cross-linked C-telopeptide (β-CTx)) and vitamin D were defined by electrochemiluminescence method. Results. SCI patients demonstrated significantly lower parameters of bone mineral status compared with the subjects of the control group. The stiffness index (SI) was 51.4 ± 11.8 % vs. 98.5 ± 16.6 % (p < 0.05) in men and 50.1 ± 9.8 % vs. 92 9 ± 11.1 % (p < 0.05) in women. There was significant reduction of bone mass index in SCI patients and in the individuals of the control group after 2 years, but bone loss over time was significantly worse in SCI patients (–16.5 ± 2.4 % vs. –2.5 ± 0.9 %, respectively; p < 0.05). In SCI patients levels of bone turnover markers were significantly higher than the relative values in Ukrainian population. Conclusions. SCI with complete spinal cord injury leads to increased bone resorption with formation of secondary osteoporosis (according to the data of ultrasound densitometry of the calcaneal bone). In the late posttraumatic period bone destruction processes are slowing down but remain higher than in the population as a whole, combined with low levels of vitamin D and absence of axial load results in continued loss of trabecular bone mass.
Вступ
Покращання якості та доступності ранньої хірургічної допомоги зменшило летальність пацієнтів із тяжкими травмами хребта та спинного мозку (ТХСМ), а отже, в популяції зростає кількість осіб із параплегіями та тетраплегіями. Збільшення тривалості життя цих хворих призводить до підвищення чисельності пізніх ускладнень ТХСМ. До них, зокрема, відносять остеопороз — найбільш поширене метаболічне захворювання скелета, що характеризується зменшенням кісткової маси, порушенням мікроархітектури кістки з подальшим збільшенням її крихкості та збільшенням ризику переломів.
Остеопороз у пацієнтів із ТХСМ досліджується вже понад 50 років, проте єдиного підходу до його діагностики та лікування не розроблено. Після травми хребта та спинного мозку порушення нормальних нейронних, судинних, гормональних і механічних чинників призводить до швидкої втрати кісткової маси в усьому скелеті, за винятком черепа. У перший місяць демінералізація кісткової тканини відбувається виключно в регіонах скелета, розташованих нижче рівня травми та позбавлених осьового навантаження, а саме у кістках нижніх кінцівок. Протягом перших років після травми хребта з повним поперечним пошкодженням спинного мозку розвивається швидке зниження кісткової маси, яке досягає 20–50 % мінеральної щільності кісткової тканини (МЩКТ) паралізованих кінцівок [3]. Тривалість підвищення темпів резорбції кісткової тканини після ТХСМ залишається дискутабельним питанням. Результати одних досліджень показали, що втрата кісткової тканини уповільнюється через 3–5 років після травми [10], проте, згідно з іншими дослідженнями, висока резорбція кісткової тканини продовжується й у більш пізніх термінах посттравматичного періоду [9]. Тривалість та ступінь втрати кісткової маси зумовлені багатьма факторами, зокрема ступенем пошкодження спинного мозку, але роль факторів, що впливають на стан кісткової тканини у пацієнтів з повним пошкодженням спинного мозку, ще не визначена [2].
Мета дослідження — оцінити структурно-функціональний стан і показники метаболізму кісткової тканини в пацієнтів із травмою хребта та спинного мозку через 5 і більше років після травми.
Матеріали та методи
У рамках співпраці з Асоціацією інвалідів-спінальників України були обстежені 73 особи, які перенесли травму хребта з повним пошкодженням спинного мозку з тетра- або параплегією. Серед них чоловіків — 38, середній вік яких становив 40,1 ± 12,2 року, жінок — 35, середній вік — 41,3 ± 11,3 року, тривалість посттравматичного періоду — 15,7 ± 10,6 року. Обстеження пацієнтів проводили під час заходів Асоціації інвалідів-спінальників. Обстежені пацієнти ведуть активний спосіб життя, що дозволяє виключити вплив тривалого ліжкового режиму. Також були обстежені волонтери, які супроводжували осіб із ТХСМ, як контрольна група. Волонтерами зазвичай виступають родичі пацієнтів: батьки, діти, дружини, що дозволяє частково зменшити вплив на результати дослідження інших факторів, які впливають на кісткову тканину, зокрема особливості харчування, середовище проживання, генетичні фактори.
Серед обстежених пацієнтів та осіб контрольної групи частина була обстежена двічі з інтервалом 2 роки (табл. 2).
Стан кісткової тканини визначали методом ультра–звукової (УЗ) денситометрії п’яткової кістки за допомогою кількісного кісткового ультрасонометра Sahara (Hologic Inc., model 04874, 2008). При проведенні УЗ-денситометрії оцінювали: швидкість поширення ультразвуку через кістку (ШПУ, м/с); широкосмугове ослаблення ультразвукового сигналу (ШОУ, дБ/МГц); індекс міцності кісткової тканини (ІМ, %), який вираховували на комп’ютері на підставі показників ШПУ та ШОУ, екстрапольовану МЩКТ п’яткової кістки; Т-показник (відмінність ІМ пацієнта від показника умовно здорових дорослих осіб віком 20 років, відображена в середньоквадратичних відхиленнях); Z-показник (відмінність ІМ пацієнта від показника умовно здорових дорослих осіб того ж віку, відображена в середньоквадратичних відхиленнях).
Визначення маркерів ремоделювання кісткової тканини в периферичній крові (остеокальцину, пропептидів проколагену І типу (P1NP), С-телопептиду зшивок колагену І типу (β-CTx)) виконували за допомогою електрохемілюмінесцентного методу на аналізаторі Eleсsys 2010 (Roche Diagnostics, Німеччина) за допомогою тест-систем cobas.
Статистичний аналіз проводили із застосуванням програми Statistica 10. Результати подані як середні величини (M ± m). Різницю показників між групами встановлювали за допомогою однофакторного дисперсійного аналізу ANOVA. Різницю показників вважали вірогідною при р < 0,05.
Результати
За результатами УЗ-денситометрії серед обстежених основної групи низька мінеральна щільність кісткової тканини (Z-показник ≤ –2,0) була діагностована в усіх жінок репродуктивного віку (n = 21) та в усіх чоловіків молодше 50 років (n = 25). Остеопороз (Т-показник ≤ –2,5) зареєстровано в 12 жінок постменопаузального періоду та 13 чоловіків старше 50 років. У жодного пацієнта із травмою хребта та спинного мозку не були зареєстровані нормальні показники структурно-функціонального стану кісткової тканини. В обстежених контрольної групи остеопороз не був діагностований, низька мінеральна щільність кісткової тканини знайдена в 10 осіб (3 чоловіки і 7 жінок), усі жінки в постменопаузальному періоді, 2 чоловіки старше 50 років.
У пацієнтів із травмою хребта та спинного мозку зареєстровані вірогідно нижчі показники структурно-функціонального стану кісткової тканини порівняно з особами контрольної групи (табл. 3).
Слід зауважити, що при аналізі даних не виявлено впливу статі на показники структурно-функціонального стану кісткової тканини (р > 0,05). Також не відзначено вірогідної залежності параметрів кісткової тканини від віку, зросту, рівня та тривалості травми.
Відомо, що травма хребта та спинного мозку з повним поперечним пошкодженням спинного мозку призводить до інтенсивної втрати кісткової тканини в перші роки після травми [6]. У подальшому темпи втрати уповільнюються й досліджувані параметри кісткової тканини мало залежать від тривалості посттравматичного періоду.
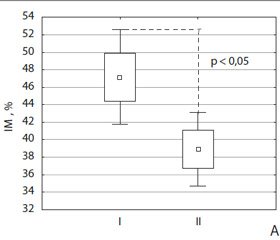
Через 2 роки отримано вірогідне зменшення ІМ як у пацієнтів із ТХСМ, так і в осіб контрольної групи, але динаміка втрати кісткової маси була вірогідно гіршою в пацієнтів із ТХСМ і становила 16,5 ± 2,4 % та 2,5 ± 0,9 % відповідно, p < 0,05 (рис. 1). Отримані дані підтверджують прискорене руйнування кісткової тканини (на рівні п’яткової кістки) у пацієнтів із ТХСМ через 5 і більше років після травми.
Метаболізм кісткової тканини за даними маркерів ремоделювання аналізували окремо в жінок і чоловіків та порівнювали з референтними даними для української популяції [1]. Результати надані в табл. 4.
/35-2.jpg)
Згідно з результатами попередніх досліджень, темпи метаболізму кісткової тканини значно прискорюються після настання ТХСМ, поступово уповільнюються, але залишаються високими у перші роки після травми [4]. Нами показано, що показники ремоделювання кісткової тканини залишаються підвищеними й у пізньому періоді після травми (тривалість травматичної хвороби — від 5 до 38 років, середня тривалість — 14,7 ± 1,2 року). Як у жінок, так і в чоловіків із ТХСМ показники P1NP були вірогідно вищі, ніж референтні значення. У чоловіків також зберігаються вищими показники маркера резорбції кісткової тканини (β-CTx). Рівень вітаміну D був вірогідно нижчим у пацієнтів із ТХСМ, ніж референтні значення. Вірогідних зв’язків рівнів маркерів ремоделювання кісткової тканини та тривалості ТХСМ не знайдено, проте при поділі пацієнтів на 2 групи залежно від тривалості посттравматичного періоду (підгрупа < 14,7 і підгрупа > 14,7 року) рівень β-CTх був вірогідно вищим у підгрупі з меншою тривалістю посттравматичного періоду й становив 0,55 ± 0,07 пг/мл та 0,39 ± 0,04 пг/мл відповідно (р < 0,05), що свідчить про поступове уповільнення процесів руйнування в пізньому посттравматичному періоді.
Обговорення
Підвищена резорбція кісткової тканини у хворих із ТХСМ виникає досить швидко після травми й стосується перш за все кісток нижче рівня ураження спинного мозку. Згідно з результатами попередніх досліджень, зокрема J.E. Bryson та співавт. (2009), у пацієнтів з ознаками повного поперечного ушкодження спинного мозку, які мали перелом внаслідок низькоенергетичної травми, діагностовано значну втрату МЩКТ у дистальному відділі стегнової кістки (на 54 %) і в проксимальних відділах великогомілкової кістки (на 73 %), що відбулася протягом перших 5–7 років після травми [6]. Звертає увагу, що в дистальній ділянці кінцівки втрата кісткової тканини більша. Вказана тенденція дозволяє припустити, що на рівні п’яткової кістки втрата буде ще більшою. Застосування УЗ-денситометрії п’яткової кістки як скринінгового методу в діагностиці остеопорозу базується на тісному зв’язку параметрів кісткової тканини тіл хребців і п’яткової кістки. У пацієнтів із ТХСМ такий зв’язок відсутній [2]. Після повного поперечного пошкодження спинного мозку кісткова тканина змінюється по-різному, залежно від локалізації. У ділянках скелета, розташованих вище рівня травми, МЩКТ знижується відразу після травми, але поступово повертається до вихідних показників і навіть збільшується при підвищенні навантаження, наприклад, МЩКТ верхніх кінцівок у пацієнтів із параплегією. У ділянках нижче рівня травми, де порушена іннервація та зменшене статичне навантаження, наприклад, нижні кінцівки, МЩКТ прогресивно зменшується [2]. Отже, незалежно від рівня травми поперекові хребці та п’яткова кістка знаходяться в різних умовах, і зміни в них є різноспрямованими. Найчастішою локалізацією переломів у цієї категорії хворих, а отже, зоною інтересу є дистальний відділ стегнової кістки та проксимальний відділ великогомілкової кістки. Ці ділянки переважно складаються з губчастої кісткової тканини й схожі за складом з п’ятковою кісткою, а також однаково втрачають кісткову тканину в умовах відсутності осьового навантаження й адекватних трофічних впливів.
За результатами ультразвукової денситометрії п’яткової кістки може бути встановлений діагноз «остеопороз», але, згідно з літературними даними, можливості цього методу в динамічному спостереженні пацієнтів із ТХСМ обмежені [5, 7]. Втрата кісткової тканини після перенесеної тяжкої травми хребта та спинного мозку розвивається швидко, призводячи до формування остеопорозу та значного підвищення ризику переломів, але через 3–5–10 років темпи резорбції кісткової тканини уповільнюються. У подальшому тривалість посттравматичного періоду вже меншою мірою впливає на структурно-функціональний стан кісткової тканини [4]. Був показаний зворотний кореляційний зв’язок між тривалістю посттравматичного періоду та кількістю трабекул проксимального відділу великогомілкової кістки, що підтверджувало тривале переважання процесів резорбції в губчастій кістковій тканині. Паралельно також відбувалося стоншення кортикального шару довгих трубчастих кісток нижніх кінцівок, але втрата кортикального шару відбувалася значно повільніше, ніж трабекулярної кісткової тканини. Саме повільне стоншення кортикального шару може пояснити, що середній період до настання першого перелому в пацієнтів із ТХСМ становить 9 років після травми [3]. Отже, корекція структурно-функціонального стану кісткової тканини як запобігання перелому має досить велике терапевтичне вікно — 9 років. Усі пацієнти в нашому дослідженні мали низьку МЩКТ (згідно з Z- чи Т-критерієм, залежно від віку). Згідно з рекомендаціями National Osteoporosis Foundation від 2014 року, ТХСМ відноситься до переліку захворювань і станів, що сприяють розвитку остеопорозу та переломів, а отже, пацієнтам із ТХСМ та низькою МЩКТ може бути встановлений діагноз «вторинний остеопороз» [8]. Поширеність цього стану серед пацієнтів із ТХСМ спонукає продовжувати наукові дослідження.
Висновки
Травма хребта та спинного мозку з повним поперечним ураженням спинного мозку призводить до посилення резорбції кісткової тканини з формуванням вторинного остеопорозу (за даними УЗ-денситометрії п’яткової кістки). У пізньому посттравматичному періоді процеси руйнування кісткової тканини уповільнюються, але залишаються вищими, ніж у популяції в цілому, що в поєднанні з низьким рівнем вітаміну D та відсутністю осьового навантаження призводить до продовження втрати губчастої кісткової маси.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Vaida VM. (Donetsk National Medical University). Gendernі j vіkovі osoblivostі osteoporozu ta jogo uskladnen [Gender and age features of osteoporosis and its complications]. Donetsk; 2011. 310 p. (In Ukrainian).
2. Povoroznyuk VV. Zahvorjuvannja kіstkovo-m’jazovoї sistemi v ljudej rіznogo vіku (vibranі lekcії, ogljadi, stattі) [Musculo-skeletal disorders in patients of different age (selected lectures, reviews, articles)]. Kyiv; 2009. 3 vol. (In Ukrainian).
3. Battaglino R, Lazzari A, Garshick E, Morse L. Spinal cord injury-induced osteoporosis: pathogenesis and emerging therapies. Curr Osteoporos Rep. 2012 Dec;10(4):278-85. doi: 10.1007%2Fs11914-012-0117-0.
4. Bauman W, Cardozo C. Osteoporosis in individuals with spinal cord injury. PM R. 2015 Feb;7(2):188-201. quiz 201. doi: 10.1016/j.pmrj.2014.08.948. Epub 2014 Aug 27.
5. Bittar C, Cliquet A. Utility of quantitative ultrasound of the calcaneus in diagnosing osteoporosis in spinal cord injury patients. American Journal of Physical Medicine & Rehabilitation. 2011 Jun;90(6):477-81. PMID: 21765270. doi: 10.1097/PHM.0b013e31821a7386.
6. Bryson JE, Gourlay ML. Bisphosphonate use in acute and chronic spinal cord injury: a systematic review. J Spinal Cord Med. 2009;32(3):215-25.
7. Chow YW, Inman C, Pollintine P, Sharp CA, et al. Ultrasound bone densitometry and dual energy X-ray absorptiometry in patients with spinal cord injury: a cross-sectional study. Spinal Cord. 1996;34:736-41. doi: 10.1038/sc.1996.134.
8. Cosman F, de Beur SJ, LeBoff MS, et al. Clinician’s Guide to Prevention and Treatment of Osteoporosis. Osteoporos Int. 2014 Oct;25(10):2359-81. PMID: 25182228. PMCID: PMC4176573. doi: 10.1007/s00198-014-2794-2.
9. Dolbow J, Dolbow D, Gorgey A, Adler R, et al. The effects of aging and electrical stimulation exercise on bone after spinal cord injury. Aging Dis. 2013 Jun;4(3):141-53. PMCID: PMC3660124.
10. Frotzler A, Berger M, Knecht H, Eser P. Bone steady-state is established at reduced bone strength after spinal cord injury: a longitudinal study using peripheral quantitative computed tomography (pQCT). Bone. 2008;43:549-55. PMID: 18567554. doi: 10.1016/j.bone.2008.05.006.

/34-1.jpg)
/34-2.jpg)
/35-1.jpg)
/36-1.jpg)
/35-2.jpg)