Вступ
Однією з невирішених соціально значимих проблем сучасної біомедичної науки є відновне лікування травми спинного мозку. Перспектива вирішення проблеми пов’язана з розвитком технології тканинної інженерії та нейробіоніки [1–5]. До переліку видів незрілих клітин, ефективність трансплантації яких у комплексі з біосумісними матриксами при травмі спинного мозку активно вивчають, відносять стовбурові клітини кісткового мозку (СККМ) [6–8]. Ефективність трансплантації СККМ доцільно порівнювати з результатами втручань за участю нейрогенних стовбурових клітин (НСК), отримання яких у клінічних умовах значно утруднене. На даний час питання про механізми позитивного впливу трансплантації СККМ залишається відкритим [6, 9]. З огляду на фазність перебігу травми спинного мозку [10, 11], суттєві відмінності патофізіології її періодів [12–18] важливу роль у визначенні механізмів позитивного ефекту відновного втручання може відіграти з’ясування часових особливостей його впливу на рухову функцію паретичних кінцівок. У даній роботі наведено результати використання такого методологічного підходу для порівняльного аналізу ефективності ксенотрансплантації СККМ та НСК у комплексі з макропористим гідрогелем на моделі бічного половинного перетину спинного мозку зрілого щура.
Матеріали та методи
Як первинні цифрові дані використано емпіричний матеріал, отриманий у ряді попередніх досліджень [19, 20], виконаних із дотриманням чинних норм біоетики на білих щурах-самцях (ДУ «Інститут нейрохірургії імені акад. А.П. Ромоданова НАМН України»; інбредна лінія на основі Wistar; групи ЛПП, ЛПП + NG) та щурах-самцях лінії Wistar (Інститут фізіології імені О.О. Богомольця НАН України; групи ЛПП + НСК та ЛПП + СККМ), віком 5 міс., масою 250 г, утримуваних у стандартних умовах. Експериментальні групи: ЛПП — лівобічний половинний перетин (ЛПП) спинного мозку (n = 40); ЛПП + NG — ЛПП + негайна гомотопічна імплантація фрагмента макропористого гідрогелю (NeuroGelTM (NG); n = 20); ЛПП + НСК — ЛПП + гомотопічна імплантація фрагмента макропористого гідрогелю, асоційованого з фетальними НСК миші (n = 20); ЛПП + СККМ — ЛПП + гомотопічна імплантація фрагмента макропористого гідрогелю, асоційованого з СККМ зрілої миші (n = 16).
Оперативні втручання здійснювали за умов загального знеболювання (внутрішньоочеревинне введення суміші розчинів ксилазину (Bіowet, Польща; 15 мг/кг) і кетаміну («Гедеон Ріхтер А.О.», Угорщина; 70 мг/кг)). Протокол виконання ЛПП включав ламінектомію на рівні Т11, перфорування спинного мозку по лівому краю задньої серединної артерії у дор–совентральному напрямку, перетин лівої половини спинного мозку офтальмологічними ножицями, контроль повноти перетину [21]. Макро–пористий гідрогель NeuroGelTM [22] (полі[N-(2-гідроксипропіл)-метакриламід]) синтезовано в лабораторії E. Pinet (FISO Technologies Inc., Quebec, Canada) шляхом гетерогенної полімеризації та асоціації. СККМ отримували в мишей-самців лінії FVB-Cg-Tg(GFPU)5Nagy/J (трансгенної за геном зеленого флуоресцентного білка) віком 3 міс., масою 40 г шляхом вимивання зі стегнової кістки; клітини культивували за стандартних умов у присутності 1 нг/мл основного фактора росту фібробластів (Sigma, США), фенотипували та досліджували на здатність до диференціювання в адипогенному та остеогенному напрямках [20]. НСК отримували з гіпокампа плодів (Е17) миші аналогічної лінії, культивували в багатокомпонентному середовищі в присутності 10 нМ фактора росту фібробластів 2 (Sigma, США) [19]. Через 5 діб у обох випадках у середовище вкладали фрагменти NeuroGelTM, культивували протягом 10 діб. Трансплантацію в рану спинного мозку фрагментів матрикса здійснювали одразу ж після моделювання ЛПП, рану закривали звичайним чином, застосовували протизапальну та антибактеріальну терапію [21].
Показник функції (ПФ) задньої іпсилатеральної щодо зони травми кінцівки визначали починаючи із 7-ї доби згідно зі шкалою, запропонованою D.M. Basso, M.S. Beattie та J.C. Bresnahan [21]. Враховуючи асинхронність визначення ПФ у різних когортах кожної експериментальної групи, у цьому та попередніх дослідженнях [19–21, 23–31] використано стандартизовану часову шкалу відображення результатів, яка включає 1, 2, 3, 4, 5, 6, 7, 8, 12, 16, 20, 24, 28-й тижні загального періоду спостереження. Приведення індивідуальних результатів моніторингу ПФ до зазначеної часової шкали здійснено шляхом квазілінійної рандомізованої інтерполяції за алгоритмом ковзного середнього. Відсутність суттєвого впливу використаного алгоритму на динаміку та внутрішньогруповий розподіл значень ПФ з’ясовано окремим дослідженням з використанням релевантних методів статистичного аналізу.
Протягом перших 2 місяців спостереження щотижневий приріст ПФ (VПФ, швидкість зміни ПФ з точністю до одного тижня згідно зі стандартизованою часовою шкалою) визначали за формулою:
де n — тиждень спостереження.
Аналогічно обчислювали прискорення приросту ПФ (аПФ).
Починаючи з 3-го місяця VПФ і аПФ отримували за формулою:
де n — місяць спостереження.
Розрахунок здійснювали автоматично в межах програмного пакета Statistica 10.0 на персональному комп’ютері, умовно приймаючи значення ПФ, VПФ і аПФ одразу ж після виходу тварини зі стану наркотичного сну рівними нулю (стан спінального шоку).
Для порівняльної оцінки середніх у групах значень досліджуваних показників використовували непараметричний U-тест Манна — Уїтні (Mann-Whitney U-test). У всіх випадках припущення щодо статистичної значущості отриманого результату вважали вірним, якщо ймовірність нульової гіпотези була меншою ніж 0,05
(р < 0,05). Усереднені величини подавали у вигляді М ± m, де М — середнє значення величини, m — стандартна похибка середнього значення.
Результати
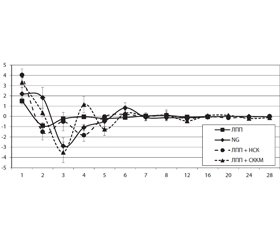
Протягом перших 2 тижнів спостереження у групі ЛПП відмічали інтенсивне зменшення VПФ на 1 бал/тиж, упродовж наступних 3 тижнів — до нульового значення, яке утримувалося до кінця експерименту (рис. 1). Максимум аПФ виявляли на 1-му тижні, мінімум — на 2-му тижні (рис. 2).
Динаміка VПФ та аПФ у групі ЛПП + NG характеризується наявністю максимумів, реєстрованих станом на 2-й і 6-й (VПФ) та на 1–2-й і 6-й тиждень спостереження (аПФ), а також мінімумів, реєстрованих станом на 1-й і 5-й (VПФ) та 3-й (аПФ) тиждень спостереження (рис. 1, 2). Вірогідні зміни ПФ відмічали станом на 2–3-й, 7-й, 8-й, 12-й та 20-й тиждень спостереження [19, 20]. Статистично значущу різницю значень VПФ з показником групи ЛПП виявляли протягом 2–4-го тижня (р < 0,001; р = 0,002; р = 0,001).
Для динаміки VПФ та аПФ групи ЛПП + НСК характерні максимуми на 1-му і 8-му (VПФ) та 1-му і 3-му тижні спостереження (аПФ), а також мінімуми на 4-му (VПФ) та 2-му і 4-му (аПФ) тижні спостереження (рис. 1, 2). Від’ємні значення VПФ не виявляли, вірогідні зміни ПФ групи реєстрували станом на 2, 4, 5, 8, 16, 20, 24, 28-й тиждень спостереження [19]. Статистично значущу різницю значень VПФ та показника групи ЛПП виявляли на 1-му та 4-му тижні (р < 0,001; р = 0,002), групи ЛПП + NG — упродовж перших 2 тижнів (р = 0,02; р = 0,006).
Для динаміки VПФ та аПФ у групі ЛПП + СККМ характерні максимуми на 2, 4, 8-му (VПФ), 1, 4, 6-му (аПФ) тижнях спостереження, а також мінімуми на 3-му і 5-му (VПФ) та 3, 5, 12-му (аПФ) тижнях спостереження (рис. 1, 2). Вірогідні зміни ПФ реєстрували станом на 2, 4, 5, 8, 16, 20, 24, 28-й тиждень спостереження [20]. Статистично значущу різницю значень VПФ та показника групи ЛПП виявляли впродовж 1–3-го тижня (р < 0,033), групи NG + НСК — на 2-му тижні (р = 0,02) спостереження, стосовно групи ЛПП + NG — не виявили.
Враховуючи, що вірогідна різниця між VПФ груп ЛПП + NG і ЛПП + СККМ відсутня, для груп ЛПП + НСК і ЛПП + NG — наявна протягом 1–2-го тижня, різницю між VПФ груп ЛПП + НСК та ЛПП + СККМ на 1-му тижні, не підтверджену прямим зрівнянням, можна вважати суттєвою. Станом на 2-й тиждень спостереження VПФ групи ЛПП + НСК вірогідно поступався показнику групи ЛПП + СККМ та групи ЛПП + NG. Пік позитивного впливу NeuroGelТМ на динаміку ПФ припадає на 2-й тиждень після імплантації, максимум позитивного ефекту трансплантації СККМ у комплексі з NeuroGelТМ — на 1–2-й тиждень спостереження. Незважаючи на те, що перевага VПФ групи ЛПП + НСК над групою ЛПП + СККМ станом на 3-й тиждень невірогідна, саме її існування є причиною статистично значущої різниці ПФ двох зазначених груп, виявленої станом на 5-й тиждень спостереження (р = 0,027).
Обговорення
Отримані дані свідчать, що НСК вірогідно потенціює позитивний ефект NeuroGelТМ протягом 1-го тижня, значущо зменшує — протягом 2-го тижня, але подовжує до 3-го тижня спостереження включно. Згідно з динамікою аПФ протягом перших трьох тижнів групи формують дві пари. Пара ЛПП і ЛПП + НСК характеризується різким зменшення приросту ПФ протягом 2-го тижня, відсутністю зменшення протягом 3-го тижня. Для іншої пари, ЛПП + NG і ЛПП + СККМ, характерне збільшення приросту протягом 2-го тижня та різке зменшення протягом 3-го тижня. Отже, трансплантація НСК у комплексі з NeuroGelТМ не деформує процес автогенного відновлення рухової системи після травми спинного мозку, лише потенціює його; трансплантація СККМ у комплексі з гідрогелем деформує процес автогенного відновлення, слабше потенціює його в гострому періоді, сильніше і менш тривало — у ранньому.
Відомо, що в гострому періоді травми протягом перших 3–8 год превалюючим механізмом загибелі нейронів навколо зони травми є апоптоз, тривалість періоду максимальної апоптотичної загибелі нейронів обмежена першою добою після травми [18]. Інші клітини, наприклад гліального фенотипу, можуть гинути за апоптотичним механізмом і протягом усього раннього періоду [18]. Отже, клітини, що продукують фактори нейротрофічного типу і цим самим обмежують апоптотичну дегенерацію нейронів спинного мозку поблизу зони травми, можуть спричиняти суттєвий позитивний ефект, який на функціональному рівні проявлятиметься вже протягом першого тижня. Переваги групи ЛПП + НСК у цьому розумінні очевидні, оскільки НСК є джерелом багатьох нейротрофічних факторів [32, 33]. І водночас нейропротекторні властивості характерні й для СККМ [32].
Пролонгована динаміка VПФ групи ЛПП + НСК протягом 2–3-го тижня може бути наслідком реалізації пластичності в збережених елементах нейрональної мережі, отже, повністю відповідатиме динаміці групи ЛПП, однак через більшу кількість збережених від вторинної альтерації та апоптозу клітин перифокальної зони матиме більший масштаб, супроводжуватиметься вищими значеннями ПФ.
Прояв відстрочених ефектів НСК та СККМ, ймовірно, має місце у віддаленому періоді травми, обумовлюючи позитивну динаміку в групах ЛПП + НСК та ЛПП + СККМ: протягом 9–28-го тижня спостерігали зростання ПФ на ~30 % від величини збільшення ПФ протягом усього періоду спостереження, тоді як у групі ЛПП + NG — лише на 6,5 %.
Нейротрофічна, антиапоптотична, антиоксидантна, проремієлінізуюча дія описана для мезенхімальних стовбурових клітин, у тому числі й для СККМ [34], отже, зрозумілою є відсутність значущої різниці між VПФ груп ЛПП + НСК та ЛПП + СККМ. Однак СККМ мають ще й суттєвий проангіогенний вплив [34], причому не лише факторний: серед клітин кісткового мозку наявна значна популяція ендотеліальних прогеніторів [35]. За даними ряду авторів [15], протягом перших 3 днів спостерігають найбільш інтенсивне надходження в тканину спинного мозку нейтрофілів через зруйнований гемато-спинномозковий бар’єр, протягом 1–2-го тижня характерний пік міграції макрофагів, протягом 2–8-го тижня — пологий пік проліферативної реакції мікрогліоцитів. Отже, фактори, що стабілізують гемато-спинномозковий бар’єр, мають захисний та замісний ефект стосовно ендотеліоцитів й потенціюють ангіогенні реакції, можуть у кінцевому результаті обмежувати надходження в тканину спинного мозку імунних клітин периферійної крові, зменшувати локальне запалення та вторинну альтерацію. Це може пояснити інтенсивну динаміку ПФ у групі ЛПП + СККМ, а також ЛПП + NG протягом 2-го тижня після трансплантації.
Однак новоутворені судини перифокальної зони зазвичай мають аномальну проникність щодо антитіл та антигенів [36, с. 141–143, 173], тому стимуляція ангіогенезу має й негативний наслідок, що виявляється у групах ЛПП + NG і ЛПП + СККМ станом на 3-й тиждень спостереження різким зменшенням VПФ. У групі ЛПП + НСК такий патофізіологічний механізм вірогідно відсутній.
Потребує пояснення суттєве зменшення VПФ у групі ЛПП + НСК протягом другого тижня, нехарактерне для груп ЛПП + NG і ЛПП + СККМ. Уже протягом першого тижня реактивні астроцити та олігодендрогліальні попередники навколо епіцентру травми обумовлюють продукцію значної кількості протеогліканів типу хондроїтинсульфату — neural/glial antigen 2 (NG2; пік тканинної концентрації — 7-ма доба), нейрокан/версикан (пік тканинної концентрації — 14-та доба), бревікан (пік тканинної концентрації — з 14-ї доби), фосфакан (пік тканинної концентрації — з 7–8-го тижня) [15]. Усі ці фактори є суттєвими інгібіторами регенераційного росту аксонів [15]. Отже, нащадки НСК, що в реципієнтній тканині диференціюються, передусім у клітини глії [37], можуть сприяти продукції NG2, нейрокану/версикану та фосфакану, негативний ефект яких проявлятиметься уже протягом 2–4-го тижня травми. Таким чином НСК можуть суттєво обмежувати позитивний вплив NeuroGelТМ на 2-му тижні після імплантації. У групах ЛПП + NG і ЛПП + СККМ такий механізм, ймовірно, відсутній. Більш того, деякі види мезенхімальних стовбурових клітин можуть стимулювати тканинну експресію металопротеїназ, що беруть участь у руйнуванні репелентних стосовно аксональних конусів росту компонентів посттравматичного рубця [34]. Нарешті, окремі дослідження демонструють можливість трансдиференціювання СККМ у шванівські гліоцити [34], що мієлінізують волокна в зоні травми за периферичним типом і тому, на відміну від олігодендроцитів, стимулюють аксоногенез. Така можливість пояснюється наявністю серед популяції стовбурових клітин кісткового мозку прогеніторів, похідних нервового гребеня [38].
Висновки
Динаміка рівня рухової активності у випадку трансплантації в зону травми НСК та СККМ у комплексі з макропористим гідрогелем NeuroGelTM суттєво відрізняється протягом першого місяця. Для трансплантації НСК у поєднанні з гідрогелем характерна максимальна швидкість відновлення рухової функції на 1-му тижні, менша — упродовж 2–3-го тижня; для трансплантації СККМ у поєднанні з гідрогелем та для імплантації порожнього гідрогеля максимальна активність відновлення рухової функції виявлена на 2-му тижні. Виявлені відмінності можуть бути обумовлені проангіогенним впливом СККМ та гліогенним диференціюванням НСК.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Hydrogels and cell based therapies in spinal cord injury regeneration [Електронний ресурс] / R.C. Assunção-Silva, E.D. Gomes, N. Sousa [et al.] // Stem Cells International. — 2015. — Vol. 2015, Article 948040. — P. 1-24. — Режим доступу: https://www.hindawi.com/journals/sci/2015/948040.
2. Ahuja C. Concise review: bridging the gap: novel neuroregenerative and neuroprotective strategies in spinal cord injury / C. Ahuja, M. Fehlings // Stem Cells Transl. Med. — 2016. — Vol. 5, № 7. — P. 914-924.
3. Cell transplantation and neuroengineering approach for spinal cord injury treatment: a summary of current laboratory findings and review of literature / Lin X.Y., Lai B.Q., Zeng X. [et al.] // Cell Transplantation. — 2016. — Vol. 25, № 8. — P. 1425-1438.
4. Control of an ambulatory exoskeleton with a brain–machine interface for spinal cord injury gait rehabilitation [Електронний ресурс] / E. López-Larraz, S. Pérez-Nombela, A.J. Del-Ama [et al.] // Front. Neurosci. — 2016. — Vol. 10, Article 359. — P. 1-15. — Режим доступу: https://journal.frontiersin.org/article/10.3389/fnins.2016.00359/full.
5. Miller L.E. Clinical effectiveness and safety of powered exoskeleton-assisted walking in patients with spinal cord injury: systematic review with metaanalysis / L.E. Miller, A.K. Zimmermann, W.G. Herbert // Med. Devices (Auckl). — 2016. — Vol. 9. — P. 455-466.
6. Oliveri R.S. Mesenchymal stem cells improve locomotor recovery in traumatic spinal cord injury: Systematic review with meta-analyses of rat models / R.S. Oliveri, S. Bello, F. Biering-Sørensen // Neurobiol. Dis. — 2014. — Vol. 62. — P. 338-353. doi: 10.1016/j.nbd.2013.10.014.
7. Safety and neurological assessments after autologous transplantation of bone marrow mesenchymal stem cells in subjects with chronic spinal cord injury [Електронний ресурс] / M.V.P. Mendonça, T.F. Larocca, B.S. de Freitas Souza [et al.] // Stem Cell Res. Ther. — 2014. — Vol. 5, Art. 126. — P. 1-11. — Режим доступу: http://stemcellres.biomedcentral.com/articles/10.1186/scrt516.
8. Bone marrow mesenchymal stromal cells and olfactory ensheathing cells transplantation after spinal cord injury — a morphological and functional comparison in rats / A. Torres-Espіn, E. Redondo-Castro, J. Hernandez, X. Navarro // Eur. J. Neurosci. — 2014. — Vol. 39. — P. 1704-1717.
9. Karantalis V. Use of mesenchymal stem cells for therapy of cardiac disease / V. Karantalis, J.M. Hare // Circ. Res. — 2015. — Vol. 116, № 8. — P. 1413-1430.
10. Полищук Н.Е., Слынько Е.И. Патогенез травмы спинного мозга, периодизация травматической болезни спинного мозга. Спинальный шок // Полищук Н.Е. Повреждения позвоночника и спинного мозга (механизмы, клиника, диагностика, лечение) / Н.Е. Полищук, Н.А. Корж, В.Я. Фищенко; под ред. Н.Е. Полищука и др. — К.: Книга плюс, 2001. — С. 42-56.
11. Слинько Є.І. Ургентна нейрохірургічна допомога при ускладненій хребетно-спинномозковій травмі на Україні (програмна доповідь) / Є.І. Слинько // Український нейрохірургічний журнал. — 2005. — № 3. — С. 63-74.
12. Цымбалюк В.И. Спинной мозг. Элегия надежды: монография / В.И. Цымбалюк, В.В. Медведев. — Винница: Нова Книга, 2010. — 944 с.
13. Ng M.T.L. Vascular disruption and the role of angioge–nic proteins after spinal cord injury / M.T.L. Ng, A.T. Stammers, B.K. Kwon // Transl. Stroke Res. — 2011. — Vol. 2, № 4. — P. 474-491.
14. Posttraumatic inflammation as a key to neuroregeneration after traumatic spinal cord injury / A. Moghaddam, C. Child, T. Bruckner [et al.] // Int. J. Mol. Sci. — 2015. — Vol. 16, № 4. — P. 7900-7916.
15. Biomaterial approaches to enhancing neurorestoration after spinal cord injury: strategies for overcoming inherent biological obstacles [Електронний ресурс] / J.R. Siebert, A.M. Eade, D.J. Osterhout // BioMed Research International. — 2015. — Vol. 2015, Article ID 752572. — P. 1-20. — Режим доступу: https://www.hindawi.com/journals/bmri/2015/752572.
16. Advances in regenerative therapies for spinal cord injury: a biomaterials approach / M. Tsintou, K. Dalamagkas, A.M. Seifalian // Neural Regen. Res. — 2015. — Vol. 10, № 5. — P. 726-742.
17. Cytokine and growth factor activation in vivo and in vitro after spinal cord injury / E. Garcia, J. Aguilar-Cevallos, R. Silva-Garcia, A. Ibarra [Електронний ресурс] // Mediators Inflamm. — 2016. — Vol. 2016, Article ID 9476020. — P. 1-21. — Режим доступу: https://www.hindawi.com/journals/mi/2016/9476020.
18. Kjell J. Rat models of spinal cord injury: from pathology to potential therapies / J. Kjell, L. Olson // Dis. Model Mech. — 2016. — Vol. 9, № 10. — P. 1125-1137.
19. Вплив ксенотрансплантації нейрогенних стовбурових клітин у комплексі з тканинним матриксом NeuroGelTM на відновлення рухової функції спинного мозку щура після експериментальної спінальної травми / В.І. Цимбалюк, В.В. Медведєв, О.А. Рибачук [та ін.] // Клінічна хірургія. — 2017. — № 1. — С. 64-66.
20. Вплив імплантації NeuroGelTM у асоціації з ксеногенними стовбуровими клітинами кісткового мозку на відновлення рухової функції задньої кінцівки щура після спінальної травми / В.І. Цимбалюк, В.В. Медведєв, О.А. Рибачук, В.І. Козявкін [та ін.] // Міжнародний неврологічний журнал. — 2016. — № 6(84). — С. 13-19.
21. Модель перетину половини поперечника спинного мозку. Частина І. Технічні, патоморфологічні та клініко-експериментальні особливості / В.І. Цимбалюк, В.В. Медведєв, В.М. Семенова [та ін.] // Укр. нейрохірург. журнал. — 2016. — № 2. — С. 18-27.
22. Reconstruction of the transected cat spinal cord following NeuroGel implantation: axonal tracing, immunohistochemical and ultrastructural studies / S. Woerly, V.D. Doan, N. Sosa [et al.] // Int. J. Dev. Neurosci. — 2001. — Vol. 19, № 1. — Р. 63-83.
23. Вплив обмеження спонтанної локомоторної активності на перебіг синдрому спастичності за умови експериментальної травми спинного мозку та імплантації матриксу NeuroGelTM, асоційованого з нейрогенними стовбуровими клітинами / В.І. Козявкін, В.І. Цимбалюк, В.В. Медведєв [та ін.] // Буковинський медичний вісник. — 2016. — Т. 20, № 4(80). — C. 83-89.
24. Медведєв В.В. Варіативність кореляції рівня функції та спастичності паретичної кінцівки за різного перебігу відновного процесу на моделі спінальної травми / В.В. Медведєв // Шпитальна хірургія. — 2016. — № 4. — С. 21-26.
25. Вплив трансплантації тканини фетального мозочка на відновлення локомоторної функції задньої кінцівки при травмі спинного мозку у щура / В.В. Медведєв, Ю.Ю. Сенчик,
Н.Г. Драгунцова [та ін.] // Клітинна та органна трансплантологія. — 2016. — Т. 4, № 2. — С. 168-174.
26. Клініко-морфологічні особливості моделі відкритої проникної травми спинного мозку з тривалим перебуванням стороннього тіла у хребтовому каналі / В.І. Цимбалюк, В.В. Медведєв, В.М. Семенова [та ін.] // Укр. нейрохірург. журнал. — 2016. — № 4. — С. 16-25.
27. Тривала персистенція біосумісного стороннього тіла у хребтовому каналі за відкритої проникної травми спинного мозку: клініко-експериментальні та патоморфологічні особливості / В.І. Цимбалюк, В.В. Медведєв, В.М. Семенова [та ін.] // Клінічна хірургія. — 2016. — № 8. — С. 64-69.
28. Вплив трансплантації тканини нюхової цибулини на перебіг регенераційного процесу при травмі спинного мозку в експерименті / В.І. Цимбалюк, В.В. Медведєв, Ю.Ю. Сенчик [та ін.] // Український неврологічний журнал. — 2016. — № 3. — С. 59-65.
29. Вплив трансплантації тканини фетальної нирки на перебіг регенераційного процесу при травмі спинного мозку в експерименті / В.І. Цимбалюк, В.В. Медведєв, Ю.Ю. Сенчик
[та ін.] // Наука і практика. — 2016. — № 1–2 (7–8). — С. 104-115.
30. Медведєв В.В. Вплив нейротрансплантації різних типів алогенних тканин на відновлення рухової функції після експериментальної травми спинного мозку / В.В. Медведєв // Український нейрохірургічний журнал. — 2017. — № 1. — С. 11-23.
31. Вплив імплантації NeuroGel у поєднанні з ксеногенними стовбуровими клітинами нервового гребня на відновлення рухової функції задніх кінцівок щура після травми спинного мозку / В.І. Цимбалюк, В.В. Медведєв, Р.Г. Васильєв [та ін.] // Український неврологічний журнал. — 2017. — № 1. — С. 65-71.
32. Cell transplantation therapy for spinal cord injury / P. Assinck, G.J. Duncan, B.J. Hilton [et al.] // Nat. Neurosci. — 2017. — Vol. 20, № 5. — P. 637-647.
33. Lu P. Stem cell transplantation for spinal cord injury repair / P. Lu // Prog. Brain Res. — 2017. — Vol. 231. — P. 1-32.
34. Concise review: spinal cord injuries — how could adult mesenchymal and neural crest stem cells take up the challenge? / V. Neirinckx, D. Cantinieaux, C. Coste [et al.] // Stem Cells. — 2014. — Vol. 32, № 4. — P. 829-843.
35. Endothelial progenitor cells: novel biomarker and promising cell therapy for cardiovascular disease / S. Sen, S.P. McDo–nald, P.T. Coates, C.S. Bonder // Clin. Sci. (Lond). — 2011. — Vol. 120, № 7. — P. 263-283.
36. Цимбалюк В.І. Ce.re.bellum, або мозочок: Монографія / В.І. Цимбалюк, В.В. Медведєв, Ю.Ю. Сенчик. — Вінниця: Нова Книга, 2013. — 272 с.
37. Synergistic effects of transplanted adult neural stem/progenitor cells, chondroitinase, and growth factors promote functional repair and plasticity of the chronically injured spinal cord / S. Karimi-Abdolrezaee, E. Eftekharpour, J. Wang [et al.] // J. Neurosci. — 2010. — Vol. 30, № 5. — P. 1657-1676.
38. Lindsay S.L. Are nestin-positive mesenchymal stromal cells a better source of cells for CNS repair? / S.L. Lindsay, S.C. Barnett // Neurochem. Int. — 2017. — Vol. 106. — P. 101-107.

/17-1.jpg)
/17-2.jpg)
/18-1.jpg)