Вступ
Синдром ендогенної інтоксикації в складі багатьох патологічних станів та його терапія є важливим питанням різних підрозділів педіатричної науки та практики. Особливе місце в структурі синдрому ендогенної інтоксикації посідає дисфункція мікробіоценозів у тих чи інших біотопах дитячого організму, що є актуальним для численних кишкових інфекцій, неінфекційної патології шлунково-кишкового тракту (ШКТ) та алергічної патології, шкірних і ендокринних хвороб тощо. Синдром ендотоксемії пов’язаний із накопиченням у значних концентраціях продуктів фізіологічного обміну: пірувату, лактату, креатиніну, білірубіну, сечовини, продуктів порушеного метаболізму (кетонів, альдегідів, спиртів, аміаку, карбонових кислот), медіаторів запалення, біогенних амінів, цитокінів, простагландинів, мікробних токсинів, різних антигенів та імунних комплексів [13, 16].
У наш час сформувалися стійкі уявлення про механізми взаємодії макроорганізму й бактерій-коменсалів, яким властива низька вірулентність і патогенність, але в разі дії факторів ризику на тлі морфофункціональних особливостей органів ці бактерії здатні обумовлювати різні захворювання [16, 22]. Щодо цього значний практичний інтерес становить феномен бактеріальної транслокації — проникнення бактерій із ШКТ у внутрішнє середовище організму. Сьогодні транслокацію бактерій розглядають як патологічний процес, що розвивається при стресі, імунодефіциті, інтоксикації будь-якого генезу, різних тяжких захворювань. Проте є думка, що транслокація бактерій може бути природним захисним механізмом, що пов’язаний зі здатністю бактерій-симбіонтів проникати в кров, лімфу й лімфатичні вузли, селезінку, печінку, накопичуватися у вогнищах ураження й виділяти біологічно активні речовини [16].
Існують докази того, що цукролітичні бактерії разом з неперетравлюваними вуглеводами формують ентеросорбент з великою адсорбційною потужністю, який акумулює велику частину токсинів і видаляє їх з організму разом з кишковим вмістом, паралельно посилюючи перистальтику кишечника [8, 16]. Багато токсинів і метаболітів (алергенів, гістаміну, нітратів, ксенобіотиків, мутагенних стероїдів) знешкоджуються нормальною мікрофлорою, що одночасно захищає ентероцити та віддалені органи від їх дії. Частина токсинів утилізується бактеріями-коменсалами для власних потреб. При цьому останні першими вступають у взаємодію з усіма речовинами, що потрапляють в організм природним шляхом [1, 14].
Окрім антагоністичної дії сапрофітної флори визначений її суттєвий вплив на функцію слизового фільтраційного бар’єра проти бактерій і контамінуючих агентів, що має 3 лінії захисту [16]. Одним з найбільш значущих компонентів захисту слизової оболонки кишки є зволоження її поверхні слизом (перша лінія фізіологічного захисту).
Слиз продукується келихоподібними клітинами у вигляді безперервного гетерогенного шару високоглікозильованих білків (муцинових глікопротеїнів і факторів трилисника), покриває внутрішню поверхню кишки й діє, з одного боку, як мастильний матеріал, з іншого — як захисний шар на поверхні епітеліоцитів. Активне переміщення слизу вздовж поверхні слизової оболонки кишечника здійснюється за рахунок перистальтичної активності останнього й сприяє подальшому видаленню патогенних мікроорганізмів. Існує оптимальна концентрація муцину в слизовому шарі ШКТ, що необхідна для повноцінного виконання транспортної, фільтраційної та антибактеріальної функції [9].
У відповідь на потрапляння вірусів або патогенних мікробів відбувається гіперплазія келихоподібних клітин зі збільшенням їх числа й площі поширення, що стимулює надмірну продукцію слизу. Зменшення вмісту кислих і збільшення концентрації нейтральних муцинів у слизу призводить до підвищення його в’язкості. Цьому сприяє й виникнення між молекулами муцинів дисульфідних містків і водневих зв’язків, посилюється гідрофобність зі збільшенням адгезивності [5, 16]. Іншими словами, фізіологічний захист переходить у патологічну фазу зі зміною нормального утворення слизу, його фізико-хімічних якостей та адгезії.
Специфічним фактором захисту кишечника є антитіла, що належать до класу секреторних імуноглобулінів (sIgA), вміст яких у декілька разів вищий за імуноглобуліни інших класів. Визначено роль sIgA у механізмах специфічного захисту. До типових ефектів належать обмеження мікробної адгезії до епітеліоцитів, нейтралізація токсинів вірусів і посилення спільних дій з іншими антибактеріальними факторами — лізоцимом, лактоферином, пероксидазою, муцином [5, 16].
Другу лінію захисту слизової оболонки становить епітеліальний бар’єр. Епітелій кишечника, що відділяє просвітний вміст від підлеглої слизової оболонки, складається з ентероцитів (93–95 % клітин), келихоподібних клітин, які секретують слиз (3–5 % клітин), та ентероендокринних клітин, що виробляють шлунково-кишкові гормони (1–2 %). Апікальні поверхні епітелію виступають як захисний механічний бар’єр від патогенних факторів (чужорідні агенти, мікроорганізми, токсини), що присутні в просвіті кишечника. У той же час епітелій з міжклітинними сполуками працює як вибірково проникний фільтр, що сепарує молекули різної маси [12, 16, 21].
Ще одна лінія захисту включає нормальний кровотік, який сприяє видаленню іонів водню, що забезпечує енергією метаболічні процеси й підтримує першу та другу лінії захисту, а також репаративні процеси в слизовій оболонці кишечника. Особлива роль у регуляції мікроциркуляції товстої кишки через судинні сфінктери належить пропіоновій кислоті, що є продуктом бактеріальної ферментації, а також іншим біологічно активним речовинам: калікреїну, гістаміну, реніну, простагландинам Е, F та I [8]. Останні покращують продукцію та екскрецію захисного слизу, стимулюють адекватний кровотік у капілярах слизової оболонки, посилюють енергетичний метаболізм в епітеліальних клітинах.
Наведені дані дозволяють сформулювати такі висновки: кишкова цитопротекція включає великий спектр внутрішньопросвітних і клітинно-тканинних механізмів, взаємодія яких забезпечує цілісність слизової оболонки кишечника та її стійкість до факторів агресії. Протективні механізми є первинними, діють постійно й перебувають у тісному взаємозв’язку з нормальною мікрофлорою кишечника [16, 19].
Особливого значення набуває синдром ендотоксемії при алергічних захворюваннях у дитячому віці, які в наш час, на жаль, є лідерами серед хвороб: у світі їх поширеність сягає 50 % дитячої популяції. Алергічні дерматози посідають провідне місце у цій групі хвороб і включають декілька нозологічних форм, у тому числі атопічний дерматит (АД), кропив’янку, ангіонабряк (Квінке), медикаментозні алергічні васкуліти тощо [7, 12, 24].
Алергія є системною патологією. Навіть у тому випадку, коли ушкоджується один орган, завжди є небезпека розвитку системних проявів. Сучасними особливостями формування алергії в дітей є ранній (вже внутрішньоутробний) розвиток сенсибілізації та рання клінічна маніфестація атопії вже в перші роки життя дитини у вигляді харчової алергії та АД з дещо більш пізнім приєднанням алергічного риніту й бронхіальної астми, що є підтвердженням значного помолодшання алергічних хвороб [13, 20, 24]. На жаль, спостерігається й збільшення питомої ваги тяжких фармакорезистентних форм [4, 13].
Давно відомо, що алергічні ураження шкіри, як правило, формують коморбідну патологію з боку органів травлення, особливо гепатобіліарної системи, синдром надмірного бактеріального росту, які найчастіше мають вторинний характер. Разом з тим ушкодження анатомо-фізіологічних та імунних бар’єрів унаслідок запальних, інфекційних та інших захворювань сприяє харчовій сенсибілізації [2, 3, 20, 24]. Останнім часом велика увага приділяється розладам не лише порожнинного, а й пристінкового травлення. Неповноцінне перетравлювання білків чинить токсичний вплив та сприяє підвищенню проникності слизових оболонок травного каналу. Печінка є одним з основних ефекторних органів фагоцитарної мононуклеарної системи. Вона бере участь у захваті й елімінації в першу чергу антигенів кишкового походження. Харчова алергія може виникнути в тому випадку, коли великі білкові молекули або їх частки проходять через печінковий фільтр, зберігаючи свої антигенні властивості [4]. Більше того, підвищена проникність тонкої кишки сприяє всмоктуванню великої кількості гістаміну з подальшим потраплянням його в кровотік, оскільки можливості діамінооксидази (гістамінази) щодо його інактивації обмежені. Масивному потраплянню антигенів з кишечника в циркуляцію крові також сприяє зниження функції підшлункової залози, зменшення кислотності шлункового соку, дисбіотичні процеси в кишечнику [6].
Розвиток алергічних реакцій при синдромі надмірного бактеріального росту пов’язують з посиленим розмноженням гістаміногенної флори, яка шляхом декарбоксилювання харчового гістидину підвищує кількість гістаміну в організмі. Має значення й зменшення продукції гістамінази ушкодженою оболонкою кишки. Алергенами можуть бути й продукти метаболізму мікроорганізмів [6, 11–13].
Розвиток патологічних реакцій на їжу може здійснюватися за рахунок різних механізмів. В основі істинної харчової алергії лежать імунні механізми — IgE-опосередкована реакція, еозинофільне запалення й клітинні імунні реакції, тобто патологічний процес має суто імунний характер. Реакція, що за клінічними проявами схожа на алергію, але не має імунозалежної фази розвитку, при збігу патохімічної й патофізіологічної стадії патологічного процесу характеризується як неімунна реакція (раніше називалася псевдоалергією). З часом у дітей з істинною харчовою алергією розвиваються неімунні реакції на їжу [12, 13, 17, 18].
Незважаючи на різні шляхи формування патологічних реакцій на їжу, всі вони супроводжуються розвитком синдрому ендогенної інтоксикації різного ступеня вираженості, клінічними проявами якого є загальна слабкість, дратівливість, порушення сну та апетиту, зниження концентрації уваги, зміни температурної реакції тіла, м’язові болі тощо. Нерідко інтоксикаційний синдром виражений слабко або маскується іншими клінічними проявами.
Потенційна патогенетична роль ендотоксемії незалежно від механізмів її походження може бути компенсована призначенням додаткової терапії, до якої належить еферентна терапія як метод елімінації токсичних продуктів із середовищ організму. Серед усіх її методів значну увагу привертає такий метод неінвазивної детоксикації, як ентеросорбція, яка при адекватному застосуванні дозволяє досягти позитивного локального й системного ефекту [15, 16]. Видалення сполук, що негативно впливають на організм, таких як алергени, активні перекисні сполуки, віруси, токсини, медіатори запалення, а також запобігання їх переміщенню в системний кровотік стимулює механізми резистентності організму, запобігає розвитку надмірних запальних реакцій і покращує метаболізм [1, 2, 13].
Сорбенти — це природні або синтетичні речовини, які містять найдрібніші часточки, що здатні адсорбувати й виводити з кишечника мікроби, віруси, алергени та різноманітні токсичні сполуки, немов притягуючи та вбираючи їх у себе. Основними їх характеристиками є сорбційна ємність (кількість речовини, яка здатна зв’язати сорбент на одиницю своєї маси (мг/г)), активна поверхня (загальна площа адсорбуючої поверхні на одиницю маси (м2/г)) і здатність сорбенту зв’язувати різні за масою й розміром молекули сорбату, у тому числі бактерії. Як правило, чим більша сорбційна поверхня сорбенту, тим вища його сорбційна ємність [15].
Основні механізми дії ентеросорбентів поділяються на чотири групи. Перша група механізмів стосується безпосередньо взаємодії та сорбції в просвіті ШКТ токсичних продуктів, екзо- та ендотоксинів, патогенних і умовно-патогенних мікроорганізмів, можливих алергенів, а також ксенобіотиків і метаболітів — як тих, що потрапили у просвіт ШКТ ззовні, так і тих, що утворилися в просвіті кишки. Механізми другої групи включають контактний вплив на структури ШКТ, дію на ферментний склад слизової оболонки органів травлення й вміст у тканинах кишечника біологічно активних речовин і, як наслідок, зміни функціонування ШКТ. Третя група механізмів стимулює вихід ендотоксинів із системного кровотоку й внутрішніх середовищ у просвіт ШКТ шляхом безпосередньої дифузії з крові і/або більшою мірою — виділення з травними соками. Четверта група механізмів включає опосередковане посилення обміну та екскреції токсинів органами детоксикації, а також фіксацію й перенесення на поверхні ентеросорбенту біологічно активних речовин, зокрема ферментів і жовчних кислот [15, 16].
У наш час великий інтерес викликають ентеросорбенти на основі глинистих мінералів, що належать до підкласу смектитів [15]. Механізм захисту ними слизової оболонки ШКТ від дії бактерій і порушення цілісності мембран ентероцитів полягає в збільшенні в’язкості слизу й гальмуванні деградації глікопротеїнів слизу. Цим зумовлені антацидні, антидіарейні й цитопротекторні властивості смектиту, наслідком дії якого є також і нормалізація водно-електролітного балансу й всмоктування нутрієнтів. Вступаючи у взаємодію зі слизом, смектит утворює на поверхні слизової оболонки захисну плівку, що знижує агресивну дію середовища шлунка. Він також сорбує гази, токсини, бактерії та віруси [1, 15]. Діосмектит здатен закріпити на своїй поверхні та елімінувати до 90 % вірусних часточок, зокрема ротавірусів [17].
У дослідах in vivo встановлено, що природний ентеросорбент діосмектит ефективно обмежує проникнення ротавірусів через захисний слизовий бар’єр кишечника тварин, а також має високу зв’язувальну здатність щодо ротавірусів: до 90 % вірусних часточок видаляється при мінімальній концентрації сорбенту в перші хвилини після їх контакту [17, 18]. Не випадково в документі Європейського товариства з дитячої гастроентерології у 2014 році зазначено: «Ефективна інтервенція включає введення діосмектиту. Антиінфекційні препарати слід давати у виняткових випадках» [23].
Ентеросорбентам властива практично повна відсутність несприятливих ефектів, що дозволяє призначати їх пацієнтам різних вікових груп, включаючи вагітних і дітей раннього віку, особливо це стосується діосмектитів, активованого вугілля й каоліну [5, 16]. Окремо слід зазначити, що ентеросорбенти не всмоктуються в ШКТ, а тому не чинять резорбтивної дії [15].
Ентеросорбенти широко використовуються також і для нормалізації гомеостазу в складі комплексного лікування хворих на алергічні захворювання як у гострому періоді, так і під час ремісії [12]. Використання сучасних ентеросорбентів при алергічній патології прямо впливає на потрапляння з просвіту кишечника алергенів, медіаторів анафілаксії, ксенобіотиків, біологічно активних речовин, екзотоксинів, перешкоджає утворенню циркулюючих імунних комплексів, що знижує навантаження на імунну систему та органи детоксикації, нормалізує дисбаланс біологічно активних речовин і мікробіоценоз в організмі дитини [11, 13].
Сорбенти, що рекомендуються для використання в педіатричній практиці у вигляді пероральних форм, повинні відповідати таким вимогам [10]:
— мати високу селективну сорбційну ємність;
— бути відносно інертними в просвіті кишечника;
— мінімально сорбувати корисні речовини;
— не спричиняти травматизації чи будь-яких реактивних змін у тканинах травного каналу;
— сприятливо впливати на шлунково-кишкову секрецію й мікробіоценоз органів травлення;
— не бути токсичними, а бути гіпоалергенними;
— добре виводитися з кишечника;
— не мати неприємного смаку й запаху;
— бути зручними для застосування в дітей (мати зручну форму й легко дозуватися).
Серед сорбентів природного походження привертає увагу смектит діоектаедричний (діосмектит), який давно та успішно використовується в клінічній практиці. Головна його властивість — відновлення мікробіоценозу й бар’єрної функції кишечника, причому це має переконливу доказову базу ефективності й безпечності [16].
Виражені сорбційні властивості, що відповідають цим вимогам, має діосмектит виробництва віт–чизняної фармацевтичної компанії «Фармак» під торговою назвою Апсорбін саше, який є дієтичною добавкою із беззаперечними перевагами, широким спектром використання для абсорбції із ШКТ і виведення з організму екзо- та ендогенних токсичних речовин різного походження (у тому числі продуктів життєдіяльності патогенних мікроорганізмів, харчових і бактеріальних алергенів) [10]. Активна речовина Апсорбіну саше — це подвійний силікат алюмінію й магнію (діосмектит — діоектаедричний смектит) природного походження з різноманітними адсорбційними властивостями, а також додатковими, так званими побічними, лікувальними ефектами. Діосмектит утворює з водою суспензію й має виражені адсорбуючі, обволікаючі та гастропротективні властивості. Площа активної поверхні 1 г діосмектиту становить 100 м2/г, при цьому вона в 50 разів більша за таку активованого вугілля, завдяки чому мікроскопічні часточки (1–2 мкм) з величезною сумарною поверхнею самі збираються на поверхні молекул токсинів і бактерій, зв’язують їх у комплекси та знешкоджують для подальшого виведення з кишечника.
Завдяки високій обволікаючій здатності діосмектиту щодо слизової оболонки травного каналу він цілеспрямовано запобігає порушенню водно-сольового обміну, внаслідок чого, з одного боку, виводяться з організму токсини й патогенна мікрофлора, а з іншого боку — не втрачаються корисні речовини (вода, вітаміни, мінерали та амінокислоти), що відбувається в разі інтенсивної діареї інфекційного або алергічного походження [10].
Гастропротективні властивості діосмектиту проявляються в захисті слизової оболонки ШКТ від агресивної дії соляної кислоти, пепсину й жовчних кислот. Особливе значення мають і цитопротекторні якості діосмектиту: взаємодіючи з глікопротеїнами слизу, він підвищує бар’єрну функцію слизової оболонки травного каналу, захищаючи її від негативного впливу мікроорганізмів, їх токсинів та інших подразників.
Апсорбін саше не руйнується й не всмоктується у ШКТ, а тому виділяється в незміненому вигляді. Він не чинить ніяких пошкоджень (механічних, хімічних) слизової оболонки порожнини рота, стравоходу, шлунка, кишечника й не впливає на склад і функції нормальної пристінкової мікрофлори кишечника.
Завдяки наведеним вище властивостям Апсорбін саше може бути рекомендований для корекції раціону дієтичного харчування в таких випадках [10]:
— при перших ознаках розладів травлення;
— при надмірному потраплянні в організм токсичних, отруйних речовин, ліків, а також при несприятливих екологічних умовах;
— при зміні звичного способу й раціону харчування під час відпустки, подорожі, відряджень;
— при кишкових інфекціях.
Апсорбін саше має вигляд порошку, що міститься в саше (3 г в 1 пакеті), має приємний смак, високий профіль безпеки та ефективності [23], тому використовується як у дорослих, так і в малят з 2-місячного віку. Розчинна (у воді) форма випуску є особливо зручною для використання в дітей. Його можна змішувати з різними продуктами дитячого харчування, легко застосовувати в школі, на роботі, під час подорожі. У дітей віком від 2 місяців до 2 років добова доза становить 1 саше, дітям 2–6 років — 2 саше на добу, від 6 років і дорослим — 3 саше на добу, середній курс лікування — 3–5 днів. При адсорбції зменшується швидкість і ступінь всмоктування в кишці різних ліків, які одночасно per os приймаються з Апсорбіном саше, і харчових інгредієнтів, тому інтервал між їх прийомом і прийомом ліків та їжі повинен становити 1–1,5 год [10].
Зважаючи на вищенаведене, привабливим і перспективним є застосування Апсорбіну саше в дітей з алергічною патологією, зокрема при алергічних дерматозах — атопічному дерматиті, гострій та рецидивній кропив’янці.
Мета. На базі інфекційно-боксованого відділення для дітей молодшого віку Національної дитячої спеціалізованої лікарні «ОХМАТДИТ» проведено дослідження ефективності та переносимості Апсорбіну саше в складі комплексної терапії в дітей, хворих на АД, гостру й рецидивнy кропив’янку.
Матеріали та методи
Основна група — діти, які отримували в комплексному лікуванні Апсорбін саше:
— 1-ша група — 20 дітей віком від 1 до 5 років, хворих на АД;
— 2-га група — 10 дітей віком від 2 до 15 років, хворих на гостру (5 дітей) і рецидивну (5 дітей) кропив’янку.
Групу порівняння становили діти, які були порівнянними з дітьми основної групи за віком, нозологічною формою й тяжкістю перебігу хвороби, у комплекс терапії яких ентеросорбент не був включений:
— 1-ша група — 20 дітей, хворих на АД;
— 2-га група — 10 дітей з кропив’янкою: 5 хворих з гострою формою і 5 — з рецидивною.
До комплексної терапії, що включала системні препарати й препарати зовнішнього застосування, було додано Апсорбін саше. Показанням до призначення Апсорбіну саше була гостра фаза алергічного процесу. Тривалість лікування становила 5 днів. Засіб призначався перорально, розведений у воді, у добовій дозі: дітям віком до 2 років — 1 саше (3 г), від 2 до 6 років — 2 саше (6 г), дітям від 6 років і старше — 3 саше (9 г), за 1–1,5 год до прийому їжі та між прийомами ліків.
Для отримання об’єктивної оцінки динаміки перебігу захворювання та ефективності терапії звертали увагу на аналіз даних алергологічного анамнезу й харчового щоденника, клінічні прояви, їх динаміку, індекс SCORAD (АД), аналіз крові, а саме динаміку показників імуноглобулінів класу Е, проводили мікробіологічне дослідження калу, дворазове вимірювання показників — до лікування (0-й день) та на 5-й день дослідження.
Результати та обговорення
Середній ступінь тяжкості АД був встановлений у 10 (50 %) дітей (середнє значення індексу SCORAD — 37,8), тяжкий ступінь — у 7 (35 %) дітей (середнє значення індексу SCORAD — 62,3), легкий ступінь тяжкості — у 3 (15 %) пацієнтів (середнє значення індексу SCORAD — 17,5).
У дітей із середнім ступенем тяжкості АД відзначалося свербіння шкіри в осередках ураження, шкірний процес був поширеним і локалізувався в ділянці шиї, шкіри обличчя, на згинальних і розгинальних поверхнях променевозап’ясткового суглоба. Також відмічалося порушення сну.
У дітей із тяжким перебігом АД були вогнища інфільтрації з глибокими тріщинами, осередки ліхенізації чітко позначені. Зі слів батьків та дітей відзначали тривожний сон та інтенсивне свербіння на початку захворювання.
Аналіз отриманих даних засвідчив, що на тлі застосування Апсорбіну саше відзначено сприятливу динаміку клінічних проявів АД, а саме зменшення вираженості об’єктивних ознак (набряку, гіперемії, висипу, кірок), зниження інтенсивності свербіння, порушень сну, що проявлялося значним зменшенням інтегративного індексу SCORAD (рис. 1).
Оцінка динаміки перебігу АД показала, що на тлі використання ентеросорбенту ознаки тяжкого перебігу нівелювались, на 7,2 % зменшилась кількість дітей з АД середнього ступеня тяжкості. Найбільш стійкими до терапії були діти із сенсибілізацією до аероалергенів та харчових антигенів, а також пацієнти з тяжким ступенем АД. На тлі терапії Апсорбіном саше гіперемія, набряк, запальна інфільтрація шкіри на обличчі більш активно досягали регресу, ніж в інших місцях. У дітей раннього віку клінічне покращання починалось раніше й шкірні прояви були не такими стійкими до лікування, як у дітей 3–5 років, у яких повільно піддавались лікуванню ураження шкіри в ділянці ліктьових згинів. Площа висипань та інтенсивність об’єктивних симптомів пропорційно зменшувалась у процесі проведення терапії в усіх дітей вже через 5 днів лікування. Вивчення динаміки свербіння показало, що уже через 5 днів лікування його вираженість значно зменшилась (майже у 2 рази). Діти стали більш спокійними, відновився сон. Через 7 днів відзначалось зниження рівня специфічних IgE до харчових алергенів на 25–30 %.
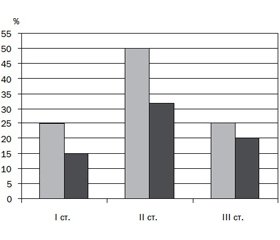
На тлі лікування ентеросорбентом у дітей з алергічними захворюваннями шкіри нормалізувались показники мікробіоценозу кишечника. У дітей із ІІ і ІІІ ступенем дисбактеріозу відмічався дефіцит біфідобактерій на тлі зменшення кількості лактобацил, дисбаланс кількості та якості кишкових паличок, при цьому була знижена кількість повноцінних ешерихій. У динаміці відзначено вірогідне підвищення до нормального рівня популяції біфідо- і лактобактерій у дітей, які лікувалися Апсорбіном саше та мали вихідний знижений рівень цих бактерій. При повторному дослідженні калу в дітей, які отримували Апсорбін саше, нормалізацію мікробіоценозу кишечника відзначено в 14 дітей: I ступінь — зниження дисбактеріозу до 15 %, II ступінь — зниження дисбактеріозу до 32 %, III ступінь — 20 %. У дітей групи порівняння нормалізація кишкової флори або не відзначалась, або відбувалась у більш пізні строки (рис. 3).
Використання Апсорбіну саше в дітей основної групи з гострою кропив’янкою та загостренням рецидивної кропив’янки сприяло покращанню стану хворих на 2-гу добу лікування в 45,4 % дітей, на 3-тю добу — у 42,3 %, що проявлялося зменшенням шкірного свербіння й відсутністю нових висипань на шкірі. Купірувано симптоми метеоризму, нормалізувалися випорожнення. За даними опитування дітей та їх батьків, на 3-й день використання Апсорбіну саше відмічалось покращання загального стану майже в усіх пацієнтів (96 %): зменшились неспокій і роздратованість за рахунок зниження інтенсивності свербіння, покращився апетит. В 1 дитини відзначався рецидивний перебіг (рис. 4). У дітей групи порівняння, які не приймали діосмектит, позитивна динаміка відмічалась на 6-ту — 7-му добу.
Отже, використання даного ентеросорбенту прискорило клінічне покращання загального стану й місцевих проявів у хворих з алергодерматозами після закінчення комплексної терапії з включенням Апсорбіну саше.
Під час комплексного лікування з Апсорбіном саше не зареєстровано ніяких небажаних ефектів та ускладнень. У жодному випадку не відзначено патологічних змін основних біохімічних констант організму. Побічних явищ у вигляді диспепсії та алергічних реакцій не виявлено. Слід відзначити добрі органолептичні властивості даного сорбенту. Діти, навіть молодшого віку, не відмовлялись від прийому Апсорбіну саше.
Отже, ентеросорбент Апсорбін саше зарекомендував себе як ефективний і важливий компонент комплексної терапії алергічної патології, що опосередкована харчовими продуктами. Застосування Апсорбіну саше дозволяє скоротити тривалість гострого періоду атопічного дерматиту та кропив’янки.
Отже, наведені вище дані однозначно свідчать про те, що терапія сучасними ентеросорбентами набуває особливого значення практично при будь-яких гострих і хронічних хворобах, для яких характерний синдром ендогенної інтоксикації, критичною ланкою якого є дисфункції мікробіоценозу й кишкового бар’єра, що властиво й алергічній патології.
Висновки
1. Апсорбін саше — сучасний ентеросорбент з унікальними властивостями, що добре переноситься дітьми будь-якого віку.
2. Включення в комплексну терапію АД і кропив’янки високоселективного ентеросорбенту Апсорбін саше є патогенетично обґрунтованим і клінічно доцільним.
3. Ефективність Апсорбіну саше переконливо доведена у хворих зі значущою харчовою алергією, що проявлялося скороченням тривалості гострого періоду АД та кропив’янки, зниженням рівня специфічного ІgE, покращанням стану шлунково-кишкового тракту (у тому числі зниженням дисбіозу при синдромі надлишкового бактеріального росту).
Конфлікт інтересів. Не заявлений.
Список литературы
1. Андрейчин М.А. Ефективність смекти у лікуванні хворих на інфекційні діареї [Текст] / М.А. Андрейчин // Інфекційні хвороби. — 2007. — № 1. — С. 69-72.
2. Атопический дерматит: Руководство для врачей / Под ред. Ю.В. Сергеева. — М.: Медицина для всех, 2002. — С. 181-183.
3. Атопический дерматит: Руководство для врачей / Под ред. проф. Т.В. Проценко. — 2-е изд., перераб. — Донецк: Восточный издательский дом, 2003. — 128 с.
4. Балаболкин И.И. Атопический дерматит у детей. — М.: Медицина, 1999. — 238 с.
5. Бурков С.Г. Современные возможности медикаментозного лечения заболеваний органов пищеварения у беременных женщин [Текст] / С.Г. Бурков, Е.И. Шарапова // Практическая медицина. — 2012. — № 3(58). — С. 29-32.
6. Горячева І.П. Оптимізація лікування хронічного гастродуоденіту у дітей (клініко-експериментальне дослідження) [Текст] / І.П. Горячева: Автореф. дис... канд. мед. наук. — 2000. — 18 с.
7. Калюжная Л.Д. Атопический дерматит. Современные вопросы диагностики и лечения [Текст] / Л.Д. Калюжная // Клиническая иммунология. Аллергология. Инфектология. — 2006. — № 1. — С. 19-22.
8. Козлов С.В. Влияние различных энтеросорбентов и энтерального питания на химус, интоксикацию, переваривающую и всасывающую функцию кишечника [Текст] / С.В. Козлов // Абдоминальная хирургия. — Ярославль, 1999. — С. 119-121.
9. Лысиков Ю.А. Применение сорбционных технологий в хирургической практике [Текст] / Ю.А. Лысиков // Сборник работ по применению препарата энтеросгель в медицине. — М., 2002. — Ч. I. — С. 13-16.
10. Матвиенко С. Апсорбин саше — эффективное средство выведения токсинов из организма [Текст] / С. Матвиенко // Современная фармация. — http://modern-pharmacy.com.ua/2426
11. Нагорная Н.В. Использование энтеросорбции в лечении атопического дерматита [Текст] / Н.В. Нагорная, Е.В. Бордюгова, А.В. Дубовая // Современная педиатрия. — 2005. — № 4(9). — С. 67-70.
12. Охотникова Е.Н. Использование энтеросорбента «Белый уголь» при аллергических заболеваниях у детей: результаты собственных исследований [Текст] / Е.Н. Охотникова, Ю.И. Гладуш, Т.П. Иванова // Современная педиатрия. — 2009. — № 4(26). — С. 39-43.
13. Охотникова Е.Н. Место современной энтеросорбции в лечении детей с аллергическими дерматозами [Текст] / Е.Н. Охотникова, К.В. Меллина, Л.В. Бондаренко, И.В. Паппа // Современная педиатрия. — 2012. — № 3(43). — С. 79-89.
14. Палий И.Г. Применение энтеросорбента Энтеросгель в комплексном лечении заболеваний, сопровождающихся кожными аллергическими проявлениями (краткий обзор данных литературы) [Текст] / И.Г. Палий, И.Г. Резниченко // Медико-биологические аспекты применения энтеросорбента энтеросгель для лечения различных заболеваний: Сб. науч. работ. — К., 2004. — С. 48-51.
15. Тишин А.Н. Физико-химические свойства монтмориллонитовых глин и их применение в клинической практике (обзор литературы) [Текст] / А.Н. Тишин, У.А. Круть, О.М. Тишина, Е.А. Бесхмельницына и др. // Сборник работ по применению препарата энтеросгель в медицине. — М., 2002. — Ч. I. — С. 13-16.
16. Урсова Н.И. Место энтеросорбентов в терапии синдрома эндогенной интоксикации [Текст] / Н.И. Урсова // Вопр. совр. педиатрии. — 2012. — Т. 11, № 6. — С. 26-31.
17. Усенко Д.В. Острые кишечные инфекции у детей в практике педиатра: возможности диагностики и терапии [Текст] / Д.В. Усенко, А.А. Плоскирева, А.В. Горелов // Вопр. совр. педиатрии. — 2014. — Т. 13, № 3. — С. 12-20.
18. Фадеенко Г.Д. «Смекта» — безопасный препарат с поливалентным механизмом действия в лечении заболеваний желудочно-кишечного тракта [Текст] / Г.Д. Фадеенко, О.Г. Гапонова // Сучасна гастроентерологія. — 2013. — № 1(69). — С. 111-121.
19. Щелкунов Л.Ф. Энтеросорбенты экологически вредных веществ — важная группа пищевых добавок в рационе человека [Текст] / Л. Ф. Щелкунов // Сучасні проблеми токсикології. — 2003. — № 4. — С. 68-73.
20. Agostoni C. Growth pattern of breastfed and no breastfed infants with atopic dermatitis in the first year of life [Теxt] / C. Agostoni, F. Grandi, S. Scaglioni et al. // Pеdiatry. — 2000. — № 106(5).
21. Full-Young Chang. Efficacy of dioctahedral smectite in treating patients of diarrhea-predominant irritable bowel syndrome [Теxt] / Full-Young Chang, Ching-Liang Lu, Chih-Yen et al. // J. Gastroenterology, Hepatology. — 2007. — № 22. — Р. 2266-2272.
22. Guarino A. Clinical role diosmectite in the management of diarrhea [Теxt] / A. Guarino, A.L. Vecchio, M.R. Pirozzi // Expert. Opin. Drug Metab. Toxicol. — 2009. — № 5(4). — Р. 433-440.
23. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition / European Society for Pediatric Infectious Diseases Evidence-Based Guidelines for the Management of Acute Gastroenteritis in Children in Europe: Update 2014 // J. Рed. Gastroenterology, Nutrition. — 2014. — Vol. 59, № 1 (July). — P. 132-152.
24. Nakagami, T. Is atopy increasing? [Теxt] / T. Nakagami, H. Itaya, T. Tominaga et al. // Lancet. — 1994. — № 343. — Р. 121-122.

/32-1.jpg )