Острые респираторные заболевания занимают ведущее место в структуре заболеваемости детей и являются наиболее распространенной причиной обращений к педиатру. Боль в горле как частый симптом острого фарингита и тонзиллита, в свою очередь, является самой частой причиной обращения за амбулаторной медицинской помощью или самолечения. По данным статистики, в США ежегодно врачами общей практики и педиатрами осуществляется до 15 млн консультаций в связи с подобной жалобой [1, 2].
Фарингит, как и тонзиллит, представляет собой воспалительное заболевание глотки и небных миндалин, соответственно, в настоящее время в зарубежной литературе в связи с едиными подходами к лечению оба этих заболевания объединяют в одно и называют «тонзиллофарингит», так как воспаление миндалин редко обходится без воспаления задней стенки глотки и наоборот. Возможно, это происходит из-за тесного анатомического соседства и сходства гистологического строения, так как миндалины и фолликулы задней стенки глотки — это скопления лимфоидной ткани [3].
По данным Центра по контролю и профилактике заболеваний [4], подавляющее большинство (85 %) случаев острого тонзиллофарингита имеет вирусное происхождение (респираторные и энтеровирусы, вирус Эпштейна — Барр) и поэтому не требует назначения антибактериальной терапии. Среди бактериальных возбудителей важнейшее значение имеет гемолитический стрептококк группы А (БГСА). С этим возбудителем связано от 5 до 15 % случаев острых тонзиллофарингитов во взрослой популяции и 20–30 % — у детей [5, 6]. Ряд авторов указывают на определенную роль других бактериальных возбудителей, таких как стрептококки группы С и G, Streptococcus pneumoniae [7], Arcanobacterium haemolyticum, анаэробы, Mycoplasma pneumoniae и Chlamydophila pneumoniae [8]. Тем не менее отсутствие доказательств участия указанных микроорганизмов в формировании осложнений острого тонзиллофарингита и практическая невозможность дифференцировать носительство подобной флоры и ее непосредственное этиологическое значение заставляют с определенной долей критики относиться к приведенным данным и необходимости проведения антибактериальной терапии в отношении указанных возбудителей. Таким образом, современная стратегия в отношении антибактериальной терапии острых тонзиллофарингитов определяется этиологической расшифровкой диагноза. В качестве практически единственного показания к системной противомикробной терапии у иммунокомпетентных лиц рассматривается стрептококковый (БГСА) генез воспаления (за исключением крайне редких случаев дифтерии и гонококкового тонзиллита). Эта концепция отражена и в Международной классификации болезней 10-го пересмотра, в соответствии с которой острые фарингиты и тонзиллиты разделены на «Стрептококковые» (J02.0 [9] и J03.0 [10]) и «Вызванные другими уточненными возбудителями» (J02.8 и J03.8) [9, 10].
Попытки систематизировать и стандартизировать тактику лечения острых тонзиллофарингитов в течение последних лет вылились в создание множества национальных и международных клинических рекомендаций и систематических обзоров, таких как «Руководство по диагностике и лечению острого фарингита» (Toward Optimized Practice, Guidelines Alberta clinical practice, Canada, 2008, update) [11], «Анализ рекомендаций международных руководств по лечению острых фарингитов у взрослых и детей» (обзор 12 руководств, E. Chiapinni и соавт., 2011) [12], «Рекомендации по ведению острой боли в горле» под руководством P. Huovinen, 2012 (Евро–пейское общество по клинической микробиологии и инфекционным болезням, ESMID) [13], «Практическое руководство по диагностике и лечению БГСА-фарингитов» (Американское общество по инфекционным болезням, IDSA, Stanford T. Shulman, 2012) [14], «Antibiotic prescription strategies for acute sore throat: a prospective observational cohort study» [15].
Как представлено в рекомендациях Медицинской ассоциации Канады (Альберта) [11], вирусы являются наиболее частой причиной острых фарингитов, в связи с чем антибиотики не показаны для лечения. Также в отдельный пункт вынесена рекомендация не использовать такие препараты, как антисептические или антибактериальные пастилки, спреи и антибактериальные препараты для полоскания горла, в связи с тем что они могут способствовать росту резистентности орофарингеальной флоры.
Руководство рекомендует нестероидные противовоспалительные препараты для контроля симптомов и профилактики развития осложнений, связанных с распространением воспалительного процесса.
Согласно новым рекомендациям Американского общества инфекционных болезней (Infectious Diseases Society of America), большинство инфекционных заболеваний горла вызываются вирусами и не должны лечиться антибиотиками [14]. Этиология острого фарингита представлена в табл. 1.
За исключением весьма редких инфекций (например, вызванных Corynebacterium diphteriae и Neisseria gonorrhoeae), антибактериальная терапия при остром фарингите неэффективна, если заболевание не вызвано БГСА.
Таким образом, у больного с фарингитом ключевое значение имеет установление возможной связи с БГСА, поскольку только тогда антибактериальная терапия, несомненно, показана.
Основной целью этих рекомендаций, опубликованных в сентябрьском (2012) номере журнала Clinical Infectious Diseases, является ограничение применения антимикробных препаратов для лечения вирусных инфекций задней стенки глотки, а также своевременное выявление и адекватное лечение фарингитов, вызываемых стрептококками группы А (стрептококковая ангина).
По мнению американских ученых, данные рекомендации являются важным своевременным руководством для врачей по обследованию и лечению больных, страдающих стрептококковым тонзиллофарингитом. Стрептококковая ангина является распространенным заболеванием, однако в повседневной практике чаще встречаются вирусные инфекции. По словам исследователей, врач должен уметь различать их, что позволит избежать ненужного назначения антибиотиков, которые обладают побочными эффектами, а также повышают вероятность того, что последующая инфекция (у того же пациента или у другого) станет устойчивой к лечению антибиотиками.
Ученые отмечают, что, хотя бактериальные и вирус–ные инфекционные заболевания горла часто имеют ряд схожих симптомов, другие проявления, такие как кашель, насморк, охриплость голоса и язвы в полости рта, наиболее характерны для вирусной инфекции.
Напротив, стрептококковую природу заболевания следует заподозрить при остром его начале, наличии резкой болезненности при глотании и лихорадки. В таких случаях для определения возбудителя можно использовать независимый анализ для быстрого выявления антигена. У детей младше 3 лет проведение такого анализа не является обязательным, так как в данной возрастной группе маловероятно развитие стрептококковой ангины.
В настоящих рекомендациях указывается, что клиницист должен разъяснять пациентам, что не все инфекции имеют бактериальную природу и, соответственно, не во всех случаях следует принимать антибиотики, которые не помогут при вирусной инфекции, и что существуют другие методы лечения.
Значимой рекомендацией этого руководства является положение о том, что нестероидные противовос–палительные препараты должны быть использованы в качестве дополнения к адекватной антибактериальной терапии фарингита, ассоциированного с БГСА, для контроля болевого и воспалительного синдромов [14].
Европейское общество по клинической микробиологии и инфекционным заболеваниям (European Society for Clinical Microbiology and Infectious Diseases, ESMID) в апреле 2012 года в журнале Clinical microbiology and infection (April 2012, volume 18, supplement 1, p. 1-27) [13] опубликовало обновленное руководство по диагностике и лечению пациентов с острой болью в горле. Это руководство отвечает на вопросы, касающиеся использования клинико-диагностических критериев и лабораторной диагностики для выявления возможной бактериальной инфекции при острой боли в горле. В дополнение к рекомендациям по диагностическому поиску приведены режимы лечения первого выбора. Для диагностики вероятности стрептококковой этиологии боли в горле рекомендуется использовать шкалу оценки клинических симптомов Центора [16], которая помогает выявить пациентов с высокой вероятностью стрептококковой этиологии заболевания (табл. 2). У пациентов с высокой вероятностью стрептококковой инфекции (3–4 балла по шкале Центора) врач может рассматривать использование быстрого антигенного теста. У пациентов с низкой вероятностью стрептококковой этиологии боли в горле (1–2 балла по шкале Центора) нет необходимости рутинно проводить быстрый антигенный тест.
Шкала оценки клинических симптомов Центора может использоваться только для взрослых пациентов, для детей от 3 до 15 лет в 2004 г. W. McIsaac была предложена шкала оценки клинических симптомов с учетом возраста [17] (табл. 3).
/84-1.jpg )
Рекомендации по выбору тактики лечения преду–сматривают, что антибиотики не должны использоваться у пациентов с менее серьезными признаками боли в горле, в частности при оценке по шкале Центора от 0 до 2 баллов (уровень доказательности АI — на основании систематических обзоров или данных метаанализов или рандомизированных клинических исследований). Если у пациентов более серьезные проявления боли в горле, соответствующие 3–4 баллам по шкале Центора, следует обсудить с ними вероятные плюсы антибиотикотерапии. Умеренные преимуще–ства антибиотикотерапии, которые наблюдались у БГСА-позитивных пациентов и пациентов с клиническими признаками боли в горле, которые соответствовали 3–4 баллам по шкале Центора, необходимо сопоставить с побочными эффектами — воздействием антибиотика на микробиоту, увеличением бактериальной резистентности, с медикаментозной нагрузкой на пациента и затратами на лечение. Боль в горле не следует лечить антибиотиками, чтобы предотвратить развитие ревматизма и острого гломерулонефрита у больных низкого риска (например, пациентов без предшествующей истории ревматизма, АI). Предотвращение гнойных осложнений не является специфическим показанием для антибиотикотерапии при боли в горле. Клиницистам не нужно использовать антибиотики для лечения большинства случаев острой боли в горле, чтобы предотвратить ангину, острый средний отит, шейный лимфаденит, мастоидит и острый синусит [13].
Рекомендацией с наивысшим уровнем доказательности является использование нестероидных противовоспалительных препаратов (НПВП) для лечения боли в горле.
Проблемы, ассоциированные с нерациональной антибактериальной терапией
Необоснованное применение лекарственных средств и полипрагмазия — серьезнейшие проблемы современной фармакотерапии. Это в полной мере касается и применения средств антибактериальной терапии. Согласно статистике Всемирной организации здравоохранения (ВОЗ), во всем мире до 75 % антибактериальных лекарственных средств применяются нерационально [18]. По мнению экспертов ВОЗ, использование даже локальных антибиотикосодержащих средств не позволяет создать высокие концентрации препарата в очаге инфекции, что способствует стремительному росту числа антибиотикорезистентных бактерий [19]. Разно–образие микроорганизмов, заселяющих респираторный тракт, позволяет оптимизировать передачу детерминант резистентности, и в качестве резервуара в этом случае выступает нормальная микрофлора человека. Кроме того, показана и возможность обмена генетической информацией между бактериями, что вносит значительный вклад в процесс формирования резистентных штаммов и способствует распространению их в популяции. Помимо повсеместного роста антибиотикорезистентности, последствиями необос–нованного назначения антибиотиков являются увеличение количества случаев побочных эффектов (до 25–30 % всех побочных эффектов лекарственных средств), возникновение ряда нежелательных лекарственных взаимодействий [20].
Несмотря на то что метаанализы клинических исследований, проведенные специалистами Кокрановского сотрудничества, не выявили преимуществ рутинного применения антибиотиков при лечении острого бронхита и боли в горле, врачи повсеместно продолжают назначать антибактериальные препараты при этих заболеваниях [21, 22].
Вирусное инфицирование может служить инициирующим фактором для присоединения бактериального патогена. Помимо этого, к бактериальному инфицированию могут приводить и разные заболевания, сопровождающиеся снижением местной и общей сопротивляемости организма, общее охлаждение или местное переохлаждение глотки холодным воздухом и пищей; раздражение едкими газами или запыленным воздухом, курение, наличие выделений, стекающих по задней стенке глотки при воспалении околоносовых пазух.
В ответ на внедрение инфекционного агента происходит развитие воспалительного процесса в глоточных миндалинах, что проявляется местным нарушением кровообращения, повышением проницаемости сосудистой стенки, снижением уровня нейтрофилов, лимфоцитов, фагоцитирующих клеток, местной иммунодепрессией и, как следствие, активацией транзиторной микрофлоры с постепенным развитием сначала острого, а затем и хронического воспаления в тканях небных миндалин [24].
Известно, что основным патогенетическим механизмом возникновения боли в горле является воспаление. В свою очередь, любое воспаление связано с гиперфункцией провоспалительных простагландинов, обусловленной активацией фермента циклооксигеназы (ЦОГ). ЦОГ-1 обладает функциональной активностью структурного фермента, экспрессируется в большинстве клеток, регулирует продукцию простагландинов, участвующих в обес–печении нормальной функциональной активности клеток. ЦОГ-2 в норме отсутствует в большинстве тканей, однако ее экспрессия существенно увеличивается на фоне воспаления.
С учетом этиопатогенетических особенностей заболеваний, сопровождающихся воспалением и болью в горле, становится очевидной нерациональность назначения антибактериальных препаратов в большинстве случаев. Альтернативными лекарственными средствами для лечения боли в горле являются нестероидные противовоспалительные препараты. Однако врачу всегда необходимо соотносить пользу с возможными рисками, поскольку нестероидные противовос–палительные препараты для системного применения могут вызывать нежелательные побочные эффекты, среди которых: дисбактериоз слизистой оболочки ротоглотки (антисептики), гастропатия и нефропатия (системные НПВП), гепатотоксичность (парацетамол) и гематотоксичность (метамизол натрия), возрастные ограничения при применении ацетилсалициловой кислоты у детей (синдром Рея) [25].
Кроме того, в связи с вирусной этиологией многих форм тонзиллофарингита, появлением все большего числа резистентных штаммов бактерий, а также нежелательными побочными эффектами антибиотиков (в том числе при использовании топических форм) местное назначение лекарственных средств, обладающих выраженной противовоспалительной активностью, во многих случаях может стать альтернативой традиционной антибиотикотерапии [26]. Таким образом, именно воспалительный процесс является одной из важнейших точек приложения лекарственной терапии при патологии респираторного тракта и лор-органов.
Возможности нестероидных противовоспалительных препаратов
Лечение, направленное на подавление воспалительной реакции в ротоглотке, может быть эффективным при применении нестероидных противовоспалительных препаратов, действующих на ключевое звено поддержания этой реакции.
Альтернативой системным НПВП считаются местные лекарственные формы в виде спреев или растворов для полоскания ротовой полости и горла [27], которые могут рассматриваться в том числе и как средства патогенетической терапии. Местные противовоспалительные препараты для лечения тонзиллофарингита должны соответствовать ряду требований: быстро купировать боль, иметь низкую скорость абсорбции со слизистых оболочек, не оказывать аллергического и раздражающего действия на слизистую оболочку. Целью местного лечения НПВП при тонзиллофарингите является облегчение боли в глотке и затруднения глотания, снижение продолжительности и интенсивности местного воспаления благодаря противовоспалительным свойствам и системному обезболивающему эффекту.
Наиболее часто для устранения воспаления в полости рта и горла применяются препараты, содержащие в качестве противовоспалительного компонента бензидамина гидрохлорид [28], холина салицилат [29] и фенол [30].
Пациенты и методы
Открытое рандомизированное проспективное клиническое исследование эффективности применения местных препаратов с противовоспалительным действием при тонзиллофарингите проводилось в трех параллельных группах детей. В исследование были включены 67 детей в возрасте от 4 до 16 лет (средний возраст 9,10 ± 3,99 года) с диагнозом: ОРВИ, тонзиллофарингит. Диагноз был основан на клинических признаках: температуре, симптомах интоксикации (головная боль, общее недомогание, потеря аппетита, нарушение сна), катаральных симптомах (боль в горле, сухой кашель, гиперемия, отечность и зернистость задней стенки глотки и миндалин, гипертрофия подчелюстных лимфоузлов).
Критерии включения детей в исследование были следующие: срок от начала заболевания 1–2 дня, состояние пациентов средней тяжести, отсутствие местной терапии перед началом исследования, способность пациентов или их родителей адекватно оценить состояние (свое или ребенка) и симптомы болезни.
Критерии исключения: температура тела выше 39 °С, наличие гнойных налетов на миндалинах, болезненность шейных лимфоузлов, общее тяжелое состояние ребенка, что требовало назначения системной антибактериальной терапии.
Всем пациентам было рекомендовано: полупостельный режим, щадящая диета, теплое щелочное питье, жаропонижающие препараты (парацетамол, ибупрофен) по необходимости.
Пациенты были разделены на три группы. 27 пациентов первой группы (10 мальчиков и 17 девочек, средний возраст 9,40 ± 4,09 года) в качестве местной противовоспалительной терапии получали оригинальное лекарственное средство в виде спрея с действующим веществом бензидамина гидрохлоридом в возрастных дозировках (в среднем 4 впрыскивания) 4 раза в сутки, 20 пациентов второй группы (12 мальчиков и 8 девочек; в группу входили дети только старше 6 лет, средний возраст 12,2 ± 5,8 года) получали комбинированный препарат в форме спрея, содержащий гексетидин, хлорбутанол и холина салицилат, в возрастных дозировках (одно распыление) 3 раза в сутки, третья группа — 20 детей (14 мальчиков и 6 девочек, средний возраст 8,2 ± 4,8 года) — получала в качестве местной терапии спрей, содержащий в качестве действующего вещества фенол, в возрастных дозировках (в среднем 4 впрыскивания) 6 раз в сутки.
Группы были сопоставимы по возрасту, полу и начальным клиническим проявлениям, которые позволили сравнить результаты наблюдений и определить их надежность. Размер выборки был достаточным для достоверности выводов. Осмотр детей проводился ежедневно до выздоровления и включал в себя сбор и анализ анамнеза, субъективную оценку интенсивности симптомов (першение и боль в горле, боль при глотании, характер кашля) самим пациентом, объективную оценку наличия и тяжести фарингоскопических симптомов (размер миндалин, лимфатических узлов) врачом. Тяжесть симптомов оценивали по 4-балльной шкале, где 0 — нет симптомов, 1 — легкие симптомы, 2 — умеренные симптомы, 3 — тяжелые симптомы. Все результаты были занесены в индивидуальную регистрационную карточку. Эффективность терапии определялась по времени снижения симптомов заболевания, до полного исчезновения клинических симптомов, наличию и тяжести острых –осложнений ОРВИ. На протяжении всего исследования проводился мониторинг побочных реакций, в случае возникновения которых употребление препаратов могло быть прекращено. Статистический анализ проводили на персональном компьютере с помощью Statgraphics Plus 3.0 и Microsoft Excel 2010. Для параметрических переменных средние значения индекса пациентов (М) и стандартного отклонения (s) были определены. Разница между средними значениями считалась значимой при уровне значимости р < 0,05, что соответствует достоверности ≥ 0,95.
Результаты и обсуждение
Причиной обращения в клинику для всех пациентов была лихорадка (температура тела у детей составляла 37,5–38,5 °С), наличие признаков интоксикации (недомогание, слабость, снижение аппетита), боль в горле, сухость, першение в горле и сухой кашель. При фарингоскопии у всех пациентов выявлены различной степени тяжести типичные симптомы воспаления миндалин: гиперемия и отечность миндалин, передних арок небных миндалин и язычка, зернистость и гиперемия задней стенки глотки. У 31 ребенка (46,2 %) зафиксировано увеличение регионарных лимфатических узлов. Большинство пациентов пришли в клинику на 2-й день болезни (73,3 %). В ходе первоначального –осмотра выраженность симптомов интоксикации, сухого кашля, боли в горле, температуры тела, а также объективных признаков заболевания (гиперемия слизистой оболочки ротоглотки, зернистость и рыхлость задней стенки глотки, увеличение миндалин и гипертрофия регионарных лимфоузлов) у детей во всех группах не различалась статистически (табл. 4). Таким образом, в момент посещения клиники группы были сравнимы на основе демографических и клинических критериев.
/86-1.jpg )
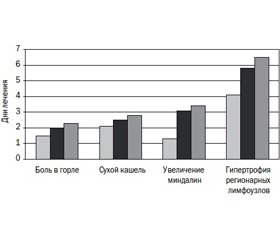
В процессе лечения отмечено более быстрое купирование (в течение первых суток) повышенной температуры тела в группе пациентов, получавших спрей, содержащий бензидамина гидрохлорид (через 1,50 ± 0,85 дня). При этом в группе, получавшей комбинированный спрей и спрей на основе фенола, снижение температуры тела у детей зафиксировано только после вторых суток лечения (2,00 ± 0,57 и 2,30 ± 0,34 дня соответственно). Также у детей, получавших спрей, содержащий бензидамина гидрохлорид, быстрее, чем при применении комбинированного спрея и спрея, содержащего фенол, купировались основные симптомы тонзиллофарингита (табл. 5, рис. 1).
/87-1.jpg )
/87-2.jpg )
Независимо от времени нормализации клинической картины, в соответствии со стандартами лечения детей с неосложненным тонзиллофарингитом в амбулаторных условиях все пациенты были выписаны с восстановлением на 7-й день наблюдения. При приеме терапии было установлено, что трое детей из группы, получавшей комбинированный спрей, прервали лечение из-за ощущения жжения при нанесении спрея на слизистую оболочку ротоглотки, двое детей из группы, получавшей спрей на основе фенола, прекратили лечение из-за развития аллергических реакций (один ребенок — крапивница, один ребенок — отек слизистой оболочки полости рта). Следует отметить, что отмеченные выше причины отказа от лечения описаны в инструкции к медицинскому применению указанных лекарственных препаратов. В группе детей, получавших лечение с использованием спрея на основе бензидамина гидрохлорида, аллергических реакций не отмечено.
Таким образом, наше клиническое наблюдение показало, что применение местных нестероидных препаратов для лечения детей с тонзиллофарингитами является эффективным для скорейшего выздоровления и профилактики развития осложнений (трахеит, бронхит, синусит). Спрей, содержащий в качестве действующего вещества бензидамина гидрохлорид, был эффективнее, чем комбинированный спрей (гексетидин + хлорбутанол + холина салицилат) и спрей на основе фенола, по скорости устранения симптомов тонзиллофарингита, а также по переносимости лечения детьми. Спрей на основе бензидамина гидрохлорида имеет быстрый обезболивающий эффект, что позволяет сократить использование системных НПВП (парацетамол, ибупрофен), снизить лекарственную нагрузку на ребенка. Препарат ускоряет обратное развитие симптомов воспаления, удобен в применении и в большинстве случаев с удовольствием используется детьми.
Выводы
Таким образом, с появлением НПВП для местного применения стал возможен прицельный подход к решению проблемы купирования боли в горле и улучшения качества жизни пациентов при инфекционно-воспалительных процессах в ротоглотке, в частности при тонзиллофарингите как вирусного, так и бактериального происхождения.
Применение оригинального лекарственного препарата в виде спрея, содержащего бензидамина гидрохлорид, приводит к скорейшему устранению боли и воспаления в горле, что предупреждает распространение воспалительного процесса по дыхательным путям и развитие осложнений.
Список литературы
1. Delayed antibiotic prescribing strategies for respiratory tract infections in primary care pragmatic, factorial, randomized controlled trial // BMJ. — 2014. — 348. — g 1606; doi: 10.1136/bmg.g 1606 (published 5 March 2014)
2. Shulman S.T., Bisno A.L., Clegg H.W., Gerber M.A., Kaplan E.L., Lee G., Martin J.M., van Beneden C. Clinical Practice Guideline for the Diagnosis and Management of Group A Streptococcal Pharyngitis: 2012 Update by the Infectious Diseases Society of America // Clin. Infect. Dis. Adv. — 2012. — Access published September 9.
3. Bisno A.L. Acute pharyngitis: etiology and diagnosis // Pediatrics. — 1996. — 97. — 949-954.
4. http://www.cdc.gov/getsmart/campaign-materials/info-sheets/child-pharyngitis.pdf
5. Ebell M.H., Smith V.F., Barry H.C., Ives K., Carey M. The rational clinical examination. Does this patient have strep throat? // JAMA. — 2000. — 284. — 2912-2918.
6. Дарманян А.С. Совершенствование методов диагностики и лечения острых тонзиллитов у детей: Автореф. дис… канд. мед. наук. — М., 2010.
7. Bista M., Amatya R.C., Basnet P. Tonsillar microbial flora: a comparison of infected and non-infected tonsils // Kathmandu Univ. Med. J. — 2006. — 4 (1). — 18-21.
8. Esposito S., Bosis S., Begliatti E., Droghetti R. et al. Acute tonsillopharyngitis associated with atypical bacterial infection in children: natural history and impact of macrolide therapy // Clin. Infect. Dis. — 2006. — 43 (2). — 206-209.
9. http://mkb-10.com/index.php?pid = 9012
10. http://mkb-10.com/index.php?pid = 9016
11. Guideline for the Diagnosis and Management of Acute Pha–ryngitis. Toward Optimized Practice. Guideline Alberta Clinical Practice. Administered by the Alberta Medical Association. www.topalbertadoctors.org
12. Chiappini E., Principi N., Mansi N., Serra A., de Masi S., Camaioni A., Esposito S., Felisati G., Galli L., Landi M., Speciale A.M., Bonsignori F., Marchisio P., de Martimo M. Management of acute pharyngitis in children: summary of the Italian Institute of Health guidelines // Clin. Ther. — 2012. — 34 (6). — 1442-1458.
13. Pelluchi C., Grigoryan L., Galeone C., Esposito S., Huovi–nen P., Little P. and Verheij T. Guideline for the Management of Acute Sore Throat. ESMID Sore Throat Guideline Group // Clinical Microbiology and Infection. — 2012. — Vol. 18, Suppl. 1, April 12.
14. Stanford T. Shulman, Alan L. Bisno, Herbert W. Clegg, Michael A. Gerber, Edward L. Kaplan, Grace Lee, Judith M. Martin, and Chris Van Beneden. Clinical Practice Guideline for Diagnosis and Management of Group A Streptococcal Pharyngitis: 2012 Update by the Infectious Diseases Society of America // Clinical Infectious Di–seases Advance Access. — Published September 9, 2012.
15. Little P., Stuart B., Hobbs R. Antibiotic strategies for acute sore throat: a prospective observational cohort study // The Lancet Infectious Diseases, Early Online Publication, 17 January 2014; doi: 10.1016/S1473-3099 (13)70294-9
16. Meier F.A., Centor R.M., Graham L. Jr., Dalton H.P. Cli–nical and microbiological evidence for endemic pharyngitis among adults due to group C streptococci // Arch. Intern. Med. — 1990. — 150. — 825-829.
17. McIsaac W.J., Kellner J.D., Aufricht P., Vanjaka A., Low D.E. Empirical validation of guidelines for the management of pharyngitis in children and adults // JAMA. — 2004. — 291. — 1587-1595. Erratum in: JAMA. — 2005. — 294. — 2700.
18. Глобальная стратегия ВОЗ по сдерживанию устойчивости к противомикробным препаратам WHO/CDS/CSR/DRS/2001.2a, http://www.antibiotic.ru/files/pdf/execsumr.pdf
19. http://www.euro.who.int/en/health-topics/Health-systems/medicines
20. http://www.euro.who.int/en/health-topics/disease-prevention/antimicrobial-resistance/antimicrobial-resistance
21. Spinks A., Glasziou P.P., Del Mar C.B. (2013). Antibiotics for sore throat. Cochrane Database of Systematic Reviews Issue 11: CD000023. DOI: 10.1002/14651858. CD000023.pub4
22. Spurling G.K.P., Del Mar C.B., Dooley l. et al. Delayed antibiotics for respiratory infections // Cochrane Database of Systematic Reviews. — 2013. — Issue 4: CD004417. DOI: 10.1002/14651858. CD004417.pub4

/83-1.jpg )
/84-1.jpg )
/86-1.jpg )
/87-1.jpg )
/87-2.jpg )