Журнал «Здоровье ребенка» Том 12, №7, 2017
Роль пробиотиков в формировании микрофлоры у детей, вскармливаемых искусственными смесями
Резюме
У статті представлені сучасні уявлення про значення грудного молока в процесі первинного бактеріального заселення травного тракту в дітей. Відображено особливості девіації становлення мікробіоти кишечника при вигодовуванні дітей штучними сумішами і ризик виникнення асоційованих із мікробіотою порушень стану здоров’я у дітей. Представлені докази профілактичної дії бактерій Bifidobacterium animalis subsp. lactis BB-12, що запобігає виникненню гострих інфекційних захворювань респіраторного і травного тракту і алергічних захворювань.
В статье даны современные представления о значении грудного молока в процессе первичного бактериального заселения пищеварительного тракта у детей. Отражены особенности девиации1 становления микробиоты кишечника при вскармливании детей искусственными смесями и риск возникновения ассоциированных с микробиотой нарушений состояния здоровья у детей. Представлены доказательства профилактического действия бактерий Bifidobacterium animalis subsp. lactis BB-12, предупреждающего возникновение острых инфекционных заболеваний респираторного и пищеварительного тракта и аллергических заболеваний.
The article gives modern ideas about the importance of breast milk in the process of primary bacterial colonization of the digestive tract in children. The features of the deviation in the formation of intestinal microbiota when feeding children with formulas and the risk of microbiota-associated health disorders in children are described. The evidence of preventive action of Bifidobacterium animalis subsp. lactis BB-12, which prevents the emergence of acute infectious diseases of the respiratory and digestive tract and allergic diseases, is given.
Ключевые слова
діти; грудне вигодовування; молочні суміші; мікробіота; Bifidobacterium animalis subsp. lactis BB-12
дети; грудное вскармливание; молочные смеси; микробиота; Bifidobacterium animalis subsp. lactis BB-12
children; breastfeeding; infant formula; microbiota; Bifidobacterium animalis subsp. lactis BB-12
Введение
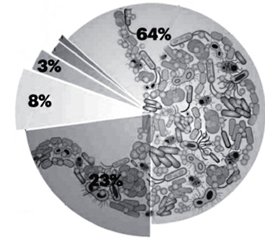
Микробиота пищеварительного тракта человека является сверхсложной биологической эко-системой, организованной различными бактериями, число которых достигает 1013–1014 [3, 50]. Бактериальное представительство в организме человека в 10 раз больше числа его собственных клеток, а размер общего генома микробиоты превосходит геном человека более чем в 150 раз. По предварительной оценке, общий геном микробиоты содержит около 3,3 млн микробных генов [35]. Количество колонизирующих микроорганизмов зависит от места расположения бактериальной колонии. В одном грамме содержимого ротовой полости содержится 1012, желудка — 103–104, тощей кишки — 105–106, подвздошной кишки — 108–109 бактерий. Наибольшее количество бактериальных микроорганизмов находится в содержимом толстого кишечника — приблизительно 1011 в одном грамме кишечного сока. В одном грамме кала человека содержится примерно 1012 бактерий [48]. В микробиоте сосуществуют как минимум 1800 родов и примерно 15 000–36 000 видов бактерий. Подавляющее большинство микробиоты (> 99 %) представлено бактериями: Firmicutes (64 %) (в основном клостридии и эубактерии), Bacteroidetes (23 %), Proteobacteria (8 %), Actinobacteria (3 %), Fusobacteria (менее 2 %), Verrucomicrobiaphyla (менее 1 %) (рис. 1).
/104-1.jpg )
Около 80 % бактерий микробиоты пищеварительного тракта человека не растет на питательных средах, и поэтому они не могут быть идентифицированы обычными культуральными методами [31]. Каждый взрослый человек имеет свой собственный уникальный профиль микрофлоры кишечника, для которого характерна устойчивая стабильность доминирования определенной активной группы комменсалов. В отличие от микрофлоры кишечника взрослых людей микробиота кишечника детей первого года жизни является менее стабильной и быстро изменяемой системой. До недавнего времени было принято считать, что люди рождаются со стерильным пищеварительным трактом. Однако на сегодняшний день появились фактические доказательства его микробной колонизации во внутриутробном периоде жизни с момента начала глотания амниотической жидкости плодом [32].
Kjersti Aagaard и соавт. [4] показали, что профиль микробиоты плаценты характеризуется наличием непатогенных комменсальных1 бактерий Tenericutes, Proteobacteria, Bacteroidetes и Fusobacteria филюмов и напоминает состав микробиоты ротовой полости человека. Показано, что микрофлора пищеварительного тракта новорожденных, находящихся на грудном вскармливании, представлена преимущественно Bifidobacterium spp. [7]. Постепенно на первом году жизни пищеварительный тракт ребенка достигает высокой степени бактериальной колонизации, которая очень близка по составу к микробиоте кишечника взрослых людей [5].
Предполагают, что первоначальная бактериальная колонизация играет основную роль в определении траектории сукцессии2, целью которой является достижение стабильной бактериальной экосистемы [14].
Значение естественного вскармливания в процессе становления микробиоты кишечника у ребенка
Первоначальный состав кишечной микробиоты пищеварительного тракта зависит от множества различных эндо- и экзогенных факторов, среди которых питание ребенка на первом году жизни занимает особое место, так как в отличие от молочных смесей грудное молоко содержит не только питательные вещества, иммуноциты, антитела, но и разнообразные комменсальные материнские бактерии, включая бифидобактерии и лактобактерии [2, 20, 53].
Грудное молоко является важнейшим источником комменсальных бактерий для новорожденного и грудного ребенка. Показано, что грудное молоко, асептически собранное у здоровых матерей, содержит жизнеспособные разнообразные комменсальные бактерии в концентрации 103 КОЕ/мл. На сегодняшний день из человеческого молока было выделено более 200 видов бактерий (табл. 1) [15, 20, 40].
Секвенирование MiSeq показало, что основными бактериальными группами в образцах молока были филюмы Proteobacteria, Firmicutes и роды Pseudomonas, Staphylococcus, Streptococcus. Микробное ядро, состоящее из 12 родов, составляло 81 % всего бактериального представительства в образцах молока на 1, 3 и 6-й неделе лактации. Представляет интерес тот факт, что бактериальная структура микробиоты грудного молока и фекалий ребенка совпадала на 70–88 %, подтверждая гипотезу вертикального переноса бактерий из молока в кишечник ребенка.
По всей вероятности, вертикальная передача бактерий от матери ребенку через грудное молоко является важнейшим механизмом, который способствует первоначальному становлению микробиоты в развивающемся кишечнике новорожденного [34].
Ted Jost и соавт. [20] считают, что бактерии, присутствующие в материнском молоке, выживают в пищеварительном тракте и выступают в качестве бактерий, формирующих микробиоту кишечника у детей. Авторы подчеркивают, что данное утверждение верно для факультативных анаэробов (Staphylococcus, Streptococcus, Lactobacillus, Propionibacterium, Rothia, Escherichia и Enterococcus spp.) и, что более важно, облигатных анаэробов, ассоциированных со слизистой кишечника (Bifidobacterium, Bacteroides, Parabacterides, Blautia, Clostridium, Collinsella и Veil–lonella spp.).
Грудное вскармливание ассоциируется с более низкой частотой возникновения некротизирующего энтероколита и острых диарей в неонатальный и ранний период детства и с более низким риском развития воспалительных заболеваний кишечника, диабета 2-го типа и ожирения в более поздних возрастных периодах жизни [26].
Влияние искусственных смесей на микробиоту кишечника у ребенка
У детей вне зависимости от вида вскармливания представительство бифидобактерий, идентифицируемых с помощью зонда Bif 164, всегда доминирует над содержанием других видов бактерий. Отсутствие в диете грудного молока кардинально влияет на микробиоту кишечника.
Дети, получающие искусственные смеси, по сравнению с грудными детьми, находившимися на грудном вскармливании, отличаются более высоким содержанием Atopobium (7,47 % при вскармливании смесями и 1,09 % при грудном вскармливании) в сочетании с более низким содержанием Bifidobacterium (рис. 2). Исследования интраиндивидуальных отличий бифидобактериальной популяции показали, что у новорожденных при естественном вскармливании наблюдается более стабильная и однородная бактериальная структура микробиоты по сравнению с новорожденными, получающими искусственные смеси [8, 13]. Согласно представлениям Martin F. Laursen и соавт. [25], ограниченность разнообразия микробиоты пищеварительного тракта, которая обусловлена грудным вскармливанием, у детей раннего возраста является признаком здорового кишечника. По всей вероятности, компоненты и соотношение их содержания в материнском молоке (высокое содержание лактозы и низкое казеина, наличие олигосахаридов, фосфата кальция, его низкая буферная способность, комменсальных бактерий и др.) благоприятствуют росту бифидобактерий, которые подавляют рост представителей других филюмов [9].
/107-1.jpg )
Нарушения состава микробиоты и состояние здоровья у детей
Особенности состава микробиоты пищеварительного тракта у детей раннего возраста предопределяют состояние здоровья и вероятность развития различных заболеваний в последующие периоды жизни. Постнатальный период раннего возраста считается критическим для становления микробиоты у детей [25].
Продемонстрировано, что постнатальное развитие и функционирование кишечника и иммунной системы в значительной степени зависят от состояния кишечной микробиоты [6, 17]. Изменения состава кишечной микробиоты ассоциированы с повышенным риском развития некоторых патологических состояний [19, 22, 33]. Так, низкий уровень микробного разнообразия кишечной микробиоты, не ассоциированный с приемом грудного молока, ассоциирован с риском последующего развития аллергических заболеваний [52]. Показано, что нарушение функционирования микробиоты ассоциировано с развитием функциональных и воспалительных заболеваний пищеварительного тракта [45], болезни Крона [27], бронхиальной астмы [42, 50], атопического дерматита [28], ожирения [11, 24], диабета 1-го [23] и 2-го типа [12], аутоиммунных заболеваний [36], неоплазм толстого кишечника [29, 49], расстройств аутистического спектра [39].
Предупреждение неблагоприятных эффектов, ассоциированных с нарушением состояния микробиоты у детей
Детям, которые вскармливаются преимущественно искусственными смесями, учитывая высокую вероятность развития у них клинически значимых нарушений состояния микробиоты, рекомендуется назначение пробиотических препаратов.
В настоящее время одной из наиболее исследованных пробиотических бактерий является Bifidobacterium animalis subsp. lactis BB-12, эффективность и безопасность клинического применения которой была подтверждена результатами более 300 исследований. Данная пробиотическая бактерия входит в состав препаратов Линекс Беби® и Линекс® Детские капли (109 КОЕ в каплях), присутствующих на фармацевтическом рынке Украины. Пробиотики, созданные на основе данного пробиотического штамма, используются в клинической практике на протяжении более 30 лет [1].
Микроорганизм Bifidobacterium animalis subsp. lactis BB-12 представляет собой каталазанегативную палочковидную бактерию, которая была зарегистрирована в банке клеточных культур Chr. Hansen в 1983 году. Продемонстрировано, что при приеме внутрь бактерии Bifidobacterium animalis subsp. lactis BB-12 не только хорошо выживают в пищеварительном тракте, но и транзиторно колонизируют толстый кишечник. Прием пробиотиков, содержащих бактерии Bifidobacterium animalis subsp. lactis BB-12, способствует увеличению общего количества бифидобактерий и подавлению патогенных бактерий в пищеварительном тракте. В частности, показано, что in vitro бактерии Bifidobacterium animalis subsp. lactis BB-12 ингибируют Bacilluscereus, Clostridium difficile, Clostridium perfringens type A, Escherichia coli ATCC 4328, Enterococcus faecalis, Listeria monocytogenes, Pseudomonas aeruginosa, Salmonella enterica subsp. entericaserovar Typhimurium, S.enterica subsp. Entericaserovar Typhi, Shigella sonnei и Сandida albicans [21].
Клинические исследования назначения пробиотиков, содержащих бактерии Bifidobacterium animalis subsp. lactis BB-12, продемонстрировали достоверное благоприятное их влияние на состояние здоровья детей.
Согласно результатам рандомизированного двойного слепого плацебо-контролируемого исследования, ежедневный прием йогурта с бактериями Bifidobacterium animalis subsp. lactis BB-12 способствует снижению частоты заболевания острыми инфекциями и повышению качества жизни у детей [37].
Дети, которые вскармливались искусственными смесями, подвержены частым респираторным и кишечным инфекциям, а назначение пробиотиков снижает риск повторных инфекций [18]. Так, в двойном слепом рандомизированном контролируемом исследовании установлено, что назначение пробиотиков, содержащих бактерии Bifidobacterium animalis subsp. lactis BB-12, снижает риск развития инфекционных заболеваний [47]. Также бактерии Bifidobacterium animalis subsp. lactis BB-12 улучшают функционирование кишечника, препятствуют развитию диареи и уменьшают побочные эффекты антибиотикотерапии [21]. Таким образом, бактерии Bifidobacterium animalis subsp. lactis BB-12 повышают устойчивость организма ребенка к респираторным и кишечным инфекциям.
Становление кишечной микробиоты в период раннего детства необходимо для обеспечения созревания иммунной системы и баланса эффекторных СD4+ Т-лимфоцитов [16]. Нарушение состава микробиоты ассоциировано с вероятностью развития Т-клеточного воспалительного процесса и ассоциированных с ним бронхиальной астмы [30, 44] и атопического дерматита [51].
Пробиотические бактерии обладают способностью изменять баланс Th-хелперных субпопуляций, направляя воспалительный процесс. Anne Dorthea Bjerkenes и соавт. [38] показали, что прием пробиотического препарата, содержащего бактерии Bifidobacterium animalis subsp. lactis BB-12, в перинатальный период приводит у детей в трехмесячном возрасте к снижению представительства Th22-клеток на фоне сохраненного содержания Treg, Th1-, Th2-, Th9- и Th17-клеток. Известно, что Th22-клетки играют ключевую роль в развитии бронхиальной астмы и атопического дерматита [10, 43]. Прием пробиотиков, содержащих бактерии Bifidobacterium animalis subsp. lactis BB-12, женщинами во время беременности способствует снижению риска развития атопического дерматита у детей в первые шесть лет жизни [41]. Таким образом, бактерии Bifidobacterium animalis subsp. lactis BB-12, ингибируя пролиферацию Th22-клеток, препятствуют развитию аллергических заболеваний, которые часто проявляются у детей, вскармливаемых искусственными смесями.
Также показано, что применение пробиотиков, содержащих бактерии Bifidobacterium animalis subsp. lactis BB-12, у детей в раннем детском возрасте предупреждает развитие кариеса [46].
Заключение
Постнатальная физиологическая микробная колонизация пищеварительного тракта, ассоциированная с грудным вскармливанием, играет ключевую роль в морфофункциональном созревании кишечника и иммунной системы ребенка. Вертикальная передача микроорганизмов во время лактации от матери ребенку способствует становлению микробиоты. Вскармливание молочными смесями приводит к нарушению состояния микробиоты пищеварительного тракта и повышению риска возникновения инфекционных, воспалительных и аллергических заболеваний как в раннем детстве, так и в последующие возрастные периоды детства. Пробиотические бактерии, представляющие собой живые микроорганизмы, способствуют поддержанию общего состояния здоровья и предохраняют от развития некоторых заболеваний. Первый год жизни является предпочтительным временем для проведения пробиотической терапии. Одной из наиболее безопасных пробиотических бактерий, предназначенных для терапевтического использования у детей, является Bifidobacterium animalis subsp. lactis –BB-12. Применение пробиотиков, содержащих бактерии Bifidobacterium animalis subsp. lactis –BB-12, способствует предупреждению возникновения острых инфекционных заболеваний респираторного тракта и кишечника, профилактирует развитие хронических аллергических заболеваний (бронхиальной астмы и атопического дерматита). Назначение пробиотиков, содержащих бактерии Bifidobacterium animalis subsp. lactis BB-12, детям, вскармливаемым искусственными смесями, позволяет избежать некоторых неблагоприятных эффектов, ассоциированных с отменой грудного вскармливания, в частности повышенной восприимчивости к инфекционным патогенам.
Конфликт интересов. Не заявлен.
Список литературы
1. Бережний В.В., Маменко М.Є. Мікробіота кишечника новонародженої дитини: вплив на стан здоров’я та фізіологічні підходи до корекції порушень // Дитячий лікар. — 2016. — № 3 (48). — С. 14-20.
2. Бережной В.В. Микрофлора человека и роль современных пробиотиков в ее регуляции / В.В. Бережной, С.А. Крамарев, Е.Е. Шунько // Здоровье женщины. — 2004. — № 1 (17). — С. 134-139.
3. Майданник В.Г. Клинические рекомендации по применению пробиотиков в педиатрической практике / В.Г. Майданник. — К., 2013. — 30 с.
4. Aagaard K. The placenta harborsaunique microbiome / K. Aagaard, J. Ma, K.M. Antony, R. Ganu, J. Petrosino, J. Versalovic // Sci Transl. Med. 2014 May 21; 6 (237): 237ra65. doi: 10.1126/scitranslmed.3008599.
5. Arrieta M.C. The intestinal microbiome in early life: health and disease / M.C. Arrieta, L.T. Stiemsma, N. Amenyogbe et al. // Front. Immunol. 2014 Sep 5; 5: 427. doi: 10.3389/fimmu.2014.00427.
6. Belkaid Y., Harrison O.J. Homeostatic Immunity and the Microbiota // Immunity. 2017 Apr 18; 46 (4): 562-576. doi: 10.1016/j. immuni.2017.04.008.
7. Bezirtzoglou E., Romond C. Effect of the feeding practices on the establishment of bacterial interactions in the intestine of the newborn delivered by cesarean section // J. Perinat. Med. 1990; 18 (2): 139-43. PMID: 2366135.
8. Bezirtzoglou E., Tsiotsias A., Welling G.W. Microbiota profile in feces of breast- and formula-fed newborns by using fluorescence in situ hybridization (FISH) // Anaerobe. 2011 Dec; 17 (6): 478-82. doi: 10.1016/j. anaerobe.2011.03.009.
9. Chichlowski M. The influence of milk oligosaccharides on microbiota of infants: opportunities for formulas / M. Chichlowski, J.B. German, C.B. Lebrilla, D.A. Mills // Annu Rev. Food Sci Technol. 2011; 2: 331-51. doi: 10.1146/annurev-food-022510-133743.
10. Czarnowicki T. Early pediatric atopic dermatitis shows only a cutaneous lymphocyte antigen (CLA) (+) TH2/TH1 cell imbalance, whereas adults acquire CLA (+) TH22/TC22 cell subsets / T. Czarnowicki, H. Esaki, J. Gonzalez et al. // J. Allergy Clin. Immunol. 2015 Oct; 136 (4): 941-951.e3. doi: 10.1016 /j.jaci.2015.05.049.
11. Dahiya D.K. Gut Microbiota Modulation and Its Relationship with Obesity Using Prebiotic 30. Fibers and Probiotics: A Review / D.K. Dahiya, Renuka, M. Puniya et al. // Front. Microbiol. 2017 Apr 4; 8: 563. doi: 10.3389/fmicb.2017.00563.
12. de Mello V.D. Indolepropionic acid and novel lipid metabolites are associated with a lower risk of type 2 diabetes in the Finnish Diabetes Prevention Study / V.D. de Mello, J. Paananen, J. Lindstrom et al. // Sci Rep. 2017 Apr 11; 7: 46337. doi: 10.1038/srep46337.
13. de Morais M.B. Microbiota, Environment and Diet / M.B. de Morais, C.S. Mello, M.S. Carmo-Rodrigues et al. // J. Pediatr. Gastroenterol. Nutr. 2017 Apr 18. doi: 10.1097/MPG.0000000000001605.
14. Dominguez-Bello M.G. Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns / M.G. Dominguez-Bello, E.K. Costello, M. Contreras, M. Magris, G. Hidalgo, N. Fierer, R. Knight // Proc. Natl. Acad. Sci. USA. — 2010. — Vol. 107, № 26. — P. 11971-11975.
15. Fitzstevens J.L. Systematic Review of the Human Milk Microbiota / J.L. Fitzstevens, K.C. Smith, J.I. Hagadorn et al. // Nutr. Clin. Pract. Sep 27. pii: 0884533616670150.
16. Gensollen T. How colonization by microbiota in early life shapes the immune system / T. Gensollen, S.S. Iyer, D.L. Kasper, R.S. Blumberg // Science. 2016 Apr 29; 352 (6285): 539-44. doi: 10.1126/science. aad9378.
17. Goulet O. Potential role of the intestinal microbiota in programming health and disease // Nutr. Rev. 2015 Aug; 73 Suppl 1: 32-40. doi: 10.1093/nutrit /nuv039.
18. Hetzner N.M. Associations among feeding behaviors during infancy and child illness at two years / N.M. Hetzner, R.A. Razza, L.M. Malone, J. Brooks-Gunn // Matern. Child Health J. 2009 Nov; 13 (6): 795-805. doi: 10.1007/s10995-008-0401-x.
19. Iebba V. Gut microbiota and pediatric disease / V. Iebba, M. Aloi, F. Civitelli, S. Cucchiara // Dig. Dis. 2011; 29 (6): 531-9. doi: 10.1159/000332969.
20. Jost T. Assessment of bacterial diversity in breast milk using culture-dependent and culture-independent approaches / T. Jost, С. Lacroix, C. Braegger, C. Chassard // Br. J. Nutr. 2013 Оct; 110 (7): 1253-62. doi: 10.1017/S0007114513000597.
21. Jungersen M. The Science behind the Probiotic Strain Bifidobacterium animalis subsp. lactis BB-12 (®) / M. Jungersen, A. Wind, E. Johansen et al. // Microorganisms. 2014 Mar 28; 2 (2): 92-110. doi: 10.3390/41. microorganisms2020092.
22. Khan I. Implication of gut microbiota in human health / Khan I., Yasir M., Azhar E.I. et al. // CNS Neurol Disord Drug Targets. 2014; 13 (8): 1325-33. doi: 10.2174/187152731366 6141023153506.
23. Kugelberg E. Microbiota: Diet can protect against type 1 diabetes // Nat. Rev. Immunol. 2017 Apr 19. doi: 10.1038/nri.2017.40.
24. Lafortuna C.L. Clinical, functional, behavioural and epi–genomic biomarkers of obesity / C.L. Lafortuna, A.R. Tovar, F. Rastelli et al. // Front. Biosci (Landmark Ed). 2017 Jun 1; 22: 1655-1681.
25. Laursen M.F. First Foods and Gut Microbes / M.F. Laursen, M.I. Bahl, K.F. Michaelsen, T.R. Licht // Front. Microbiol. 2017 Mar 6; 8: 356. doi: 10.3389/fmicb.2017.00356.
26. Le Huërou-Luron I., Blat S., Boudry G. Breast-v. formula-feeding: impacts on the digestive tract and immediate and long-term health effects // Nutr. Res. Rev. 2010 Jun; 23 (1): 23-36. doi: 10.1017/S0954422410000065.
27. Li Y. Cesarean delivery and risk of inflammatory bowel di–sease: a systematic review and meta-analysis / Y. Li, Y. Tian, W. Zhu et al. // Scand. J. Gastroenterol. 2014 Jul; 49 (7): 834-44. doi: 10.3109/00365521.2014.910834.]
28. Lindberg M., Soderquist B. Atopic dermatitis and gut microbiota // Br. J. Dermatol. 2017 Feb; 176 (2): 297-298. doi: 10.1111/bjd.15276.
29. Ma N. Contributions of the Interaction between Dietary Protein and Gut Microbiota to Intestinal Health / N. Ma, Y. Tian, Y. Wu, X. Ma // Curr. Protein. Pept. Sci. 2017 Feb 16. doi: 10.2174/1389203718666170216153505.
30. Moldaver D.M., Larche M., Rudulier C.D. An update on lymphocyte subtypes in Asthma and Airway Disease // Chest. 2016 Nov 3. pii: S0012-3692 (16)62326-7. doi: 10.1016/j. chest.2016.10.038.
31. Morgan X.C., Huttenhower C. Meta'omic analytic techniques for studying the intestinal microbiome // Gastroenterology. May; 146 (6): 1437-1448.e1. doi: 10.1053/j. gastro.2014.01.049.
32. Mshvildadze M., Neu J. The infant intestinal microbiome: friend or foe? // Early Hum. Dev. 2010 Jul; 86 Suppl 1: 67-71. doi: 10.1016/j. earlhumdev.2010.01.018.
33. Mueller N.T. Prenatal exposure to antibiotics, cesarean section and risk of childhood obesity / N.T. Mueller, R. Whyatt, L. Hoepner et al. // Int. J. Obes. (Lond.). 2015 Apr; 39 (4): 665-70. doi: 10.1038/ijo.2014.180.
34. Murphy K. The Composition of Human Milk and Infant Faecal Microbiota Over the First Three Months of Life: A Pilot Study / K. Murphy, D. Curley, T.F. O'Callaghan et al. // Sci Rep. 2017 Jan 17; 7: 40597. doi: 10.1038/srep40597.
35. Qin J. A human gut microbial gene catalogue established by metagenomic sequencing / J. Qin, R. Li, J. Raes et al.; MetaHIT Consortium, P. Bork, S.D. Ehrlich, J. Wang // Nature. 2010 Mar 4; 464 (7285): 59-65. doi: 10.1038/nature08821.
36. Raghunath P. Role of Gut Microbiota and Infectious Burden in the Development of Autoimmune and Allergic Diseases // Iran. J. Allergy Asthma Immunol. 2017 Feb; 16 (1): 77-78. PMID: 28417628.
37. Ringel-Kulka T. Randomized, double-blind, placebo-controlled study of synbiotic yogurt effect on the health of children / T. Ringel- Kulka, J.B. Kotch, E.T. Jensen et al. // J. Pediatr. Jun; 166 (6): 1475-81.e1-3. doi: 10.1016/j. jpeds.2015.02.038.
38. Ro A.D., Simpson M.R., Ro T.B. Reduced Th22 cell proportion and prevention of atopic dermatitis in infants following maternal probiotic supplementation // Clin. Exp. Allergy. Mar 27. doi: 10.1111/cea.12930.
39. Rosenfeld C.S. Microbiome Disturbances and Autism Spectrum Disorders // Drug. Metab. Dispos. 2015 Oct; 43 (10): 1557-71. doi: 10.1124 / dmd.115.063826.
40. Sakwinska O. Microbiota in Breast Milk of Chinese Lactating Mothers / O. Sakwinska, Moine, M. Delley et al. // PLoS One. 2016 Aug 16; 11 (8): e0160856. doi: 10.1371/journal. pone.0160856.
41. Simpson M.R. Perinatal probiotic supplementation in the prevention of allergy related disease: 6 year follow up of a randomised controlled trial / M.R. Simpson, C.K. Dotterud, O. Storrø et al. // BMC Dermatol. 2015 Aug 1; 15: 13. doi: 10.1186/s12895-015-0030-1.
42. Singanayagam A., Ritchie A.I., Johnston S.L. Role of microbiome in the pathophysiology and disease course of asthma // Curr. Opin. Pulm. Med. 2017 Jan; 23 (1): 41-47. PMID: 27755161.
43. Souwer Y. IL-17 and IL-22 in atopic allergic disease / Y. Souwer, K. Szegedi, M.L. Kapsenberg, E.C. de Jong // Curr. Opin. Immunol. 2010 Dec; 22 (6): 821-6. doi: 10.1016/j. coi.2010.10.013.
44. Stiemsma L.T., Turvey S.E. Asthma and the microbiome: defining the critical window in early life // Allergy Asthma Clin. Immunol. 2017 Jan 6; 13: 3. doi: 10.1186/s13223-016-0173-6.
45. Sundin J., Ohman L., Simren M. Understanding the Gut Microbiota in Inflammatory and Functional Gastrointestinal Diseases // Psychosom Med. 2017 Apr 18. doi: 10.1097/PSY.0000000000000470.
46. Taipale T. Administration of Bifidobacterium animalis subsp. lactis BB-12 in early childhood: a post-trial effect on caries occurrence at four years of age / T. Taipale, K. Pienihakkinen, P. Alanen et al. // Caries Res. 2013; 47 (5): 364-72. doi: 10.1159/000348424.
47. Taipale T.J. Bifidobacterium animalis subsp. lactis BB-12 in reducing the risk of infections in early childhood / T.J. Taipale, K. Pienihakkinen, Isolauri et al. // Pediatr. Res. 2016 Jan; 79 (1-1): 65-9. doi: 10.1038/pr.2015.174.
48. Tlaskalova-Hogenova H. The role of gut microbiota (commensal bacteria) and the mucosal barrier in the pathogenesis of inflammatory and autoimmune diseases and cancer: contribution of germ-free and gnotobiotic animal models of human diseases / H. Tlaskalova-Hogenova, R. Stepankova, H. Kozakova et al. // Cell. Mol. Immunol. 2011 Mar; 8 (2): 110-20. doi: 10.1038/cmi.2010.67.
49. Tomkovich S. Locoregional effects of microbiota in a preclinical model of colon carcinogenesis / S. Tomkovich, Y. Yang, K. Winglee et al. // Cancer. Res. 2017 Apr 17. pii: canres.3472.2016. doi: 10.1158/0008-5472. CAN-16-3472.
50. Vaiserman A.M., Koliada A.K., Marotta F. Gut microbiota: A player in aging and a target for anti-aging intervention // Ageing Res. Rev. 2017 May; 35: 36-45. doi: 10.1016/j.arr.2017.01.001.
51. Werfel T. Cellular and molecular immunologic mechanisms in patients with atopic dermatitis / T. Werfel, J.P. Allam, T. Biedermann et al. // J. Allergy Clin. Immunol. Aug; 138 (2): 336-49. doi: 10.1016/j. jaci.2016.06.010.
52. West C.E. Gut microbiota and allergic disease: new findings // Curr. Opin. Clin. Nutr. Metab. Care. 2014 May; 17 (3): 261-6. doi: 10.1097/MCO.0000000000000044.
53. Xu Z., Knight R. Dietary effects on human gut microbiome diversity // Br. J. Nutr. 2015 Jan; 113 Suppl: S1-5. doi: 10.1017/S0007114514004127.
Получено 26.10.2017

/104-1.jpg )
/105-1.jpg )
/106-1.jpg )
/107-1.jpg )