Вступ
Остеопороз — багатофакторне поліетіологічне захворювання скелета є найбільш поширеною формою метаболічної остеопатії. Захворювання характеризується втратою маси кісток, порушенням їх мікроархітектоніки (руйнуванням трабекул), зниженням міцності кісткової тканини та супроводжується високим ризиком переломів [1]. За даними Всесвітньої організації охорони здоров’я, остеопороз як причина інвалідизації і смертності посідає четверте місце після захворювань серцево-судинної системи, онкологічних і цукрового діабету [2].
Глюкокортикоїди є ефективними лікарськими засобами, що знаходять широке застосування в медичній практиці для лікування гострих і хронічних запальних процесів [3]. Однак відомо, що пацієнти, які тривалий час приймають пероральні стероїдні протизапальні препарати, мають підвищений ризик розвитку остеопорозу зі значними втратами кісткової маси в перші місяці лікування [4, 5]. Стероїдний остеопороз належить до класу вторинних остеопорозів, що викликається як патологічним підвищенням ендогенної продукції глюкокортикоїдів наднирниками, так і може бути результатом тривалого введення синтетичних аналогів кортикостероїдів, що застосовуються для лікування численних захворювань людини. Тому корекція порушень структурної організації та функціонування кісткової тканини при глюкокортикоїдній терапії є надзвичайно актуальною теоретичною та клінічною проблемою.
В основі розвитку остеопорозу лежить переважання остеокласт-залежної резорбції кістки над її остеобласт-опосередкованим формуванням і мінералізацією, що веде до втрати щільності, порушень мікроархітектури кістки та, зрештою, підвищення ризику переломів [6]. Ключова роль у контролюванні процесу ремоделювання кісткової тканини належить цитокіновим системам. Так, зокрема, остеосинтез за участю остеобластів забезпечується регуляторним протеїном — остеокальцином, який є валідним маркером формування кісткової тканини, а процес резорбції регулюється остеотропною цитокіновою системою RANKL — RANK — OPG [6, 7]. Відомо, що взаємодія рецептора активатора NF-κB (RANK) і його ліганда (RANKL) призводить до активації NF-κВ, що посилює диференціювання й активування остеокластів, тоді як остеопротегерин (OPG), діючи як рецептор-пастка, зв’язує RANKL і нейтралізує його біологічну дію. Водночас RANKL та OPG можуть здійснювати значний вплив і на клітини імунної системи, адже продемонстровано експресію компонентів цитокінової системи RANKL — RANK — OPG у макрофагах, дендритних клітинах, Т- та В-лімфоцитах, залучених до регулювання імунних реакцій [8].
Наслідком системної дії глюкокортикоїдів може бути активація експресії RANKL і пригнічення експресії OPG в остеобластах [9]. У низці досліджень було показано, що глюкокортикоїди інгібують експресію мРНК OPG, подальшу секрецію самого протеїну та одночасно позитивно регулюють надекспресію мРНК RANKL у культурі остеобластів незалежно від стадії диференціювання й базального рівня експресії [10]. Оскільки глюкокортикоїд-чутливі елементи були виявлені в гені RANKL, припускають можливість регуляції експресії цього цитокіну через посилення транскрипційної активності гормону [11]. Отже, цитокінова система RANKL — RANK — OPG може розглядатись як інтегруюча ланка у взаємодії різних типів клітин, залучених в імунні реакції, розвиток запалення та підтримання рівноваги між клітинами кісткової тканини, що робить її фармакологічною мішенню для здійснення регуляторних і корегувальних впливів на процес ремоделювання за різних патологій кісткової тканини. Наведені вище експериментальні дані здебільшого стосуються досліджень на культурах клітин або змін у кістковій тканині, пов’язаних переважно з короткотривалим уведенням синтетичних глюкокортикоїдів у високих дозах. Проте недостатньо з’ясованим залишається питання систематичного дослідження порушень експресії всіх трьох компонентів системи RANKL — RANK — OPG у кістковій тканині за довготривалої дії глюкокортикоїдів in vivo.
Останнім часом значні зусилля спрямовані на експериментальне обґрунтування ефективності вітаміну D3 (холекальциферолу) у протидії побічним ефектам тривалого застосування глюкокортикоїдних препаратів [12]. Одним із важливих чинників, що порушують структурно-функціональний стан кісткової тканини, може бути недостатність/дефіцит вітаміну D. На сьогодні відомо, що стан забезпеченості населення вітаміном D у світі характеризується як глобальна пандемія D-недостатності [13]. Проведені недавні масштабні дослідження дозволили виявити кореляцію між дефіцитом вітаміну D та поширеністю таких захворювань, як автоімунні (цукровий діабет, хвороба Крона, поліартрит тощо), серцево-судинні, онкологічні та остеопороз [14, 15].
Вітамін D є попередником утворення справжнього секостероїдного гормону (1,25(OH)2D) з добре вивченими ефектами, пов’язаними у першу чергу з регулюванням кальцієвого гомеостазу [16]. Крім того, на сьогодні встановлено важливу роль вітаміну D3 у проліферації та диференціюванні клітин, модулюванні імунної відповіді та протизапальному захисті [17–19]. Гормональна форма вітаміну D3 (1,25(ОН)2D3) відіграє потенційну роль у контролюванні утворення цитокінів у різних тканинах [20]. На молекулярному рівні ці ефекти можуть реалізовуватись через рецептор вітаміну D — VDR-опосередкований вплив на транскрипційне активування NF-κB та експресію залежних від даного фактора транскрипції генів. Оскільки асоційовані з тривалою дією глюкокортикоїдів зміни ремоделювання кісткової тканини можуть включати порушення тонкої взаємодії різних типів клітин, інтегруючою компонентою якої є система цитокінів, актуальним залишається питання, яким чином недостатність або дефіцит вітаміну D і порушення процесу ремоделювання кісткової тканини пов’язані зі змінами у системі RANKL-RANK-OPG і чи корелюють ці зміни з порушеннями експресії VDR при глюкокортикоїд-індукованому остеопорозі.
Метою даної роботи було вивчення взаємов’язку між забезпеченістю організму вітаміном D, експресією VDR і станом остеотропної цитокінової системи RANKL-RANK-OPG у кістковій тканині при експериментальному глюкокортикоїд-індукованому остеопорозі.
Матеріали та методи
Моделювання глюкокортикоїд-індукованого остеопорозу в щурів і схема введення вітаміну D3
Дослідження проводили на білих щурах (самиці лінії Wistar масою 100 ± 5 г), які утримувались на стандартному харчовому повноцінному раціоні віварію (вміст кальцію — 1,2 %, фосфору — 0,8 %), при температурі в межах 18–22 °С, вологості 50–60 % та природному світловому режимі «день — ніч». Після періоду акліматизації, який становив один тиждень, щурів було розподілено на 3 групи за методом випадкових чисел: 1 — контрольні тварини; 2 — тварини, яким щодоби вводили преднізолон («Дарниця», Україна) у дозі 0,5 мг на одну тварину протягом 30 діб у вигляді водної суспензії; 3 — тварини, яким разом із преднізолоном уводили вітамін D3 (Sigma, США) у дозі 100 МО на одну тварину протягом 30 діб у вигляді масляної суспензії. Препарати вводили дослідним тваринам у один і той самий час перорально за допомогою зонда. Усі маніпуляції з тваринами проводили з дотриманням загальноприйнятих біоетичних норм гуманного поводження з лабораторними тваринами відповідно до міжнародних та національних положень стосовно проведення експериментів із залученням тварин: «Європейської конвенції про захист хребетних тварин, що використовуються для дослідних та інших наукових цілей» (Страсбург, 1986); «Загальних етичних принципів проведення експериментів на тваринах» (Україна, 2001), Закону України «Про захист тварин від жорстокого поводження» № 3447-IV (Україна, 2006).
Визначення вмісту 25OHD у сироватці крові
Забезпеченість організму вітаміном D3 оцінювали за рівнем 25ОНD, який визначали імуноензимним методом з використанням тест-набору 25-Hydroxy Vitamin D kit (IDS, США) за стандартним протоколом виробника. Концентрацію 25ОНD вимірювали в нмоль/л сироватки крові.
Вивчення мінерального обміну
Рівень кальцію в сироватці крові визначали за допомогою біотест-наборів («Лахема», Чехія). Вміст неорганічного фосфату (Рі) досліджували після осадження протеїнів сироватки крові 12% розчином трихлороцтової кислоти за методом Dyce [21]. Активність загальної лужної та кислої фосфатази в сироватці крові вимірювали за допомогою біотест-наборів виробництва «Лахема» (Чехія). Активність ізоензимів лужної фосфатази визначали з використанням інгібіторів згідно з описаним методом [22].
Вміст мінеральних компонентів у кістковій тканині вивчали після екстракції з тканини протеїнів методом сухої мінералізації при температурі 600–800 °С. Рівень мінеральних компонентів у золі визначали після її розчинення у 0,5 мл соляної кислоти та подальшого двадцятикратного розведення в дистильованій воді.
Вестерн-блот-аналіз
Визначення вмісту цільових протеїнів у кістковій тканині щурів проводили за методом вестерн-блот-аналізу. Для приготування загального протеїнового лізату наважку кісткової тканини 200–250 мг розтирали у фарфоровій ступці з рідким азотом, після чого 100 мг подрібненої тканини інкубували протягом 20 хв з буфером екстракції протеїнів RIPA (20 мМ трис-НCl, рН 7,5; 1% тритону Х-100, 150 мМ NaCl, 1 мМ ЕДТА, 1% дезоксихолату натрію 20 мМ Tris-HCl, рН 7,6, 1% Triton-X100, 150 мM NaCl, 50 мM NaF, 0,2% ДСН) у співвідношенні 1 : 10 (вага/об’єм) та коктейлем інгібіторів протеїназ і фосфатаз (protease inhibitor cocktail — PIC, Sigma) на льодяній бані. Гомогенат додатково обробляли ультразвуковим дезінтегратором, після чого центрифугували при 14 000 g протягом 20 хв при 4 °С. Уміст тотального протеїну в аліквотах проб визначали за методом Лоурі. До лізату додавали 1/5 частину об’єму буфера Леммлі 5х (60 мM Tris-Cl pH 6.8, 2% додецилсульфат натрію, 10% гліцерин, 5% β-меркаптоетанол, 0,01% бромфеноловий синій), перемішували та проварювали на водяній бані +95 °С протягом 5 хв, а після охолодження зберігали у фризері при –80 °С для подальшої роботи. Електрофоретичне розділення протеїнів у 10–15% поліакриламідному гелі (ПААГ) проводили в трис-гліциновому буфері рН 8,3 (25 мМ Тris, 192 мМ гліцину, 0,1% додецилсульфату натрію) (30–100 мкг
протеїну на лунку) при напрузі 100–110 V [23]. Розділені за молекулярною масою протеїни з ПААГ переносили на нітроцелюлозну мембрану протягом 1 год при 350 mA у трансфер-буфері (25 мМ трис, 192 мМ гліцину, рН 8,3, 0,1% додецилсульфату натрію, 20% метанолу). Вільні центри зв’язування блокували 5% знежиреним сухим молоком у PBS з 0,05% твіну-20 протягом 1 год. Мембрану відмивали тричі по 5 хв у PBS з 0,1% твіном-20 (PBST), після чого інкубували ніч при 4 °С з цільовими антитілами в попередньо підібраних оптимальних концентраціях: RANKL (1 : 250), RANK (1 : 400), OPG (1 : 500), остеокальцину (1 : 500), VDR (1 : 200) та β-актину (1 : 20 000). Після інкубації з первинними антитілами мембрану відмивали у PBST, після чого протягом 1–1,5 год при кімнатній температурі інкубували зі специфічними вторинними антитілами, кон’югованими з пероксидазою хрону в розведенні 1 : 4000 для anti-mouse, 1 : 2500 для anti-goat та anti-rabbit антитіл. Надалі мембрану знову відмивали та виявляли імунореактивні сигнали за допомогою реактивів для посиленої хемілюмінесценції (1,25 мМ розчин люмінолу, 2,72 мМ розчин кумарової кислоти та 0,01% розчин гідрогенпероксиду в 0,1 М Тris-HCl рН 8,5). Плівку проявляли та фіксували стандартними фотопроявником і фіксажем. Інтенсивність сигналів на рентгенівських плівках обраховували за допомогою програмного забезпечення GELPRO32. Відносний уміст цільових протеїнів було нормалізовано додатково за β-актином і подано в умовних одиницях.
Статистична обробка результатів
Статистичну обробку експериментальних даних проводили з використанням програми Microsoft Excel загальноприйнятими методами варіаційної статистики з вирахуванням середного арифметичного значення показника (М) і стандартної похибки середнього значення (SD). Визначення вірогідності відмінностей між отриманими величинами двох вибірок проводили з використанням t-критерію Стьюдента [24]. Вірогідними вважали відмінності між групами при р < 0,05.
Результати
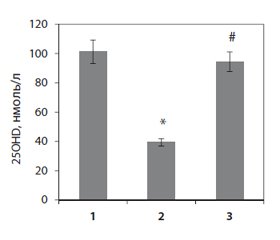
Дослідження вмісту 25-гідроксивітаміну D (25ОНD), основного маркера забезпеченості організму вітаміном D та попередника його гормонально активної форми, показало зниження за довготривалого введення преднізолону рівня цього похідного холекальциферолу в сироватці крові до 39,4 ± 0,7 нмоль/л, що майже у 3 рази нижче, ніж у контрольних тварин (рис. 1).
На фоні індукованого преднізолоном порушення метаболізму вітаміну D та розвитку D-гіповітамінозу були виявлені вірогідні зміни мінерального обміну в організмі тварин. Подані у табл. 1 результати свідчать, що введення тваринам преднізолону супроводжується зниженням вмісту Са2+ за рахунок його біологічно активної фракції, та Рі у сироватці крові на 17 і 14 % відповідно порівняно з показниками інтактних тварин. Введення преднізолону також викликало зниження вмісту кальцію та неорганічного фосфату в золі великогомілкових кісток за дії преднізолону (табл. 1).
/26.jpg)
Пов’язані з глюкокортикоїдною терапією гіпокальціємія та гіпофосфатемія корелювали з підвищенням активності маркерного ензиму процесу кісткоутворення — лужної фосфатази (ЛФ), яка в 1,51 раза перевищувала показник контрольних тварин (табл. 1). Підвищення активності ЛФ відбувалось головним чином за рахунок зміни активності її кісткової ізоформи, що становить 70 % від загальної активності ЛФ сироватки крові та зростає за дії преднізолону на 60 %. У той самий час преднізолон не спричиняв вірогідних змін активності кислої (тартрат-резистентної) фосфатази (маркер резорбції кісткової тканини) у сироватці крові (дані не наводимо).
Нормалізація рівня 25ОНD внаслідок тривалого введення щурам із глюкокортикоїд-індукованим остеопорозом вітаміну D3 (рис. 1) вірогідно впливала на рівень мінеральних компонентів як у сироватці крові, так і в кістковій тканині щурів порівняно з показниками тварин, які отримували глюкокортикоїди. Показано, що активність лужної фосфатази в сироватці крові нормалізується при введенні вітаміну D3 на фоні дії преднізолону (табл. 1). Ці дані можуть вказувати на істотну роль дефіциту вітаміну D у порушенні мінерального обміну та кісткового гомеостазу, що призводить до посиленої демінералізації кісткової тканини та втрати її маси за дії преднізолону.
Оскільки глюкокортикоїди як системні гормони знаходяться в тісній взаємодії з різними регуляторами процесу ремоделювання, спектр патогенетичних впливів на стан кісткової тканини за тривалої їх дії в терапевтичних дозах є надзвичайно широким і може включати зміни в ключовій остеокіновій системі кісткового ремоделювання RANKL — RANK — OPG. Подані на рис. 2 результати свідчать, що введення тваринам преднізолону, не викликаючи істотного підвищення вмісту RANKL у кістковій тканині, призводить до 31% зниження рівня остеопротегерину порівняно з контрольними щурами.
Було встановлено індуковане тривалою дією преднізолону зниження співвідношення OPG/RANKL майже в 1,4 раза порівняно з контролем (рис. 3). Крім того, дослідження рівня експресії RANK як ключового компонента остеокінової системи активації остеобластів, що забезпечує трансдукцію сигналу RANKL у процесі диференціювання та активування остеобластів, показало його зниження майже в 2 рази за введення преднізолону.
Таке дерегулювання остеокінової системи RANKL — RANK — OPG, детермінантної для процесу остеокластогенезу, за дії преднізолону доповнюється значним зниженням експресії ключового маркера остеосинтезу — остеокальцину, на 35,0 % порівняно з контролем (рис. 4). Значне зниження вмісту остеокальцину, вітамін-K-залежного неколагенового протеїну кісткової тканини, який синтезується зрілими остеобластами і є чутливим індикатором інтенсивності метаболізму кісткової тканини, вказує на чітко виражене гальмування остеосинтезу за дії преднізолону.
Введення тваринам вітаміну D3 сприяло незначному (11% зниженню вмісту RANKL та більш вираженому підвищенню (на 22 %) вмісту OPG у кістковій тканині порівняно з дією преднізолону (рис. 2). У свою чергу, це призводило до майже повного відновлення співвідношення вмісту OPG/RANKL, яке було вище у 1,4 раза, ніж за дії преднізолону (рис. 3). Рівень протеїну RANK зростав на 60 % за введення холекальциферолу порівняно з глюкокортикоїд-індукованим остеопорозом. Свідченням нормалізації процесу формування кісткової тканини та покращення метаболічних процесів у ній є підвищення експресії остеокальцину, відносний вміст якого досягав рівня контрольних значень за дії вітаміну D3 (рис. 4).
/28__2.jpg)
Оскільки біологічні ефекти гормональної форми вітаміну D3 у різних типах клітин реалізуються через специфічні рецептори до 1,25(OH)2D3 (VDR), було досліджено їх рівень у кістковій тканині. Встановлено, що за дії преднізолону вміст протеїну VDR значно (на 36 %) знижувався в цій тканині, що свідчить про можливе зниження кількості та функціональної активності остеобластів і остеоцитів, що забезпечують остеосинтез, і/або чутливості клітин до дії вітаміну D-гормону (рис. 4). Холекальциферол на тлі дії преднізолону на 20 % підвищував уміст протеїну VDR порівняно з дією лише преднізолону.
Обговорення
Тривале лікування стероїдними протизапальними препаратами значно підвищує через геномні та негеномні механізми ризик розвитку остеопорозу зі значними втратами кісткової маси [4, 5, 25]. Відомо, що кісткова тканина є тканиною-мішенню для глюкокортикоїдів, оскільки специфічні рецептори для них локалізовані на остеобластах, остеоцитах і остеокластах. Взаємодіючи з рецепторами, глюкокортикоїди впливають на проліферацію, диференціювання й метаболізм клітин. Порушення балансу між двома різнонаправленими процесами кісткового ремоделювання, превалювання кісткової резорбції над процесом формування нової кісткової тканини є центральною ланкою патогенезу глюкокортикоїд-індукованого остеопорозу. Дисбаланс формування та резорбції кісткової тканини за остеопорозу може відображати порушення основних механізмів системної гормональної та місцевої (цитокінової) регуляції активності остеобластів та остеокластів [26].
У даній роботі було досліджено за рівнем експресії ключових маркерів ремоделювання кісткової тканини, інтенсивність і характер зміни циклу її формування-резорбції за глюкокортикоїд-індукованого остеопорозу у взаємозв’язку із забезпеченістю організму тварин вітаміном D. Показано, що експресія детермінантних для остеобласт-остеокластичної взаємодії протеїнів OPG, RANK, VDR і маркера фізіологічного стану кісткової тканини — остеокальцину зазнає преднізолон-індукованої негативної регуляції і може корегуватись введенням вітаміну D3 як критично важливого фактора, що забезпечує формування кісткової тканини та депонування мінеральних компонентів.
RANK є ключовим компонентом остеокінової системи, локалізованим на клітинній поверхні преостеокластів, що сприяє їх диференціюванню в остеокласти та активуванню зрілих остеокластів, відповідальних за посилення процесу резорбції кісткової тканини. Тому вміст протеїну RANK може корелювати як із кількістю клітин остеобластів, так і з їх активністю в кістковій тканині. Встановлене нами зниження вмісту RANK скоріше за все відображає гальмування інтенсивності остекластогенезу за глюкокортикоїд-індукованого остеопорозу. Однак, з іншого боку, відомо, що резорбтивна активність остеокластів і характер ремоделювання кісткової тканини здебільшого визначаються співвідношенням продукування OPG та RANKL [11]. У кістковій тканині OPG синтезується переважно остеобластами й остеоцитами та діє як ендогенний розчинний рецептор-пастка для RANKL [6, 7]. Остеопротегерин, зв’язуючи RANKL, запобігає активації RANK на клітинній поверхні остеокластів, що знижує як остеокластогенез, так і резорбтивну активність остеокластів. Отже, виявлене зниження рівня OPG, імовірно, сприяє посиленню RANKL-опосередкованої резорбції кісткової тканини.
У цілому отримані результати узгоджуються з даними літератури щодо можливості модуляторних ефектів глюкокортикоїдів на стан цитокінової системи RANKL — RANK — OPG [9–11]. Незважаючи на відсутність істотних змін експресії RANKL і зниження рівня RANK, недостатнє утворення OPG може свідчити про пригнічення функціональної активності остеобластів і переважання остеокласт-опосередкованої резорбції кісткової тканини над остеобласт-залежним процесом остеосинтезу, що було підтверджено даними порушень стану мінерального обміну. Зважаючи на роль остеокальцину як гідроксіапатит-зв’язувального протеїну й однієї з детермінантних сполук остеобласт-опосередкованого формування кісткового матриксу, можна констатувати чітко виражене гальмування остеосинтезу та подальшу демінералізацію кісткової тканини за дії преднізолону [27]. Крім того, додатковим свідченням пригнічення функціональної активності клітин, відповідальних за остеосинтез (остеобласти та остеоцити), є виявлене нами зниження вмісту в кістковій тканині маркерного для цих клітин протеїну — VDR.
У роботах інших авторів показано, що високі концентрації глюкокортикоїдів пригнічують експресію генів колагену І типу, фібронектину, остеокальцину в остеобластах, а також активують синтез тканинних колагеназ. Глюкокортикоїди змінюють інтенсивність синтезу й активність факторів росту остеобластів, інгібують диференціацію клітин-попередників та індукують апоптоз остеобластів [28], що частково може пояснювати встановлене нами зниження рівнів маркерних для остеобластів протеїнів, остеокальцину та VDR, у кістковій тканині. З іншого боку, за деякими даними літератури, глюкокортикоїди посилюють експресію клітинами-попередниками остеобластів колоній-стимулюючого фактора І та RANKL; стимулюють резорбцію кістки, в основному, через активацію зрілих остеокластів і подовження їх життєвого циклу [11].
Беручи до уваги наявність вираженого дефіциту вітаміну D за умов глюкокортикоїдної терапії та ефективність введення холекальциферолу, виявлені зміни вмісту досліджуваних остеокінів та їх співвідношення, можуть, принаймні частково, бути зумовленими порушеннями механізмів реалізації біологічної дії холекальциферолу в регулюванні кісткового ремоделювання та вказувати на пряме чи опосередковане залучення D-гормону до цих процесів.
Одна з причин негативного балансу кальцію в організмі за розвитку преднізолон-індукованого остеопорозу, по-перше, може бути пов’язана зі зниженням його біодоступності внаслідок негативного впливу глюкокортикоїдів на обмін вітаміну D та його фізіологічну функцію в регуляції кальцієвого гомеостазу. Зниження рівня 25ОНD у сироватці крові за дії преднізолону значною мірою зумовлено гепатотоксичністю глюкокортикоїдів і зниженням умісту й активності ізоензимів вітамін D-25-гідроксилази гепатоцитів, про що свідчать результати наших попередніх досліджень [29]. По-друге, вітамін D є одним з основних регуляторів формування кісткової тканини в процесі її розвитку й ремоделювання протягом усього життєвого циклу. Через прямий вплив на клітини кісткової тканини гормонально активна форма вітаміну D контролює процес проліферування мезенхімальних стовбурових клітин, їх диференціювання з утворенням колонок хондроцитів, ростової пластинки (резервна зона — зона спокою) й остеобластів, а також може прямо або опосередковано регулювати диференціацію й активність остеокластів [30]. Не виключено, що здатність вітаміну D3 підвищувати експресію VDR та досліджуваних цитокінів у кістковій тканині зумовлена наявністю конкурентних взаємодій між вітаміном D3 і преднізолоном за зв’язування з консенсусною послідовністю промоторних ділянок генів-мішеней.
Висновки
Отримані результати дослідження продемонстрували, що зміни в цитокінових системах остеокальцину та RANKL-RANK-OPG, які відбуваються на фоні недостатньої забезпеченості організму вітаміном D3, можуть відповідати за втрату кісткової тканини при тривалому введенні преднізолону. Вітамін D3 здатен нормалізувати виявлені порушення ремоделювання кісткової тканини через VDR-опосередкований вплив на клітини кісткової тканини, зміщуючи остеобласт-остеокластну рівновагу в бік посилення процесів остеосинтезу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Інформація про внесок кожного автора
Шиманський І.О. Концепція й дизайн дослідження, написання статті.
Лісаковська О.О. Отримання, обробка експериментальних даних та їх інтерпретація, оформлення ілюстрацій.
Великий М.М. Концепція дослідження та аналіз отриманих результатів.
Список литературы
1. Zofkova I, Blahos J. New molecules modulating bone metabolism - new perspectives in the treatment of osteoporosis. Physiol Res. 2017 Sep 26;66(Supplementum 3):S341-S347. PMID: 28948818.
2. Wacker M, Holick MF. Vitamin D - effects on skeletal and extraskeletal health and the need for supplementation. Nutrients.2013 Jan 10;5(1):111-48. doi: 10.3390/nu5010111.
3. Cruz-Topete D, Cidlowski JA. One hormone, two actions: anti- and pro-inflammatory effects of glucocorticoids. Neuroimmunomodulation. 2015;22(1-2):20-32. doi: 10.1159/000362724.
4. Hartmann K, Koenen M, Schauer S, et al. Molecular actions of glucocorticoids in cartilage and bone during health, disease, and steroid therapy. Physiol Rev. 2016 Apr;96(2):409-47. doi: 10.1152/physrev.00011.2015.
5. Pereira RM, Carvalho JF, Canalis E. Glucocorticoid-induced osteoporosis in rheumatic diseases. Clinics (Sao Paulo). 2010 Nov; 65(11):1197-1205. doi: 10.1590/S1807-59322010001100024.
6. Xiao W, Wang Y, Pacios S, Li S, Graves DT. Cellular and molecular aspects of bone remodeling. Front Oral Biol. 2016;18:9-16. doi: 10.1159/000351895.
7. Liu W, Zhang X. Receptor activator of nuclear factor-κB ligand (RANKL)/RANK/osteoprotegerin system in bone and other tissues (review). Mol Med Rep. 2015 May;11(5):3212-8. doi: 10.3892/mmr.2015.3152.
8. Takayanagi H. New developments in osteoimmunology. Nat Rev Rheumatol. 2012 Nov;8(11):684-9. doi: 10.1038/nrrheum.2012.167.
9. Canalis E. Clinical review 83: Mechanisms of glucocorticoid action in bone: implications to glucocorticoid-induced osteoporosis. J Clin Endocrinol Metab. 1996 Oct;81(10):3441-7. doi: 10.1210/jcem.81.10.8855781.
10. Brändström H, Bjorkman T, Ljunggren O. Regulation of osteoprotegerin secretion from primary cultures of human bone marrow stromal cells. Biochem Biophys Res Commun. 2001 Jan 26;280(3):831-5. doi: 10.1006/bbrc.2000.4223.
11. Shi C, Qi J, Huang P, et al. MicroRNA-17/20a inhibits glucocorticoid-induced osteoclast differentiation and function through targeting RANKL expression in osteoblast cells. Bone. 2014 Nov;68:67-75. doi: 10.1016/j.bone.2014.08.004.
12. Kinoshita Y, Masuoka K, Miyakoshi S, Taniguchi S, Takeuchi Y. Vitamin D insufficiency underlies unexpected hypocalcemia following high dose glucocorticoid therapy. Bone. 2008 Jan;42(1):226-8. doi: 10.1016/j.bone.2007.09.042.
13. Pludowski P, Grant WB, Bhattoa HP, et al. Vitamin D status in central Europe. Int J Endocrinol. 2014;2014:589587. doi: 10.1155/2014/589587.
14. Guessous I. Role of Vitamin D deficiency in extraskeletal complications: predictor of health outcome or marker of health status? Biomed Res Int. 2015;2015:563403. doi: 10.1155/2015/563403.
15. Komissarenko YuI, Bobryk MI. Autoimmune Disorders in Endocrine Pathology. A New Look on the Diagnosis and Management. According to the Materials of 18th European Congress of Endocrinology (Munich, May 2016). Mezhdunarodnyi Endokrinologicheskii Zhurnal. 2016;76(4):41-4. doi: 10.22141/2224-0721.4.76.2016.77797. (in Russian).
16. Montecino MA, Lian JB, Stein JL, Stein JS, van Wijnen AJ, Cruzat F. Biological and molecular effect of vitamin D on bone. In: Holick MF. Vitamin D. Physiology, molecular biology, and clinical applications. Totowa, USA: Humana Press; 2010. 1160 p.
17. Tanner SB, Harwell SA. More than healthy bones: a review of vitamin D in muscle health. Ther Adv Musculoskelet Dis. 2015 Aug;7(4):152-9. doi: 10.1177/1759720X15588521.
18. Caprio M, Infante M, Calanchini M, Mammi C, Fabbri A. Vitamin D: not just the bone. Evidence for beneficial pleiotropic extraskeletal effects. Eat Weight Disord. 2017 Mar;22(1):27-41. doi: 10.1007/s40519-016-0312-6.
19. Kvashnina LV. Immunomodulatory properties of vitamin D in children. Zdorov’ye Rebenka. 2013;7(50):134-8. (in Russian).
20. Li H, Xie H, Fu M, et al. 25-hydroxyvitamin D3 ameliorates periodontitis by modulating the expression of inflammation-associated factors in diabetic mice. Steroids. 2013 Feb;78(2):115-20. doi: 10.1016/j.steroids.2012.10.015.
21. Dyce BJ, Bessman SP. A rapid nonenzimatic assay for 2,3-DPG in multiple specimens of blood. Arch Environ Health. 1973 Aug;27(2):112-5. PMID: 4721197.
22. Vroon DH, Israili Z, authors; Walker HK, Hall WD, Hurst JW, editors. Clinical methods: the history, physical, and laboratory examinations. 3rd edition. Boston: Butterworths; 1990. 1087 p.
23. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970 Aug 15;227(5259):680-5. PMID: 5432063.
24. Lapach SN, Chubenko AV, Babich PN. Statisticheskie metody v mediko-biologicheskikh issledovaniiakh s ispol’zovaniem Excel [Statistical methods in biomedical studies using Excel]. Kiev: Morion; 2000. 320 p. (in Russian).
25. Povorozniuk VV, Dedukh NV, Grigor’eva NV, Gopkalova IV. Eksperimental’nyi osteoporoz [Experimental osteoporosis]. Kiev: Ekspress; 2012. 228 p. (in Russian).
26. Matsubara R, Kukita T, Ichigi Y, et al. Characterization and identification of subpopulations of mononuclear preosteoclasts induced by TNF-α in combination with TGF-β in rats. PLoS One. 2012; 7(10): e47930. doi: 10.1371/journal.pone.0047930.
27. Song L. Calcium and Bone Metabolism Indices. Adv Clin Chem. 2017;82:1-46. doi: 10.1016/bs.acc.2017.06.005.
28. Weinstein RS, Jilka RL, Parfitt AM, Manolagas SC. Inhibition of osteoblastogenesis and promotion of apoptosis of osteoblasts and osteocytes by glucocorticoids. Potential mechanism of their deleterious effects on bone. J Clin Invest. 1998 Jul 15;102(2):274-82. doi: 10.1172/JCI2799.
29. Lisakovska O, Shymanskyy I, Mazanova A, Khomenko A, Veliky M. Vitamin D3 protects against prednisolone-induced liver injury associated with the impairment of the hepatic NF-κB/iNOS/NO pathway. Biochem Cell Biol. 2017 Apr;95(2):213-22. doi: 10.1139/bcb-2016-0070.
30. St-Arnaud R, Naja RP. Vitamin D metabolism, cartilage and bone fracture repair. Mol Cell Endocrinol. 2011 Dec 5;347(1-2):48-54. doi: 10.1016/j.mce.2011.05.018.
/26_2.jpg)
/28.jpg)

/26.jpg)
/27.jpg)
/28__2.jpg)