Резюме
Мета дослідження: визначити вплив консервативної терапії на генетично зумовлені порушення метаболізму кісткової тканини у хворих на D-залежний рахіт ІІ типу з генетичним ушкодженням формування колагену І типу. Матеріали та методи. На базі консультативно-поліклінічного відділу ДУ «Інститут травматології та ортопедії НАМНУ» було обстежено та проліковано 13 пацієнтів із діагнозом вітамін-D-залежного рахіту ІІ типу з генетичним ушкодженням формування колагену І типу (ВДЗР(COL1)). Консервативне лікування пацієнтів з даним рахітоподібним захворюванням проводилось у 4 етапи. Перший етап включав повне обстеження пацієнта щодо рівня кальцію, фосфору крові та сечі, кальцидіолу та кальцитріолу крові, показників паратиреоїдного гормону та остеокальцину, а також маркера кісткоутворення P1NP і маркера остеорезорбції β-CTx. На першому етапі в обов’язковому порядку діти проходили генетичне дослідження для виявлення змін (поліморфізму) в алелях рецепторів до вітаміну D та колагену І типу. Обстеження на наступних етапах проводилось у повному обсязі, окрім генетичних досліджень. Результати. Виявлено, що генетично зумовлене порушення рецепції вітаміну D призводить до значного акумулювання активного метаболіту вітаміну D у сироватці крові, що при поєднанні даної патології з генетично детермінованим порушенням формування колагену І типу вірогідно впливало на процеси кісткоутворення/кісткоруйнування із залученням механізмів компенсації остеомаляційного процесу (система «паратгормон — вітамін D — остеокальцин»). Всебічне вивчення метаболізму вітаміну D та біохімічних показників життєдіяльності кісткової тканини у хворих на ВДЗР(COL1) дозволило впритул підійти до розуміння деяких питань патогенезу та сутності остеомаляційних, а в подальшому — остеопоротичних змін різного ступеня, об’єктивувати ці зміни у відповідних показниках біохімічного дослідження та залежно від змін розробити різні схеми медикаментозної корекції порушень кісткового обміну при даному захворюванні. Висновки. Порушення рецепції до кальцитріолу в поєднанні з генетично зумовленим порушенням формування колагену І типу відображає найбільш тяжкі порушення метаболізму кісткової тканини при вітамін-D-залежному рахіті, що, у свою чергу, викликає в організмі дитини, яка росте, прискорення кісткового обміну та прогресування остеомаляційних процесів поряд зі значним прискоренням розсмоктування кісткової тканини. Це, на нашу думку, пов’язано з формуванням недосконалого колагену, який організм дитини намагається перебудувати, хоча дане припущення потребує подальшого вивчення.
Цель исследования: определить влияние консервативной терапии на генетически обусловленные нарушения метаболизма костной ткани у больных витамин-D-зависимым рахитом ІІ типа с генетическим нарушением формирования коллагена І типа. Материалы и методы. На базе консультативно-поликлинического отделения ГУ «Институт травматологии и ортопедии НАМНУ» были обследованы и пролечены 13 пациентов с диагнозом витамин-D-зависимого рахита ІІ типа с генетическим нарушением формирования коллагена І типа (ВДЗР(COL1)). Консервативное лечение пациентов с рахитоподобным заболеванием проводилось в 4 этапа. Первый этап включал полное обследование пациента относительно уровня кальция, фосфора в крови и мочи, кальцидиола и кальцитриола в крови, показателей паратиреоидного гормона и остеокальцина, а также маркера костеобразования P1NP и маркера остеорезорбции β-CTx. На первом этапе в обязательном порядке дети проходили генетическое исследование для определения изменений (полиморфизма) в аллелях рецепторов к витамину D и коллагена І типа. Обследование на следующих этапах проводилось в полном объеме, кроме генетических исследований. Результаты. Было обнаружено, что генетически обусловленное нарушение рецепции к витамину D приводит к значительному аккумулированию активного метаболита витамина D в сыворотке крови, что вместе с генетически обусловленным нарушением формирования коллагена І типа достоверно влияло на процессы костеобразования/костеразрушения с вовлечением механизмов компенсации остеомаляционного процесса (система «паратгормон — витамин D — остеокальцин»). Всестороннее исследование метаболизма витамина D и биохимических показателей жизнедеятельности костной ткани у больных ВДЗР(COL1) позволило вплотную подойти к пониманию некоторых вопросов патогенеза и сущности остеомаляционных и в дальнейшем — остеопоротических изменений разного уровня, объективизировать эти изменения в соответствующих показателях биохимического исследования и в зависимости от изменений разработать разные схемы медикаментозной коррекции нарушений обмена костной ткани при данном заболевании. Выводы. Нарушение рецепции к кальцитриолу вместе с генетически обусловленным нарушением формирования коллагена І типа отражает наиболее тяжелые нарушения метаболизма костной ткани при витамин-D-зависимом рахите, что, в свою очередь, вызывает в организме растущего ребенка ускорение темпов костного обмена и прогрессирование остеомаляционных процессов вместе со значительным ускорением резорбции костной ткани. На наш взгляд, это связано с формированием несовершенного коллагена, который организм ребенка старается перестроить, хотя данное предположение требует дальнейшего исследования.
Background. The purpose of the article is to determine the effect of conservative therapy on genetically caused disorders of bone tissue metabolism in patients with vitamin D-dependent rickets type II and genetic abnormality of type I collagen formation (VDDR(COL1)). Materials and methods. At the premises of consulting and outpatient department of SI “Institute of Traumatology and Orthopaedics of the NAMS of Ukraine”, 13 patients having VDDR type II and genetic damage of type I collagen formation were examined and treated. The medical treatment was conducted in four stages. The first stage included full examination of patients (calcium and phosphorus levels in the blood serum and their urinary excretion, as well as determination of calcidiol and calcitriol serum levels, indicators of parathyroid hormone and osteocalcin, and a marker of bone formation P1NP and osteoresorption β-CTx). At this stage, children were obligated to undergo a genetic test to detect changes (polymorphism) in alleles of receptors to vitamin D and type I collagen. Besides genetic tests, examinations at the other stages were conducted in full. Results. The study has shown the following. The genetically caused abnormality of reception to vitamin D results into substantial accumulation of vitamin D active metabolite in the blood serum. When combined with genetic abnormality of type I collagen formation, it significantly affected bone formation and destruction processes that causes development of osteomalacia (parathormone — vitamin D — osteocalcin system). The comprehensive study of vitamin D metabolism and biochemical vitals of bone tissue in patients having VDDR (COL1) brought us to understanding of some issues related to pathogenesis and nature of osteomalacia and, in future, osteoporotic changes on different levels, ensured us to express these changes by corresponding indices in the biochemical research and, finally, to develop appropriate schemes for the treatment of bone metabolism abnormalities existing at this disease. Conclusions. The impaired reception to calcitriol, when combined with genetic abnormality of type I collagen formation, shows the most serious bone tissue metabolism disorders in patients with vitamin D-dependent rickets, that further causes bone metabolism acceleration and osteomalation progression in the body of a growing child, as well as substantial acceleration of bone tissue resorption. In our opinion, the cause of the aforesaid phenomenon is formation of compromised collagen, which the child’s organism tries to rebuild; however, this assumption requires further study.
Вступ
Вітамін-D-залежний рахіт (ВДЗР) (спадковий рахіт) — генетично детерміноване захворювання, пов’язане з порушенням метаболізму вітаміну D. ВДЗР поділяється на два типи. При І типі ВДЗР не відбувається чи частково гальмується конверсія 25-гідроксивітаміну D у 1,25-дигідроксивітамін D. Дане порушення відбувається через дефіцит чи аномалію ниркової 1,25-гідроксилази, що необхідна для перетворення 25-гідроксивітаміну D у 1,25-дигідроксивітамін D [3–6, 12]. При ІІ типі ВДЗР має місце нечутливість кінцевого органа до автогена 1,25-дигідроксивітаміну D. Порушення взаємодії 1,25-дигідроксивітаміну D з рецептором може бути зумовлене повною відсутністю рецепторів або дефектами гормонзв’язуючого чи ДНК-зв’язуючого домену рецептора вітаміну D (VDR) [4, 9, 12, 11]. Під час вивчення в наших дослідженнях генетично зумовленого порушення поліморфізму до рецепторів вітаміну D виявлено, що в деяких пацієнтів виявляється поліморфізм у алелях гена колагену І типу (COL1), який ми внутрішньо класифікували як вітамін-D-залежний рахіт COL1 типу (ВДЗР(COL1)).
Відомо, що органічний матрикс на 90–95 % складається з білка колагену; тільки незначна кількість протеогліканів присутня у сформованій щільній кістці. Колагенові волокна кісткового матриксу створені колагеном, який також входить до складу сухожилків та шкіри. Слушно зауважити, що існує декілька типів колагену, але для кісткової тканини основним є колаген I типу. Його синтезування є складним процесом, що відбувається при нормальній експресії генів, які відповідають за цей процес. Організація колагену I типу відрізняється в різних тканинах, що можна пояснити їх специфічними структурними властивостями та здатністю матриксу до кальцифікації [2, 10].
Існує багато різних причин рахітичних (остеомаляційних) синдромів, але всі вони призводять до відсутності доступного кальцію та фосфору для мінералізації новоутвореного остеоїду. Оскільки в цих порушеннях є спільний напрям (дефекти в мінералізації кісток), діти з рахітом і рахітоподібними захворюваннями мають дуже схожу клінічну картину. Цей стереотип спонукає лікаря разом з клінічними чи рентгенологічними широко застосовувати досить складні лабораторні дослідження для деталізації характеру порушень кісткового метаболізму. Деякі з них стали доступними для нас лише віднедавна [7, 8, 12, 13]. Отримані нами дані про метаболізм кісткової тканини [1] дали можливість проводити лікування порушень кісткового обміну при ВДЗР І типу під біохімічним контролем, лікування проводилось на підставі даних про патогенез даного захворювання.
Метою роботи було визначити вплив консервативної терапії на генетично зумовлені порушення метаболізму кісткової тканини у хворих на D-залежний рахіт ІІ типу з генетичним ушкодженням формування колагену І типу.
Матеріали та методи
На базі консультативно-поліклінічного відділу ДУ «Інститут травматології та ортопедії НАМНУ» було обстежено та проліковано 13 пацієнтів з діагнозом ВДЗР(COL1). Хлопчиків було 53,85 %, дівчаток — 46,15 %. Прогресування ортопедичних проявів спостерігалось вже до 1 року. Більшість пацієнтів (46,15 %) звернулись до лікаря у віці 3–5 років.
Консервативне лікування пацієнтів з рахітоподібними захворюваннями проводили в 4 етапи, 1-й етап включав повне обстеження пацієнта щодо рівня кальцію, фосфору крові та сечі, кальцидіолу та кальцитріолу крові, показників паратиреоїдного гормону та остеокальцину, а також маркера кісткоутворення P1NP і маркера остеорезорбції β-CTx. На першому етапі в обов’язковому порядку діти проходили генетичне дослідження для виявлення поліморфізму в алелях рецепторів до вітаміну D та колагену І типу. Обстеження на наступних етапах проводилось у повному обсязі, окрім генетичних досліджень.
На першому етапі було проліковано 13 пацієнтів, на другому — 8 хворих.
Враховуючи, що дані дослідження крові є довготривалими, а деякі з лабораторних зразків відправлялись комерційними лабораторіями за межі України, обстеження між етапами лікування продовжувалися від 3 до 3,5 місяця.
Як видно з наведених даних, не всі пацієнти пройшли всі заплановані етапи обстеження та лікування, це пов’язано з позитивним клінічним ефектом уже на перших етапах патогенетично обґрунтованих лікувальних заходів.
Результати та обговорення
При обстеженні пацієнтів з рахітоподібними захворюваннями ми виявили дітей, у яких поряд з ураженням рецепторів до вітаміну D встановлено порушення в структурі колагену І типу. Такі пацієнти найтяжче піддавались лікуванню.
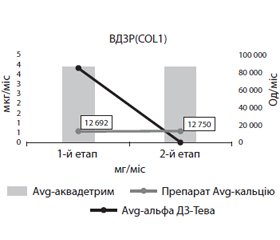
Лікування проводилось препаратами вітаміну D, попередником активного метаболіту вітаміну D — альфакальцидолом та препаратами кальцію (рис. 1).
Лікування ортопедичних проявів ВДЗР(COL1) розпочиналось з 80 000 МО вітаміну D, 4 мкг альфакальцидолу та 12 г кальцію на місяць. Після 3 місяців лікування проводилось повторне вивчення показників кісткового метаболізму, після чого доза препаратів зменшувалася — близько 60 000 МО вітаміну D, а альфакальцидол виводився з лікувального процесу у зв’язку з відсутністю потреби обходити ниркове 1α-гідроксилювання кальцидіолу. Кальцій діти споживали в дозі 400 мг на добу без корекції.
Тепер розглянемо, як змінювались показники крові та сечі в процесі метаболізму кісткової тканини у хворих на ВДЗР(COL1) під час патогенетично обґрунтованого лікування.
Як видно з табл. 1, після першого етапу лікування показники крові вірогідно покращувались, натомість дані екскреції мікроелементів із сечею не мали вірогідної різниці.
Дослідження рівня мікроелементів крові на етапах лікування показало незначну позитивну динаміку в межах вікових показників норми (рис. 2).
Уже на першому етапі лікування ми спостерігали значний приріст рівня кальцидіолу та кальцитріолу в крові, у подальшому рівень кальцидіолу був дещо вищим від верхньої вікової границі норми, а кальцитріол мав тенденцію до утримання на рівні, вищому за норму (рис. 3). Слід нагадати, що дози вітаміну D дорівнювали лікувальним дозам при ВДЗР І типу, а після другого етапу лікування діти приймали профілактичні дози вітаміну D.
Натомість кальцитріол мав тенденцію до різкого зростання. Це, на наш погляд, зумовлене акумулятивною властивістю вітаміну D: накопичуючись, він починає впливати на ті VDR, що зберегли здатність виконувати свою функцію. На підтвердження нашого припущення терапевтичний ефект, вирівнювання деформацій н/кінцівок, ми спостерігали при утриманні кальцитріолу наднормово в межах 250–350 пмоль/л, аналогічно при ВДЗР ІІ типу.
У наших дослідженнях ми спостерігали після першого етапу лікування зниження рівня паратиреоїдного гормону в крові, який до та після лікування загалом не виходив за межі вікових норм. Маркер кісткового обміну був досить низьким для дитячого організму, що росте (рис. 4).
Показники кісткоутворення та кісткоруйнування мали чітку тенденцію до зменшення після початку лікування. Як видно на рис. 5, показники P1NP і β-CTx демонструють стійку регресію, що, у свою чергу, значно сповільнює кістковий обмін, дозволяючи кістковій тканині стати повноцінно зрілою.
Ниркова реабсорбція кальцію була майже незмінною, показники добового вмісту кальцію в сечі утримувалися на межі нижче від норми, тим самим акумулюючи його в кров’яному руслі (рис. 6).
При аналізі кореляційних залежностей на першому етапі лікування виявилось, що при адекватній патогенетичній терапії спостерігалось посилення кореляційних зв’язків.
Наприклад, покращувався зв’язок між іонізованим кальцієм крові та вітаміном D. Формувався досить міцний зв’язок між процесами кісткоутворення та кісткоруйнування. Підтвердження цього можна побачити на рис. 7 (до лікування) та 8 (після першого етапу лікування). За браком кількості пацієнтів в групах 3-го і 4-го етапу лікування кореляційні подібності між показниками крові та сечі не прораховувались.
Пацієнти з ВДЗР(COL1) повинні лікуватись великими дозами вітаміну D та альфакальцидолу на початку лікування для активації рецепторів вітаміну D. Поряд з ураженням рецепторів до вітаміну D ці хворі мають генетичні порушення колагену І типу. На відміну від нозологій, при яких вражається лише колаген І типу, а саме патологічної ламкості кісток, ми не спостерігали залучення механізму надлишкового кісткоруйнування. Показники маркера кісткоруйнування були схожими на такі при інших типах вітамін-D-залежного рахіту.
/54.jpg)
Пацієнти з ВДЗР(COL1) проходили лікування, подібне до терапії ВДЗР ІІ типу. На початку лікування застосовувався вітамін D у дозі 80 000 МО, 4 мкг альфакальцидолу на місяць, кальцій у дозі 400–500 мг/д. За даними деяких авторів, що узгоджуються і з нашими результатами, високі початкові дози гормону (кальцитріолу) виявили споріднений дефект та підвищували чутливість до гормону [14]. Надалі лікування не потребувало високих доз вітаміну D, а рівень кальцитріолу підтримувався за допомогою профілактичних його доз. Рівень гормональної форми вітаміну D повинен утримуватися в межах 125–165 нг/мл, трохи більших, ніж при ВДЗР ІІ типу.
Потрібно зауважити, що клінічний ефект при лікуванні ВДЗР(COL1) наставав значно пізніше, ніж при ВДЗР ІІ типу. Можливо, це пов’язано з тим, що при даному захворюванні є не тільки неадекватна чутливість до рецепторів до вітаміну D, але й порушення синтезу колагену, необхідного для формування органічної основи кісткової тканини.
Дана терапія може використовуватися самостійно та бути направленою на покращення метаболізму й структурно-функціонального стану кісткової тканини, а також застосовуватися в перед- та післяопераційному періоді в пацієнтів, яким проводиться хірургічна корекція багатоплощинних деформацій кісток.
Метою розробленої та застосованої терапії було досягнення значного зменшення деформацій кісток, покращення структури кістки, покращення роботи зон росту дитячого організму. Дана терапія застосовувалася як самостійна, що в більшості випадків призводило до медикаментозної корекції багатоплощинних деформацій кісток нижніх кінцівок, так і разом з оперативними корекціями даних деформацій за допомогою малоінвазивного методу — геміепіфізіодезу чи операціями з використанням інтрамедулярних конструкцій, що «ростуть».
Висновки
На підставі вивчення біохімічних показників у пацієнтів із вітамін-D-залежним рахітом COL1 типу та з огляду на поєднання порушення рецепції до вітаміну D і синтезу колагену І типу розроблено патогенетично обґрунтоване лікування, що повинно розпочинатись з великих доз вітаміну D (80 000 Од/міс) та альфакальцидолу (4 мкг/міс) на початку лікування для активації рецепторів вітаміну D. У подальшому лікування не потребує високих доз вітаміну D, а рівень кальцитріолу підтримується за допомогою профілактичних доз вітаміну D (близько 60 000 Од/міс). Для досягнення терапевтичного ефекту рівень гормональної форми вітаміну D у сироватці крові (кальцитріолу) необхідно підтримувати в межах 125–165 нг/мл (p < 0,05).
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Martsynyak SM, Kincha-Polischuk TA. Bone metabolism in patients with vitamin-D-dependent rickets type 2 with formation of violation of collagen type 1. Problemy osteologii’. 2015;18(4):29-33. (in Ukrainian).
2. Kadurina TI, Gorbunova VN. Displaziia soedinitel’noi tkani [Connective tissue dysplasia]. Saint-Petersburg: Elbi; 2009. 714 p. (in Russian).
3. Alzahrani AS, Zou M, Baitei EY, et al. A novel G102E mutation of CYP27B1 in a large family with vitamin D-dependent rickets type 1. J Clin Endocrinol Metab. 2010 Sep;95(9):4176-83. doi: 10.1210/jc.2009-2278.
4. Brooks MH, Bell NH, Love L, et al. Vitamin-D-dependent rickets type II. Resistance of target organs to 1,25-dihydroxyvitamin D. N Engl J Med. 1978 May 4;298(18):996-9. doi: 10.1056/NEJM197805042981804.
5. Chan JC. Renal hypophosphatemic rickets — a review. Int J Pediatr Nephrol. 1982 Dec;3(4):305-10. PMID: 6762360.
6. Econs MJ, Drezner MK. Bone disease resulting from inherited disorders of renal tubule transport and vitamin D metabolism. In: Coe FL, Favus MJ, editors. Disorders of Bone and Mineral Metabolism. New York: Raven Press, 1992. Р. 935-950.
7. Fu GK, Portale AA, Miller WL. Complete structure of the human gene for the vitamin D 1α-hydroxylase, P450c1α. DNA Cell Biol. 1997 Dec;16(12):1499-507. doi: 10.1089/dna.1997.16.1499.
8. Holick MF. The use and interpretation of assays for vitamin D and its metabolites. J Nutr. 1990 Nov;120 Suppl 11:1464-9. PMID: 2243289.
9. Katavetin P, Katavetin P, Wacharasindhu S, Shotelersuk V. A girl with a novel splice site mutation in VDR supports the role of a ligand-independent VDR function on hair cycling. Horm Res. 2006;66(6):273-6. doi: 10.1159/000095546.
10. Katz EP, Li ST. The intermolecular space of reconstituted collagen fibrils. J Mol Biol. 1973 Feb 19;73(3):351-69. PMID: 4686200.
11. Reade TM, Scriver CR, Glorieux FH, et al. Response to crystalline 1alpha-hydroxyvitamin D3 in vitamin D dependency. Pediatr Res. 1975 Jul;9(7):593-9. DOI: 10.1203/00006450-197507000-00008.
12. Silver J, Landau H, Bab I, et al. Vitamin D-dependent rickets types I and II. Diagnosis and response to therapy. Isr J Med Sci. 1985 Jan;21(1):53-6. PMID: 2982764.
13. Tohmé JF, Seibel MJ, Silverberg SJ, Robins SP, Bilezikian JP. Biochemical markers of bone metabolism. Z Rheumatol. 1991 May-Jun;50(3):133-41. PMID: 1927060.
14. Whitfield GK, Selznick SH, Haussler CA, et al. Vitamin D receptors from patients with resistance to 1,25-dihydroxyvitamin D3: point mutations confer reduced transactivation in response to ligand and impaired interaction with the retinoid X receptor heterodimeric partner. Mol Endocrinol. 1996 Dec;10(12):1617-31. doi: 10.1210/mend.10.12.8961271.
/51.jpg)
/52.jpg)
/53.jpg)

/52_3.jpg)
/52_2.jpg)
/53_2.jpg)
/54.jpg)