Украинский журнал хирургии 4 (35) 2017
Резекция воротной вены в лечении перихилярной холангиокарциномы
Авторы: Котенко О.Г., Попов А.О., Гриненко А.В., Гусев А.В., Григорян М.С., Федоров Д.А., Коршак А.А., Остапишен А.Н., Минич А.А.
ГУ «Национальный институт хирургии и трансплантологии им. А.А. Шалимова НАМН Украины», г. Киев, Украина
Рубрики: Хирургия
Разделы: Клинические исследования
Резюме
Актуальність. Перихілярна холангіокарцинома — рідкісний вид злоякісних новоутворень, який становить 3–7 випадків на 100 000 населення. Хірургічний метод є єдиним радикальним методом лікування, що дозволяє поліпшити віддалені результати виживання. Особливу складність становлять випадки з пухлинною інвазією ворітної вени. Метою цього дослідження було вивчення результатів хірургічного лікування пацієнтів з перихілярною холангіокарциномою з інвазією в ворітну вену. Матеріали та методи. З 2003 по 2017 рік у відділенні трансплантації та хірургії печінки НІХтТ НАМН України ім О.О. Шалімова зроблено великі та розширені резекції печінки 153 хворим із перихілярною холангіокарциномою. Результати. Для встановлення характеру ураження біліарного дерева використовували анатомічну класифікацію перихілярної холангіокарциноми Bismuth-Corlette. З 153 хворих у 66 (43 %) випадках виконали резекцію ворітної вени з подальшою реконструкцією. 1, 3 і 5-річна виживаність в групі пацієнтів з резекцією ворітної вени становила 81,8, 40,9 і 31,8 % відповідно. Висновки. Агресивна тактика хірургічного лікування перихілярної холангіокарциноми забезпечує максимальну радикальність, дозволяє збільшити резектабельність при пухлинній інвазії ворітної вени з прийнятною летальністю і віддаленою виживаністю.
Актуальность. Перихилярная холангиокарцинома — редкий вид злокачественных новообразований, который составляет 3–7 случаев на 100 000 населения. Хирургический метод является единственным радикальным методом лечения, позволяющим улучшить отдаленные результаты выживаемости. Особую сложность представляют случаи с опухолевой инвазией воротной вены. Целью настоящего исследования явилось изучение результатов хирургического лечения пациентов с перихилярной холангиокарциномой с инвазией в воротную вену. Материалы и методы. С 2003 по 2017 г. в отделении трансплантации и хирургии печени НИХиТ НАМН Украины им А.А. Шалимова произведены обширные и расширенные резекции печени 153 больным с перихилярной холангиокарциномой. Результаты. Для установления характера поражения билиарного дерева использовали анатомическую классификацию перихилярной холангиокарциномы Bismuth-Corlette. Из 153 больных в 66 (43 %) случаях выполнили резекцию воротной вены с последующей реконструкцией. 1, 3 и 5-летняя выживаемость в группе пациентов с резекцией воротной вены составила 81,8, 40,9 и 31,8 % соответственно. Выводы. Агрессивная тактика хирургического лечения перихилярной холангиокарциномы обеспечивает максимальную радикальность, позволяет увеличить резектабельность при опухолевой инвазии воротной вены с приемлемой летальностью и отдаленной выживаемостью.
Background. Perichilar cholangiocarcinoma is a rare type of malignant neoplasm, and its incidence is 3–7 cases per 100,000 population. Surgery is the only radical method of treatment allowing to improve long-term survival results. The cases with tumor invasion of the portal vein are of particular complexity. The purpose of this research was to study the results of surgical treatment of patients with perihilar cholangiocarcinoma with invasion of the portal vein. Materials and methods. From 2003 to 2017, in the department of transplantation and surgery of the liver, extensive and advanced liver resections were preformed in 153 patients with perihilar cholangiocarcinoma. Results. To establish the nature of the lesion of the biliary tree, Bismuth-Corlette anatomical classification of the perihilar cholangiocarcinoma was used. Out of 153 patients, in 66 (43 %) cases, a portal vein resection was performed with subsequent reconstruction. One-, three- and five-year survival rate in the group of patients with portal vein resection was 81.8, 40.9 and 31.8 %, respectively. Conclusions. Aggressive surgical treatment of perihilar cholangiocarcinoma provides maximum radicality, allows to increase resectability in case of tumor invasion of the portal vein with acceptable mortality and long-term survival.
Ключевые слова
перихілярна холангіокарцинома; воротна вена; хірургічне лікування
перихилярная холангиокарцинома; воротная вена; хирургическое лечение
perihilar cholangiocarcinoma; portal vein; surgical treatment
Введение
Перихилярная холангиокарцинома является довольно редким видом злокачественных опухолей брюшной полости. Частота выявления составляет 3–7 случаев на 100 000 населения и составляет 3 % всех опухолей желудочно-кишечного тракта [1–3]. По данным литературы, около 30 % впервые выявленных случаев являются нерезектабельными, в 70 % предпринимаются попытки оперативного вмешательства. Из этих пациентов только в 50 % случаев возможно проведение радикального оперативного вмешательства [4].
Первоначально хирургическое лечение хилярной холангиокарциномы заключалось в резекции внепеченочных желчных протоков с последующим формированием билиоэнтероанастомоза [5, 6]. При данном подходе наблюдалось большое число случаев развития ранних рецидивов. Свойство холангиокарциномы распространяться вдоль желчных протоков и лимфатических сосудов обусловливает необходимость выполнения обширных резекций печени. L. Blumgard и B. Launois, пионеры современной гепатобилиарной хирургии, были первыми сторонниками выполнения резекции печени и внепеченочных желчных протоков для получения чистого онкологического края [7, 8]. Несмотря на относительно небольшие размеры перихилярных холангиокарцином, локализация и характер роста этих опухолей обусловливают значительные трудности их хирургического лечения. Так, в связи с субэпителиальным ростом опухоли вдоль протока под внешне неизмененной слизистой оболочкой реальная распространенность опухолевых клеток может превышать макроскопически видимый край на 5–10 мм, что значительно осложняет возможность получения чистого хирургического края. Одной из важных и характерных особенностей перихилярной холангиокарциномы является инвазия опухоли в область бифуркации воротной вены, которая встречается в 30–45 % случаев [9, 10].
Опухолевая инвазия в сосуды портальных ворот до недавнего времени являлась основной причиной нерезектабельности осложненной перихилярной холангиокарциномы. Однако в последнее десятилетие прогресс хирургической техники позволил проводить резекцию и пластику пораженной воротной вены с приемлемыми показателями послеоперационных осложнений и летальности.
Целью настоящего исследования явилось изучение результатов хирургического лечения больных перихилярной холангиокарциномой с инвазией в воротную вену.
Материалы и методы
Пациенты
С 2003 по 2017 год в отделе хирургии и трансплантации печени НИХиТ НАМН Украины были выполнены 153 радикальные резекции печени у пациентов с перихилярной холангиокарциномой. Из них в 66 случаях в связи с инвазией опухоли в воротную вену операции были дополнены резекцией и реконструкцией последней. 102 пациента (67 %) были мужского пола, 51 (33 %) — женского. Средний возраст пациентов составил 61,2 года. Всех пациентов мы стадировали согласно классификации поражения желчных протоков Bismuth-Corlette. Характеристика пациентов представлена в таблице 1.
Предоперационное обследование и подготовка пациентов к оперативному вмешательству
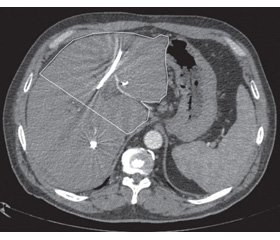
Всем пациентам проводилось дооперационное обследование, включающее общий, биохимический анализ крови, УЗИ органов брюшной полости, ФЭГДС, колоноскопию, ЭхоКГ. В обязательном порядке выполняли трехфазную компьютерную томографию органов брюшной полости и грудной клетки. По данным спиральной компьютерной томографии оценивали поражение паренхимы печени, инвазию в портальные сосуды, печеночные вены, наличие внепеченочных метастазов и рассчитывали объем остающейся части печени (рис. 1). Для оценки поражения желчного дерева всем пациентам выполняли магнитно-резонансную томографию и холангиографию (рис. 2).
Всем пациентам проводили серологическое исследование онкомаркеров. Наиболее специфичным онкомаркером при перихилярной холангиокарциноме являлся углеводный антиген CA 19-9. Известно, что при повышении уровня СA 19-9 более 180 Ед/мл его чувствительность составляет 79 %, а специфичность — 98 % [3, 11, 12].
Обструкция желчных протоков может приводить к бактериальной транслокации, нарушению свертывающей системы крови, почечной недостаточности и повышению риска развития печеночной недостаточности в послеоперационном периоде [13, 14]. Ввиду этого в предоперационном периоде выполняли декомпрессию желчных протоков с помощью их наружного дренирования под рентген- или ультразвуковым контролем либо проводили ретроградное эндобилиарное стентирование. Чреcкожную чреспеченочную холангиостомию одного долевого протока выполняли в 78 (51 %) случаях, двух долевых протоков — в 54 (35 %) случаях, трех и более долевых и сегментарных протоков — в 9 (6 %) случаях. У 14 (9 %) пациентов произвели эндоскопическую ретроградную холангиостомию. Допустимым уровнем билирубинемии в предоперационном периоде считали < 60 мкмоль/л.
Другими факторами, влияющими на возникновение печеночной недостаточности после резекции печени, являются будущий объем и качество паренхимы остающейся части печени. В исследованиях показано, что эмболизация воротной вены удаляемой части печени перед расширенной гемигепатэктомией оправдана при объеме планируемого остатка менее 25 % [15].
В случаях, когда планируемый печеночный остаток был менее 35 % от общего объема печени, мы выполняли эмболизацию ветвей воротной вены (рис. 3). Чрескожную чреспеченочную эмболизацию воротной вены проводили ипсилатеральным доступом под ультразвуковым контролем. После под рентген-контролем выполняли портографию для оценки портальной венозной анатомии. Далее выполняли селективную катетеризацию ветвей воротной вены удаляемой части печени. Используя микроэмболы эмболизировали мелкие ветви воротной вены, после чего макроэмболами или металлическими спиралями окончательно окклюзировали целевые секторальные ветви воротной вены. В 5 случаях мы выполняли одномоментную чрес–кожную чреспеченочную холангиостомию и эмболизацию правой долевой ветви воротной вены. Через 3–4 недели выполняли контрольную спиральную компьютерную томографию с целью определения регенерации остающегося остатка печени и выявления прогрессии заболевания (рис. 4).
/12-2.jpg)
/12-3.jpg)
В предоперационном периоде 81 пациенту выполнена диагностическая лапароскопия с целью исключения метастатического поражения печени, отдаленных метастазов брюшной полости и канцероматоза. Это позволило снизить количество эксплоративных лапаротомий.
Хирургическая техника
Оптимальным доступом для проведения резекции печени считаем доступ типа «мерседес». После лапаротомии оценивали наличие метастатических узлов печени, поражения регионарных и отдаленных лимфатических узлов, канцероматоза висцеральной и париетальной брюшины с целью окончательной оценки резектабельности. На первом этапе во всех случаях проводили расширенную лимфодиссекцию. После мобилизации двенадцатиперстной кишки по Кохеру приступали к расширенной лимфаденэктомии. Первым этапом выполняли лимфодиссекцию нижней полой вены и аорты до бифуркации подвздошных сосудов. После удаления ретропанкреатических лимфоузлов выделяли общий желчный проток. Дистальный отдел холедоха пересекали у верхнего края поджелудочной железы, выполняли экспресс-биопсию. При наличии опухолевых клеток в 4 случаях операцию дополняли панкреатодуоденальной резекцией. Следующим этапом выполнялась тщательная лимфодиссекция и диссекция нервных сплетений вдоль чревного ствола, общей печеночной артерии, гастродуоденальной артерии и воротной вены. Выделение сосудов портальных ворот печени проводили в проксимальном направлении, чтобы свести к минимуму протяженность сосудистой резекции (рис. 5).
/13-1.jpg)
Артерии и вены, питающие хвостатую долю печени и желчные протоки, пересекали и перевязывали. Выделяли проксимальный отдел непораженной ветви воротной вены. Печень мобилизировали, пересекая треугольную и серповидную связки, выделяли запеченочный сегмент нижней полой вены до устья печеночных вен. Следующим этапом с использованием ультразвукового аспиратора выполняли транссекцию паренхимы печени. Для минимизации интраоперационной кровопотери применяли метод Pringle с интервалом в 15 минут. По достижении желчного протока остающейся части печени последний пересекался, принимая во внимание достаточный запас для выполнения реконструктивного этапа. Далее накладывали два сосудистых зажима на дистальную и проксимальную части воротной вены и удаляли препарат единым блоком с внепеченочными желчными протоками, желчным пузырем и конфлюенсом воротной вены. Воротную вену реконструировали по типу «конец в конец» непрерывным сосудистым швом с использованием неабсорбирующего сосудистого шовного материала 5.0 (рис. 6). В случаях несоответствия диаметров сшиваемых сосудов дистальная часть воротной вены пересекалась в косопоперечном направлении для нивелирования разницы диаметров. После тщательного гемостаза операцию заканчивали формированием гепатикоеюноанастомоза на отключенной петле тонкой кишки по Ру.
/13-1.jpg)
Результаты
За период с 2003 по 2017 год в Национальном институте хирургии и трансплантологии выполнено 205 оперативных вмешательств по поводу перихилярной холангиокарциномы. Из них 153 больным выполнены радикальные оперативные вмешательства. У 52 больных произведена эксплоративная лапаротомия, во время которой выявлены отдаленные метастазы или канцероматоз. Резектабельность составила 74,6 %, что соответствует мировым данным. Пациентам исследуемой группы выполнено 66 обширных и расширенных резекций печени в сочетании с резекцией воротной вены с последующей портопластикой. Характеристика оперативных вмешательств представлена в таблице 2. Длительность операции в исследуемой группе составила 480 минут, интраоперационная кровопотеря — 750 мл. В группе сравнения средняя продолжительность оперативного вмешательства составила 420 мин, а кровопотеря — 600 мл. Разница в длительности операции связана с выполнением реконструктивного этапа портопластики, который составил в среднем 25 мин. Пребывание в стационаре в послеоперационном периоде в исследуемой группе составило 36 суток, в контрольной группе — 32. Гистологически опухоль в исследуемой группе в 15 (23 %) случаях была высокодифференцированной, в 39 (59 %) — умеренно дифференцированной, в 12 (18 %) — низкодифференцированной. Согласно гистологическому исследованию, поражение регионарных лимфоузлов было выявлено у 50 (76 %) пациентов.
Частота послеоперационных осложнений и летальности существенно не отличались в обеих группах. Все осложнения были классифицированы согласно градации Dindo-Clavien (табл. 3). У 35 (53 %) пациентов отмечалось два и более осложнения. В исследуемой группе пациентов в послеоперационном периоде наиболее часто наблюдался правосторонний экссудативный плеврит, в 35 случаях требующий дренирования плевральной полости. У 5 (7,6 %) пациентов отмечалось желчеистечение из раневой поверхности печени, у 5 (7,6 %) — несостоятельность гепатикоеюноанастомоза. Во всех случаях выполняли дренирование желчного скопления под ультразвуковым контролем.
Послеоперационная летальность в группе больных с резекцией и пластикой воротной вены составила 10 (15 %) пациентов. Наиболее частой причиной летальных исходов стала печеночная недостаточность.
Общая 1, 3, 5-летняя выживаемость в исследуемой группе составила 81,8, 40,9, 31,8 % соответственно. В группе сравнения 1, 3, 5-летняя выживаемость составила 79,3, 39,1, 31 % соответственно (рис. 7).
Обсуждение
Хирургическое лечение перихилярной холангиокарциномы является сложной проблемой хирургической гепатологии, связанной с трудностью получения чистого края резекции из-за близости желчных протоков к сосудистым структурам ворот печени и печеночной паренхимы.
Изолированная резекция желчных протоков без резекции печени связана с высокой частотой положительного края, что приводит к возникновению локального рецидива в течение первого года у 76 % пациентов [16]. Miyazaki и соавторы в своем исследовании показали, что при изолированной резекции внепеченочных желчных протоков отсутствует пятилетняя выживаемость, в то время как пятилетняя выживаемость пациентов, которым выполнялась резекция печени, составила 27 % [17]. Последние достижения в совершенствовании хирургической техники позволили повысить резектабельность перихилярной холангиокарциномы [18] и увеличить пятилетнюю выживаемость, главным образом за счет агрессивной тактики, которая включает обширные резекции печени с хвостатой долей [19–21].
Обширные резекции печени в условиях гипербилирубинемии связаны с повышенным риском послеоперационной печеночной недостаточности и инфекционными осложнениями [3, 13, 22]. В нашем исследовании всем пациентам на дооперационном этапе мы выполняли декомпрессию желчных протоков путем чрескожного чреспеченочного дренирования или энобилиарного стентирования. Оптимальным уровнем билирубина для выполнения резекционного этапа лечения перихилярной холангиокарциномы считаем менее 60 мкмоль/л.
Достаточный объем остающейся части печени является одним из основных факторов снижения послеоперационных осложнений и смертности. Эмболизацию ветвей воротной вены удаляемой части печени впервые применили Makuuchi [23] и Kinoshita [24] в 80-х годах. В настоящее время методика широко используется при подготовке пациентов к обширным и расширенным резекциям печени для минимизации послеоперационной печеночной недостаточности. В нашем исследовании при объеме остающейся части печени менее 35 % от общего объема печени мы выполняли эмболизацию ветвей воротной вены удаляемой части печени.
Инвазия перихилярной холангиокарциномы в воротную вену остается основным препятствием к выполнению оперативных вмешательств. Однако развитие гепатобилиарной хирургии и внедрение трансплантационных технологий позволили расширить показания к радикальным оперативным вмешательствам. Так, некоторые авторы сообщают о незначительной разнице послеоперационной смертности в группах пациентов с резекцией воротной вены и без резекции и портопластики [18, 20, 25]. Ebata и соавторы в своем исследовании сообщают, что резекция воротной вены и портопластика не влияют на отдаленные результаты выживаемости. И только положительный край резекции приводит к снижению выживаемости пациентов с перихилярной холангиокарциномой [25]. L. Lee и коллеги в серии из 302 пациентов с перихилярной холангиокарциномой представляют отсутствие разницы отдаленной выживаемости у пациентов с резекцией воротной вены и без таковой.
P. Neuhaus и соавторы предложили при выполнении правосторонней гемигепатэктомии рутинно выполнять резекцию и пластику воротной вены. В этой серии сообщается о достижении 5-летней выживаемости на уровне 60 %, что является лучшим результатом, о котором сообщалось в настоящее время [21, 26].
Выводы
1. Инвазия перихилярной холангиокарциномы в воротную вену не является противопоказанием к радикальному оперативному лечению.
2. Агрессивная тактика хирургического лечения перихилярной холангиокарциномы обеспечивает максимальную радикальность, позволяет увеличить резектабельность.
3. Инновационные хирургические технологии в лечении перихилярной холангиокарциномы позволяют резецировать инвазированные опухолью висцеральные сосуды и получить удовлетворительные результаты с приемлемым уровнем летальности и отдаленной выживаемости.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Hilar cholangiocarcinoma: pathology and tumor bio–logy / Kuang D., Wang G. P. // Front. Med. China. — 2010. — Vol. 4. — P. 371-377.
2. Surgical treatment of hilar cholangiocarcinoma / Nagino M., Nimura Y., Kamiya J., Kanai M., Uesaka K. // Nihon Geka Gakkai Zasshi. — 1997. — Vol. 98. — P. 491-494.
3. Original article: New surgical approaches to the Klatskin tumour / Van Gulik T.M., Dinant S., Busch O.R., Rauws E.A., Obertop H., Gouma D.J. // Aliment. Pharmacol. Ther. — 2007. — Vol. 26 (Suppl. 2). — P. 127-132.
4. Staging, resectability, and outcome in 225 patients with hilar cholangiocarcinoma / Jarnagin W.R., Fong Y., DeMatteo R.P., Gonen M., Burke E.C., Bodniewicz B.S.J., Youssef B.А.M., Klimstra D., Blumgart L.H. // Ann. Surg. — 2001. — Vol. 234. — P. 507-517; discussion 517-509.
5. Intrahepatic cholangioenteric anastomosis in carcinoma of the hilus of the liver / Bismuth H., Corlette M.B. // Surg. Gynecol. Obstet. — 1975. — Vol. 140. — P. 170-178.
6. Prognostic factors in bile duct carcinoma: analysis of 96 cases / Tompkins R.K., Thomas D., Wile A., Longmire W.P. Jr. // Ann. Surg. — 1981. — Vol. 194. — P. 447-457.
7. Clinicopathological aspects of high bile duct cancer. Experience with resection and bypass surgical treatments / Beazley R.M., Hadjis N., Benjamin I.S., Blumgart L.H. // Ann. Surg. — 1984. — Vol. 199. — P. 623-636.
8. Carcinoma of the hepatic hilus. Surgical management and the case for resection / Launois B., Campion J.P., Brissot P., Gosselin M. // Ann Surg. — 1979. — Vol. 190. — P. 151-157.
9. The impact of portal vein resection on outcomes for hilar cholangiocarcinoma: a multi-institutional analysis of 305 cases / de Jong M.C., Marques H., Clary B.M., Bauer T.W., Marsh J.W., Ribero D., Majno P., Hatzaras I., Walters D.M., Barbas A.S., Mega R., Schulick R.D., Choti M.A., Geller D.A., Barroso E., Mentha G., Capussotti L., Pawlik T.M. // Cancer. — 2012. — Vol. 118. — P. 4737-4747.
10. Combined portal vein resection for hilar cholangiocarcinoma: a meta-analysis of comparative studies / Wu X.S., Dong P., Gu J., Li M.L., Wu W.G., Lu J.H., Mu J.S., Ding Q.C., Zhang L., Ding Q., Weng H., Liu Y.B. // J. Gastrointest. Surg. — 2013. — Vol. 17. — P. 1107-1115.
11. Klatskin-mimicking lesions: still a diagnostical and therapeutical dilemma? / Juntermanns B., Kaiser G.M., Reis H., Saner F. H., Radunz S., Vernadakis S., Heuer M., Kuehl H., Paul A., Treckmann J. // Hepatogastroenterology. — 2011. — Vol. 58. — P. 265-269.
12. Diagnostic and surgical features of Klatskin tumors / Santoro E., Sacchi M., Carboni F., Santoro R., Scardamaglia F. // Chir. Ital. — 1999. — Vol. 51. — P. 1-7.
13. Surgical management of hilar cholangiocarcinoma / Hemming A.W., Reed A.I., Fujita S., Foley D.P., Howard R.J. // Ann. Surg. — 2005. — Vol. 241. — P. 693-699; discussion 699-702.
14. Patient preparation before surgery for cholangiocarcinoma / Oussoultzoglou E., Jaeck D. // HPB (Oxford). — 2008. — Vol. 10. — P. 150-153.
15. Preoperative portal vein embolization for extended hepatectomy / Hemming A.W., Reed A.I., Howard R.J., Fujita S., Hochwald S.N., Caridi J.G., Hawkins I.F., Vauthey J.N. // Ann. Surg. — 2003. — Vol. 237. — P. 686-691; discussion 691-683.
16. Aggressive preoperative management and extended surgery for hilar cholangiocarcinoma: Nagoya experience / Nimura Y., Kamiya J., Kondo S., Nagino M., Uesaka K., Oda K., Sano T., Yamamoto H., Hayakawa N. // J. Hepatobiliary Pancreat Surg. — 2000. — Vol. 7. — P. 155-162.
17. Aggressive surgical approaches to hilar cholangiocarcinoma: hepatic or local resection? / Miyazaki M., Ito H., Nakagawa K., Ambiru S., Shimizu H., Shimizu Y., Kato A., Nakamura S., Omoto H., Nakajima N., Kimura F., Suwa T. // Surgery. — 1998. — Vol. 123. — P. 131-136.
18. Surgical management of hilar cholangiocarcinoma: the Nagoya experience / Nishio H., Nagino M., Nimura Y. // HPB (Oxford). — 2005. — Vol. 7. — P. 259-262.
19. Surgical treatment for carcinoma at the confluence of the major hepatic ducts / Iwasaki Y., Okamura T., Ozaki A., Todoroki T., Takase Y., Ohara K., Nishimura A., Otsu H. // Surg. Gynecol. Obstet. — 1986. — Vol. 162. — P. 457-464.
20. Extended resections for hilar cholangiocarcinoma / Neuhaus P., Jonas S., Bechstein W. O., Lohmann R., Radke C., Kling N., Wex C., Lobeck H., Hintze R. // Ann. Surg. — 1999. — Vol. 230. — P. 808-818; discussion 819.
21. Surgical management of proximal bile duct cancer: extended right lobe resection increases resectability and radica–lity / Neuhaus P., Jonas S., Settmacher U., Thelen A., Benckert C., Lopez-Hanninen E., Hintze R.E. // Langenbecks Arch Surg. — 2003. — Vol. 388. — P. 194-200.
22. Factors influencing postoperative morbidity, mortality, and survival after resection for hilar cholangiocarcinoma / Su C.H., Tsay S.H., Wu C.C., Shyr Y.M., King K.L., Lee C.H., Lui W.Y., Liu T.J., P’Eng F.K. //Ann. Surg. — 1996. — Vol. 223. — P. 384-394.
23. Preoperative portal embolization to increase safety of major hepatectomy for hilar bile duct carcinoma: a preliminary report / Makuuchi M., Thai B. L., Takayasu K., Takayama T., Kosuge T., Gunven P., Yamazaki S., Hasegawa H., Ozaki H. //Surgery. — 1990. — Vol. 107. — P. 521-527.
24. Preoperative portal vein embolization for hepatocellular carcinoma / Kinoshita H., Sakai K., Hirohashi K., Igawa S., Yamasaki O., Kubo S. // World J. Surg. — 1986. — Vol. 10. — P. 803-808.
25. Hepatectomy with portal vein resection for hilar cholangiocarcinoma: audit of 52 consecutive cases / Ebata T., Nagino M., Kamiya J., Uesaka K., Nagasaka T., Nimura Y. // Ann. Surg. — 2003. — Vol. 238. — P. 720-727.
26. Oncological superiority of hilar en bloc resection for the treatment of hilar cholangiocarcinoma / Neuhaus P., Thelen A., Jonas S., Puhl G., Denecke T., Veltzke-Schlieker W., Seehofer D. // Ann. Surg. Oncol. — 2012. — Vol. 19. — P. 1602-1608.
/13-1.jpg)
/13-1.jpg)

/11-2.jpg)
/11-1.jpg)
/12-1.jpg)
/12-2.jpg)
/12-3.jpg)
/14-1.jpg)
/14-2.jpg)