Журнал «Здоровье ребенка» Том 12, №8, 2017
Мікробіота в житті людини: огляд сучасної літератури
Резюме
З кінця минулого сторіччя тема використання пробіотиків як з лікувальною, так і з профілактичною метою як один з аспектів формування здорового способу життя стає все більш популярною. Відкрито багато нового, зокрема, що переважна кількість пробіотичних штамів має секвенований геном (тобто власний ідентифікаційний код); досліджені як ефективність, так і можливі несприятливі наслідки; проведено значну кількість досліджень з вивчення моноштамових та меншу кількість досліджень — із вивчення мультиштамових композицій. І результати всіх досліджень демонструють: правильно сформований з народження мікробіоценоз, що підтримується людиною протягом життя, є одним з найважливіших факторів збереження здоров’я людини. Використання моноштамових пробіотиків має найбільшу доказову базу, але протягом останніх 10 років зростає кількість якісних досліджень, що демонструють ефективність і безпечність використання мультиштамових пробіотиків як у дорослих, так і в дітей.
С конца прошлого столетья тема использования пробиотиков как с лечебной, так и с профилактической целью в качестве одного из аспектов формирования здорового образа жизни становится все более популярной. Открыто много нового, в частности, то, что подавляющее количество пробиотических штаммов имеет секвенированный геном (т.е. собственный идентификационный код); исследованы как эффективность, так и возможные неприятные последствия; проведено большое количество исследований по изучению влияния моноштаммовых пробиотиков и меньшее количество — по изучению мультиштаммовых композиций. И результаты всех исследований демонстрируют один важный тезис: правильно сформированный с рождения микробиоценоз, который поддерживается человеком в течение жизни, является одним из важнейших факторов сохранения здоровья человека. Использование моноштаммовых пробиотиков имеет наибольшую доказательную базу, но на протяжении последних 10 лет возрастает число качественных исследований, демонстрирующих эффективность и безопасность использования мультиштаммовых пробиотиков как у взрослых, так и у детей.
Since the end of the last century, the issue of probiotics use for both curative and preventive purposes is gaining momentum. A lot of researches has been carried out, in the vast majority of probiotic strains, the gene has been sequenced; both efficacy and possible adverse effects were investigated; a large number of researches have been carried out to study the effect of single-strain probiotics and a smaller number — on the study of multistrain compositions. The results of all studies demonstrate one important statement: the microbiocenosis, correctly formed from birth, which is supported by a person during his life, is one of the most important base for maintaining human health.
Ключевые слова
мікробіота; мікробіоценоз; алергія; пробіотики; пребіотики
микробиота; микробиоценоз; аллергия; пробиотики; пребиотики
microbiota; microbiocenosis; allergy; probiotics; prebiotics
Історичні моменти
Розвиток та становлення кишкової мікробіоти в перші роки життя є саме тим динамічним процесом, що значно впливає на все подальше життя людини: процеси травлення, імунного захисту, відновлення та якості життя більшою мірою залежать від того, як сформувався цей симбіоз людини й мікроба в кишечнику. Результати недавніх досліджень дозволяють оцінити ці процеси, що вірогідно впливають на формування певних імунологічних (наприклад, астма або атопічні захворювання) та метаболічних (наприклад, цукровий діабет) захворювань, і саме з огляду на отримані результати зараз можливо втілювати в життя стратегії, спрямовані на запобігання розвитку цих захворювань.
Людина живе у світі, наповненому різноманітними мікроорганізмами, що на сьогодні становлять найбільшу біомасу на планеті [1]. Наприклад, кількість мікробів у кишковому тракті людини в 10 разів перевищує загальну кількість клітин організму, а геном мікробіоти людини перевищує геном людини в 150 разів [2, 3]. Саме кишкова мікробіота тісно пов’язана з організмом хазяїна та підтримує ці двосторонні відносини шляхом активної участі в процесах метаболізму, імунологічного захисту та захисту від патогенів, а також відновлення слизових оболонок [4–6].
Перші нотатки щодо «живих істот у шлунково-кишковому тракті людини» були зроблені в 1681 році голландським натуралістом Антоні ван Левенгуком, який уперше в історії за допомогою свого вдосконаленого мікроскопа зміг спостерігати мікроскопічну будову різних форм живих організмів. Він описав у зразках випорожнень різноманітних «маленьких тварин», які в 1932 році були ідентифіковані як Giardia spp., що спричиняють діарею. Через два сторіччя (1854) французький біолог Казимир Давен детально описав кишкового паразита Pentatrichomonas hominis (у ті часи він називався Trichomonas hominis). Далі німецький педіатр Тео–дор Ешеріх (Theodor Escherich (1857–1911)) дослідив стан кишкового мікробіоценозу в новонароджених дітей і в 1886 році опублікував тези щодо взаємозв’язку мікробіоценозу кишечника немовлят та фізіології травлення [7]. Теодор Ешеріх шляхом бактеріологічних досліджень продемонстрував, що меконій у новонародженої дитини є стерильним, а бактеріальна колонізація кишечника відбувається за рахунок контакту дитини з оточуючим середовищем (включаючи грудне молоко) протягом перших 3–24 годин. Надалі ідентифікація та опис мікроорганізмів шлунково-кишкового тракту людини відбувались швидкими темпами, вагомий внесок у вивчення мікрофлори був зроблений І. Мечниковим.
Становлення мікробіоценозу
Подальший розвиток молекулярної науки дещо змінив уявлення щодо початку колонізації кишечника новонародженої дитини та стерильності меконію: E. Jiménez та R. Satokari зі співавт. довели, що дитина народжується вже з мінімально колонізованим бактеріями кишечником, які дитина починає отримувати від матері ще внутрішньоутробно [9, 10]. Під час та відразу після народження дитина продовжує отримувати материнські бактерії (вагінальна мікробіота, шкіра, грудне молоко, рот) [11–13]. Надалі склад мікробіоти відрізняється залежно від етапів розвитку дитини та її вигодовування: від народження з початком грудного вигодовування до відлучення від грудного молока, і потім уже до дорослого віку. Першими мікроорганізмами, що колонізують слизові оболонки дитини, є факультативні анаероби (Staphylococcus, Streptococcus, Enterococcus та Enterobacter spp.), які створюють анаеробне середовище, що сприяє заселенню й росту облігатної мікрофлори (Bifidobacterium, Bacteroides, Clostridium та Eubacterium spp.). Бактерії, які отримує дитина з грудним молоком, потрапляють у грудні залози з кишечника матері з током лімфи через мезентеріальні лімфатичні вузли [14–16]. Наступний шлях колонізації — це отримання мікробів зі шкіри матері під час ссання грудей. На становлення мікробіоценозу дитини впливають багато факторів: власний генотип та рецепторний апарат слизової оболонки дитини, спосіб розродження (кесарський розтин чи пологи природним шляхом), вигодовування дитини, використання антибіотиків, регіональні та культурні особливості (особливо це стосується місцевого раціону харчування) [17, 18]. Наприклад, у дітей, які перебувають на грудному вигодовуванні, домінуючою флорою є біфідобактерії, натомість у дітей на штучному вигодовуванні поряд з лактобацилами домінуючими є бактероїди, клостридії та вайонели; у передчасно народжених дітей та дітей, які народились шляхом кесарського розтину, не тільки спостерігається суттєва затримка становлення мікробіоценозу, але й відмічається особливість якісного складу кишкової флори дитини: у ній мало лактобактерій, і вона більше відповідає складу флори шкіри матері [16, 19]. Підгодовування (4–6 місяців життя) значною мірою впливає на зміну складу мікрофлори дитини: зменшується кількість біфідобактерій і зростає кількість мікроорганізмів, притаманних мікробіоценозу дорослої людини, а саме Bacteroides spp. та IV і XIV кластерів Clostridium [21, 25]. Цікавим є те, що в дітей, які перебувають на штучному вигодовуванні, що не містить пребіотиків, такі зміни мікробіоценозу відбуваються набагато раніше. У подальшому розширення раціону призводить до зростання кількості Bacteroidetes (Bacteroides та Prevotella) та Firmicutes (Lactobacillus, Clostridium, Eubacterium та Ruminococcus) і значного зменшення рівня Bifidobacterium. Кількісного та якісного складу мікрофлори, що притаманний дорослій людині, дитина досягає приблизно у віці 3 років. Надалі здорова доросла людина має більш-менш стабільний склад мікробіоти, що починає дестабілізуватись уже після 55 років життя [22]. Але, незважаючи на фізіо–логічне зменшення частки Bifidobacterium у складі мікрофлори дорослої людини, вони продовжують відігравати дуже вагому метаболічну роль [26]. На думку багатьох дослідників, саме подальше зменшення кількості Bifidobacterium у людей похилого віку є однією з причин зростання інфекційної захворюваності в цьому віці [22].
Вплив мікробіоти на життя людини
До речі, вже існує дуже багато доказів того, що саме рання колонізація впливає на «дозрівання» кишечника, розвиток імунної системи та метаболізм і що будь-які зміни в складі мікрофлори, що відбулись у дитинстві під впливом факторів оточуючого середовища, можуть істотно впливати на розвиток метаболізму (наприклад, ожиріння), функціонування імунної системи (наприклад, алергії) і навіть на розвиток розладів у когнітивній сфері та сфері поведінки, зростання яких швидкими темпами у даний час спостерігається в розвинутих країнах [23, 24]. Саме тому центральна роль у запобіганні розвитку та лікуванні таких захворювань приділяється становленню якісного симбіозу («людина – мікробіота»), раціону харчування та способу життя.
Яскравим прикладом функціонування симбіозу «людина — мікробіота» є його вплив на формування/підтримання алергічних захворювань. Як усім відомо, першим видом «вакцинації», що захищає дитину від розвитку алергії, є грудне молоко: завдяки наявності численних алергенів у грудному молоці (які, звісно, відсутні в сумішах) та їх здатності викликати імунологічну толерантність унаслідок факторів, пов’язаних з процесами травлення, у дітей, які перебувають на грудному вигодовуванні, покращуються процеси «дозрівання» кишечника та формування мікробіоти, що підсилює імунологічну толерантність у цих малюків. Ще однією особливістю, що впливає на розвиток алергії, є наявність у молоці олігосахаридів (неперетравлювані людиною вуглеводи), які на рівні товстої кишки стимулюють ріст і активність кишкових бактерій [27].
Дослідження з вивчення впливу коротколанцюгових галактоолігосахаридів та довголанцюгових фруктоолігосахаридів у співвідношенні 9 : 1 продемонструвало зниження ризику розвитку атопічного дерматиту й інших проявів алергії в дітей із родинним анамнезом атопії протягом перших 5 років життя [28–30], а також зменшення частоти епізодів інфекційної захворюваності як у здорових дітей, так і в дітей із високим ризиком розвитку алергії [31]. Результати ще одного дослідження з вивчення впливу 12-тижневого вживання комбінації олігосахаридів + Bifidobacterium breve M16-V на розвиток алергії та астми продемонстрували цікаву закономірність: у групі дітей із високими рівнями IgE було значно знижено тяжкість проявів атопічного дерматиту; а у віці 1 року в дітей з астмою було знижено частоту та тяжкість проявів астми та зменшено використання медикаментів [32, 33]. Мікробний аналіз продемонстрував збільшення в мікробіоценозі в цих дітей кількості біфідобактерій за рахунок зменшення кластерів умовно-патогенних клостридій (кластери XIV дорослого типу та ті, що містять потенційні патогенні мікроорганізми C.difficile та C.perfringens). Автори дослідження зробили висновки, що зменшення в дитини числа мікроорганізмів, притаманних мікробіоцинозу дорослих людей, та зростання бактерій, характерних для дітей, призводить до зменшення ризику маніфестації алергічних захворювань у дітей.
Типи мікробіоти
Як зазначалось вище, профіль мікробіоценозу в кожної дорослої людини є індивідуальним. Але існує три загальних ентеротипи за складом головних видів мікробіоти: Вacteroides, Prevotella і Ruminococcus. Особливості індивідуального профілю мікробіоценозу визначають індивідуальну відповідь на дієту, лікування та різні види захворювань. Профіль мікробіоценозу змінюється під впливом харчування, способу життя, стресів, а також із віком. У людей, старших від 55 років, значно знижується присутність біфідобактерій, зростає кількість анаеробів та знижується реактивність імунної системи, що є однією з найголовніших причин зростання захворюваності в цьому віці.
Тип Вacteroides відзначається превалюванням у кишечнику грамнегативних анаеробних неспороутворюючих паличок родини Bacteroidaceae, він характерний для людей, які споживають велику кількість білків та жирів тваринного походження. Ці мікроорганізми беруть участь у досить великому спектрі процесів: деактивація токсинів у їжі; зброджування вуглеводів (продукція оцтової, янтарної, ізовалеріанової кислоти); утилізація білка; ферментація близько 15 % калорійності їжі; біотрансформація жовчних кислот; відновлення холестерину; гідроліз мукополісахариду хондроїтину сульфату (матрикс хряща).
Тип Prevotella характерний для людей, які споживають переважно рослинну їжу, він відзначається превалюванням грамнегативних неспороутворюючих факультативно анаеробних бактерій. Чим більше в раціоні людини вуглеводів, тим вища ймовірність наявності цього ентеротипу. Ці мікроорганізми теж задіяні в значній кількості процесів, основними з яких є перетравлення білків, вуглеводів, цукру; продукція вітаміну В1, фолієвої кислоти та інших вітамінів.
Тип Ruminococcus характеризується кількісним переважанням грампозитивних неспороносних анаеробних бактерії класу Clostridia, які заселяють товсту кишку, він характерний для людей, які споживають рослинну та вуглеводну їжу. Ці кластери беруть участь у процесах засвоєння рослинних полісахаридів (у тому числі целюлози); допомагають клітинам поглинати цукор; беруть участь в утворенні масляної кислоти, що є основним енергетичним матеріалом для ентероцитів та ворсинок, а також має протипухлинну та протизапальну дію. До речі, у людей із цим ентеротипом найчастіше зустрічається ожиріння.
Але найцікавішим є те, що у випадку, коли людина на дуже тривалий час змінює раціон харчування та спосіб життя, її ентеротип також може змінитись уже залежно від тих продуктів, які вона регулярно споживає.
Пробіотики
Як випливає з вищенаведеного, у нормі в людини, яка отримувала виключно грудне вигодовування та живе в незабрудненому середовищі, веде активне життя без стресів, вживає щоденно кисломолочну продукцію, не має хронічних захворювань шлунково-кишкового тракту (ШКТ) та не приймає антибактеріальні лікарські засоби, мікробіота сформована, функціонує правильно й корекції з використанням пробіотичних засобів не потребує.
А якщо в людини і раціон харчування без кисломолочної продукції, і стресів купа, і антибіотики використовуються при лікуванні, а ще й вік більше за 55 років, і інфекції приходять все частіше і частіше? Що робити в цих випадках?
Звісно, тоді необхідно додатково забезпечити пацієнта корисною мікрофлорою: чи у вигляді продуктів харчування, чи у вигляді харчових добавок/ліків — пробіотиків.
За визначенням ВООЗ, пробіотики — це живі мікроорганізми, які при призначенні в адекватних кількостях чинять корисний вплив на здоров’я людини [40]. Пробіотики повинні походити з мікробіо–му людини; бути здатними переживати метаболічну активність у товстому кишечнику та протистояти дії шлункового соку й жовчних кислот після пер–орального введення; бути спроможними до агрегації до клітин епітелію та мати можливість постійно або тимчасово колонізувати кишечник; бути здатними виробляти речовини, що мають протимікробні властивості (органічні кислоти, перекис водню, бактеріоцин), та мати науково доведений корисний вплив на організм людини [40–42].
Мікроорганізм, який є кандидатом у пробіотики, має бути таксономічно визначеним (рід, вид, підвид, клас): загальновизнано, що більшість ефектів пробіотиків є специфічними для штамів і не можуть бути поширені на інші пробіотичні штами одного й того ж роду або виду [43]. Це вимагає чіткої ідентифікації штамів, тобто детальної генотипової та фенотипової характеристики досліджуваного мікроорганізму. Цікавими є результати дослідження MetaHit (Metagnomics of the Human Intestinal Tract), що тривало з 01.01.2008 по 30.07.2012 за фінансової підтримки Європейської комісії. Група, що працювала над даним проектом, складалася з 13 наукових і промислових партнерів із 8 країн світу, у тому числі харчових та фармацевтичних компаній. Загальна вартість проекту була оцінена в понад 21,2 мільйона євро. Головною метою проекту було вивчення геному всіх бактерій, що становлять кишкову мікрофлору людини, а також характеристика їх функцій у нормі та при патології. У групу досліджуваних увійшли як здорові люди, так і з певними проблемами, а саме з ожирінням та захворюваннями шлунково-кишкового тракту. Дослідники довели, що два бактеріальних клани (Bacteroidetes і Firnicutes) становлять близько 90 % від усіх відомих філогенетичних груп бактерій, які домінують у дистальних відділах кишечника. Дослідники ідентифікували 1244 метагеномні кластери, що відіграють ключову роль у підтриманні здоров’я людини. У найближчому майбутньому це дозволить проводити персоналізовану корекцію мікрофлори на підставі генетичних тестів.
Відповідно до положень ВООЗ, пробіотик має бути безпечним для людини: результати токсикологічних досліджень мають демонструвати безпечність для людини; у мікроорганізму повинна бути відсутньою здатність до транслокації; у клінічних дослідженнях на когортах людей повинні бути вивчені побічні ефекти; виробники повинні мати чітко організований епідеміологічний нагляд за несприятливими реакціями/явищами у споживачів [44, 45].
На сьогодні проведена достатня кількість клінічних досліджень різного ступеня потужності в групах різних вікових категорій та при різних захворюваннях, результати яких демонструють клінічний ефект вживання пробіотиків.
Запобігання розвитку екземи в дітей [46], зниження частоти та тяжкості перебігу антибіотик-асоційованої діареї [47], нормалізація рН та ребаланс вагінальної флори при бактеріальному вагінозі [48], вплив на нормалізацію рівня артеріального тиску [49] та рівня холестерину [50], зменшення тривалості перебігу інфекційної діареї [51], покращання толерування лактози [52], зниження частоти інфекційної захворюваності верхніх дихальних шляхів [53], зменшення інтенсивності проявів при синдромі подразненого кишечника (СПК) [54] — от уже досліджені ефекти вживання пробіотиків.
До речі, за період з 2010 по 2014 рік вживання пробіотиків у США зросло на 35 %, у Європі — на 67 %, у Латинській Америці — на 47 % [55].
І ось тут перед лікарем стає питання, часто дуже складне: а що можна призначити пацієнту, у якого є певні скарги, або ж з профілактичною метою, щоб це призначення мало доказову базу й було безпечним та ефективним?
На сьогодні є дуже велика кількість якісних досліджень, що продемонстрували ефективність та безпеку певних моноштамових пробіотиків (наприклад, Saccharomyces boulardii, Bifidobacterium animalis subsp. lactis BB-12, Bifidobacterium longum, Lactobacillus acidophilus, Lactobacillus casei тощо). Але враховуючи те, що зсув нормального кількісного та якісного складу мікробіоценозу відбувається не за одним штамом, а, як правило, за декількома (найчастіше на тлі дефіциту лакто- та біфідобактерій відбувається зростання штамів, що мають патологічні властивості), науковці все більше починають вивчати ефективність та безпеку мультиштамових пробіотичних комбінацій.
Систематичний огляд досліджень [56], у яких вивчалась ефективність мультиштамових пробіотиків порівняно з моноштамовими, продемонстрував переваги перших у лікуванні антибіотик-асоційованої діареї.
Ще одне дослідження з вивчення впливу вживання комбінації двох штамів Lactobacillus acidophilus CUL60 та CUL21 (NCIMB 30156), Bifidobacterium lactis CUL34 та Bifidobacterium bifidum CUL20 протягом 8 тижнів на стан пацієнтів із синдромом подразненого кишечника продемонструвало значне покращення якості життя відповідно до змін стандартної шкали, зменшення епізодів болю, покращення процесів травлення [57].
Мультиштамова комбінація виявилась ефективною і в зниженні частоти та тяжкості перебігу інфекцій дихальних шляхів у дітей. Щоденне вживання протягом 6 місяців комбінації Lactobacillus acidophilus CUL21 та CUL60, Bifidobacterium bifidum CUL20, Bifidobacterium animalis subsp. lactis CUL34 + 50 мг вітаміну C у групі дітей 3−6 років життя призвело до вірогідного [58]:
— зниження частоти інфекцій верхніх дихальних шляхів на 33 % (Р = 0,002);
— зменшення тривалості перебігу інфекцій верхніх дихальних шляхів (середня різниця в днях: −21,0; 95% ДІ від −35,9 до −6,0; P = 0,006);
— зменшення частоти випадків відсутності в дошкільних закладах на 30 % (P = 0,007);
— зменшення тривалості використання протикашльових засобів у днях (на 6,6 дня; 95% ДІ від −12,9 до −0,3; P = 0,040).
Цікавими також виявились результати дослідження з вивчення взаємодії 5-компонентних пробіотичних штамів «в одному флаконі», а також вивчення впливу цього мультиштамового пробіотика на Clostridium difficile, Escherichia coli та S.typhimurium. Мало того, що дослідники не знайшли підтвердження інгібування між різними штамами мікроорганізмів у випадку мультиштамових комбінацій, вони ще продемонстрували вірогідно вищий показник інгібіції патогенів мультиштамовою комбінацією (р < 0,05) порівняно з моноштамовою [59].
Одним з таких мультиштамових пробіотиків є Пробіланс®, який виготовляється в Нідерландах [60−62].
На нашому вітчизняному ринку він зареєстрований ПАТ «Галичфарм» у двох формах: Пробіланс® для дітей у пакетах-саше та Пробіланс® у капсулах для дорослих.
Склад саше та капсул практично однаковий (табл. 1), крім цього, до складу Пробіланс® входить пребіотик інулін, основним завданням якого є стимуляція росту і/або активності захисної мікрофлори кишечника людини. Тобто Пробіланс® є симбіотиком, поєднанням пробіотика та пребіотика.
Усі штами бактерій, що входять до складу Пробіланс®, мають добре вивчену в доклінічних та клінічних дослідженнях ефективність та безпечність; також усім штамам бактерій у складі Пробіланс® присвоєний статус QPS (The Qualified Presumption of Safety), EFSA (Safety Authority), GRAS (Generally Recognized As Safe), це означає, що всі ці бактерії є безпечними на рівні виду та можуть входити до складу харчових продуктів.
Тобто склад симбіотика Пробіланс® повністю відповідає вимогам ВООЗ щодо безпеки та ефективності [40−45] пробіотиків.
Результати досліджень Пробіланс® in vitro продемонстрували, що:
— як продукт у цілому, так і окремі штами можуть виживати в достатній кількості при пасажі шлунково-кишковим трактом (рис. 1);
— Пробіланс®пригнічує патогенні організми: E.coli, E.faecalis, B.subtilis,Clostridium difficile (рис. 2);
— симбіотик здатний зменшувати навантаження стресових факторів на епітеліоцити, а також значною мірою збільшувати проліферацію Т- и В-лімфоцитів і продукцію IFN-γ і IL-10 і зменшувати продукцію IL-5 та IgE;
— Пробіланс® має потенціал щодо модуляції відповіді T- та B-cell та зменшення алергічної відповіді.
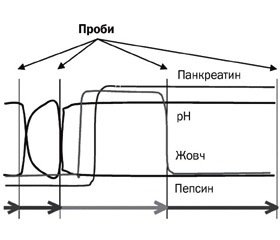
Більше того, для детального вивчення поводження штамів Пробіланс® під час проходження шлунково-кишковим трактом компанія-виробник Winclove B.V. спільно з University of Maastricht розробили модель, що повністю відображає умови всіх відділів ШКТ та впливу усіх агресивних факторів (рН, жовч, пепcин, перистальтика) (рис. 3). Саме під час дослідження на цій моделі було з’ясовано, що виживає близько 40 % бактерій, що є досить високим показником для штамів, які входять до складу Пробіланс®.
Важливим є дослідження Пробіланс® для дітей у пакетах-саше, проведене в Нідерландах у групі дітей віком від 6 міс. до 6 років. У даному дослідженні 80 дітей приймали щоденно симбіотик протягом 6 тижнів. У результаті дослідження було показано покращення загального стану здоров’я в дітей згідно із загальним опитувальником, який заповнявся їх батьками разом зі спеціалістами, а також покращення апетиту в дітей (рис. 4).
Ще однією особливістю дієтичних добавок Пробіланс® та Пробіланс® для дітей є те, що для зберігання вони не потребують спеціальних умов та мають термін придатності 2 роки при кімнатній температурі.
Отже, результати досліджень симбіотиків Пробіланс® та Пробіланс® для дітей дозволяють рекомендувати їх дорослим і дітям віком від одного року при таких станах:
— можливому порушенні балансу кишкової мікрофлори:
- при застосуванні антибіотиків;
- стресі (у тому числі при подорожах);
- зміні характеру харчування;
— порушенні режиму та погіршенні якості харчування;
— при деяких захворюваннях (алергія, синдром подразненого кишечника), що побічно пов’язані з дисбалансом кишкової мікрофлори;
— вагітним та жінкам, що годують груддю, людям із значно зниженим імунітетом — тільки за рекомендацією лікаря.
Загалом стандартне дозування капсул Пробіланс® — це 1–2 капсули на добу натщесерце зранку або перед сном; пакети-саше Пробіланс® для дітей слід приймати по 1–2 саше на добу. Вміст однієї добової дози необхідно розчинити в рідині та дати постояти близько 10 хвилин, після чого вживати.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Cavalier-Smith T. Cell evolution and Earth history: stasis and revolution // Philos. Trans. R. Soc. Lond. B. Biol. Sci. — 2006. — 361. — 969-1006. CrossRef | PubMed | CAS | Web of Science®.
2. Qin J., Li R., Raes J. et al. A human gut microbial gene catalogue established by metagenomic sequencing // Nature. — 2010. — 464. — 59-65. CrossRef | CAS | Web of Science®.
3. Hooper L.V., Littman D.R., Macpherson A.J. Interactions between the microbiota and the immune system // Science. — 2012. — 336. — 1268-73. CrossRef | CAS | Web of Science®.
4. Flint H.J., Scott K.P., Louis P., Duncan S.H. The role of the gut microbiota in nutrition and health // Nat. Rev. Gastroenterol. Hepatol. — 2012. — 9. — 577-89. CrossRef | CAS | Web of Science®.
5. Conly J.M., Stein K., Worobetz L., Rutledge-Harding S. The contribution of vitamin K2 (menaquinones) produced by the intestinal microflora to human nutritional requirements for vitamin K // Am. J. Gastroenterol. — 1994. — 89. — 915-23. PubMed | CAS | Web of Science®.
6. Albert M.J., Mathan V.I., Baker S.J. Vitamin B12 synthesis by human small intestinal bacteria // Nature. — 1980. — 283. — 781-2. CrossRef | PubMed | CAS | Web of Science®.
7. Escherich T. Die darmbakterien des säuglings und ihre beziehungen zur physiologie der Verdauung. — Stuttgart: F. Enke, 1886.
8. Eckburg P.B. Diversity of the human intestinal microbial flora // Science. — 2005. — 308. — 1635-8. CrossRef | PubMed | Web of Science®.
9. Jiménez E., Marín M.L., Martín R. et al. Is meconium from healthy newborns actually sterile? // Res. Microbiol. – 2008. — 159. — 187-93. CrossRef | PubMed | CAS | Web of Science®. Times Cited: 68.
10. Satokari R., Grönroos T., Laitinen K., Salminen S., Isolauri E. Bifidobacterium and Lactobacillus DNA in the human placenta // Lett. Appl. Microbiol. — 2009. — 48. — 8-12. Wiley Online Library | PubMed | CAS | Web of Science®.
11. Matsumiya Y., Kato N., Watanabe K., Kato H. Molecular epidemiological study of vertical transmission of vaginal Lactobacillus species from mothers to newborn infants in Japanese, by arbitrarily primed polymerase chain reaction // J. Infect. Chemother. — 2002. — 8. — 43-9. CrossRef | PubMed | CAS.
12. Martín R., Langa S., Reviriego C. et al. Human milk is a source of lactic acid bacteria for the infant gut // J. Pediatr. — 2003. — 143. — 754-8. CrossRef | PubMed | Web of Science®.
13. Makino H., Kushiro A., Ishikawa E. et al. Transmission of intestinal Bifidobacterium longum subsp. longum strains from mother to infant determined by multilocus sequencing typing and amplified fragment length polymorphism // Appl. Environ. Microbiol. – 2011. — 8. — 43-9.
14. Martin R., Jiménez E., Heilig H. et al. Isolation of bifidobacteria from breast milk and assessment of the bifidobacterial population by PCR-denaturing gradient gel electrophoresis and quantitative real-time PCR // Appl. Environ. Microbiol. – 2009. — 75. — 965-9. CrossRef | PubMed | CAS | Web of Science®.
15. Perez P.F., Doré J., Leclerc M. et al. Bacterial imprinting of the neonatal immune system: lessons from maternal cells? // Pediatrics. — 2007. — 119. — e724-32. CrossRef | PubMed | Web of Science®.
16. Jeurink P.V., van Bergenhenegouwen J., Jiménez E. et al. Human milk: a source of more life than we imagine // Benef. Microbes. — 2013. — 4. — 17-30. CrossRef | CAS | Web of Science®.
17. Fallani M., Young D., Scott J. et al. Intestinal microbiota of 6-week-old infants across Europe: geographic influence beyond delivery mode, breast-feeding, and antibiotics // J. Pediatr. Gastroenterol. Nutr. — 2010. — 51. — 77-84. CrossRef | Web of Science®.
18. Yatsunenko T., Rey F.E., Manary M.J. et al. Human gut microbiome viewed across age and geography // Nature. — 2012. — 486. — 222-7. CAS | Web of Science®.
19. Arboleya S., Binetti A., Salazar N. et al. Establishment and deve–lopment of intestinal microbiota in preterm neonates // FEMS Microbiol. Ecol. — 2012. — 79. — 763-72. Wiley Online Library | CAS | Web of Science®.
20. Sim K., Cox M.J., Wopereis H. et al. Improved detection of bifidobacteria with optimised 16s rRNA-gene based pyrosequencing // PLoS One. — 2012. — 7. — e32543. CrossRef | CAS | Web of Science®.
21. Fallani M., Amarri S., Uusijarvi A. et al. Determinants of the human infant intestinal microbiota after the introduction of first complementary foods in infant samples from five European centres // Microbio–logy. — 2011. — 157. — 1385-92. CrossRef | CAS | Web of Science®.
22. Claesson M.J., Cusack S., O’Sullivan O. et al. Composition, variability, and temporal stability of the intestinal microbiota of the elderly // Proc. Natl. Acad. Sci. – 2011. — 108. — 4586-91. CrossRef | Web of Science®.
23. Shanahan F. The gut microbiota — a clinical perspective on lessons learned // Nat. Rev. Gastroenterol. Hepatol. — 2012. — 9. — 609-14. CrossRef | CAS | Web of Science®.
24. Martin R., Nauta A., Ben A.K., Knippels L., Knol J., Garssen J. Early life: gut microbiota and immune development in infancy // Beneficial Microbes. — 2010. — 1. — 367-82.
25. Roger L.C., McCartney A.L. Longitudinal investigation of the faecal microbiota of healthy full-term infants using fluorescence in situ hybridization and denaturing gradient gel electrophoresis // Microbio–logy. — 2010. — 156. — 3317-28. CrossRef | CAS | Web of Science®. Times Cited: 29.
26. Klaassens E.S., Ben-Amor K., Vriesema A., Vaughan E.E., de Vos W. The fecal bifidobacterial transcriptome of adults: a microarray approach // Gut Microbes. — 2011. — 2. — 217-26. CrossRef.
27. Gibson G.R., Roberfroid M.B. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics // J. Nutr. — 1995. — 125. — 1401-12. PubMed | CAS | Web of Science®. Times Cited: 2364.
28. Arslanoglu S., Moro G.E., Schmitt J., Tandoi L., Rizzardi S., Boehm G. Early dietary intervention with a mixture of prebiotic oligosaccharides reduces the incidence of allergic manifestations and infections during the first two years of life // J. Nutr. — 2008. — 138. — 1091-5. PubMed | CAS | Web of Science®. Times Cited: 153.
29. Moro G., Arslanoglu S., Stahl B., Jelinek J., Wahn U., Boehm G. A mixture of prebiotic oligosaccharides reduces the incidence of atopic dermatitis during the first six months of age // Arch. Dis. Child. — 2006. — 91. — 814-9. CrossRef | PubMed | CAS | Web of Science®. Times Cited: 219.
30. Arslanoglu S., Moro G.E., Boehm G., Wiens F., Stahl B., Bertino E. Early prebiotic oligosaccharide supplementation reduces the incidence of some allergic manifestations in the first 5 years of life // J. Biol. Regul. Homeost. Agents. — 2012. — 26. — 49-59. CAS.
31. Bruzzese E., Volpicelli M., Squeglia V. et al. A formula containing galacto- and fructo-oligosaccharides prevents intestinal and extra-intestinal infections: an observational study // Clin. Nutr. – 2009. — 28. — 156-61. CrossRef | PubMed | CAS | Web of Science®. Times Cited: 43.
32. van der Aa L.B., van Aalderen W.M.C., Heymans H.S.A. et al. Synbiotics prevent asthma-like symptoms in infants with atopic dermatitis // Allergy. – 2011. — 66. — 170-7. Wiley Online Library | Web of Science®. Times Cited: 24.
33. van der Aa L.B., Heymans H.S., Aalderen W. et al. Effect of a new synbiotic mixture on atopic dermatitis in infants: a randomized-controlled trial // Clin. Exp. Allergy. — 2010. — 40. — 795-804.
34. de Kivit S., Saeland E., Kraneveld A.D. et al. Galectin-9 induced by dietary synbiotics is involved in suppression of allergic symptoms in mice and humans // Allergy. — 2012. — 67. — 343-52. Wiley Online Library | CAS | Web of Science®.
35. de Kivit S., Overbeek S.A., Hoffmans R.M. et al. Exposure of intestinal epithelial cells to CpG DNA and galacto-/fructo-oligosaccharides protects against epithelial barrier disruption in vitro. Restoring mucosal to–lerance by non-digestible oligosaccharides under inflammatory conditions. — 2013. — 169.
36. Suzuki S., Shimojo N., Tajiri Y., Kumemura M., Kohno Y. Differences in the composition of intestinal Bifidobacterium species and the development of allergic diseases in infants in rural Japan // Clin. Exp. Allergy. — 2007. — 37. — 506-11. Wiley Online Library | PubMed | CAS | Web of Science®
37. Gore C., Munro K., Lay C. et al. Bifidobacterium pseudocatenulatum is associated with atopic eczema: a nested case-control study investigating the fecal microbiota of infants // J. Allergy Clin. Immunol. — 2008. — 121. — 135-40. CrossRef | PubMed | Web of Science®.
38. Vael C., Nelen V., Verhulst S., Goossens H., Desager K. Early intestinal Bacteroides fragilis colonisation and development of asthma // BMC Pulm. Med. – 2008. — 8. — 19. CrossRef | PubMed.
39. Sjögren Y.M., Jenmalm M.C., Böttcher M.F., Björkstön B., Sverremark-Ekström E. Altered early infant gut microbiota in children developing allergy up to 5 years of age // Clin. Exp. Allergy. — 2009. — 39. — 518-26.
40. Magdalena Araya, Catherine Stanton, Lorenzo Morelli, Gregor Reid, Maya Pineiro et al, Probiotics in food: health and nutritional properties and guidelines for evaluation, Combined Report of a Joint FAO/WHO Expert Consultation on Evaluation of Health and Nutritional Properties of Probiotics in Food Including Powder Milk with Live Lactic Acid Bacteria, Cordoba, Argentina, 1–4 October 2001, and Report of a Joint FAO/WHO Working Group on Drafting Guidelines for the Evaluation of Probiotics in Food, London, Ontario, Canada, 30 April–1 May 2002 [FAO Food and Nutrition paper 85], pp. 1-50. — Rome, Italy: World Health Organization (WHO), Food and Agricultural Organization (FAO) [of the United Nations], 2006. ISBN 9251055130, see [1], accessed 11 June 2015.
41. Rijkers G.T., Bengmark S., Enck P., Haller D., Herz U., Kalliomaki M., Kudo S., Lenoir-Wijnkoop I., Mercenier A., Myllyluoma E., Rabot S., Rafter J., Szajewska H., Watzl B., Wells J., Wolvers D., Antoine J.M. Guidance for substantiating the evidence for beneficial effects of probiotics: current status and recommendations for future research // J. Nutr. — 2010. — 140(3). — 671S-6S. doi:10.3945/jn.109.113779. PMID 20130080.
42. Shane A.L., Cabana M.D., Vidry S., Merenstein D., Humme–len R., Ellis C.L., Heimbach J.T., Hempel S., Lynch S.V., San–ders M.E. et al. Guide to designing, conducting, publishing and communicating results of clinical studies involving probiotic applications in human participants // Gut Microbes. — 2010. — 1(4). — 243-253. doi:10.4161/gmic.1.4.12707. PMC 3023606 Freely accessible. PMID 21327031.
43. Fuller R. Probiotics in human medicine // Gut. — 1991. — 32(4). — 439-42. doi:10.1136/gut.32.4.439. PMC 1379087 Freely accessible. PMID 1902810.
44. Huys G., Botteldoorn N., Delvigne F., Vuyst L.D., Heyndrickx M., Pot B., Dubois J.J., Daube G. Microbial characterization of probiotics — Advisory report of the Working Group “8651 Probiotics” of the Belgian Superior Health Council (SHC) // Molecular Nutrition & Food Research. — 2013. — 57(8). — 1479-1504. doi:10.1002/mnfr.201300065. PMC 3910143 Freely accessible.
46. Commentary by the Scientific Committee on Animal Nutrition on Data Relating to Toxin Production (PDF). Scientific Opinion. European Commission, Health & Consumer Protection Directorate-General. — December 2001. Retrieved 5 June 2016.
47. Cuello-Garcia C.A., Brożek J.L., Fiocchi A., Pawankar R., Yepes-Nuñez J.J., Terracciano L., Gandhi S., Agarwal A., Zhang Y., Schünemann H.J. Probiotics for the prevention of allergy: A systematic review and meta-analysis of randomized controlled trials // J. Allergy Clin. Immunol. (Systematic review & meta-analysis). — 2015. — 136(4). — 952-61. doi:10.1016/j.jaci.2015.04.031. PMID 26044853.
47. Sazawal S., Hiremath G., Dhingra U., Malik P., Deb S., Black R.E. Efficacy of probiotics in prevention of acute diarrhoea: a meta-analysis of masked, randomised, placebo-controlled trials // Lancet Infect Dis. — June 2006. — 6(6). — 374-82. doi:10.1016/S1473-3099(06)70495-9. PMID 16728323.
48. Borges S., Silva J., Teixeira P. The role of lactobacilli and probio–tics in maintaining vaginal health // Arch. Gynecol. Obstet. (Review). — March 2014. — 289(3). — 479-89. doi:10.1007/s00404-013-3064-9. PMID 24170161.
49. Khalesi S., Sun J., Buys N., Jayasinghe R. Effect of probio–tics on blood pressure: a systematic review and meta-analysis of rando–mized, controlled trials // Hypertension (Systematic review & meta-analysis). — 2014. — 64(4). — 897-903. doi:10.1161/HYPERTENSIONAHA.114.03469. PMID 25047574.
50. Agerholm-Larsen L., Bell M.L., Grunwald G.K., Astrup A. The effect of a probiotic milk product on plasma cholesterol: a meta-analysis of short term intervention studies // European Journal of Clinical Nutrition. — 2002. — 54(11). — 856-860. doi:10.1038/sj.ejcn.1601104. PMID 11114681.
51. Allen S.J., Martinez E.G., Gregorio G.V., Dans L.F. Probiotics for treating acute infectious diarrhea // Cochrane Database Syst Rev. — 2010. — 11(11). — CD003048. doi:10.1002/14651858. CD003048.pub3. PMID 21069673.
52. Sanders M.E. Considerations for use of probiotic bacteria to modulate human health // The Journal of Nutrition. — February 2000. — 130 (2S Suppl.). — 384S-390S. PMID 10721912. Retrieved 2012-05-14.
53. Hatakka K., Savilahti E., Pönkä A., Meurman J.H., Poussa T., Näse L., Saxelin M., Korpela R. Effect of long term consumption of probiotic milk on infections in children attending day care centres: double blind, randomised trial // BMJ. — June 2001. — 322(7298). — 1327. doi:10.1136/bmj.322.7298.1327. PMC 32161 Freely accessible. PMID 11387176.
54. Saez-Lara M.J., Gomez-Llorente С., Plaza-Diaz J., Gil А. The Role of Probiotic Lactic Acid Bacteria and Bifidobacteria in the Prevention and Treatment of Inflammatory Bowel Disease and Other Related Diseases: A Systematic Review of Randomized Human Clinical Trials // Biomed. Res Int. (Systematic review). — 2015. — 15. doi:10.1155/2015/505878. PMC 4352483 Freely accessible. PMID 25793197.
55. Probiotic market: global sales by region 2010–2015 (fee-based) // Statista. — 2014. Retrieved 12 December 2014.
56. Timmerman H.M., Koning C.J., Mulder L., Rombouts F.M., Beynen A.C. Monostrain, multistrain and multispecies probiotics — A comparison of functionality and efficacy // Int. J. Food Microbiol. — 2004. — 96(3). — 219-33. doi:10.1016/j.ijfoodmicro.2004.05.012. PMID 15454313
57. Williams E.A., Stimpson J., Wang D., Plummer S., Garaiova I, Barker M.E., Corfe B.M. Clinical trial: a multistrain probiotic preparation significantly reduces symptoms of irritable bowel syndrome in a double-blind placebo-controlled study // Aliment. Pharmacol. Ther. — September 2008. — 29(1). — 97-103. doi:10.1111/j.1365-2036.2008.03848.x. PMID 18785988.
58. Garaiova I., Muchová J., Nagyová Z., Duolao Wang J., Li V., Országhová Z., Michael D.R., Plummer S.F., Ďuračková Z. Probio–tics and vitamin C for the prevention of respiratory tract infections in children attending preschool: a randomised controlled pilot study // European journal of clinical nutrition. — 2015. — 69 (3). — 373-379.
59. Chapman C.M., Gibson G.R., Rowland I. In vitro evaluation of single- and multi-strain probiotics: Inter-species inhibition between probiotic strains, and inhibition of pathogens // Anaerobe. — 2012 Aug. — 18(4). — 405-13. doi: 10.1016/j.anaerobe.2012.05.004. Epub 2012 Jun 4.
60. Vesa T., Pochart P., Marteau P. Pharmacokinetics of Lactobacillus plantarum NCIMB 8826, Lactobacillus fermentum KLD, and Lactococcus lactis MG 1363 in the human gastrointestinal tract // Alimentary Pharmacology and Therapeutics. — 2000. — 14(6). — 823-828.
61. Koning C.J.M et al. The Effect of a Multispecies Probiotic on the Intestinal Microbiota and Bowel Movements in Healthy Volunteers Ta–king the Antibiotic Amoxycillin // Am. J. Gastroenterol. — 2007. — 102. — 1–12.
62. Grossenbacher F., Gashi A., Besseling van der Vaart I. Use of the multispecies probiotic Winclove 500/Bactosan pro FOS leads to less gastrointestinal complaints in adults — an observational in vivo pilot study // Advances in Microbiology. — 2016. — 6(14). — 975-985.

/63-2.jpg)
/63-1.jpg)
/64-1.jpg)