Резюме
Мета. Встановлення залежності стану центральної зони сітківки у пацієнтів із проліферативною діабетичною ретинопатією (ДР) від тривалості цукрового діабету (ЦД) 2-го типу і рівня глікемії. Матеріали та методи. У дослідження ввійшли 62 пацієнти з ЦД 2-типу, в яких за результатами клініко-інструментального обстеження та відповідно до класифікації ETDRS виявлена непроліферативна (31 хворий, 31 око) і проліферативна ДР (31 пацієнт, 31 око). Офтальмологічне обстеження включало дослідження гостроти зору з оптимальною оптичною корекцією, тонометрію, біомікроскопію, офтальмоскопію, оптичну когерентну томографію. Результати. У пацієнтів із проліферативною ДР при субкомпенсованому стані ЦД товщина й об’єм макулярної сітківки становили: 309,0 ± 130,0 мкм і 7,6 ± 2,7 мм3, тоді як при декомпенсованому стані — відповідно 287,0 ± 40,0 мкм і 7,80 ± 0,57 мм3 (р > 0,05). За умов прогресування ДР виявлено статистично значуще зниження корегованої гостроти зору (р = 0,012) та зростання об’єму макулярної сітківки (на 6,9 %; р = 0,034). Більш виражені демонстративні зміни сітківки (р < 0,05) виявлялися у пацієнтів із проліферативною ДР, ускладненою макулярним набряком. Висновки. У хворих із проліферативною ДР не виявлено різниці стану ока при субкомпенсації і декомпенсації ЦД 2-го типу. Прогресування від непроліферативної до проліферативної ДР проявляється зниженням корегованої гостроти зору, зростанням товщини та об’єму макулярної сітківки в центральній зоні, що може бути пов’язано з розвитком набряку внаслідок прогресування патологічного процесу.
Цель. Установление зависимости состояния центральной зоны сетчатки у пациентов с пролиферативной диабетической ретинопатией (ДР) от продолжительности сахарного диабета (СД) 2-го типа и уровня гликемии. Материалы и методы. В исследование вошли 62 пациента с СД 2-го типа, у которых по результатам клинико-инструментального обследования и в соответствии с классификацией ETDRS обнаружена непролиферативная (31 больной, 31 глаз) и пролиферативная ДР (31 пациент, 31 глаз). Офтальмологическое обследование включало исследование остроты зрения с оптимальной оптической коррекцией, тонометрию, биомикроскопию, офтальмоскопию, оптическую когерентную томографию. Результаты. У пациентов с пролиферативной ДР при субкомпенсированном состоянии СД толщина и объем макулярной сетчатки составили: 309,0 ± 130,0 мкм и 7,6 ± 2,7 мм3, тогда как при состоянии декомпенсации соответственно: 287,0 ± 40, 0 мкм и 7,80 ± 0,57 мм3 (р > 0,05). При прогрессировании ДР выявлены статистически значимое снижение оптимальной коррегированной остроты зрения (р = 0,012) и увеличение объема макулярной сетчатки (на 6,9 %; р = 0,034). Более выраженные демонстративные изменения сетчатой оболочки (р < 0,05) обнаружены у пациентов с пролиферативной ДР, осложненной макулярным отеком. Выводы. У больных с пролиферативной ДР не выявлена разница состояния глаза при субкомпенсированном и декомпенсированном состояниях СД 2-го типа. Прогрессирование от непролиферативной к пролиферативной ДР проявляется снижением коррегированной остроты зрения, увеличением толщины и объема макулярной сетчатки в центральной зоне, что может быть связано с развитием отека вследствие прогрессирования патологического процесса.
Background. The purpose of the study was to determine whether the state of the central retinal area depends on the duration of type 2 diabetes mellitus (DM) and glycemia level in patients with proliferative diabetic retinopathy (DR). Materials and methods. The study included 62 patients with type 2 DM who according to the results of clinical and instrumental examination were divided into non-proliferative (n = 31, 31 eyes) and proliferative DR (n = 31, 31 eyes) groups using the Early Treatment of Diabetic Retinopathy Study classification. An ophthalmologic examination included visual acuity check with optimal optical correction, tonometry, biomicroscopy, ophthalmoscopy and optical coherence tomography. Results. In patients with proliferative DR in the subcompensated stage of DM, the thickness and volume of the macular retina were 309.0 ± 130.0 μm and 7.6 ± 2.7 mm3, respectively, whereas in the decompensated stage — 287.0 ± 40.0 μm and 7.80 ± 0.57 mm3 (p > 0.05). With the progression of DR, a statistically significant decrease in the optimal correlated visual acuity (p = 0.012) and an increase in the volume of the macular retina (by 6.9 %, p = 0.034) were revealed. More demonstrative changes in the retina tissue (p < 0.05) were revealed in patients with proliferative DR complicated by macular edema. Conclusions. In patients with proliferative DR, there was no difference in the state of the eye in subcompensated and decompensated stages of type 2 DM. Progression from non-proliferative to proliferative DR is manifested by a decrease in the correlated visual acuity, an increase in the thickness and volume of the macular retina in the central zone, which may be determined by the development of edema due to the progression of the pathological process.
Вступ
Дотепер у світі спостерігається зростання кількості хворих на цукровий діабет (ЦД), в основному за рахунок осіб, які страждають від ЦД 2-типу [1]. Захворювання сприймається як важлива медико-соціальна й економічна проблема сучасності, оскільки призводить до ранньої інвалідизації і передчасної смертності через судинні ускладнення. Зокрема, діабетичне ураження сітківки ока (проліферативна ретинопатія та дифузний макулярний набряк) є причиною сліпоти в осіб працездатного віку [2]. Вважається, що найбільш істотним фактором, який дає можливість прогнозувати розвиток діабетичної ретинопатії (ДР), є тривалість ЦД. Встановлено, якщо термін ЦД перебуває в діапазоні від 5 до 10 років, ризик ДР становить 27 %, від 10 до 20 років — ризик зростає до 71–90 %, від 20 до 30 років — досягає 95 % [3]. Значущим фактором ризику, що впливає на виникнення ДР, може бути рівень глікемії [4]. Проведені дослідження підтвердили залежність темпів прогресування мікросудинних ускладнень від компенсації ЦД [5]. У зв’язку з цим досягнення компенсації порушень вуглеводного обміну вважається важливою ланкою в комплексі заходів, спрямованих на запобігання виникненню та прогресуванню пізніх ускладнень ЦД [6]. Однак залишається нез’ясованим питання: чи відрізняється стан центральної зони сітківки ока у пацієнтів із ДР при різних стадіях? Традиційне офтальмологічне обстеження при ДР включає оцінку гостроти зору, вимірювання внутрішньоочного тиску, біомікроскопію, офтальмоскопію, фотореєстрацію стану очного дна, флуоресцентну ангіографію та ін. [7]. Одним з інформативних неінвазивних методів візуалізації сітківки ока та дифузного макулярного набряку вважається оптична когерентна томографія (ОКТ), що надає можливість прецизійно оцінити товщину і структуру шарів сітківки [8]. Незважаючи на досить інтенсивне вивчення ДР, у літературі мало даних стосовно морфометричних градацій сітківки при прогресуванні ДР. Так, характеристики структурно-функціонального стану сітківки в процесі розвитку ДР від нульової стадії (без змін на очному дні) до проліферативної ДР, тобто абсолютні значення і динаміка показників, залишаються розмитими і неповними. У зв’язку з цим актуальним залишається з’ясування впливу ЦД 2-го типу на прогресування ДР і кількісні параметри зорових функцій.
Мета роботи — встановити залежність стану центральної зони сітківки у пацієнтів із проліферативною діабетичною ретинопатією від тривалості ЦД 2-типа та рівня глікемії.
Матеріали та методи
Дослідження проводили за участю 62 пацієнтів із ЦД 2-го типу, в яких згідно з результатами клініко-інструментального обстеження та відповідно до класифікації ETDRS виявлена непроліферативна (31 хворий, 31 око) і проліферативна ДР (31 пацієнт, 31 око). Всі хворі, залучені в дослідження, оглядалися ендокринологом і нефрологом. Офтальмологічне обстеження включало візометрію за допомогою комп’ютеризованого фороптера (Refractor RT-5100, Nidek, Японія) та проектора оптичних знаків (CP-770, Nidek, Японія), пневмотонометрію (NT-530, Nidek, Японія), кераторефрактометрію (ARK-1000 OPD-Scan II, Nidek, Японія), біомікроскопію переднього відрізка (щілинна лампа Haag-Streit BQ 900, Швейцарія), біомікроретиноскопію за допомогою ширококутної лінзи Super Pupil XL (Volk Optical, США), оптичну когерентну томографію (Optovue RTVue, Optovue, США).
При проведенні аналізу використовували статистичний пакет Medcalc. Точкова оцінка величин, що підлягали аналізу, проводилася шляхом розрахунку середнього арифметичного (M) ознаки та відповідної стандартної похибки (m). При аналізі міжгрупових розбіжностей у випадку двох груп застосовували критерій Стьюдента (у випадку нормального закону розподілу та кількісних характеристик), критерій Вілкоксона (у випадку відмінності закону розподілу від нормального та кількісних характеристик). У всіх випадках відмінність вважалася статистично значущою при рівні значущості р < 0,05.
Результати
Середній вік пацієнтів із проліферативною ДР (основна група) становив 61,2 ± 2,4 року; найбільша кількість хворих — 10 (32,2 %) перебували у віковому діапазоні 60–65 років. До основної групи увійшло 8 (25,8 %) чоловіків, середній вік яких був 61,0 ± 2,6 року (95% довірчий інтервал (ДІ) 54,8–67,2 року), і 23 (74,2 %) жінки віком 60,9 ± 1,7 року (95% ДІ 57,3–64,4 року); гендерна різниця віку не є статистично значущою (р = 0,968). Однакова кількість чоловіків знаходилась у вікових категоріях 50–55, 60–65 і 65–70 років, в той час як найбільша кількість жінок — 8 (34,8 %) — у діапазоні 60–65 років. Глікемія у пацієнтів із проліферативною ДР досягала 9,15 ± 0,51 ммоль/л, рівень глікованого гемоглобіну (HbA1c) — 7,55 ± 0,15 %.
Макулярний набряк був виявлений у 19 (61,3 %) хворих основної групи, з яких — 5 (26,3 %) чоловіків і 14 (73,7 %) жінок.
Постає питання: чи відрізняється стан ока у пацієнтів із проліферативною ДР залежно від тривалості ЦД 2-го типу?
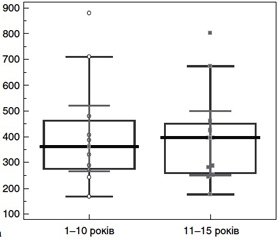
Результати дослідження проаналізовані у трьох діапазонах: тривалість ЦД від 1 до 10 років — 11 (35,5 %) пацієнтів, від 11 до 15 років — 12 (38,7 %), від 15 до 20 років — 8 (25,8 %) пацієнтів. Аналіз даних клініко-лабораторного дослідження (табл. 1) показав, що максимальний рівень глікемії відзначався у хворих із тривалістю ЦД від 11 до 15 років. Цей показник перевищував значення у пацієнтів із тривалістю захворювання 1–10 років на 46,7 % (р = 0,001).
/94-1.jpg)
Даний факт обумовлений різною кількістю пацієнтів із декомпенсованим станом ЦД: таких хворих у віковому діапазоні 1–10 років було 8 (72,7 %), тоді як у діапазоні 11–15 років — 12 (100 %) осіб. Парадоксальні результати дослідження ока при ОКТ у хворих із ЦД тривалістю 15–20 років обумовлені відсутністю макулярного набряку у більшої частини обстежених пацієнтів —7 (87,5 %) хворих. Якщо порівняти результати дослідження пацієнтів із макулярним набряком із пацієнтами, в яких тривалість ЦД становила 1–10 і 11–15 років, а в кожній групі було по 9 хворих, то статистично значущої різниці щодо товщини сітківки і об’єму макулярної сітківки в центральній зоні не виявлено (рис. 1).
Наступне питання: чи відрізняється стан ока у пацієнтів із проліферативою ДР при різних станах компенсації ЦД 2-го типу?
Наша вибірка була представлена 7 (22,6 %) пацієнтами із субкомпенсованим і 24 (77,4 %) пацієнтами із декомпенсованим станом ЦД. Підтвердженням коректності наведеного розподілу пацієнтів основної групи був рівень глікемії, який досягав у хворих при стані субкомпенсації ЦД 6,1 ± 0,36 ммоль/л (95% ДІ 5,0–6,8 ммоль/л), а при декомпенсації — 10,0 ± 0,6 ммоль/л (95% ДІ 8,0–11,0 ммоль/л), тобто був на 63,9 % (р < 0,001) вищий. Середня тривалість ЦД при субкомпенсації і декомпенсації захворювання статистично значуще не відрізнялася (р = 0,506), відповідно 19,0 ± 3,2 року (95% ДІ 5–20 років і 13,0 ± 2,0 (95% ДІ 10–15 років). Проведений аналіз не виявив статистично значущої різниці щодо основних показників (табл. 2). Результати дослідження ока при ОКТ суттєво не змінилися, якщо порівняти підгрупи пацієнтів із макулярним набряком (рис. 2). У підгрупі із субкомпенсованим станом ЦД було 5 (71,4 %) хворих із макулярним набряком і 2 (28,6 %) — без такого. Підгрупа із декомпенсованим станом ЦД складалась із 17 (70,8 %) хворих із макулярним набряком і 7 (29,2 %) хворих без такого. Зокрема, при субкомпенсованому стані товщина і об’єм макулярної сітківки були відповідно 313,0 ± 154,6 мкм і 7,94 ± 3,13 мм3, тоді як при декомпенсованому стані — 387,0 ± 45,6 мкм і 7,98 ± 0,65 мм3 (р > 0,05). Згідно з класифікацією ступеня тяжкості дифузного макулярного набряку [9], у більшості досліджених пацієнтів спостерігався виражений макулярний набряк.
/96-1.jpg)
Отже, у хворих із проліферативною ДР не виявлялася статистично значуща різниця морфофункціонального стану ока при субкомпенсованому і декомпенсованому станах ЦД 2-го типу. З огляду на невеликий обсяг дослідження необхідне подальше вивчення цієї проблеми.
Залишається нез’ясованим ще одне цікаве питання: чи впливає рівень глікемії на стан сітківки при прогресуванні ДР від непроліфератиної до проліферативної стадії?
У цьому контексті порівняли дані 24 хворих із проліферативною і 22 пацієнтів із непроліферативною ДР за умов декомпенсації ЦД 2-го типу. Рівень глікемії у хворих обох груп не відрізнявся і становив відповідно 10,0 ± 0,65 ммоль/л і 9,0 ± 0,5 ммоль/л. При проліферативній ДР середня тривалість ЦД була більшою, ніж при непроліферативній ДР, відповідно 13,0 ± 2,0 року і 8,0 ± 1,5 року (р = 0,021). Проведений аналіз виявив статистично значуще зниження корегованої гостроти зору (р = 0,012) та зростання об’єму макулярної сітківки (на 6,9 %; р = 0,034) за умов прогресування ДР (табл. 3). Більш виражені демонстративні зміни сітківки виявлялися у пацієнтів із макулярним набряком. Таких у групі з проліферативною ДР було 17 (70,8 %) і непроліферативною ДР — 15 (68,2 %) пацієнтів.
Результати дослідження засвідчили (рис. 3), що при прогресуванні ДР макулярний набряк характеризувався зростанням товщини (на 35,9 %; р = 0,026) і об’єму макулярної сітківки в центральній зоні (на 12,3 %; р = 0,005).
Обговорення
Макулярний набряк був виявлений у більшості (61,3 %) хворих основної групи. Наведена частота макулярного набряку дещо нижче, ніж подана в літературі. Так, акцентують увагу на 70 % випадків цієї патології при проліферативній стадії ДР [10]. Тому діагностика ДР повинна бути спрямована на раннє виявлення судинних ускладнень при ЦД, зокрема макулярного набряку.
Нам не вдалося виявити залежність товщини та об’єму макулярної сітківки при проліферативній ДР від тривалості ЦД 2-типу протягом 20 років. Існуюча в літературі парадигма стверджує, що погіршення стану сітківки частіше трапляється у хворих із тяжчими стадіями ДР до початку інсулінотерапії і рідше — за відсутності змін на очному дні або при мінімальних проявах ретинопатії [11]. Отже, виявлена суперечність отриманих результатів може пояснюватися станом сітківки ока до початку цукро–знижувальної терапії, терміном лікування стосовно факту виявлення ЦД та/чи неефективністю такої терапії. Початковий стан сітківки вважається найбільш значущим чинником ризику прогресування ДР після початку інсулінотерапії [12].
Значущість зростання товщини сітківки при макулярному набряку викликає інтерес у контексті зменшення оптичної щільності макулярного пігменту, що обумовлює зоровий дискомфорт, нівелює фотострес і адаптацію до відблисків від яскравого світла. Так, виявлено кореляційний зв’язок між кількісними показниками оптичної щільності макулярного пігменту і зони набряку сітківки, а також зниження світлової чутливості в центральній зоні сітківки при діабетичному макулярному набряку [13]. Аналогічну точку зору висловлюють інші автори [14], які встановили зниження порогу чутливості сітківки в зонах дифузного макулярного набряку. Отже, для досягнення порогу необхідна висока інтенсивність світлового стимулу.
Стосовно критичного аналізу прогресування ДР слід відзначити, що погіршення стану сітківки після початку інсулінотерапії частіше трапляється у хворих із тяжчими стадіями ДР і рідше — за відсутності змін на очному дні або при мінімальних проявах ретинопатії [15]. Імовірно, це пов’язано з кращим станом сітківки на момент початку інсулінотерапії та зменшенням ризику частих гіпоглікемій при субкомпенсації ЦД.
Висновки
1. У хворих із проліферативною ДР не виявлена різниця щодо стану ока при субкомпенсованому і декомпенсованому ЦД 2-го типу. Однак з огляду на системні чинники, що можуть впливати на отримані результати, вважаємо за необхідне подальше продовження досліджень.
2. Прогресування від непроліферативної до проліферативної ДР проявляється зниженням корегованої гостроти зору, зростанням товщини та об’єму макулярної сітківки в центральній зоні, що може бути пов’язано з розвитком набряку та прогресуванням патологічного процесу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Камінський О.В. Офіційні критерії діагностики цукрового діабету, нормоглікемія і самоконтроль глікемії / О.В. Камінський // Міжнародний ендокринологічний журнал. — 2017. — Т. 13, № 3. — С. 84-90. doi: 10.22141/2224-0721.13.3.2017.104117.
2. Lee R., Wong T.Y., Sabanayagam C. Epidemiology of diabetic retinopathy, diabetic macular edema and related vision loss // Eye Vis (Lond). — 2015. — Vol. 2. — P. 17. Published online 2015 Sep 30. doi: 10.1186/s40662-015-0026-2.
3. Bourne R.R., Stevens G.A., White R.A. et al. Causes of vision loss worldwide, 1990–2010: a systematic analysis // Lancet Glob. Health. — 2013. — Vol. 1(6). — P. 339-49. doi: 10.1016/S2214-109X(13)70113-X.
4. Yau J.W., Rogers S.L., Kawasaki R. et al. Global prevalence and major risk factors of diabetic retinopathy // Diabetes Care. — 2012. — Vol. 35(3). — P. 556-64. doi: 10.2337/dc11-1909.
5. He F., Xia X., Wu X.F. et al. Diabetic retinopathy in predicting diabetic nephropathy in patients with type 2 diabetes and renal disease: a meta-analysis // Diabetologia. — 2013. — Vol. 56(3). — P. 457-66. doi: 10.1007/s00125-012-2796-6.
6. Mottl A.K., Pajewski N., Fonseca V. et al. The degree of retinopathy is equally predictive for renal and macrovascular outcomes in the ACCORD Trial // J. Diabetes Complications. — 2014. — Vol. 28(6). — P. 874-9. doi: 10.1016/j.jdiacomp.2014.07.001.
7. Thomas R.L., Dunstan F.D., Luzio S.D. et al. Prevalence of diabetic retinopathy within a national diabetic retinopathy screening service // Br. J. Ophthalmol. — 2015. — Vol. 99(1). — P. 64-8. doi: 10.1136/bjophthalmol-2013-304017.
8. Azrak C., Baeza-Díaz M.V., Palazón-Bru A. et al. Validity of Optical Coherence Tomography as a Diagnostic Method for Diabetic Retinopathy and Diabetic Macular Edema. // Medicine (Baltimore). — 2015. — Vol. 94(38). — P. 1579. doi: 10.1097/MD.0000000000001579.
9. Gozlan J.. Retinal microvascular alterations related to diabetes assessed by optical coherence tomographyangiography: A cross-sectional analysis // J. Gozlan, Р. Ingrand, О. Lichtwitz [et al.] // Medicine (Baltimore). — 2017. — Vol. 96(15). — e6427. doi: 10.1097/MD.0000000000006427.
10. Bertelsen G., Peto T., Lindekleiv H. et al. Tromso eye study: prevalence and risk factors of diabetic retinopathy // Acta Ophthalmol. — 2013. — Vol. 91(8). — P. 716-21. doi: 10.1111/j.1755-3768.2012.02542.x.
11. Raman R., Gupta A., Krishna S. et al. Prevalence and risk factors for diabetic microvascular complications in newly diagnosed type II diabetes mellitus. Sankara Nethralaya Diabetic Retinopathy Epidemiology and Molecular Genetic Study (SN-DREAMS, report 27) // J. Diabetes Complications. — 2012. — Vol. 26(2). — P. 123-8. doi: 10.1016/j.jdiacomp.2012.02.001.
12. Broe R., Rasmussen M.L., Frydkjaer-Olsen U. et al. The 16-year incidence, progression and regression of diabetic retinopathy in a young population-based Danish cohort with type 1 diabetes mellitus: The Danish cohort of pediatric diabetes 1987 (DCPD1987) // Acta Diabetol. — 2014. — Vol. 51(3). — P. 413-20. doi: 10.1007/s00592-013-0527-1.
13. Thomas R.L., Dunstan F., Luzio S.D. et al. Incidence of diabetic retinopathy in people with type 2 diabetes mellitus attending the diabetic retinopathy screening service for wales: retrospective analysis // BMJ. — 2012. — Vol. 344. — P. 874. doi: 10.1136/bmj.e874.
14. Jones C.D., Greenwood R.H., Misra A., Bachmann M.O. Incidence and progression of diabetic retinopathy during 17 years of a population-based screening program in England // Diabetes Care. — 2012. — Vol. 35(3). — P. 592-6. doi: 10.2337/dc11-0943.
15. Ding J., Wong T.Y. Current epidemiology of diabetic retinopathy and diabetic macular edema // Curr. Diab. Rep. — 2012. — Vol. 12(4). — P. 346-54. doi: 10.1007/s11892-012-0283-6.

/94-1.jpg)
/95-1.jpg)
/96-1.jpg)
/97-1.jpg)