Вступ
Лікування болю при хронічних запальних захворюваннях суглобів вимагає від клініциста зваженого підходу до забезпечення ефективного знеболювання з огляду на ризики, пов’язані з анальгетиками. Патогенез хронічного больового синдрому досить складний, він включає як ноцицептивні, так і неноцицептивні механізми, у тому числі невропатичний компонент та центральну сенситизацію [1–3]. Переважна кількість рекомендацій щодо менеджменту болю, пов’язаного з артритами, не диференціюють ноцицептивний і неноцицептивний біль та не повною мірою враховують характер болю [4–6]. Нестероїдні протизапальні препарати (НПЗП) ефективні при лікуванні суглобового болю, пов’язаного з ноцицептивною складовою [7]. Проте проблема безпечності НПЗП значно обмежує можливості знеболювання в пацієнтів високого ризику розвитку НПЗП-асоційованих ускладнень [8–10]. У цьому контексті комбінована терапія больового синдрому може бути більш доцільною в цієї категорії хворих.
За критерієм фармакологічної безпечності, за даними клінічних досліджень, НПЗП селективної дії мають внутрішньокласову перевагу при лікуванні больового синдрому у хворих ревматологічного профілю [11]. Потужну доказову базу має селективний інгібітор ЦОГ-2 мелоксикам, що використовується в клінічній практиці з 1995 року та має підтверджену ефективність і безпечність, продемонстровану в численних рандомізованих плацебо-контрольованих дослідженнях [8, 12, 13]. Але в більшості цих досліджень вивчалось тривале застосування мелоксикаму, на той час як рекомендації FDA та ЕМЕА вказують на доцільність застосування мінімально можливої тривалості безперервного лікування НПЗП [14, 16], що також регламентується віт-чизняними рекомендаціями [16].
З урахуванням багатокомпонентного патогенезу больового синдрому при хронічних захворюваннях опорно-рухового апарату та рекомендації щодо зменшення використання НПЗП доцільним є застосування ад’ювантної терапії [17–19]. Тому перспективним, на наш погляд, є використання комплексних метаболічних препаратів у цієї категорії хворих, зокрема Кокарніту, що містить кокарбоксилазу, вітамін В12 (ціанокобаламін), нікотинамід (вітамін РР) і динатрію аденозинтрифосфат тригідрат. Даний препарат призначений для метаболічної терапії при хворобах серця (ішемічна хвороба серця, кардіоміопатії, міокардит), нервової системи (неврити, нейропатії, невралгії різного походження, ішіалгії; люмбаго, радикуліти), при міалгії, бурситі, тендиніті. Ефективність та добра переносимість Кокарніту в комплексній терапії хворих ревматологічного профілю вже була продемонстрована в попередніх роботах [19].
Метою даного дослідження було оцінити ефективність та безпечність комбінованої терапії з використанням мелоксикаму (Локсидолу) і Кокарніту в лікуванні пацієнтів із хронічними захворюваннями опорно-рухового апарату в період загострення.
Матеріали та методи
У дослідження було включено 30 пацієнтів із хронічними захворюваннями опорно-рухового апарату в період загострення: ревматоїдний артрит (РА) (n = 14), остеоартоз (ОА) з явищами синовіту (n = 8), серонегативна артропатія (СА) (n = 8). Серед них було 8 чоловіків (26,7 %) і 22 жінки (73,3 %) віком від 41 до 57 років (медіана віку 52,3 [42,3; 59,5] року).
Критеріями включення були: наявність хронічних запальних захворювань суглобів, що супроводжуються загостренням больового синдрому, рівень болю за візуальною аналоговою шкалою (ВАШ) > 3 см, незмінна базисна та глюкокортикостероїдна терапія впродовж останніх 3 місяців, інформована згода на участь у дослідженні. Критерії виключення: третій ступінь активності запального процесу РА, серонегативної артропатії, ІV рентгенологічна стадія ураження суглобів при ревматоїдному артриті, остеоартрозі, ендопротезування суглобів в анамнезі, інфекційний артрит, травматичний біль (наявність травми до 1 міс., переломів — до 6 міс.), активна або рецидивуюча виразкова хвороба/кровотеча в анамнезі; шлунково-кишкові кровотечі або перфорація, пов’язані з прийомом НПЗП в анамнезі; гемодинамічно значущі серцево-судинні захворювання, перенесені протягом 6 місяців гострі серцево-судинні катастрофи, порушення в системі гемостазу або одночасне використання антикоагулянтів, швидкість клубочкової фільтрації нижче від 60 мл/хв/1,73 м2, печінкова недостатність, цукровий діабет, вагітність; індивідуальна непереносимість препарату або його компонентів, бронхіальна астма, кропив’янка і/або інші алергічні реакції, пов’язані з прийомом саліцилатів, інших НПЗП чи компонентів призначуваних препаратів, відмова пацієнта від участі в дослідженні. Дослідження було погоджене з локальним етичним комітетом і проводилося згідно з принципами Гельсінської декларації прав людини, Конвенції Ради Європи про права людини й біомедицину та відповідних законів України.
Тривалість захворювання становила: РА — 9,8 [8,8; 11,7] року, ОА — 11,3 [8,3; 11,9] року, СА — 9,6 [8,5; 11,2] року. Як базисне лікування РА хворобомодифікуючу протиревматичну терапію отримували 10 (71,4 %) хворих: метотрексат із медіаною дози 15 [10; 15] мг на тиждень, тривалість лікування 7,5 [6,6; 8,7] року. Глюкокортикоїди отримували 7 (23,3 %) хворих (медіана добової дози за метилпреднізолоном на момент дослідження 4 [2; 4] мг), тривалість лікування 8,4 [7,2; 9,4] року; пероральні НПЗП до початку спостереження — 25 (83,3 %) хворих, топікальні форми НПЗП застосовували 16 (53,3 %) хворих.
Дизайн дослідження: першу групу становили 15 хворих, яким призначали ін’єкційну форму мелоксикаму в дозі 15 мг/1,5 мл на добу (препарат Локсидол, World Medicine, Румунія) триденним курсом із подальшим пероральним застосуванням у дозі 7,5–15 мг на добу за потребою пацієнта, другу — 15 хворих, які на тлі призначення мелоксикаму отримували ад’ювантну терапію комплексним препаратом Кокарніт (World Medicine) внутрішньом’язово протягом 9 діб. Групи були порівнянні за тривалістю хвороби, нозологічною структурою, отримуваним лікуванням, рентгенологічним ураженням суглобів та їх функціональним порушенням (табл. 1).
Усім хворим були проведені загальноклінічне обстеження, оцінка інтенсивності болю за ВАШ у стані спокою та при фізичному навантаженні, загальне та біохімічне дослідження крові з визначенням швидкості осідання еритроцитів, ревматоїдного фактора, С-реактивного протеїну (СРП); рентгенографія уражених суглобів із визначенням рентген-стадії захворювання. Для контролю можливого токсичного впливу препарату на печінку та нирки вивчали активність амінотрансфераз (аспартатамінотрансфераза (АСТ), аланінамінотрансфераза (АЛТ)), рівень сечовини, креатиніну, виконували загальний аналіз крові. Клініко-лабораторні дослідження проводили перед початком терапії та через 3 і 9 діб лікування. Оцінку ефективності лікування здійснювали лікар та пацієнт за 4-бальною шкалою: 0 — немає ефекту, 1 — незначний ефект, 2 — помірний ефект, 3 — виражений ефект. Статистичну обробку матеріалів дослідження проводили з використанням методів біостатистики, реалізованих у пакеті програм Statistica v.6.1 (Statsoft Inc., США) (ліцензійний номер AJAR909E415822FA). Застосовували методи непараметричної статистики: при зазначенні кількісних ознак дані були подані у вигляді медіани та меж інтерквартильного відрізку [25; 75 %], для якісних ознак — у вигляді відносних показників. Перевірка рівності дисперсій проводилась за критеріями Фішера (F) і Левена (Levene Test); оцінка вірогідності відмінностей для незв’язаних вибірок — за критерієм Манна — Уїтні (U), для зв’язаних — за критерієм Вілкоксона (Т); множинне порівняння — непараметричний (Крускала — Уолліса) дисперсійний аналіз, вірогідність відмінностей відносних показників — за критерієм хі-квадрат Пірсона (χ2). Для оцінки взаємозв’язку між ознаками виконувався кореляційний аналіз з розрахунком коефіцієнта рангової кореляції P. Spearman (R). Критичне значення рівня значимості (р) приймалося як ≤ 0,05.
Результати та обговорення
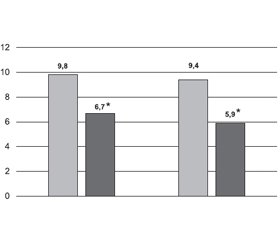
Аналіз результатів лікування хворих із хронічними захворюваннями опорно-рухового апарату в період загострення свідчить про достатньо виражений знеболювальний та протизапальний ефект серед хворих як першої групи, так і другої. Тривалість ранкової скутості вірогідно зменшилася на 32,6 та 43,2 % до кінця спостереження у хворих І та ІІ груп відповідно (р < 0,05). На тлі лікування мелоксикамом інтенсивність больового синдрому за ВАШ вірогідно знизилася (р < 0,05) порівняно з вихідними значеннями (рис. 1, 2), при цьому серед пацієнтів ІІ групи відзначалась більш значна динаміка зниження цих показників. Максимальне зниження інтенсивності болю як у спокої, так і при русі відзначалось через 9 діб спостереження — на 51,2 % (р < 0,05) і 52,1 % (р < 0,05) відповідно у хворих І групи, на 61,2 % (р < 0,05) і 63,8 % (р < 0,05) — у хворих ІІ групи. Протягом лікування кількість хворих із високою інтенсивністю болю в спокої та при русі вірогідно зменшилася в обох групах, у частини пацієнтів біль трансформувався в слабкий (рис. 3, 4). При цьому в першій групі кількість хворих з високою інтенсивністю болю в спокої та при русі скоротилась через 3 дні на 13,3 і 20,0 % відповідно (р < 0,05), у другій — на 13,3 і 33,3 % відповідно (р < 0,05). Через 9 днів лікування знеболюючий ефект був більш значущим: відбулось скорочення кількості хворих із високою інтенсивністю болю в спокої та при русі на 23,3 і 46,6 % відповідно (р < 0,05) у І групі та на 46,7 і 66,7 % відповідно (р < 0,05) у ІІ групі.
Нормалізація рівня С-реактивного протеїну на тлі призначеної терапії відзначалась у 7 (46,7 %) пацієнтів, які отримували лише ін’єкційний мелоксикам, та в 9 (60,0 %) пацієнтів із додатковим призначенням Кокарніту. Тенденція до більш вираженої динаміки зниження СРП відзначалась серед пацієнтів ІІ групи — на 37,7 %, водночас серед хворих І групи — 31,6 % (рис. 5).
За період спостереження в обох групах не зареєстровано значущих змін у показниках, що характеризують функцію печінки й нирок, і таких, що вимагали б зниження дози препаратів або їх відміни (табл. 2). За період лікування Локсидолом зареєстровано 1 випадок появи больового синдрому в епігастральній ділянці, який зник після призначення блокатора протонної помпи. Згідно з отриманими результатами, позитивний ефект лікування, на думку лікаря, відзначено у 25 (83,3 %) хворих, на думку пацієнта — у 22 (73,3 %) хворих. При цьому відзначені вірогідні відмінності в оцінці високої ефективності терапії пацієнтами ІІ групи порівняно з першою — у 66,7 та 80 % хворих відповідно (р < 0,05).
Отже, застосування короткотривалої ін’єкційної терапії мелоксикамом (Локсидол) протягом 3 діб із подальшим пероральним прийомом при хронічних захворюваннях опорно-рухового апарату в період загострення сприяє зменшенню інтенсивності болю при добрій переносимості та безпечності. Динаміка зниження інтенсивності болю, маркерів запалення, позитивна суб’єктивна оцінка ефективності лікування були більш виражені серед пацієнтів, які отримували комплексну терапію мелоксикамом та Кокарнітом.
Висновки
1. Застосування комплексної терапії загострення больового синдрому при хронічних захворюваннях опорно-рухового апарату мелоксикамом (Локсидол) та Кокарнітом сприяло вірогідному зниженню показників інтенсивності болю за ВАШ більше ніж у 2 рази та мало переваги перед монотерапією НПЗП.
2. Призначення Локсидолу та Кокарніту обумовлювало більш значуще зниження проявів системного запалення відносно групи порівняння, продемонструвало добру переносимість та безпечність цих препаратів.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Woolf C.J. Central sensitization: implications for the diagnosis and treatment of pain // Pain. — 2011. — 152 –(3 Suppl.). — S2-15.
2. Mease P., Hanna S., Frakes E., Altman R. Pain mechanisms in osteoarthritis: understanding the role of central pain and current approaches to its treatment // J. Rheumatol. — 2011. — 38. — 1546-51.
3. Lee Y., Nassikas N., Clauw D. The role of the central nervous system in the generation and maintenance of chronic pain in rheumatoid arthritis, osteoarthritis and fibromyalgia // Arth. Res. Ther. — 2011. — 13. — 211-21.
4. McAlindon T.E., Bannuru R.R., Sullivan M.C., Arden N.K., Berenbaum F., Bierma Zeinstra S.M. et al. OARSI guidelines for the non surgical management of knee osteoarthritis // Osteoarthritis Cartilage. — 2014. — 22. — 363-388.
5. EULAR evidence based recommendations for the management of hip osteoarthritis: report of a task force of the EULAR Standing Committee for International Clinical Studies Inclu–ding Therapeutics (ESCISIT) / W. Zhang et al. // Ann. Rheum. Dis. — 2005. — Vol. 64. — P. 669-681.
6. NICE. Rheumatoid arthritis: the management of rheumatoid arthritis in adults. — London: NICE, 2009. Available from: http://www.nice.org.uk/nicemedia/live/12131/43327/43327.pdf.
7. Magliano M., Morris V., editors. Use of analgesics in rheumatology. — London: Arthritis Research Campaign, 2002.
8. García Rodríguez L.A., González-Pérez A., Bueno H., Hwa J. NSAID use selectively increases the risk of non-fatal myocardial infarction: a systematic review of randomised trials and observational studies // PLoS One. — 2011. — 6. — e16780.
9. Rostom A., Goldkind L., Laine L. Nonsteroidal anti-inflammatory drugs and hepatic toхicity: a systematic review of randomized controlled triаls in arthritis patients / A. Rostom, L. Goldkind, L. Laine // Clin. Gastroenterol. Hepatol. — 2005. — Vol. 3. — P. 489-498.
10. Jobanputra P., Barton P. et al. Cyclooxygenase-2 selective non-steroidal anti-inflammatory drugs (etodolac, meloxicam, celecoxib, rofecoxib, etoricoxib, valdecoxib and lumiracoxib) for osteoarthritis and rheumatoid arthritis: a systematic review and economic evaluation // Health Technology Assessment. — 2008. — 1211. — 1-298.
11. Makarovski W., Zhao W.W., Bevirt T., Reckes D.P. Efficacy and safety of the COX2 specific inhibitor meloxicam in the management of osteoarthritis of the hip: a randomized, double-blind, placebo-controlled comparison with naproxen // Osteoarthritis Carbilage. — 2002. — Vol. 10. — P. 290-296.
12. Distel M., Mueller C., Bluhmki E., Fries J. Safety of Meloxicam: A Global Analysis of Clinical Trials // Rheumato-logy (Oxford). — 1996. — 35 (suppl. 1). — 68-77. doi: 10.1093/rheumatology/35.suppl_1.68
13. Gastrointestinal tolerability of meloxicam compared to diclofenac in osteoarthritis patients. International MELISSA Study Group. Meloxicam Large-scale International Study Safety Assessment / C. Hawkey, A. Kahan, K. Steinbruck et al. // Br. J. Rheumatol. — 1998. — Vol. 37, № 9. — P. 937-945.
14. FDA Information for healthcare professionals: NSAIDs. — 2005. — http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/DrugSafetyInformationforHeathcareProfessionals/ucm085282.htm.
15. Assessment report for Non-Steroidal Anti-Inflammatory Drugs (NSAIDs) and cardiovascular risk. — EMA, 2012.
16. Про затвердження протоколів надання медичної допомоги за спеціальністю «Ревматологія». Наказ Міністерства охорони здоров’я України № 676 від 12.10.2006.
17. Курята О.В. Біль у суглобах у хворих ревматологічного профілю: роль контролю тривожно-депресивних розладів // Курята О.В., Сіренко О.Ю. / Український ревматологічний журнал. — 2017. — 2(68). — С. 52-57.
18. Курята О.В. Особливості хронічного больового синдрому при запальних захворюваннях суглобів та ефективність контролю болю на тлі корекції тривожно-депресивних розладів / Курята О.В., Лисунець Т.К., Нода О.Ю. // Український ревматологічний журнал. — 2012. — № 2(48). — С. 14-18.
19. Курята О.В. Эффективность кокарнита в комплексной терапии у пациентов c системными заболеваниями соединительной ткани с поражением миокарда и проявлениями сердечной недостаточности / Курята А.В., Лысунец Т.К., Нода О.Ю. // Международный медицинский журнал. — 2012. — № 2. — С. 44-49.