Резюме
Метою дослідження було вивчення ефективності та безпечності триметазидину (Карметадин, компанія World Medicine) в комплексному лікуванні пацієнтів з ішемічною хворобою серця та хронічною серцевою недостатністю. 80 включеним у дослідження хворим з ішемічною хворобою серця (стабільна стенокардія напруження II–III функціонального класу) та хронічною серцевою недостатністю (II–III функціональний клас за класифікацією NYHA) проводили стандартне загальноклінічне обстеження, лабораторні (загальні аналізи крові та сечі, ліпідний, печінковий, нирковий комплекси, коагулограма, глюкоза крові) та інструментальні (електрокардіографія, ехокардіографія, добове моніторування електрокардіограми) дослідження. Пацієнти були розділені на дві групи. У контрольну групу увійшли 40 хворих, яким було призначено комплексне лікування: антитромботична терапія (аспірин 100 мг на добу), бета-адреноблокатор (бісопролол 5–10 мг на добу залежно від початкової частоти серцевих скорочень та рівня артеріального тиску за умови попередньої титрації дози), інгібітор ангіотензинперетворюючого ферменту (раміприл 5–10 мг на добу залежно від початкового рівня артеріального тиску за умови попередньої титрації дози), статин (розувастатин 20 мг на добу), при необхідності були рекомендовані нітрати та діуретики. 40 пацієнтів основної групи на фоні вищезазначеної базисної терапії приймали Карметадин (35 мг 2 рази на добу, таблетки з модифікованим вивільненням препарату). Період спостереження становив 6 місяців. Застосування Карметадину в складі комплексного лікування хворих на ішемічну хворобу серця та хронічну серцеву недостатність асоціювалося з поліпшенням якості життя пацієнтів, суттєвим зменшенням кількості та тривалості ангінозних атак, зниженням потреби в короткодіючих нітратах, поліпшенням функціонального класу серцевої недостатності, збільшенням фракції викиду лівого шлуночка; не призводило до розвитку побічних ефектів, що потребували би відміни препарату.
Целью исследования стало изучение эффективности и безопасности триметазидина (Карметадин, компания World Medicine) в комплексном лечении пациентов с ишемической болезнью сердца и хронической сердечной недостаточностью. 80 включенным в исследование больным с ишемической болезнью сердца (стенокардия напряжения II–III функционального класса) и хронической сердечной недостаточностью (II–III функциональный класс по классификации NYHA) проводили стандартное общеклиническое обследование, лабораторные (общий анализ крови и мочи, липидный, печеночный, почечный комплексы, коагулограмма, глюкоза крови) и инструментальные (электрокардиография, эхокардиография, суточное мониторирование электрокардиограммы) исследования. Пациенты были разделены на две группы. В контрольную группу вошли 40 больных, которым было назначено комплексное лечение: антитромбоцитарная терапия (аспирин 100 мг в сутки), бета-адреноблокатор (бисопролол 5–10 мг в сутки в зависимости от исходного уровня частоты сердечных сокращений и артериального давления с предшествующей титрацией дозы), ингибитор ангиотензинпревращающего фермента (рамиприл 5–10 мг в сутки в зависимости от исходного уровня артериального давления с предшествующей титрацией дозы), статин (розувастатин 20 мг в сутки), при необходимости были рекомендованы нитраты и диуретики. 40 пациентов основной группы на фоне вышеуказанной базисной терапии принимали Карметадин (по 35 мг 2 раза в сутки, таблетки с модифицированным высвобождением препарата). Период наблюдения составил 6 месяцев. Применение Карметадина в составе комплексного лечения больных с ишемической болезнью сердца и хронической сердечной недостаточностью ассоциировалось с улучшением качества жизни пациентов, существенным уменьшением количества и длительности ангинозных атак, снижением потребности в короткодействующих нитратах, улучшением функционального класса хронической сердечной недостаточности, увеличением фракции выброса левого желудочка; не приводило к развитию побочных эффектов, требующих отмены препарата.
The purpose of study was to assess the effectiveness and safety of trimetazidine (Сarmetadin) in the comprehensive treatment of patients with ischemic heart disease and chronic heart failure. Eighty persons with ischemic heart disease (stable angina pectoris, II–III functional class) and chronic heart failure (II–III functional class, New York Heart Association classification) were included in our investigation. We performed standard clinical investigation, evaluation of laboratory indices, electrocardiography, echocardiography, daily monitoring of electrocardiogram. Patients were divided into two groups. Forty persons of the control group received comprehensive treatment — antithrombotic therapy (aspirin — 100 mg per day), beta-blocker (bisoprolol — 5–10 mg per day, depending on the initial heart rate and blood pressure, with previous dose titration), angiotensin-converting enzyme inhibitor (ramipril — 5–10 mg per day, depending on the initial blood pressure, with previous dose titration), statin (rosuvastatin — 20 mg per day) and, if necessary, nitrates and diuretics were recommended. Forty patients of the main group additionally took Сarmetadin (35 mg twice daily, modified release tablets). Observation period was 6 months. The use of Сarmetadin in the comprehensive therapy of ischemic heart disease and chronic heart failure was associated with improvement of patients’ quality of life, significant decrease in the number and duration of angina attacks, reduction of the demand for short-acting nitrates, improvement of the functional class of chronic heart failure, increase in the left ventricular ejection fraction. Besides, comprehensive treatment with Сarmetadin was well tolerated by patients — serious adverse effects were not registered.
Введение
На сегодняшний день сердечно-сосудистые заболевания (ССЗ) являются основной причиной летальных исходов в Украине, составляя 68,3 % в структуре общей смертности. Таким образом, 7 из 10 смертей в нашей стране — это следствие ССЗ. Согласно статистическим данным в Украине зарегистрировано около 8 000 000 больных, страдающих ишемической болезнью сердца (ИБС), и около 1 000 000 пациентов с хронической сердечной недостаточностью (ХСН). Ежегодно происходит 50 000 инфарктов миокарда (ИМ), 110 000 инсультов [4].
Все вышеизложенное вызывает необходимость выполнения европейских и национальных рекомендаций по лечению больных с ССЗ, мотивации пациентов к соблюдению рекомендаций врача, а также поиска дополнительных возможностей, позволяющих оптимизировать терапию этой категории пациентов [5, 18].
В течение последних десятилетий считалось, что клинические проявления ИБС возникают только при наличии коронарной обструкции. Однако данные недавно завершившихся исследований свидетельствуют о том, что обструкция коронарной артерии является лишь одним из многих компонентов сложного процесса, ведущего к развитию ИБС, а также о том, что не всегда наличие коронарного стеноза по данным ангиографии означает наличие ИБС, а клиническая картина ИБС не всегда сочетается со значительной коронарной обструкцией [7, 14, 16]. По данным крупного регистра, из 398 978 человек, прошедших плановую ангиографию, у 37,6 % была обнаружена обструктивная ИБС [20]. В то же время анализ результатов ангиографии 304 больных со стабильной стенокардией в 47 % случаев выявил интактные или практически интактные коронарные артерии [21]. Следует отметить, что из всех возможных вариантов сочетание документированного коронарного стеноза и признаков миокардиальной ишемии отвечает за самый плохой прогноз, самое низкое качество жизни и самый высокий риск смерти пациентов [24, 26].
На то, что коронарный стеноз является не единственной причиной развития стенокардии, указывает и невозможность полного излечения ИБС при помощи реваскуляризации миокарда. В исследовании RITA-2 (Randomized Intervention Treatment of Angina 2), в котором сравнивалась консервативная и интервенционная стратегия лечения ИБС, было показано, что 70 % пациентов после коронарной ангиопластики получали более одного антиангинального препарата [13]. А в исследовании Euro Heart Survey частота применения антиангинальных препаратов пациентами со стабильной ИБС после коронарной реваскуляризации была такой же или даже большей, чем до вмешательства на коронарных артериях. Только у 3 % из 3779 больных удалось отменить лечение антиангинальными средствами, в то время как 55 % пациентов принимали два препарата, а еще 20 % — более двух [9]. Согласно результатам этих исследований, потребность пациентов со стабильной ИБС в антиангинальных препаратах не отменяет даже проведение реваскуляризационных процедур, а значит, помимо коронарной обструкции существуют и другие патогенетические механизмы, влияющие на поставку кислорода к миокарду и потребность миокарда в кислороде, которые ведут к развитию ишемии.
Таким образом, ишемия миокарда представляет собой многофакторное заболевание, в основе которого лежат различные патофизиологические механизмы: коронарный стеноз, тромбоз, хроническое воспаление, высокая частота сердечных сокращений (ЧСС), вазоспазм, эндотелиальная и микрососудистая дисфункция, а также митохондриальная дисфункция с избыточной активацией бета-окисления свободных жирных кислот и нарушением процессов синтеза энергии в кардиомиоцитах [17].
Следовательно, для выбора адекватного лечения пациентов с ИБС можно использовать два подхода. Первый — выявлять у каждого больного механизмы, ответственные за развитие ишемии, и подбирать соответствующие препараты. Второй — выбрать препарат, который оказывает действие непосредственно на клеточном уровне и защищает кардиомиоциты от ишемии независимо от причины [1, 2]. На наш взгляд, наиболее универсальным является второй подход. И в качестве препарата выбора может быть рассмотрен триметазидин.
Триметазидин действует на уровне кардиомиоцитов путем ингибирования длинноцепочечной 3-кетоацил-СоА-тиолазы — митохондриального фермента, участвующего в окислении свободных жирных кислот. Подавление активности этого фермента блокирует бета-окисление свободных жирных кислот с последующей стимуляцией окисления глюкозы и угнетением гликолиза. Реакции, индуцируемые триметазидином, увеличивают соотношение креатинфосфат/АТФ в миокарде на 33 %, способствуя сохранению уровней высокоэнергетических фосфатов и функции ионного насоса, и, как следствие, повышают эффективность сердечной деятельности и уменьшают выраженность ишемических симптомов [3, 10, 15, 22, 23]. Оптимизируя процессы образования АТФ в кардиомиоцитах и устраняя изменения, вызванные ишемией, триметазидин выступает как цито- и кардиопротектор и поэтому рекомендован к применению для долго–срочного лечения стабильной стенокардии в сочетании с препаратами первой линии — бета-блокаторами и антагонистами кальция [8, 18, 25]. Эффекты триметазидина дополняют эффекты гемодинамически активных препаратов, что ведет к уменьшению частоты приступов стенокардии и улучшает переносимость физических нагрузок без влияния на ЧСС и уровень артериального давления (АД) [23, 28].
Триметазидин, добавленный к стандартной терапии, уменьшает симптомы ХСН, увеличивает фракцию выброса (ФВ) желудочков, повышает сократимость миокарда и улучшает эндотелиальную функцию. В ряде исследований было продемонстрировано, что у пациентов с ИБС и ХСН триметазидин в сравнении с плацебо улучшает функцию левого желудочка (ЛЖ), увеличивает толерантность к физической нагрузке и функциональный класс по NYHA [6, 11, 12, 19, 27, 29].
На фармацевтический рынок Украины не так давно вышел генерический триметазидин — Карметадин (компания World Medicine), который продемонстрировал полную биоэквивалентность оригинальному препарату. С учетом непростой экономической ситуации в нашей стране вопрос стоимости препарата приобретает решающее значение (безусловно, при соответствующей эффективности), поскольку, чем доступнее лекарственное средство, тем большее число пациентов сможет его принимать.
Таким образом, целью нашего исследования стало изучение эффективности и безопасности Карметадина в комплексном лечении пациентов с ишемической болезнью сердца и хронической сердечной недостаточностью.
Материалы и методы
В исследование было включено 80 больных (56 мужчин и 24 женщины, средний возраст — 57,3 ± 8,2 года) с ишемической болезнью сердца (стабильная стенокардия напряжения II–III функционального класса) и хронической сердечной недостаточностью (II–III функциональный класс по классификации NYHA). 42 пациента страдали эссенциальной артериальной гипертензией (АГ) 1–2-й степени тяжести. Стаж существования эссенциальной АГ составил 6,8 ± 3,7 года. В исследование не включались пациенты, перенесшие в предыдущие 2 месяца острое нарушение мозгового кровообращения или острый коронарный синдром, а также больные с клинически значимыми пороками сердца, декомпенсированным сахарным диабетом, хроническими неспецифическими заболеваниями легких, дыхательной недостаточностью, хронической почечной недостаточностью, хроническими заболеваниями печени.
Всем больным проводили общефизикальные, лабораторные (общий анализ крови и мочи, липидный, печеночный, почечный комплексы, коагулограмма, глюкоза крови) и инструментальные (электрокардиография, эхокардиография, суточное мониторирование электрокардиограммы) исследования.
Пациенты были разделены на две группы. В контрольную группу вошли 40 больных, которым было назначено комплексное лечение: антитромбоцитарная терапия (аспирин 100 мг в сутки), бета-адреноблокатор (бисопролол 5–10 мг в сутки в зависимости от исходного уровня частоты сердечных сокращений и артериального давления с предшествующей титрацией дозы), ингибитор ангиотензинпревращающего фермента (АПФ) (рамиприл 5–10 мг в сутки в зависимости от исходного уровня артериального давления с предшествующей титрацией дозы), статин (розувастатин 20 мг в сутки), при необходимости были рекомендованы нитраты и диуретики. 40 пациентов основной группы на фоне вышеуказанной базисной терапии принимали Карметадин (по 35 мг 2 раза в сутки, таблетки с модифицированным высвобождением препарата).
Группы были сопоставимы по среднему возрасту пациентов, гендерному профилю, частоте встречаемости АГ, клиническому течению ИБС и ХСН. До включения в исследование пациенты систематически не лечились. Период наблюдения составил 6 месяцев.
Оценку эффективности лечения проводили на основе изменения качества жизни пациентов (улучшение самочувствия больных, уменьшение интенсивности боли и дискомфорта в области сердца, нормализация сна, повышение работоспособности), уменьшения количества и длительности приступов стенокардии, снижения потребности в короткодействующих нитратах, улучшения функционального класса сердечной недостаточности, увеличения фракции выброса левого желудочка.
Степень выраженности жалоб определяли согласно шкале: 0 — отсутствие жалоб, 1 — незначительная выраженность, 2 — умеренная выраженность, 3 — значительная выраженность симптома.
Переносимость назначенного лечения оценивали следующим образом: «отлично» — побочные эффекты в течение периода наблюдения не возникали; «хорошо» — возникали побочные эффекты, не требующие отмены препарата; «неудовлетворительно» — возникали побочные эффекты, требующие отмены лечения.
Статистическую обработку полученных результатов исследования выполняли на персональном компьютере с использованием формул теории статистики. Оценивали средние значения полученных данных (M), их стандартные отклонения (m), достоверность статистических показателей (p) c использованием t-критерия Стьюдента.
Результаты и обсуждение
На фоне рекомендованной терапии отмечалось улучшение самочувствия пациентов, уменьшение интенсивности боли и дискомфорта в области сердца, повышение работоспособности, нормализация сна, причем положительная динамика была более выражена у пациентов, принимающих Карметадин (рис. 1).
Через 6 месяцев лечения у пациентов основной группы в сравнении с пациентами контрольной группы наблюдалось существенное уменьшение количества и продолжительности приступов стенокардии, уменьшение потребности в короткодействующих нитратах (табл. 1).
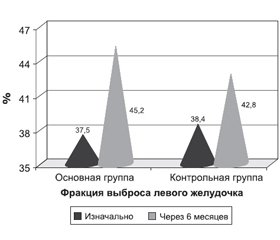
В конце периода наблюдения у 62,5 % (25 из 40) пациентов основной группы и у 50 % (20 из 40) больных контрольной группы улучшился функциональный класс ХСН (рис. 2, 3). На фоне применения Карметадина выявлено достоверное увеличение фракции выброса левого желудочка, в то время как у пациентов контрольной группы была отмечена тенденция к увеличению этого показателя (рис. 4).
Существенной разницы в биохимических показателях у пациентов основной и контрольной группы как в начале исследования, так и через 6 месяцев наблюдения выявлено не было.
Переносимость назначенной терапии расценивалась как «отличная» у 95 % больных основной группы и 97,5 % больных контрольной группы (побочные эффекты в течение периода наблюдения не возникали) и «хорошая» — у 4 % пациентов основной группы и 2 % пациентов контрольной группы (на начальных этапах лечения отмечался незначительный дискомфорт в эпигастральной области, что не привело к необходимости отмены рекомендованного лечения).
Выводы
1. Применение Карметадина (35 мг 2 раза в сутки, таблетки с модифицированным высвобождением препарата) в составе комплексного лечения больных с ишемической болезнью сердца и хронической сердечной недостаточностью ассоциировалось с улучшением качества жизни пациентов, существенным уменьшением количества и длительности ангинозных атак, снижением потребности в короткодействующих нитратах, улучшением функционального класса хронической сердечной недостаточности, увеличением фракции выброса левого желудочка.
2. Комплексное лечение пациентов с ишемической болезнью сердца и хронической сердечной недостаточностью с использованием Карметадина хорошо переносилось пациентами и не вызывало побочных явлений, требующих отмены терапии.
Конфликт интересов. Не заявлен.
Список литературы
1. Акимов А.Г. Перспективы применения миокардиальных цитопротекторов в кардиологической практике / А.Г. Акимов, В.Ю. Полумисков // Terra Medica. — 2005. — Vol. 4. — С. 24-31.
2. Амосова Е.Н. Метаболическая терапия повреждений миокарда, обусловленная ишемией. Новый подход к лечению ишемической болезни сердца и сердечной недостаточности / Е.Н. Амосова // Укр. кардиол. журнал. — 2000. — № 4. — С. 86-92.
3. Малиновская И.Э. Клиническая эффективность триметазидина у пациентов, перенесших острый инфаркт миокарда / И.Э. Малиновская, Т.М. Терещенко // Ліки України. — 2016. — № 10. — С. 87-90.
4. Проблеми здоров’я і медичної допомоги та модель покращання в сучасних умовах / За ред. В.М. Коваленка, В.М. Корнацького. — К.: Гордон, 2016. — 262 с.
5. Серцево-судинні захворювання. Класифікація, стандарти діагностики та лікування / За ред. В.М. Коваленка, М.І. Лутая, Ю.М. Сіренка, О.С. Сичова. — К.: Моріон, 2016. — 192 с.
6. Belardinelli R. Trimetazidine improves endothelial dysfunction in chronic heart failure: an antioxidant effect / R. Belardinelli, M. Solenghi, L. Volpe, A. Purcaro // Eur. Heart J. — 2007. — Vol. 28. — P. 1102-1108.
7. Boden W. Optimal medical therapy with or without PCI for stable coronary disease / W. Boden, R. O’Rourke, K. Teo // N. Engl. J. Med. — 2007. — Vol. 356. — P. 1503-1516.
8. Cross H. Trimetazidine for stable angina pectoris / H. Cross // Expert. Opin. Pharmacother. — 2001. — Vol. 2. — P. 857-875.
9. Daly C. The initial management of stable angina in Europe, from the Euro Heart Survey: a description of pharmacological management and revascularization strategies initiated within the first month of presentation to a cardiologist in the Euro Heart Survey of Stable Angina / C. Daly, F. Clemens, J. Lopez-Sendon // Eur. Heart J. — 2005. — Vol. 26. — P. 1011-1022.
10. Di Napoli P. Anti-ischemic cardioprotection with trimetazidine / P. Di Napoli // Heart Metab. — 2008. — Vol. 41. — P. 25-29.
11. Doenst T. Cardiac metabolism in heart failure: implications beyond ATP production / T. Doenst, T.D. Nguyen, E.D. Abel // Circ. Res. — 2013. — Vol. 113 (6). — P. 709-724.
12. Gao D. Trimetazidine: a meta-analysis of randomized controlled trials in heart failure / D. Gao, N. Ning, X. Niu // Heart. — 2011. — Vol. 97. — P. 278-286.
13. Henderson R. Seven-year outcome in the RITA-2 trial: coronary angioplasty versus medical treatment / R. Henderson, S. Pocock, T. Clayton // J. Am. Coll. Cardiol. — 2003. — Vol. 42. — P. 1161-1170.
14. Jespersen L. Stable angina pectoris with no obstructive coronary artery disease is associated with increased risk of major adverse cardiovascular events / L. Jespersen, A. Hvelplund, S. Abildstrom // Eur. Heart J. — 2012. — Vol. 33. — P. 734-744.
15. Marzilli M. Cardioprotective effects of trimetazidine: a review / M. Marzilli // Curr. Med. Res. Opin. — 2003. — Vol. 19. — P. 661-672.
16. Marzilli M. Obstructive coronary atherosclerosis and ischemic heart disease: an elusive link! / M. Marzilli, C. Merz, W. Boden // J. Am. Coll. Cardiol. — 2012. — Vol. 60. — P. 951-956.
17. Milinkovic I. Clinical benefits of treating angina directly at the cardiac cell level with trimetazidine / I. Milinkovic, A. Coats, G. Rosano // Heart Metab. — 2017. — Vol. 72. — P. 25-31.
18. Montalescot G. 2013 ESC guidelines on the management of stable coronary disease: the Task Force on the management of stable coronary disease of the European Society of Cardiology / G. Montalescot, U. Sechtem, S. Achenbach // Eur. Heart J. — 2013. — Vol. 34. — P. 2949-3003.
19. Lopatin Y. Rationale and benefits of trimetazidine by ac-ting on cardiac metabolism in heart failure / Y. Lopatin, G. Rosano, G. Fragasso // Int. J. Cardiol. — 2016. — Vol. 203. — P. 909-915.
20. Patel M. Low diagnostic yield of elective coronary angiography / M. Patel, E. Peterson, D. Dai // N. Engl. J. Med. — 2010. — Vol. 362. — P. 886-895.
21. Pijls N. Measurement of fractional flow reserve to assess the functional severity of coronary artery stenosis / N. Pijls, B. De Bruyne, K. Peels // N. Engl. J. Med. — 1996. – Vol. 334. — P. 1703-1708.
22. Rosano G. Metabolic approach to heart failure: the role of metabolic modulators / G. Rosano, C. Vitale, I. Spoletini // The Egyptian Heart Journal. — 2015. — Vol. 67. — P. 177-181.
23. Tsioufis K. Trimetazidine and cardioprotection: facts and perspectives / K. Tsioufis, G. Andrikopoulos, A. Manolis // Angio–logy. — 2015. — Vol. 66. — P. 204-210.
24. Villines T. CONFIRM Registry Investigators. Prevalence and severity of coronary artery disease and adverse events among symptomatic patients with coronary artery calcification scores of zero undergoing coronary computed tomography angiography: results from the CONFIRM (Coronary CT Angiography Evaluation for Clinical Outcomes: an International Multicenter) registry / T. Villines, E. Hulten, L. Shaw // J. Am. Coll. Cardiol. — 2011. — Vol. 58. — P. 2533-2540.
25. Vitale C. Trimetazidine improves left ventricular function and quality of life in elderly patients with coronary artery disease / C. Vitale, M. Wajngaten, B. Sposato // Eur. Heart J. — 2004. — Vol. 25. — P. 1814-1821.
26. Weintraub W. Effects of PCI on quality of life in patients with stable coronary artery disease / W. Weintraub, J. Spertus, P. Kolm // N. Engl. J. Med. — 2008. — Vol. 359. — P. 677-687.
27. Zhang L. Additional use of trimetazidine in patients with chronic heart failure: a meta-analysis / L. Zhang, Y. Lu, H. Jiang // J. Am. Coll. Cardiol. — 2012. — Vol. 59. — P. 913-922.
28. Zhao Y. Trimetazidine improves exercise tolerance in patients with ischemic heart disease: a meta-analysis / Y. Zhao, L. Peng, Y. Luo // Herz. — 2016. — Vol. 41. — P. 514-522.
29. Zhou X. Is treatment with trimetazidine beneficial in patients with chronic heart failure? / X. Zhou, J. Chen // PLoS One. — 2014. — Vol. 9. — e94660.

/29-1.jpg)
/30-1.jpg)