Серьезные успехи в развитии сердечно-сосудистой визуализации с помощью ультразвука в последние десятилетия способствовали не только формированию интереса кардиологов к оценке функции миокарда, но и расширению представлений о физиологии сердца. Имеются данные о том, что такая общепринятая характеристика функции миокарда, как фракция выброса, в ряде случаев может быть недостаточно информативна и не коррелировать с тяжестью клинического состояния, особенно на начальных стадиях сердечной недостаточности [1, 2]. Cовершенствование цифровой обработки ультразвуковых изображений способствовало появлению принципиально новой методики оценки механики миокарда — спекл-трекинг эхокардиографии (СТЭ). Сейчас сложно представить себе современный кардиологический ультразвуковой сканер без технологии СТЭ. Основной принцип этого метода очень прост: каждый сегмент ткани миокарда кодируется индивидуальным оттенком серого цвета. При оценке в целом пространственного распределения оттенков формируется особый рисунок, который называют speckle pattern, что в переводе с английского языка означает «рисунок точек» (рис. 1) [3]. Такой рисунок характеризует акустические свойства ткани и является специфическим для каждого сегмента. При изменении положения сегмента во время сердечного цикла меняется и пространственное размещение акустических точек, а современное программное обеспечение ультразвуковых сканеров дает возможность отслеживать кадр за кадром смещение этих точек (speckles).
Наиболее частым параметром, который измеряется при проведении СТЭ, является продольный стрейн (strain). Под стрейном понимают изменение длины волокна относительно ее исходного значения, эта величина выражается в процентах. Важно помнить, что отрицательное значение стрейна (–) означает укорочение (продольный и циркулярный стрейн) или истончение (радиальный стрейн) сегмента, в то время как положительная величина (+) — растяжение (продольный и циркулярный стрейн) или утолщение (радиальный стрейн) сегмента. Большинство научных публикаций посвящено изучению стрейна левого желудочка (ЛЖ), однако левое предсердие (ЛП) и правый желудочек (ПЖ) сегодня также интенсивно изучаются.
Область применения и практическое значение стрейна в кардиологии сегодня чрезвычайно велики. Вследствие особенностей специализированного программного обеспечения различных производителей методики оценки стрейна не являются взаимозаменяемыми, и в рекомендациях представлен диапазон его средних значений [1]. Величина глобального продольного стрейна –20 % служит в рекомендациях примерным ориентиром; абсолютные значения, которые ее превышают, свидетельствуют о норме [1]. В 2017 году опубликованы результаты исследования NORRE (normal reference ranges for echocardiography), которое было спланировано Европейской ассоциацией специалистов по методам визуализации сердечно-сосудистой системы (EACVI) и проводилось для установления норм стрейна в популяции здоровых людей [4]. Было установлено, что стрейн ЛЖ выше у женщин, чем у мужчин: нижней границей нормы у женщин и мужчин считается величина продольного стрейна ≤ –17,8 и –16,7 % соответственно (табл. 1) [1, 4].
/34-1.jpg)
Также, согласно исследованию NORRE, была выявлена связь с возрастом у женщин и отсутствие таковой у мужчин. У женщин с увеличением возраста происходит уменьшение продольного стрейна и увеличение циркулярного и радиального. В 2015 году было проведено сравнение результатов продольного стрейна, полученного при использовании наиболее известных ультразвуковых сканеров (рис. 2) [5]. Величина продольного глобального стрейна колебалась от –8,0 до –21,5 % с умеренной, но статистически значимой разницей среди сканеров. Наибольшая разница продольного стрейна в абсолютном значении среди сканеров составила 3,7 %. При этом при повторном измерении стрейна была выявлена высокая воспроизводимость показателя.
Последние разработки в области трехмерной (3D) эхокардиографии позволили применить ее также для оценки стрейна (рис. 3).
Преимуществами 3D СТЭ являются возможность получения объемных изображений, преодоление проблемы зависимости от частоты кадров, ритма сердца, дыхания и помех от движения пациента. Имеются данные о более точном анализе стрейна миокарда с помощью 3D СТЭ по сравнению с двухмерной СТЭ [6]. Результаты 3D СТЭ хорошо коррелируют с анализом стрейна с помощью магнитно-резонансной томографии [7]. На сего–дняшний день уже существуют значения нормального продольного, циркулярного и радиального стрейна, полученного с помощью 3D СТЭ, а также объемные показатели ЛЖ (табл. 2) [8].
Спекл-трекинг эхокардиография при гипертрофии левого желудочка
Одним из направлений использования СТЭ в клинической практике является изучение функции миокарда при заболеваниях, сопровождающихся гипертрофией ЛЖ, в частности при артериальной гипертензии и гипертрофической кардиомиопатии (ГКМП). В действующих рекомендациях Европейского общества кардиологов по ГКМП подчеркивается, что у пациентов с этой патологией наблюдается ухудшение продольного стрейна ЛЖ (рис. 4), что позволяет применять данный показатель для постановки диагноза на ранней стадии заболевания [9].
Продольная функция может быть нарушена даже до формирования выраженной гипертрофии миокарда у родственников с соответствующей генетической мутацией [10]. Использование СТЭ позволяет дифференцировать ГКМП от поражения сердца вследствие гипертонической болезни, и величина глобального продольного стрейна > –10 % свидетельствует в пользу ГКМП (рис. 5) [11].
СТЭ позволяет также дифференцировать поражение сердца при гипертонической болезни от физиологической гипертрофии ЛЖ у спортсменов, и снижение стрейна > –16 % будет свидетельствовать о гипертонической болезни как причине гипертрофии ЛЖ [12].
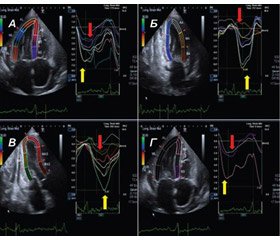
Анализ стрейна ЛЖ с помощью СТЭ дает дополнительные возможности в диагностике амилоидоза сердца. Особенности инфильтрации сердечной мышцы амилоидными массами обусловливают базально-верхушечный градиент стрейна, когда стрейн базальных сегментов ЛЖ значительно снижен в сравнении с верхушечными сегментами. D. Phelan и соавт. при оценке продольного стрейна ЛЖ показали важное дифференциально-диагностическое значение его региональных особенностей [13]. Соотношение суммы величин продольного стрейна апикальных сегментов ЛЖ с суммой величин стрейна сегментов средних и базальных отделов ЛЖ ≥ 1 позволяло с чувствительностью 93 % и специфичностью 82 % дифференцировать амилоидоз сердца с ГКМП и гипертрофией ЛЖ при гипертонической болезни (рис. 6А–В).
D. Liu и соавт. провели похожее исследование, в котором сравнили сегментарный стрейн межжелудочковой перегородки у пациентов с амилоидозом сердца и другими заболеваниями с концентрической гипертрофией ЛЖ — болезнью Фабри, гипертонической болезнью, атаксией Фридрейха [14]. Было установлено, что величина стрейна базального сегмента межжелудочковой перегородки у пациентов с амилоидозом была значительно снижена по сравнению с таковой при других причинах гипертрофии ЛЖ на фоне отсутствия существенной разницы в деформации апикального сегмента перегородки между группами. Авторами в качестве диагностического критерия было предложено соотношение величины деформации апикального сегмента с базальным сегментом межжелудочковой перегородки, а предложенная ими величина разграничения > 2,1 обладала высокой чувствительностью и специфичностью (соответственно 88 и 85 %) для дифференциальной диагностики амилоидоза сердца и других нозологий с концентрической гипертрофией ЛЖ (рис. 6Г).
Спекл-трекинг эхокардиография при ишемической болезни сердца
Многочисленные исследования подтверждают важную роль СТЭ в диагностике дисфункции миокарда у больных ишемической болезнью сердца (ИБС). Это обусловлено возможностью оценки продольного стрейна ЛЖ, характеризующей функцию наиболее подверженных ишемии субэндокардиальных волокон миокарда. Перспективным может быть выявление факта снижения систолического стрейна на фоне нагрузочной пробы в ишемизированных сегментах миокарда — регионального стрейна [15]. Такой подход обеспечивает дополнительный количественный критерий для выявления участков миокарда в бассейне кровоснабжения стенозированных коронарных артерий (рис. 7).
В то же время известно, что величина регионального стрейна может отличаться при анализе на ультразвуковых сканерах разных производителей [16]. Следует отметить, что нормативы параметров регионального стрейна, в отличие от глобального, оцениваемых с помощью СТЭ, являются предметом продолжающихся научных исследований и остаются окончательно не решенными [1].
В нескольких исследованиях было показано, что значительный стеноз коронарной артерии может вызвать нарушение продольной функции ЛЖ в состоянии покоя, которая может остаться незамеченной при визуальной оценке сократимости в В-режиме, но может быть выявлена при проведении СТЭ [17–20]. По результатам метаанализа 10 исследований с включением более 1300 пациентов были выявлены различия в величине продольного глобального стрейна у лиц без поражения коронарных артерий и при его наличии. В первом случае величина стрейна составила –19,7 % (95% доверительный интервал (ДИ) 18,8–20,7 %), в то время как у пациентов с ИБС стрейн был снижен до –16,5 % (95% ДИ 15,8–17,3 %) [21]. При этом величина продольного стрейна < –18,9 % позволяет исключить наличие ИБС (табл. 3).
/39-1.jpg)
Другая сфера применения СТЭ при ИБС — диагностика инфаркта миокарда (ИМ) без подъема сегмента ST, когда отсутствие типичных для инфаркта изменений на электрокардиограмме ограничивает чувствительность выявления лиц с окклюзией коронарных артерий [22]. Кроме того, у пациентов с острым коронарным синдромом СТЭ позволяет прогнозировать эффект реперфузионной терапии и осложнения [23].
Было показано, что величина продольного стрейна ЛЖ является независимым предиктором постинфарктной дилатации ЛЖ и ассоциируется с развитием смерти и повторной госпитализации по поводу сердечной недостаточности [24]. В первые часы развития острого ИМ показатели циркулярного стрейна ЛЖ > –11 % могут быть использованы для выявления пациентов с высоким риском развития ранней постинфарктной дилатации ЛЖ, в то время как показатели продольного стрейна > –8,4 % — для выявления лиц с высоким риском возникновения острой сердечной недостаточности во время госпитального периода лечения [25].
В экспериментальных и клинических работах было показано, что стрейн и скорость стрейна (стрейн рейт) миокарда коррелируют с объемом некротизированного миокарда [26]. Кроме того, величина продольного глобального стрейна ЛЖ у пациентов с острым ИМ является сильным предиктором восстановления систолической функции ЛЖ в будущем [27] и имеет большее значение для стратификации риска пациентов после острого ИМ по сравнению с фракцией выброса (ФВ) ЛЖ и индексом нарушения локальной сократимости [28]. Внутрижелудочковая диссинхрония, по данным СТЭ, также является важным фактором, обусловливающим направление изменения систолической функции ЛЖ после ИМ [29]. Гетерогенность времени до пикового стрейна среди сегментов ЛЖ ассоциируется с возникновением желудочковых нарушений ритма, а механическая дисперсия ≥ 75 мс позволяет предсказать опасные желудочковые нарушения ритма и провести отбор пациентов для имплантации кардиовертера-дефибриллятора при ФВ ЛЖ больше 35 % (рис. 8) [30].
Разница во времени до пикового радиального стрейна между двумя сегментами более 130 мс в острый период ИМ позволяет предположить ремоделирование ЛЖ через 6 месяцев [31].
Стресс-эхокардиография (ЭхоКГ) с добутамином — экономически доступный и безопасный метод оценки жизнеспособности миокарда, однако его недостатками являются субъективность, качественный способ оценки сократимости и плохая воспроизводимость между различными исследователями [32]. Именно поэтому актуально использование методик определения жизнеспособности, основанных на количественном способе оценки сократимости ЛЖ, таком как СТЭ (рис. 9) [33].
/36-1.jpg)
Изучается возможность применения СТЭ для дифференциации жизнеспособного миокарда и рубцовой ткани [10]. В качестве потенциальных критериев рассматривается снижение глобального продольного стрейна [34], сегментарного радиального стрейна [35]. Оценка локальной сократимости вместе с анализом стрейн рейта миокарда позволяет более точно предсказать эффективность реваскуляризации миокарда по сравнению с определением только локальной сократимости. Так, чувствительность метода стресс-ЭхоКГ с добутамином для предсказания функционального восстановления сегмента увеличивается с 73 до 82 %, если параллельно с локальной сократимостью анализировать показатели стрейна и стрейн рейта [36]. С. Cianfrocca и соавт. провели оценку жизнеспособности миокарда, применив фармакологическую стресс-ЭхоКГ с левосименданом вместе со СТЭ. Критерием жизнеспособности считали улучшение локальной сократимости через 8 месяцев после реваскуляризации. Так, чувствительность фармакологической стресс-ЭхоКГ с левосименданом для предсказания жизнеспособности составила 75 %, а специфичность — 80 %, в то время как специфичность показателя роста стрейн рейта ≥ 0,29 при введении левосимендана составила 93 % [37].
Спекл-трекинг эхокардиография при сердечной недостаточности
Оценка стрейна миокарда с помощью СТЭ является чувствительным методом выявления нарушений сократимости миокарда у лиц с сохраненной фракцией выброса ЛЖ [38]. У больных с хронической сердечной недостаточностью (ХСН) отмечается снижение стрейна миокарда в продольном, радиальном и циркулярном направлениях, что может быть обусловлено изменением ориентации волокон на фоне ремоделирования миокарда [39]. Обнаружено, что более выраженное нарушение стрейна миокарда наблюдается у пациентов с ХСН III–IV функциональных классов NYHA [40]. СТЭ может быть полезна для стратификации риска больных с ХСН [41].
Дополнительная информация о функции ЛЖ может быть получена с помощью СТЭ у больных с терминальной ХСН при трансплантации сердца.
Показано, что ухудшение глобального радиального стрейна, радиального и циркулярного стрейн рейта может служить ранним неинвазивным маркером отторжения трансплантата [42]. Снижение продольного стрейна ЛЖ > –15,5 % с чувствительностью 85,7 % и специфичностью 81,4 % позволяет выявлять раннее отторжение трансплантата [43]. С этой целью также может быть полезным измерение продольного стрейна правого желудочка, и его снижение > –17 % должно вызывать настороженность [43].
Изменения в структуре и функции сердца при различных сердечно-сосудистых заболеваниях могут приводить к появлению участков с ранним или поздним сокращением миокарда, так называемой механической диссинхронии. Одним из эффективных способов лечения ХСН является сердечная ресинхронизирующая терапия (СРТ), позволяющая уменьшить электромеханическую неоднородность миокарда желудочков и связанную с ней внутрисердечную диссинхронию [2]. На сегодняшний день существует множество эхокардиографических методик выявления внутрисердечной диссинхронии у больных с ХСН [44]. В то же время результаты многоцентровых исследований не дают оснований использовать их в качестве надежного критерия отбора пациентов для сердечной ресинхронизирующей терапии [45].
Определенные надежды в плане выявления внутрисердечной диссинхронии связывают с применением СТЭ. В исследовании STAR было установлено, что асинхронность показателей радиального и циркулярного стрейна позволяет спрогнозировать успешность сердечной ресинхронизирующей терапии [46]. Позднее эти результаты были подтверждены исследованиями MUSIC и MADIT-CRT [47, 48]. При этом увеличение уровня глобального продольного стрейна после СРТ ассоциировалось со снижением смертности пациентов [48]. Данные исследований свидетельствуют о том, что оценка диссинхронии миокарда с помощью СТЭ является более надежной и воспроизводимой, чем традиционные эхокардиографические подходы [49, 50].
Спекл-трекинг эхокардиография при клапанной патологии
СТЭ может использоваться для оценки функции миокарда у больных с клапанной патологией, особый интерес представляют бессимптомные пациенты [10]. У лиц с тяжелым аортальным стенозом и нормальной фракцией выброса ЛЖ нарушение продольного стрейна пропорционально степени клапанного стеноза [51]. Снижение продольного стрейна ЛЖ ≥ –15,9 % является предиктором появления симптомов, потребности в проведении замены клапана и смерти у бессимптомных пациентов с умеренным и тяжелым аортальном стенозом [52]. У симптомных пациентов с тяжелым аортальным стенозом, являющихся кандидатами к оперативному лечению, снижение продольного стрейна служит важным прогностическим фактором, превосходящим по значимости шкалу EuroScore, анамнез ИБС, величину ФВ ЛЖ [53].
Снижение глобального продольного стрейна ЛЖ отмечается при выраженной бессимптомной аортальной недостаточности [54], умеренной или тяжелой степени митральной регургитации [55] и может быть чувствительным маркером для раннего выявления нарушения сократительной способности миокарда [56]. Незначительный прирост глобального продольного стрейна (< 2 %) при проведении стресс-ЭхоКГ у пациентов с первичной тяжелой бессимптомной митральной регургитацией может прогнозировать появление дисфункции ЛЖ после оперативного лечения [57].
Спекл-трекинг эхокардиография в оценке эффекта кардиотоксичности при лечении онкопатологии
Современные препараты для лечения онкологических заболеваний способствуют снижению смертности среди больных раком. В то же время химиотерапия может оказывать токсическое воздействие на миокард, приводящее к развитию сердечной недостаточности [2]. Для диагностики кардиотоксического эффекта противоопухолевой терапии используется эхокардиографическая оценка функции миокарда и измерение ФВ ЛЖ [58]. По данным литературы, снижение стрейна миокарда является более информативным показателем, чем ФВ ЛЖ, для раннего выявления бессимптомной систолической дисфункции, вызванной фармакологическим влиянием при лечении онкологических заболеваний [59].
В согласительном документе по применению визуализации при противоопухолевой терапии указано, что наиболее точно позволяет прогнозировать развитие кардиотоксического эффекта относительное уменьшение величины продольного стрейна > 15 % от исходной величины [58].
Выводы
В настоящее время стрейн и стрейн рейт имеют клиническое значение и применяются для оптимизации диагностики патологических состояний в обычной клинической практике с учетом определенных ограничений технологии СТЭ. Дальнейшее развитие СТЭ должно быть сосредоточено на стандартизации методологии между различными разработчиками ультразвуковых сканеров, а продолжающаяся разработка 3D-стрейна должна улучшить диагностический потенциал технологии.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Lang R.M., Badano L.R., Mor-Avi V. et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging // Eur. Heart J. Cardiovasc. Imaging. — 2015. — Vol. 16(3). — P. 233-70.
2. Ponikowski P., Voors A.A., Anker S.D. et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC // Eur. Heart J. — 2016. — Vol. 37(27). — P. 2129-200.
3. Marwick T.H., Yu C., Sun J.P. Myocardial Imaging: Tissue Doppler and Speckle Tracking // Wiley-Blackwell. — 2007. — P. 334.
4. Sugimoto T., Dulgheru R., Bernard A. et al. Echocardiographic reference ranges for normal left ventricular 2D strain: results from the EACVI NORRE study // Eur. Heart J. Cardiovasc. Imaging. — 2017. — Vol. 18(8). — P. 833-840.
5. Farsalinos K.E., Daraban A.M., Ünlü S. et al. Head-to-Head Comparison of Global Longitudinal Strain Measurements among Nine Different Vendors: The EACVI/ASE Inter-Vendor Comparison Study // J. Am. Soc. Echocardiogr. — 2015. — Vol. 28(10). — P. 1171-1181.
6. Seo Y., Ishizu T., Atsumi A. et al. Three-dimensional speckle tracking echocardiography // Circ. J. — 2014. — Vol. 78(6). — P. 1290-301.
7. Chang S.A., Lee S.C., Kim E.Y. et al. Feasibility of single-beat full-volume capture real-time three-dimensional echocardiography and auto-contouring algorithm for quantification of left ventricular volume: validation with cardiac resonance imaging // J. Am. Soc. Echocardiogr. — 2011. — Vol. 24(8). — P. 853-9.
8. Bernard A., Addetia K., Dulgheru R. et al. 3D echocardiographic reference ranges for normal left ventricular volumes and strain: results from the EACVI NORRE study // Eur. Heart J. Cardiovasc . Imaging — 2017. — Vol. 18(4). — P. 475-483.
9. Elliott P.M., Anastasakis A., Borger M.A. et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology // Eur. Heart J. — 2014. — Vol. 35. — P. 2733-79.
10. Smiseth O.A., Torp H., Opdahl A. et al. Myocardial strain imaging: how useful is it in clinical decision making? // Eur. He-art J. — 2016. — Vol. 37(15). — P. 196-207.
11. Kato T.S., Noda A., Izawa H. et al. Discrimination of nonobstructive hypertrophic cardiomyopathy from hypertensive left ventricular hypertrophy on the basis of strain rate imaging by tissue Doppler ultrasonography // Circulation. — 2004. — Vol. 110(25). — P. 3808-14.
12. Saghir M., Areces M., Makan M. Strain rate imaging differentiates hypertensive cardiac hypertrophy from physiologic cardiac hypertrophy (athlete's heart) // J. Am. Soc. Echocardiogr. — 2007. — Vol. 20(2). — P. 151-7.
13. Phelan D., Collier P., Thavendiranathan P. et al. Relative apical sparing of longitudinal strain using two-dimensional speckle-tracking echocardiography is both sensitive and specific for the diagnosis of cardiac amyloidosis // Heart. — 2012. — Vol. 98(19). — P. 1442-8.
14. Liu D., Hu K., Niemann M. et al. Effect of combined systolic and diastolic functional parameter assessment for differentiation of cardiac amyloidosis from other causes of concentric left ventricular hypertrophy // Circ. Cardiovasc. Imaging. — 2013. — Vol. 6(6). — P. 1066-72.
15. Argyle R.A., Ray S.G. Stress and strain: double trouble or useful tool? / Eur. J Echocardiogr. — 2009. — Vol. 10(6). — P. 716-22.
16. Mor-Avi V., Lang R.M., Badano L.P. et al. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics: ASE/EAE consensus statement on methodology and indications endorsed by the Japanese Society of Echocardiography // Eur. J. Echocardiogr. — 2011. — Vol. 12(3). — P. 167-205.
17. Smedsrud M.K., Sarvari S., Haugaa K.H. et al. Duration of myocardial early systolic lengthening predicts the presence of significant coronary artery disease // J. Am. Coll. of Cardiol. — 2012. — Vol. 60. — P. 1086-1093.
18. Montgomery D.E., Puthumana J.J., Fox J.M. et al. Global longitudinal strain aids the detection of non-obstructive coronary artery disease in the resting echocardiogram // Eur. Heart J. Cardiovasc. Imaging. — 2012. — Vol. 13. — P. 579-587.
19. Nucifora G., Schuijf J.D., Delgado V. et al. Incremental value of subclinical left ventricular systolic dysfunction for the identification of patients with obstructive coronary artery di–sease // Am. Heart. – 2010. — Vol. 159. — P. 148-157.
20. Choi J.O., Cho S.W., Song Y.B. et al. Longitudinal 2D strain at rest predicts the presence of left main and three vessel coronary artery disease in patients without regional wall motion abnormality // Eur. J. Echocardiogr. — 2009. — Vol. 10. — P. 695-701.
21. Liou K., Negishi K., Ho S. еt al. Detection of Obstructive Coronary Artery Disease Using Peak Systolic Global Longitudinal Strain Derived by Two-Dimensional Speckle-Tracking: A Systematic Review and Meta-Analysis // J. Am. Soc. Echocardiogr. — 2016. — Vol. 29(8). — P. 724-735.
22. Eek C., Grenne B., Brunvand H. Strain echocardiography predicts acute coronary occlusion in patients with non-ST-segment elevation acute coronary syndrome // Eur. J. Echocardiogr. — 2010. — Vol. 11(6). — P. 501-8.
23. Park Y.H., Kang S.J., Song J.K. et al. Prognostic value of longitudinal strain after primary reperfusion therapy in patients with anterior-wall acute myocardial infarction // J. Am. Soc. Echocardiogr. — 2008. — Vol. 21. — P. 262-7.
24. Hung C.L., Verma A., Uno H. et al. Longitudinal and circumferential strain rate, left ventricular remodeling, and prognosis after myocardial infarction // J. Am. Coll. Cardiol. — 2010. — Vol. 56(22). — P. 1812-1822.
25. Пархоменко А.Н., Лутай Я.М., Степура А.А. Новые возможности оценки геометрии сокращения и процессов раннего ремоделирования сердца у больных с острым инфарктом миокарда: двухмерная спекл-трекинг эхокардиография // Український кардіологічний журнал. — 2013. — № 2. — С. 31-39.
26. Vartdal T., Brunvand H., Pettersen E. Early prediction of infarct size by strain Doppler echocardiography after coronary reperfusion // J. Am. Coll. Cardiol. — 2007. — Vol. 49(16). — P. 1715-1721.
27. Kylmälä M.M., Antila M., Kivistö S.M. Can strain rate imaging predict recovery of contraction after acute myocardial infarction // Eur. J. Echocardiogr. — 2011. — Vol. 12 (5). — Р. 364-371.
28. Stanton T., Leano R., Marwick T.H. Prediction of all-cause mortality from global longitudinal speckle strain: comparison with ejection fraction and wall motion scoring // Circ. Cardiovasc. Imaging. — 2009. — Vol. 2(5). — Р. 356-364.
29. Nucifora G., Bertini M., Ajmone Marsan N. et al. Temporal evolution of left ventricular dyssynchrony after myocardial infarction: relation with changes in left ventricular systolic function // Eur. Heart J. Cardiovasc. Imaging. — 2012. — Vol. 13(12). — P. 1041-1046.
30. Haugaa K.H., Grenne B.L., Eek C.H. Strain echocardiography improves risk prediction of ventricular arrhythmias after myocardial infarction // JACC Cardiovasc. Imaging — 2013. — Vol. 6(8). — P. 841-50.
31. Mollema S.A., Liem S.S., Suffoletto M.S. et al. Left ventricular dyssynchrony acutely after myocardial infarction predicts left ventricular remodeling // J. Am. Coll. Cardiol. — 2007. — Vol. 50(16). — P. 1532-1540.
32. Hoffmann R., Lethen H., Marwick T. et al. Analysis of interinstitutional observer agreement in interpretation of dobutamine stress echocardiograms // J. Am. Coll. Cardiol. — 1996. — Vol. 27. — Р. 330-336.
33. Коваленко В.М., Несукай О.Г., Поленова Н.С. та співавт. Значення спекл-трекінг ехокардіографії в оцінці життєздатності міокарда у хворих після Q інфаркту міокарда // Український кардіологічний журнал. — 2013. — № 2. — С. 23-28.
34. Roes S.D., Mollema S.A., Lamb H.J. et al. Validation of echocardiographic two-dimensional speckle tracking longitudinal strain imaging for viability assessment in patients with chronic ischemic left ventricular dysfunction and comparison with contrast-enhanced magnetic resonance imaging // Am. J. Cardiol. — 2009. — Vol. 104(3). — P. 312-7.
35. Becker M., Hoffmann R., Kühl H.P. Analysis of myocardial deformation based on ultrasonic pixel tracking to determine transmurality in chronic myocardial infarction // Eur. Heart J. — 2006. — Vol. 27(21). — P. 2560-6.
36. Hanekom L., Jenkins C., Jeffries L. et al. Incremental value of strain rate analysis as an adjunct to wall-motion scoring for assessment of myocardial viability by dobutamine echocardiography // Circulation. — 2005. — Vol. 112. — Р. 3892-3900.
37. Cianfrocca C., Pelliccia F., Pasceri V. et al. Strain Rate Analysis and Levosimendan Improve Detection of Myocardial Viability by Dobutamine Echocardiography in Patients with Post-Infarction Left Ventricular Dysfunction: A Pilot Study // Journal of the American Society of Echocardiography. — 2009. — Vol. 21. — P. 1068-1074.
38. Lo C.I., Lai Y.H., Wu J.J. et al. Cardiac systolic mecha-nics in heart failure with preserved ejection fraction: new insights and controversies // Acta Cardiol. Sin. — 2013. — Vol. 29(6). — P. 515-23.
39. Popescu B.A., Beladan C.C., Calin A. et al. Left ventricular remodelling and torsional dynamics in dilated cardiomyopathy: reversed apical rotation as a marker of disease severity // Eur. J. Heart Fail. — 2009. — Vol. 11(10). — P. 945-51.
40. Mondillo S., Galderisi M., Mele D. et al. Echocardio-graphy Study Group of The Italian Society Of Cardiology (Rome, Italy). Speckle-tracking echocardiography: a new technique for assessing myocardial function // J. Ultrasound Med. — 2011. — Vol. 30(1). — P. 71-83.
41. Stanton T., Leano R., Marwick T.H. Prediction of all-cause mortality from global longitudinal speckle strain: comparison with ejection fraction and wall motion scoring // Circ. Cardiovasc. Imaging. — 2009. — Vol. 2(5). — P. 56-64.
42. Pieper G.M., Shah A., Harmann L. et al. Speckle-tracking 2-dimensional strain echocardiography: a new noninvasive imaging tool to evaluate acute rejection in cardiac transplantation // J. Heart Lung. Transplant. — 2010. — Vol. 29(9). — P. 1039-46.
43. Mingo-Santos S., Moñivas-Palomero V., Garcia-Lunar I. Usefulness of Two-Dimensional Strain Parameters to Diagnose Acute Rejection after Heart Transplantation // J. Am. Soc. Echocardiogr. — 2015. — Vol. 28(10). — P. 1149-56.
44. Mor-Avi V., Lang R.M., Badano L.P. et al. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics: ASE/EAE consensus statement on methodology and indications endorsed by the Japanese Society of Echocardiography // Eur. J. Echocardiogr. — 2011. — Vol. 12(3). — P. 167-205.
45. Brignole M., Auricchio A., Baron-Esquivias G. et al. 2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy: the task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA) // Europace. — 2013. — Vol. 15(8). — P. 1070-118.
46. Tanaka H., Nesser H., Buck T. et al. Dyssynchrony by speckle-tracking echocardiography and response to cardiac resynchronization therapy: results of the Speckle Tracking and Resynchronization (STAR) study // Eur. Heart J. — 2010. — Vol. 31. — P. 1690-700.
47. Lim P., Donal E., Lafitte S. et al. Multicentre study using strain delay index for predicting response to cardiac resynchronization therapy (MUSIC study) // Eur. J. Heart Failure. — 2011. — Vol. 13. — P. 981-84.
48. Pouleur A., Knappe D., Shah A. et al. Relationship between improvement in left ventricular dyssynchrony and contractile function and clinical outcome with cardiac resynchronization therapy: the MADIT-CRT trial // Eur. Heart J. — 2011. — Vol. 32. — P. 1720-29.
49. Maruo T., Seo Y., Yamada S. et al. The Speckle Tracking Imaging for the Assessment of Cardiac Resynchronization Therapy (START) study // Circ. J. — 2015. — Vol. 79(3). — P. 613-22.
50. Khan S.G., Klettas D., Kapetanakis S. et al. Clinical utility of speckle-tracking echocardiography in cardiac resynchronisation therapy // Echo Res. Pract. — 2016. — № 3(1). —
P. 1-11.
51. Lafitte S., Perlant M., Reant P. et al. Impact of impaired myocardial deformation on exercise tolerance and prognosis in patients with asymptomatic aortic stenosis // Eur. J. Echocardiogr. — 2009. — Vol. 10(3). — P. 414-9.
52. Lancellotti P., Donal E., Magne J. Risk stratification in asymptomatic moderate to severe aortic stenosis: the importance of the valvular, arterial and ventricular interplay // Heart. — 2010. — Vol. 96(17). — P. 1364-71.
53. Dahl J.S., Videbæk L., Poulsen M.K. et al. Global strain in severe aortic valve stenosis: relation to clinical outcome after aortic valve replacement // Circ. Cardiovasc. Imaging. — 2012. — Vol. 5(5). — P. 613-20.
54. Mizariene V., Bucyte S., Zaliaduonyte-Peksiene D. et al. Left ventricular mechanics in asymptomatic normotensive and hypertensive patients with aortic regurgitation // J. Am. Soc. Echocardiogr. — 2011. — Vol. 24(4). — P. 385-91.
55. Lancellotti P., Cosyns B., Zacharakis D. et al. Importance of left ventricular longitudinal function and functional reserve in patients with degenerative mitral regurgitation: assessment by two-dimensional speckle tracking // J. Am. Soc. Echocardiogr. — 2008. — Vol. 21(12). — P. 1331-6.
56. Galli E., Lancellotti P., Sengupta P.P. et al. LV mecha-nics in mitral and aortic valve diseases: value of functional assessment beyond ejection fraction // JACC Cardiovasc. Imaging. — 2014. — Vol. 7(11). — Р. 1151-66.
57. Magne J., Mahjoub H., Dulgheru R. Left ventricular contractile reserve in asymptomatic primary mitral regurgitation // Eur. Heart J. — 2014. — Vol. 35(24). — P. 1608-16.
58. Plana J.C., Galderisi M., Barac A. et al. Expert consensus for multimodality imaging evaluation of adult patients during and after cancer therapy: a report from the American Society of Echocardiography and the European Association of Cardiovascular Imaging // Eur. Heart J. Cardiovasc. Imaging — 2014. — Vol. 15(10). — P. 1063-93.
59. Pizzino F., Vizzari G., Qamar R. et al. Multimodality imaging in cardiooncology // J. Oncol. — 2015. — Vol. 2015. — P. 1-9.
60. Vrettos A., Dawson D., Grigoratos C. Correlation between global longitudinal peak systolic strain and coronary artery dise-ase severity as assessed by the angiographically derived SYNTAX score // Echo Res. Pract. — 2016. — Vol. 3(2). — P. 29-34.
61. Joyce E., Hoogslag G.E., Al Amri I. Quantitative Dobutamine Stress Echocardiography Using Speckle-Tracking Analysis versus Conventional Visual Analysis for Detection of Significant Coronary Artery Disease after ST-Segment Elevation Myocardial Infarction // J. Am. Soc. Echocardiogr. — 2015. — Vol. 28(12). — P. 1379-89.
62. Saito M., Okayama H., Yoshii T. et al. Clinical significance of global two-dimensional strain as a surrogate parameter of myocardial fibrosis and cardiac events in patients with hypertrophic cardiomyopathy // Eur. Heart J. Cardiovasc. Imaging. — 2012. — Vol. 13(7). — P. 617-23.

/34-1.jpg)
/37-1.jpg)
/35-1.jpg)
/39-1.jpg)
/36-1.jpg)