Согласно последним руководствам Американской диабетической ассоциации (ADA), Европейской ассоциации по изучению диабета (EASD) и Международной диабетической федерации (IDF), при первой линии лечения сахарного диабета 2-го типа (СД2) в качестве терапии рекомендуется назначать метформин после использования диеты и физических упражнений [1, 2]. Метформин стал одним из наиболее часто приписываемых пероральных глюкозоснижающих препаратов для первой линии лечения СД2 [3] во многих странах мира [4]. Так, в Великобритании метформин в 2013 г. был применен у 83,6 % больных СД2, а в США в 2012 г. он назначался 61,6 млн пациентов [5].
Метформин также широко применяется и в более поздний период течения СД2 в виде комбинационной терапии второй линии, то есть совместно с инсулином, препаратами сульфонилмочевины, тиазолидиндионами, агонистами глюкагоноподобного пептида-1 (ГПП-1), ингибиторами фермента дипептидилпептидазы-4 (ДПП-4) и другими, для снижения дозы инсулина и усиления действия глюкозоснижающих препаратов [6–10]. Особенно эффективно сочетание метформина с агонистами ГПП-1 и ингибиторами ДПП-4 при лечении сердечно-сосудистых осложнений при СД2 [11, 12].
Имеются также данные об использовании метформина для профилактики развития СД2. На большом клиническом материале пациентов с инсулинорезистентностью (ИР) показано, что метформин нормализует регуляцию глюкозы и препятствует превращению предиабета в клинически выраженный диабет [13–15]. Все же степень благоприятного действия метформина имеет индивидуальный характер и в определенной мере зависит от вида сопутствующих заболеваний [11, 16].
Имеющаяся информация о лечебном действии метформина при сахарном диабете 1-го типа (СД1) весьма ограниченна и противоречива. Одни авторы [17] показали, что метформин у больных СД1 способен уменьшать потребность в инсулине, снижать массу тела и уровень холестерина низкой плотности, но не улучшать гликемический конт–роль. Другие авторы [18] установили, что при терапии метформином пациентов с СД1 по программе REMOVAL-study улучшение гликемического контроля только незначительно, но наблюдается выраженное улучшение атеросклеротических и сердечно-сосудистых осложнений. По данным этих авторов, метформин также способен затормозить развитие предиабета при СД1. Вместе с тем рандомизированные клинические исследования у подростков, больных СД1, проведенные по программе ECNM study group, не обнаружили у них положительного гликемического контроля, но возникал риск возникновения желудочно-кишечных осложнений [19]. Одновременно Управление США по санитарному надзору за безопасностью продуктов питания и лекарственных средств (FDA) не рекомендует использовать метформин для лечения больных СД1 (ADA) [1].
/91-1.jpg)
История получения метформина как химически чистого соединения и использования его как лекарственного средства для лечения сахарного диабета весьма длительна. Еще в 1772 году упоминается о том, что многолетнее травянистое растение Galega officinalis (козлятник лекарственный), растущий и в Украине, содержит бигуаниды и используется в народной медицине для лечения ряда симптомов и заболеваний, в том числе диабета, и нарушения обмена веществ.
В 1878–1879 гг. был осуществлен синтез бигуанидов, а в 1888 г. получен чистый метформин. В 1929 году в эксперименте установлено, что метформин снижает уровень глюкозы у животных. В 1957 году французский ученый Jean Sterne впервые опубликовал работы, в которых сообщалось об успешном лечении метформином больных сахарным диабетом [20].
Метформин (1,1-диметилбигуанид гидрохлорид) не метаболизируется in vivo и выделяется из организма в неизменном виде с мочой в 100 % случаев и имеет 50% доступность [21]. Положительными его свойствами по сравнению с другими пероральными гипогликемическими препаратами являются хорошая толерантность и низкая стоимость [9].
Согласно последним публикациям, метформин, кроме гипогликемического эффекта, обладает и другими лечебными свойствами. Особенно большую ценность представляет его свойство оказывать благоприятное, во многом, по-видимому, самостоятельное влияние на характерные диабетассоциированные осложнения и заболевания, такие как сердечно-сосудистая патология, являющаяся причиной смертности у 80 % больных СД2 [9], а также ожирение, о чем более подробно будет сказано в дальнейшем.
Естественно, наиболее известным свойством метформина является его способность снижать уровень глюкозы в плазме крови у больных СД2, прежде всего в виде монотерапии у пациентов с впервые выявленным СД2.
До недавнего времени механизм гипогликемического эффекта метформина объяснялся его способностью уменьшать образование глюкозы печенью и ее поглощение в кишечном тракте, улучшать утилизацию глюкозы тканями, снижать уровень общего холестерина и липополисахаридов низкой плотности, а также триглицеридов. Однако в последние годы были получены новые неожиданные данные о механизме сахароснижающего действия метформина при СД2, которые требуют коррекции в существенных «классических» представлениях по этому вопросу. Так, при исследовании больных СД2, леченных метформином, было обнаружено [3, 22], что начальный первичный гипогликемический эффект метформина осуществляется не в циркуляции (плазме крови), а в двенадцатиперст–ной и тонкой кишках, в которых находятся энтероэндокринные L- и К-клетки, секретирующие инкретиновый гормон — ГПП-1, регулирующий наряду с инсулином гомеостаз глюкозы и аппетита в организме [23, 24]. Причем недавно была обнаружена значительная разница числа этих клеток и их секреции в кишечном тракте между здоровыми людьми и больными СД2 [25]. При этом следует подчеркнуть, что аккумуляция глюкозы в кишечнике после введения метформина в 300 раз выше, чем в плазме крови, в то время как накопление глюкозы в печени лишь в 10 раз больше, чем в циркулирующей крови [22].
Вместе с тем появились сообщения о более действенном гипогликемическом контроле метформина, когда его применяют совместно с препаратами агонистов ГПП-1 или ингибиторов фермента ДПП-4 у больных СД2 [26, 27]. Причем установлено, что метформин стимулирует секрецию ГПП-1 L-клетками кишечника [26]. Имеются также публикации о том, что в механизме гипогликемического действия метформина может иметь значение и микробиота (совокупность микробов в кишечнике) [28]. Причем показано, что подобные изменения бактериального состава микробиоты кишечника после применения метформина могут наблюдаться не только у больных СД2, но также и у здоровых лиц [29].
Механизм гипогликемического действия метформина на сегодняшний день представляется следующим. Так, на основании исследований, проведенных на молекулярном уровне, показано, что после приема метформина он аккумулируется в митохондриях клеток (в 1000 раз выше, чем в экстрацеллюлярной среде). Его физиологическое действие прямо или косвенно приводит к снижению продукции глюкозы в печени и повышению ее утилизации в кишечнике вследствие увеличения уровня ГПП-1. Показано, что метформин действует посредством как аденозинмонофосфатазы (АМР), активированной зависимой протеинкиназы (АМРК), так и АМРК независимого механизма, тормозя митохондриальное дыхание, подавляя митохондриальную дегидрогеназу гликофосфата и процесс, включающий лактат цитозола и лизосомы [30].
Как уже указывалось, механизм целебного эффекта метформина при СД2, согласно последним данным, не ограничивается только его гипогликемическим свойством, но и имеет более широкий спектр позитивного действия, так как метформин способен оказывать благоприятное действие и на характерные для этого заболевания жизненно важные осложнения — снижает степень ожирения, которым страдает более 70 % больных СД2 [31], нормализует ИР [13, 32], улучшает работу сердца, мозга, почек, глаз, благодаря чему продлевает жизнь больных СД2 [33]. Особенно сенсационными оказались работы, показавшие благоприятное влияние метформина на микро- и макрососудистые осложнения, включающие коронарно-сердечные, цереброваскулярные, артериальные и сердечно-ревматоидные заболевания, наиболее специфические при СД2 [4], которые в 80 % случаев являются основной причиной смерт–ности у этих больных [9].
В 1957 году в журнале Lancet были опубликованы две статьи [34, 35], в которых излагались чрезвычайно важные результаты, полученные по программе NKPD5 (проспективные исследования диабета, Великобритания), в которых впервые в литературе были представлены данные о благоприятном действии метформина на сердечно-сосудистые осложнения у больных СД2. В этих работах было установлено, что лечение метформином по сравнению с сульфонилмочевиной приводит к значительной редукции кардиоваскулярных осложнений (p < 0,01) и снижению процента смертности (p < 0,02). В последующих проспективных исследованиях, проведенных на большом клиническом материале, по программам UKPDS, SPRCAD, DPP и др., были подтверждены приведенные в журнале Lancet выводы о высоком предиктивном и лечебном действии метформина у больных с кардиоваскулярными заболеваниями по сравнению с препаратами сульфонилмочевины при одновременно более низком побочном действии метформина [7, 9, 15, 33, 36–39]. В последних публикациях по этому вопросу приводятся также данные о том, что при лечении метформином у больных СД2 наблюдается благоприятное действие на развитие сердечно-сосудистой недостаточности и возникновение инфаркта, которое сопровождается нормализацией уровня холестерина низкой плотности в плазме крови по сравнению с сульфонилмочевиной и плацебо [7, 9, 39]. Сообщается также о гипотензивном эффекте метформина при повышенном артериальном давлении [12, 39] и защитном его действии при развитии атеросклероза [40]. Положительное действие метформина, предохраняющее больного от развития депрессии, потери памяти, деменции, возникновения инсульта, описано также при сосудистых нарушениях мозга [41].
Информация о целебном действии метформина при почечной недостаточности, особенно ассоциированной с СД2, очень незначительна и неодно–значна и требует своего решения. Причем, согласно последним данным IDF, конечная стадия заболевания почек у больных СД в 10 раз выше, чем при других болезнях [4]. По имеющимся немногочисленным данным считается, что метформин безопасен и может назначаться при хронических почечных болезнях и диабетической нефропатии, но в определенной стадии их развития, при этом следует иметь в виду, что метформин в 100 % случаев выделяется почками [7, 9, 39]. Недавно было показано, что оптимально приемлемая действующая доза метформина при лечении пациентов с хронической почечной недостаточностью III и IV стадии тяжести составляет 2000 мг/сутки. Снижение такой дозы метформина для уменьшения нагрузки на почки нежелательно, так как это ведет к ухудшению гликемического контроля [42, 43].
Заслуживают также внимания появившиеся сообщения о том, что метформин оказывает защитное действие против развития новообразований как у больных СД2, так и у пожилых людей без этого заболевания [15, 41, 44].
Следовательно, метформин в отличие от других глюкозоснижающих средств одновременно с гипогликемическим свойством обладает и другими, вероятно, самостоятельными свойствами, то есть оказывает положительное воздействие на макро- и микрососудистые нарушения жизненно важных органов. Однако механизм этого действия только начал изучаться. Вместе с тем роли иммунной системы в механизме благоприятного лечебного действия метформина при СД2 посвящены только единичные публикации [55, 56]. В пользу этой гипотезы говорят многочисленные данные литературы, полученные при анализе обширного клинического материала, в которых показано, что у больных СД2 закономерно выявляются классические маркеры низкоградиентного воспаления: лейкоцитоз, нейтрофилез, моноцитоз, повышение уровня С-реактивного белка, провоспалительных цитокинов (интерлейкин (ИЛ)-1, -6, -18, фактор некроза опухоли альфа (ФНО-α)), хемокинов (CCL2, CCL4 и др.), фибриногена, селектинов и др. [46, 47]. Имеются также работы, в которых отмечается, что лейкоцитоз и повышение содержания провоспалительных цитокинов у пациентов с ИР и метаболическим синдромом являются достоверными маркерами предсказания перехода предиабета в клинически диагностируемый СД2 [49].
Субклиническое системное хроническое низкоградиентное (low-grade) воспаление характерно и для наиболее частых осложнений и сопутствующих заболеваний при СД2, то есть для ожирения [50], атеросклероза малых и больших сосудов [51–53] сердечно-сосудистых нарушений, особенно острого коронарного синдрома [36, 53, 54].
Одним из первых сообщений, непосредственно посвященных вопросу роли иммунной системы в механизме действия метформина при СД2, следует считать сообщения A.R. Cameron и др. [55, 56]. Согласно этим работам, контролируемое проспективное исследование действия метформина на ряд показателей воспаления и иммунитета больных СД2 с сердечно-сосудистыми заболеваниями по сравнению с сульфoнилмочевиной показало, что только монотерапия метформином (в течение от 8 до 12 мес.), в отличие от лечения сульфoнилмочевиной, приводила к снижению показателей воспалительного процесса, что подтверждалось достоверным уменьшением индекса ОН/Л (соотношение числа нейтрофилов с числом лимфоцитов в плазме крови).
Кстати, следует напомнить, что, согласно недавним клиническим работам [57], а также проведенному метаанализу [53], отношение количества нейтрофилов к количеству лимфоцитов (индекс ОН/Л), получившее еще название индекса риска смертности, является наиболее простым, дешевым, доступным и надежным биомаркером различных видов воспаления и их прогноза, вплоть до предсказания возможности смерти больного. Особенно важен этот индекс при оценке тяжести течения сопутствующих сердечно-сосудистых заболеваний [57].
По данным A.R. Cameron et al. [55], у больных, леченных метформином, наряду с уменьшением индекса ОН/Л одновременно отмечалось также достоверное снижение уровня провоспалительных цитокинов (ИЛ-1β, ИЛ-6 и хемокинов CXCL1/2) в плазме крови, что сопровождалось улучшением тяжести клинического состояния больных. В опытах на животных было также обнаружено, что метформин подавляет секрецию ФНО-α посредством торможения активности ингибитора каппа В-киназы с последующим сложным механизмом изменения дифференциации М1/М2-макрофагов. Но так как противовоспалительный эффект метформина обнаруживается и у больных с сердечно-сосудистыми заболеваниями без сахарного диабета, то авторы приходят к заключению, что противовоспалительное свойство метформина является самостоятельным, в значительной мере независимым от гипогликемического действия этого препарата.
Собственные исследования [58], направленные на выяснение роли иммунной системы в механизме лечебного действия метформина при СД2, были проведены на больных с впервые выявленным заболеванием. Метформин (в дозе 2000 мг/сутки) был применен в течение 3 мес. Обследованию подверглись следующие показатели иммунитета: 1) лейкоцитарный состав крови; 2) иммунофенотип лимфоцитов (CD3+T-, CD4+T–-, CD8+T-, CD20+- и CD56+-клетки) в периферической крови (ПК); 3) уровень цитокинов (ИЛ-1β, -2, -10 и ФНО-α) в сыворотке крови.
Проведенные нами исследования, как видно из рис. 1, показали, что в результате монотерапии метформином у больных с впервые выявленным СД2 происходит выраженная нормализация абсолютного числа нейтрофилов, закономерно повышенных у нелеченых больных СД2 (3,61 ± 0,18 × 109/л против 4,88 ± 0,23 × 109/л; p < 0,001), то есть оно становится близким к абсолютному содержанию этих видов лейкоцитов у здоровых лиц (3,43 ± 0,19 × 109/л). Вследствие этого происходит достоверное снижение индекса ОН/Л (с 2,06 ± 0,19 × 109/л против 3,19 ± 0,26 × 109/л; р < 0,05), который, как нами уже упоминалось ранее, является достоверным маркером воспалительного процесса [53, 57].
/93-1.jpg)
Одновременно с нормализацией числа нейтрофилов в ПК и индекса ОН/Л у больных, леченных метформином, нами также наблюдалось снижение числа моноцитов, то есть предшественников макрофагов, содержание которых при СД2, особенно у лиц с повышенным индексом массы тела (ИМТ), увеличено [32, 46]. В то же время макрофаги считаются основными продуцентами ФНО-α [14], что согласуется со снижением данного цитокина у этих больных после приема метформина, как будет видно из дальнейшего изложения [58].
В результате терапии метформином у большинства обследуемых нами больных происходило также достоверное снижение относительного (p < 0,05) и абсолютного (p < 0,05) содержания CD4+Т-клеток, которое приближалось к величинам, близким к таковым лиц контрольной группы. Достоверно снижалось и абсолютное количество CD3+Т-клеток в плазме крови.
Абсолютное количество естественных клеток-киллеров (CD56+-лимфоцитов) в ПК у многих больных, леченных метформином, было увеличенным, что наводит на мысль о повышении естественного иммунитета у пациентов после такой терапии.
Довольно демонстративными оказались данные [58], полученные при исследовании содержания провоспалительных цитокинов (ИЛ1-β и ФНО-α) в ПК пациентов, принимавших метформин. Из рис. 2А и Б видно, что у большинства больных СД2 до лечения их метформином по сравнению с группой здоровых лиц наблюдалось достоверное повышение уровня как ИЛ1-β, так и ФНО-α в плазме крови. Так, содержание ИЛ1-β было увеличено у 8 из 11 нелеченых больных СД2 (медиана содержания — 1,8 пг/мл против 0 пг/мл в контроле; p < 0,05) и ФНО-α — у 7 из 11 пациентов (медиана — 2,7 пг/мл против 0 пг/мл в контроле; p < 0,05), что согласуется с нашими предыдущими результатами [58] и данными литературы [59, 60].
После терапии метформином у большинства обследуемых пациентов происходила выраженная нормализация содержания как ИЛ1-β, так и ФНО-α в плазме крови. Медиана содержания ИЛ1-β, как видно из рис. 2А и Б, снижается с 1,8 пг/мл до 0 пг/мл (p < 0,05), а ФНО-α — с 2,7 пг/мл также до 0 пг/мл (p < 0,05).
Содержание иммунорегуляторного цитокина ИЛ-2 (рис. 2В) в плазме крови нелеченых больных СД2 было достоверно снижено по сравнению с группой здоровых лиц, однако после терапии метформином восстановление содержания наблюдалось только у 3 из 11 пациентов.
Содержание иммунорегуляторного цитокина ИЛ-10, обладающего, как известно, мощным иммуносупрессивным и антивоспалительным действием [61], не имело достоверных изменений ни в группе нелеченых больных СД2 по сравнению со здоровыми лицами, ни у больных СД2 до и после их лечения метформином (рис. 2Г). Вместе с тем следует отметить, что у 3 из 10 леченых больных отмечался более высокий уровень ИЛ-10 в сыворотке крови, причем у двух из них одновременно наблюдалось и наиболее значительное снижение ИМТ.
Предполагают также, что одновременно с приведенными выше существуют и другие пути положительного действия метформина на иммунную систему больных СД2, в частности, осуществляемые посредством его воздействия на моноциты/макрофаги [62, 63]. Как известно, с одной стороны, макрофаги являются мощными продуцентами провос–палительных цитокинов, особенно ФНО-α [46], а с другой стороны — макрофаги участвуют в регуляции эндотелия сосудов, который значительно поражен у больных СД2, особенно осложненного атеросклерозом и коронарно-сосудистыми нарушениями [33, 64, 65]. В подтверждение этого имеется информация о том, что у больных СД2, леченных метформином, наблюдается снижение количества молекул адгезии (ICAM, ICAM-2, ICAM-1) в плазме крови, которые принимают участие в прилипании нейтрофилов и моноцитов/макрофагов к эндотелию сосудистой стенки и их миграции через нее, а также повышают концентрацию tPA, способствующего фибринолизу и считающегося одним из маркеров низкоградиент–ного воспаления [36].
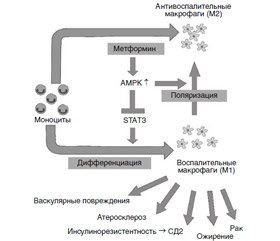
На молекулярном уровне (рис. 3) было установлено [63, 66], что противовоспалительный механизм действия метформина при СД2 осуществляется также посредством его взаимодействия с активатором моноцитарной протеиназы (АМРК) — сигнального трансдуктора и активатора транскрипции 3 (STAT3), которая играет кардинальную роль в дифференциации моноцитов в макрофаги, что проявляется в нейтрализации провос–палительных цитокинов.
Выводы
Представленный анализ литературы и результаты собственных исследований дают основание считать, что в механизме благоприятного лечебного действия метформина у больных СД2 существенную роль играет не только антигипергликемический эффект метформина, но и его воздействие на другие мишени, в частности, иммунообусловленный воспалительный процесс, присущий этому заболеванию и его осложнениям. Монотерапия метформином у больных с впервые диагностированным СД2 приводит к нормализации индекса ОН/Л, то есть биомаркера риска смертности, иммунофенотипа лимфоцитов (преимущественно субпопуляции CD4+Т-лимфоцитов), а также к снижению уровня провоспалительных цитокинов (ИЛ-1β, ИЛ-6 и ФНО-α) и ряда хемокинов (CXCL-1, CXCL-2) в плазме крови. Полученные данные наводят также на мысль, что антивоспалительный эффект метформина во многом независим от его гипогликемического действия, так как он проявляется и у больных без диабета.
Существующие работы, с одной стороны, подтверждают современную гипотезу о том, что СД2 является специфическим воспалительным заболеванием, а с другой стороны, что лечебное действие метформина во многом осуществляется посредством его воздействия на иммунную систему, приводя к нормализации ее регуляторных механизмов и ослаблению низкоградиентного воспаления. Дальнейшее более глубокое изучение роли иммунной системы в механизме действия метформина при СД2 имеет ключевое значение для более направленного научно обоснованного применения данного препарата в терапии различных подвидов этого заболевания и его осложнений.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Cefalu W.T. Metformin should remain the foundation therapy for type 2 diabetes // Diabetes Care. — 2017. — Vol. 40, № 8. — P. 1128-1132.
2. American Diabetes Association. Pharmacologic approa–ches to glycemic treatment: Standards of medical care in diabetes — 2018 // Diabetes Care. — 2018. — Vol. 41(Suppl. 1). — P. S73-S85.
3. Sang R. Mechanism of metformin: a tale of two sites // Diabetes Care. — 2016. — Vol. 39, № 2. — P. 187-189.
4. IDF Diabetes Atlas. 8th Edition. — 2017.
5. Marshall S.M. 60 years of metformin use: a glance at the past and a look to the future // Diabetologia. — 2017. — Vol. 60, № 9. — P. 1561-1565.
6. Livingstone R., Boyle J.G., Petrie J.R.; REMOVAL Study Team. A new perspective on metformin therapy in type 1 diabetes // Diabetologia. — 2017. — Vol. 60, № 9. — P. 1594-1600.
7. Sanchez-Rangel E., Inzucchi S.E. Metformin: clinical use in type 2 diabetes // Diabetologia. — 2017. — Vol. 60, № 9. — P. 1586-1593.
8. Abdul-Ghani M., Migahid O., Megahed A. et al. Combination therapy with exenatide plus pioglitazone versus basal/bolus insulin in patients with poorly controlled type 2 diabetes on sulfonylurea plus metformin: the Qatar Study // Diabetes Care. — 2017. — Vol. 40, № 3. — P. 325-331.
9. Inzucchi S.E. Is it time to change the type 2 diabetes treatment paradigm? No! Metformin should remain the foundation therapy for type 2 diabetes // Diabetes Care. — 2017. — Vol. 40, № 8. — P. 1128-1132.
10. Lu L.-H., Chung C.-H., Lee C.-H. et al. Combination COX-2 inhibitor and metformin attenuate rate of joint replacement in osteoarthritis with diabetes: A nationwide, retrospective, matched-cohort study in Taiwan // PLoS One. — 2018. — Vol. 13, № 1. — P. e0191242.
11. Crowley M.J., Williams J.W. Jr, Kosinski A.S. et al. Metformin use may moderate the effect of DPP-4 inhibitors on cardiovascular outcomes // Diabetes Care. — 2017. — Vol. 40, № 12. — P. 1787-1789.
12. Wu T., Trahair L.G., Little T.J. et al. Effects of vildagliptin and metformin on blood pressure and heart rate responses to small intestinal glucose in type 2 diabetes // Diabetes Care. — 2017. — Vol. 40, № 5. — P. 702-705.
13. Luo T., Nocon A., Fry J. et al. AMPK activation by metformin suppresses abnormal extracellular matrix remodeling in adipose tissue and ameliorates insulin resistance in obesity // Diabetes. — 2016. — Vol. 65, № 8. — P. 2295-2310.
14. Tseng E., Yeh H.C., Maruthur N.M. Metformin use in prediabetes among U.S. adults, 2005–2012 // Diabetes Care. — 2017. — Vol. 40, № 7. — P. 887-893.
15. Aroda V.R., Knowler W.C., Crandall J.P. et al. Metformin for diabetes prevention: insights gained from the Diabetes Prevention Program/Diabetes Prevention Program Outcomes Study // Diabetologia. — 2017. — Vol. 60, № 9. — P. 1601-1611.
16. Herman W.H., Pan Q., Edelstein S.L. et al. Impact of lifestyle and metformin interventions on the risk of progression to diabetes and regression to normal glucose regulation in overweight or obese people with impaired glucose regulation // Diabetes Care. — 2017. — Vol. 40, № 12. — P. 1668-1677.
17. Vella S., Buetow L., Royle P. et al. The use of metformin in type 1 diabetes: a systematic review of efficacy // Diabetologia. — 2010. — Vol. 53, № 5. — P. 809-820.
18. Petrie J.R., Chaturvedi N., Ford I. et al. Cardiovascular and metabolic effects of metformin in patients with type 1 diabetes (REMOVAL): a double-blind, randomised, placebo-controlled trial // Lancet Diabetes Endocrinol. — 2017. — Vol. 5, № 8. — P. 597-609.
19. Libman I.M., Miller K.M., DiMeglio L.A. et al. Effect of metformin added to insulin on glycemic control among overweight/obese adolescents with type 1 diabetes: a randomized clinical –trial // JAMA. — 2015. — Vol. 314, № 21. — P. 2241-2250.
20. Bailey C.J. Metformin: historical overview // Diabetologia. — 2017. — Vol. 60, № 9. — P. 1566-1576.
21. Graham G.G., Punt J., Arora M. et al. Clinical pharmacokinetics of metformin // Clin. Pharmacokinet. — 2011. — Vol. 50, № 2. — P. 81-98.
22. Buse J.B., DeFronzo R.A., Rosenstock J. et al. The primary glucose-lowering effect of metformin resides in the gut, not the circulation: results from short-term pharmacokinetic and 12-week dose-ranging studies // Diabetes Care. — 2016. — Vol. 39, № 2. — P. 198-205.
23. Орленко В.Л., Зак К.П. Лечение аналогами глюкагоноподобного пептида-1 — прорыв в терапии сахарного диабета 2-го типа // Международный эндокринологический журнал. — 2014. — № 4(60). — С. 112-117.
24. Konopka A.R., Esponda R.R., Robinson M.M. et al. Hyperglucagonemia mitigates the effect of metformin on glucose production in prediabetes // Cell Rep. — 2016. — Vol. 15, № 7. — P. 1394-1400.
25. Jorsal T., Rhee N.A., Pedersen J. et al. Enteroendocrine K and L cells in healthy and type 2 diabetic individuals // Diabetologia. — 2018. — Vol. 61, № 2. — P. 284-294.
26. Mulherin A.J., Oh A.H., Kim H. et al. Mechanisms underlying metformin-induced secretion of glucagon-like peptide-1 from the intestinal L cell // Endocrinology. — 2011. — Vol. 152, № 12. — P. 4610-4619.
27. Nauck M., Rizzo M., Johnson A. et al. Once-daily liraglutide versus lixisenatide as add-on to metformin in type 2 diabetes: A 26-week randomized controlled clinical trial // Diabetes Care. — 2016. — Vol. 39, № 9. — P. 1501-1509.
28. De la Cuesta-Zuluaga J., Mueller N.T., Corrales-Agudelo V. et al. Metformin is associated with higher relative abundance of mucin-degrading akkermansia muciniphila and several short-chain fatty acid-producing microbiota in the gut // Diabetes Care. — 2017. — Vol. 40, № 1. — P. 54-62.
29. Nielsen T., Bryrup T., Thomsen C.W. et al. The effect of metformin on a healthy human gut microbiota // Diabetologia. — 2017. — Vol. 60(Suppl. 1). — P. 241.
30. Rena G., Hardie D.G., Pearson E.R. The mechanisms of action of metformin // Diabetologia. — 2017. — Vol. 60, № 9. — P. 1577-1585.
31. Kumar S., Wilson B., Watson L., Alsop J. Obesity is associated with poorer clinical outcomes following insulin initiation for patients with type 2 diabetes // Diabetologia. — 2009. — Vol. 52(Suppl. 1).
32. Саенко Я.А., Зак К.П., Попова В.В., Семионова Т.А. Лейкоцитарный состав и иммунофенотип лимфоцитов крови у женщин, больных сахарным диабетом 2-го типа, с ожирением // Міжнародний ендокринологічний журнал. — 2016. — № 5. — С. 13-19.
33. Lamanna C., Monami M., Marchionni N., Mannucci E. Effect of metformin on cardiovascular events and mortality: a meta-analysis of randomized clinical trials // Diabetes Obes. Metab. — 2011. — Vol. 13, № 3. — P. 221-228.
34. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). UK Prospective Diabetes Study (UKPDS) Group // Lancet. — 1998. — Vol. 352, № 9131. — P. 837-853.
35. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). UK Prospective Diabetes Study (UKPDS) Group // Lancet. — 1998. — Vol. 352, № 9131. — P. 854-865.
36. Kooy A., de Jager J., Wulffele M.G. et al. Long-term effect of metformin on endothelial function and inflammation in type 2 diabetes treated with insulin: a randomized, placebo-controlled trial // Diabetologia. — 2009. — Vol. 52(Suppl. 1). — A-861.
37. Hong J., Zhang Y., Lai S. et al. Effects of metformin versus glipizide on cardiovascular outcomes in patients with type 2 diabetes and coronary artery disease // Diabetes Care. — 2013. — Vol. 36, № 5. — P. 1304-1311.
38. Claesen M., Gillard P., De Smet F. et al. Mortality in individuals treated with glucose-lowering agents: a large, controlled cohort study // J. Clin. Endocrinol. Metab. — 2016. — Vol. 101, № 2. — P. 461-469.
39. Anabtawi A., Miles J.M. Metformin: nonglycemic effects and potential novel indications // Endocr. Pract. — 2016. — Vol. 22, № 8. — P. 999-1007.
40. Wang Q., Zhang M., Torres G. et al. Metformin suppresses diabetes-accelerated atherosclerosis via the inhibition of Drp1-mediated mitochondrial fission // Diabetes. — 2017. — Vol. 66. — P. 193-205.
41. Valencia W.M., Palacio A., Tamariz L., Florez H. Metformin and ageing: improving ageing outcomes beyond glycaemic control // Diabetologia. — 2017. — Vol. 60, № 9. — P. 1630-1638.
42. Bakris G., Taylor A., Walsh B. et al. Metformin exposure with gut-restricted delayed-release metformin in CKD stage 4 does not exceed that of current metformin used on-label: results from population PK modelling // Diabetologia. — 2017. — Vol. 60(Suppl. 1). — P. 244.
43. Fineman M., Frias J., Bakris G. et al. Delayed-release metformin targeting the lower bowel elicits sustained improvements in HbA1c and fasting glucose with minimal systemic exposure // Diabetologia. — 2017. — Vol. 60(Suppl. 1). — P. 243.
44. Pernicova I., Korbonits M. Metformin — mode of action and clinical implications for diabetes and cancer // Nat. Rev. Endocrinol. — 2014. — Vol. 10, № 3. — P. 143-156.
45. Fernandez-Real J.-M., Pickup J.C. Innate immunity, insulin resistance and type 2 diabetes // Diabetologia. — 2012. — Vol. 55, № 2. — P. 273-278.
46. Зак К.П., Тронько Н.Д., Попова В.В., Бутенко А.К. Сахарный диабет. Иммунитет. Цитокины. — К.: Книга плюс, 2015. — 485 с.
47. Donath M.Y. Multiple benefits of targeting inflammation in the treatment of type 2 diabetes // Diabetologia. — 2016. — Vol. 59, № 4. — P. 679-682.
48. Donath M.Y. Targeting inflammation in the treatment of type 2 diabetes: time to start // Nature Reviews Drug Discovery. — 2014. — Vol. 13. — P. 465-476.
49. Ford E.S. Leukocyte count, erythrocyte sedimentation rate, and diabetes incidence in a national samples of US adults // Am. J. Epidemiol. — 2002. — Vol. 155, № 1. — P. 57-64.
50. Тронько Н.Д., Зак К.П. Ожирение и сахарный диабет // Лікарська справа. — 2013. — № 8. — С. 3-21.
51. Ross R. Atherosclerosis — an inflammatory disease // N. Engl. J. Med. — 1999. — Vol. 340, № 2. — P. 115-126.
52. Libby P., Ridker P.M., Hansson G.K. Inflammation in atherosclerosis: from pathophysiology to practice // J. Am. Coll. Cardiol. — 2009. — Vol. 54, № 23. — P. 2129-2138.
53. Armstrong E.J., Morrow D.A., Sabatine M.S. Inflammatory biomarkers in acute coronary syndromes: part I: introduction and cytokines // Circulation. — 2006. — Vol. 113, № 6. — P. e72-75.
54. Wang X., Zhang G., Jiang X. et al. Neutrophil to lymphocyte ratio in relation to risk of all-cause mortality and cardiovascular events among patients undergoing angiography or cardiac revascularization: a meta-analysis of observational studies. — Atherosclerosis. — 2014. — Vol. 234, № 1. — P. 206-213.
55. Cameron A.R., Morrison V., McNeilly A.D. et al. The anti-inflammatory role of metformin // Diabetes. — 2015. — Vol. 64(Suppl. 1). — P. 1822 (A471).
56. Cameron A.R., Morrison V.L., Levin D. et al. Anti-inflammatory effects of metformin irrespective of diabetes status // Circ. Res. — 2016. — Vol. 119, № 5. — P. 652-665.
57. Arbel Y., Finkelstein A., Halkin A. et al. Neutrophil/lymphocyte ratio is related to the severity of coronary artery di–sease and clinical outcome in patients undergoing angiography // –Atherosclerosis. — 2012. — Vol. 225, № 2. — P. 456-460.
58. Zak K.P., Orlenko V.L., Popova V.V. et al. The role of the immune system in mechanism of metformin therapeutic effect in patients with type 2 diabetes // Mezhdunarodnyi Endokrinologicheskii Zhurnal. — 2017. — Vol. 13, № 5. — P. 340-346.
59. Dinarello C.A. Interleukin-1 in the pathogenesis and treatment of inflammatory diseases // Blood. — 2011. — Vol. 117, № 14. — P. 3720-3732.
60. Donath M.Y. Multiple benefits of targeting inflammation in the treatment of type 2 diabetes // Diabetologia. — 2016. — Vol. 59, № 4. — P. 679-682.
61. Heuts F., Edner N.M., Walker L.S.K. Follicular T helper cells: a new marker of type 1 diabetes risk? // Diabetes. — 2017. — Vol. 66, № 2. — P. 258-260.
62. Coppola A., Caputo M.P., Pastore D. et al. Metformin inhibits leptin release induced by HMGB1 and exerts an anti-inflammatory action reducing TLR4/2 expression in T2D subjects // Diabetes. — 2015. — Vol. 64(Suppl. 1). — P. 1830 (A473).
63. Hattori Y., Hattori K., Hayashi T. Pleiotropic benefits of metformin: macrophage targeting its anti-inflammatory mechanisms // Diabetes. — 2015. — Vol. 64, № 6. — P. 1907-1909.
64. Hong J., Zhang Y., Lai S. et al. Effects of metformin versus glipizide on cardiovascular outcomes in patients with type 2 diabetes and coronary artery disease // Diabetes Care. — 2013. — Vol. 36, № 5. — P. 1304-1311.
65. Griffin S.J., Leaver J.K., Irving G.J. Impact of metformin on cardiovascular disease: a meta-analysis of randomised trials among people with type 2 diabetes // Diabetologia. — 2017. — Vol. 60, № 9. — P. 1620-1629.
66. Vasamsetti S.B., Karnewar S., Kanugula A.K. et al. Metformin inhibits monocyte-to-macrophage differentiation via AMPK-mediated inhibition of STAT3 activation: potential role in atherosclerosis // Diabetes. — 2015. — Vol. 64, № 6. — P. 2028-2041.

/91-1.jpg)
/93-1.jpg)
/94-1.jpg)
/95-1.jpg)