Введение
Нестабильность внутриполитической жизни многих государств, нарастание числа вооруженных конфликтов с масштабным применением различных боеприпасов, сложная криминогенная обстановка, большое количество террористических актов, многочисленные природные катаклизмы, рост числа техногенных катастроф, качественное изменение структуры травматизма с увеличением доли множественной, сочетанной и комбинированной патологии сделали актуальным изучение боевых повреждений [3]. Около 50 % раненых получают легкие ранения. В структуре санитарных потерь ранения мягких тканей конечностей составляют 30–35 % [1]. В структуре боевой хирургической травмы легкораненые составляют 60–70 %, по локализации преобладают повреждения конечностей — 80 %, ранения мягких тканей головы составляют до 10 %, прочие ранения — 10 % [2].
Главной задачей при оказании специализированной хирургической помощи этому контингенту пострадавших является своевременное распознавание, удаление инородных тел и восстановление анатомо-функциональной целостности тканей [1, 2]. Своеобразие вариантов клинического течения, разногласия в вопросах репарации соединительной ткани при минно-взрывной и огнестрельной травме диктуют необходимость более глубокого изучения данной проблемы.
Основными компонентами регенераторного процесса являются клеточная пролиферация, дифференцировка, миграция клеток воспаления, а также реструктуризация стромы и ангиогенез. Важнейшими участниками реализации этой генетической программы названы факторы роста, коллагены различного типа, индукторы созревания грануляционной ткани. Среди них существенным влиянием обладает трансформирующий фактор роста (TGF-β1), вырабатываемый нейтрофилами, макрофагами, эндотелиальными клетками. Этот белок в тканях стимулирует дегрануляцию нейтрофилов, синтез бактерицидных факторов, привлечение моноцитов и макрофагов в очаг альтерации [7, 9]. На завершающих этапах репарации TGF-β1 способствует ангио–генезу, пролиферации фибробластов, синтезу ими соединительной ткани с трансформацией разных типов коллагена [4], чем обеспечивает иммунный гомеостаз.
Коллаген IV типа секретируется эндотелиальными, мышечными, нервными, жировыми клетками и является ключевым структурным компонентом базальных мембран. Накопление его в межклеточном матриксе считается патологическим и ведет к изменению тинкториальных свойств соединительной ткани [5, 6].
Эндотелиальные клетки продуцируют как трансформирующий фактор роста, так и коллаген IV типа, обеспечивают таким образом баланс между выполняемыми им разнонаправленными функциями: выработкой про- и противовоспалительных факторов, вазодилатирующих и вазоконстрикторных веществ, про- и антиагрегантов, про- и антикоагулянтов, про- и антифибринолитиков, факторов пролиферации и ингибиторов роста. Дисфункция сосудистых клеток нарушает этот баланс и предрасполагает сосуды к вазоконстрикции, адгезии лейкоцитов, активации тромбоцитов, митогенезу, воспалению [8, 12]. Поэтому функциональное состояние эндотелия в стенках сосудов, а также особенности васкуляризации структур созревающей соединительной ткани при огнестрельных ранениях также являются показателями качества процессов репарации [10, 11].
Цель работы — проанализировать данные иммуногистохимического исследования мягких тканей после огнестрельного ранения с наличием инородного тела в разные сроки после ранения.
Материалы и методы
Материалом для исследования были мягкие ткани, удаленные у 36 раненых хирургическим путем вместе с инкапсулированным инородным телом огнестрельного происхождения в период от 2 месяцев до 23 лет после ранения. Удаленные частицы ткани представлены фиброзной, жировой и мышечной тканью, местами с четко сформированной капсулой.
Для детализации морфологических изменений применяли иммуногистохимический метод. Экспрессию трансформирующего фактора роста, как маркера хронизации воспалительного процесса в раневом канале, определяли с использованием кроличьих поликлональных антител (ПКАТ) к –TGF-β1(V) Antibody (Thermo scientific, Германия), Rady-to-Use. Тенденцию к образованию патологического типа коллагена для изучения «зрелости» грануляционной ткани в исследуемых образцах определяли с помощью мышиных моноклональных антител (МКАТ) к Collagen IV (CIV22) фирмы DAKO (Дания), Rady-to-Use. Особенности васкуляризации в тканях изучались по экспрессии маркера эндотелиальных клеток (CD31 JC 70A) Rady-to-Use (МКАТ, фирма DAKO).
Материал для исследования методами иммуногистохимии фиксировался в 10% растворе нейтрального формалина, забуференном фосфатным буфером. Затем материал подвергался стандартной проводке по этанолам возрастающей концентрации, хлороформу, после чего заливался парафином. Из приготовленных парафиновых блоков изготавливались серийные срезы толщиной 3–4 мкм, которые наносили на высокоадгезивные стекла Super Frost и высушивали при температуре 37 °С в течение 18 часов. Демаскирующая термическая обработка была выполнена по методу кипячения срезов в цитратном буфере (рН 6,0). Для визуализации первичных антител применялась система детекции UltraVision Quanto Detection Systems HRP Polymer (Thermo scientific). В качестве хромогена использовался DAB (диаминобензидин).
Для оценки иммуногистохимической метки использовали качественную шкалу: позитивная или негативная реакция определялась по наличию или отсутствию коричневого окрашивания тканевых и клеточных структур.
Комплекс иммуноморфологических исследований проводился на микроскопе Primo Star (Carl Zeiss) с использованием программы AxioCam (ERc 5s).
Результаты и обсуждение
Через 2 мес. после ранения у пациентов в фиброзной капсуле регистрируются воспалительные очаги и свежие геморрагии с гемосидерофагами. В геморрагических очагах отмечаются расширенные полнокровные сосуды. В сосудах нарушена структура эндотелия с отсутствием его на отдельных участках по периметру поперечного и продольного среза (рис. 1).
Экспрессия TGF-β1 в тканевых фрагментах ярко выражена, что, вероятно, связано с наличием зон вторичной альтерации (рис. 2).
Микроскопически раневой канал заполнен склерозированной соединительной тканью с капиллярами, лишенными эндотелиальной выстилки (рис. 3).
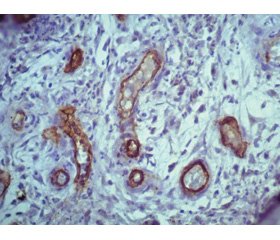
Общая фиброзная капсула вокруг инородного тела неоднородна. В местах отсутствия копоти фиброзная капсула васкуляризирована множеством капилляров с пролиферирующим многорядным эндотелием (рис. 4).
Реакция с TGF-β1 и Сollagen IV в 1/3 раневого канала показывает слабое неравномерное окрашивание, что свидетельствует об отсутствии формирования зрелой соединительной ткани в этих зонах капсулы (рис. 5).
Обнаруживалось интенсивное окрашивание этих участков капсулы с использованием МКАТ к TGF-β1 и Collagen IV (рис. 6). Распределение хромогена было неравномерным, глыбчатым.
Через 6 месяцев после ранения выявлена четкая демаркация очага поражения зрелой соединительной тканью и формирование фиброзной капсулы. Фиброзная ткань незрелая, о чем свидетельствует пикринофилия коллагеновых волокон и диффузное окрашивание при реакции с TGF (рис. 7).
Через 10 мес. после ранения процессы организации поврежденных тканей еще не стабилизированы. Фиброзная капсула вокруг инородного тела недостаточно зрелая, с большим количеством фибробластов, сосудов капиллярного типа и наличием гигантоклеточных гранулем хронического продуктивного воспаления с примесью нейтрофильных гранулоцитов, умеренного количества лимфоидного типа клеток, плазмоцитов, макрофагов (рис. 8).
Как в жировой, так и в незрелой соединительной ткани, особенно в стенках капилляров и артериол, выявляется избыточное накопление патологического коллагена IV типа (рис. 9).
При реакции с ПКАТ к TGF-β1 выявляется порозность, неравномерность окрашивания тканей разной степени созревания (рис. 10).
Через 1 год удалено инородное тело с капсулой из подкожной клетчатки. Окрашивание гиалинизированной капсулы с МКАТ к Collagen IV и TGF-β1 показывает слабую очаговую экспрессию этих антител (рис. 11).
Через 2 года процессы заживления не завершены. В фиброзной капсуле выявлены скопления миоцитов в состоянии мумификации с однородной гомогенизированной структурой цитоплазмы. Ткань капсулы неравномерно плотная, образована однонаправленными пучками гиалинизированных коллагеновых волокон и их шаровидными завихрениями, потерявшими волокнистую структуру с неравномерной очаговой экспрессией Collagen IV и TGF-β1. В некоторых мелких раневых фрагментах на фоне пылевидной копоти выявлены щелевидные капилляры, частично лишенные эндотелия, фибробласты и фиброциты, пролиферация которых более выражена в наружных отделах капсулы (рис. 12).
Через 23 года после ранения в мягких тканях все еще сохранялись альтернативные изменения наряду с организацией некротических очагов (рис. 13).
Выводы
1. Накопление коллагена IV типа и незначительное содержание трансформирующего фактора роста в сроки от 2 мес. до 23 лет подтверждает несостоятельность процессов регенерации в фиброзных структурах капсулы и свидетельствует о своеобразной дисплазии соединительной ткани, которая наряду с вторичными альтернативными процессами препятствует качественному рубцеванию раневого канала.
2. Наличие инородного тела в мягких тканях является причиной инкапсуляции очага поражения и незавершенной регенерации мышечной и жировой ткани.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Вказівки з воєнно-польової хірургії / За ред. Я.Л. Заруцького, А.А. Шудрака. — К.: СПД Чалчинська Н.В., 2014. — 396 с.
2. Военно-полевая хирургия: учебник. — 2-е изд., доп. / Под ред Е.К. Гуманенко. — М.: ГЭОТАР-Медиа, 2016. — 768 с.
3. Патологическая анатомия боевых поражений и их осложнений / Под ред. С.А. Повзуна, Н.Д. Клочкова, М.В. Рогачева. — СПб.: ВМедА, 2002. — 179 с.
4. Туманский В.А. Тяжелый фиброз поджелудочной железы при хроническом панкреатите: основные патоморфологические составляющие, иммунофенотип фиброгенных клеток и коллагена / В.А. Туманский, И.С. Коваленко // Патология. — 2013. — № 1 (27). — С. 27-30.
5. Abreu-Velez A.M. et al. Collagen IV in Normal Skin and in Pathological Processes // N. Am. J. Med. Sci. — 2012. — 4. — 1-8.
6. Feru J., Delobbe E., Ramont L., Brassart B., Terryn C., Dupont-Deshorgue A., Garbar C., Monboisse J.-C., Maquart F.-X., Brassart-Pasco S. Aging decreases collagen IV expression in vivo in the dermo-epidermal junction and in vitro in dermal fibroblasts: possible involvement of TGF-β1 // European Journal of Dermatology. — 2016. — 26 (4). — 350-360.
7. Han G., Li F., Singh T.P., Wolf P., Wang X.J. The Pro-inflammatory Role of TGFβ1: A Paradox? // Int. J. Biol. Sci. — 2012. — 8 (2). — 228-235.
8. Hvingel B., Lieng M., Roald B., Оrbo A. Vascular markers CD31, CD34, actin, VEGFB, and VEGFR2, are prognostic markers for malignant development in benign endometrial polyps // Open Journal of Obstetrics and Gyneco–logy. — 2012. — 2. — 18-26.
9. Klingberg F., Chow M. ., Koehler A., Boo S., Buscemi L., M.Quinn T., Costell M., Alman B.A., Genot E., Hinz B. Prestress in the extracellular matrix sensitizes latent TGF-β1 for activation // JCB Archive. — 2014. — 207 (2). — 283-297.
10. Liu L., Shi G.-P. CD31: beyond a marker for endothelial cells // Cardiovasc. Res. — 2012. — 94 (1). — 30-37.
11. Tepekoylu C., Wang F.-Sh., Kozaryn R., Albrecht-Schgoer K., Theurl M., Schaden W., Ke H.-J., Yang Y., Kirchmair R., Grimm M., Wang Ch.-J., Holfeld J. Shock wave treatment induces angiogenesis and mobilizes endo–genous CD31/CD34-positive endothelial cells in a hindlimb ischemia model: Implications for angiogenesis and vasculogenesis // The Journal of Thoracic and Cardiovascular Surgery. — 2013. — 146 (4). — 971-978.
12. Wai Yin Leung, Matthew B. Jensen Histological Quantification of Angiogenesis after Focal Cerebral Infarction: A Systematic Review Neurology Volume 2013 (2013), Article ID 853737, 5 pages http://dx.doi.org/10.1155/2013/853737.

/49-1.jpg)
/49-2.jpg)
/50-1.jpg)
/51-1.jpg)