Синдром Дауна — найчастіша хромосомна аномалія у новонароджених, частота виявлення якої коливається від 1 : 600 до 1 : 900 немовлят [1]. Характерною особливістю хвороби вважається затримка психічного розвитку, мальформації серцево-судинної та травної системи. Часто мають місце автоімунні феномени, гіпотиреоз, целіакія, а також гострий лімфобластний лейкоз і мієлопроліферативні захворювання.
Клінічне спостереження дитини А., 3 місяці, демонструє первинний дефіцит адаптивного імунітету у пацієнта з синдромом трисомії за 21-ю хромосомою.
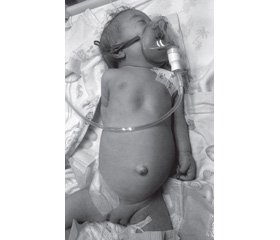
З анамнезу життя та захворювання відомо, що дитина народилась шляхом кесарева розтину від 3-ї вагітності, 2-х пологів у терміні гестації 38 тижнів. Вагітність перебігала на тлі анемії та варикозного розширення вен нижніх кінцівок. Дівчинка народилась в асфіксії, ускладненої синдромом пригнічення центральної нервової системи та серцевою недостатністю на тлі природженої вади серця (дефекту міжшлуночкової та міжпередсердної перегородок). З народження знаходилась на штучній вентиляції легень (ШВЛ). З народження встановлений синдром трисомії за 21-ю хромосомою. На 7-му добу життя у дитини сформувалась госпітальна двобічна сегментарна пневмонія, яка, незважаючи на масивну етіотропну антибактеріальну терапію, поширювалась в верхній і нижній частках легень. Дитина залишалась киснезалежною та потребувала ШВЛ. У 3 місяці діагностований інфекційний ендокардит.
/135-1.jpg)
Діагноз. Основний: синдром трисомії за 21-ю хромосомою. Природжена вада серця: дефект міжшлуночкової та міжпередсердної перегородок. Первинний імунодефіцит (В- і Т-лімфопенія, гіпогаммаглобулінемія), асоційований з трисомією за 21-ю хромосомою. Ускладнення: госпітальна двобічна сегментарна пневмонія, тяжкий перебіг. Інфекційний ендокардит. Синдром поліорганної недостатності (дихальна, церебральна, серцево-судинна, гостра ниркова недостатності, синдром дисемінованого внутрішньосудинного згортання).
У клінічних аналізах крові з народження спостерігалась лімфопенія. Абсолютна кількість лімфоцитів становила 0,37–0,92 • 109/л.
За даними імунограми виявлено різке зниження Т- та В-лімфоцитів, імуноглобулінів: лейкоцити — 1,9 • 109/л (норма — 10,3–11 • 109/л), лімфоцити — 9 % (норма — 52–69 %), абсолютна кількість лімфоцитів — 0,86 • 109/л (норма — 5,4–7,59); СД3 — 58 % (норма — 58–67 %), абсолютна кількість Т-лімфоцитів — 0,5 • 109/л (норма — 1,7–3,6 • 109/л); СД22 — 9 % (норма — 19–31 %), абсолютна кількість Т-лімфоцитів — 0,16 • 109/л (норма — 0,5–1,5 • 109/л); СД4 — 35 % (норма — 38–50 %), СД8 — 33 % (норма — 18–25 %), СД4/СД8 — 1,06 (норма — 1,5–2,0), СД16 — 11 % (норма — 8–17 %), фагоцитуючі нейтрофіли — 50 % (норма — 40–90 %), фагоцитарна кількість — 1,6 (норма — 1–2), комплемент — 47 (норма — 40–80), IgA — 0,18 г/л (норма — 0,21 ± 0,13 г/л), IgМ — 0,21 г/л (норма — 0,30 ± 0,11 г/л), IgG — 2,1 г/л (норма — 4,30 ± 1,19 г/л).
Дитина знаходилась в лікарні 18 діб. Отримувала лікування, в тому числі антибактеріальну терапію за протоколами Товариства інфекційних захворювань Сполучених Штатів Америки і Американської торакальної асоціації [26] та внутрішньовенний імуноглобулін у дозі 0,4 г/кг. Проте, незважаючи на лікування, стан дитини прогредієнтно погіршувався, прогресувала поліорганна недостатність. Комплекс реанімаційних заходів без ефекту. Зареєстрована біологічна смерть.
Обговорення. Інфекції дихальних шляхів визначені як одна з найбільш значущих причин госпіталізації дітей із синдромом Дауна [2]. Нещодавно закінчені дослідження показали, що 45 % дітей з трисомією за 21-ю хромосомою віком 1–5 років, 27 % пацієнтів до 1 року та 14 % спостережених від 10 до 17 років мали необхідність госпіталізації при наявності гострої респіраторної інфекції. Найпоширенішими захворюваннями були пневмонія (18 %), бронхіоліт (7 %) та ларинготрахеобронхіт (5 %). Діти з пневмонією частіше госпіталізувалися до відділення інтенсивної терапії, а найбільш тяжкою причиною інфекцій нижніх дихальних шляхів у дітей із синдромом Дауна була RSV-інфекція.
Інфекції нижніх дихальних шляхів у дітей із синдромом Дауна перебігають більш тяжко, ніж у інших пацієнтів. У дослідженні Hilton і –співавт. [3] середня тривалість перебування, частота ускладнень та вартість госпіталізації були у 2–3 рази більше, ніж у первинно здорових дітей. У 4 рази частіше діти з трисомією за 21-ю хромосомою потребували механічної вентиляції легень, в тому числі за рахунок респіраторного дистрес-синдрому. Вищенаведені дані підтримують гіпотезу щодо аномальних регуляторних механізмів запалення, такі як дисбаланс антиоксидантів та оксидантний стрес [4], що сприяє апоптозу клітин легеневої тканини. Огляд великої когорти дітей із синдромом Дауна у Швеції та Данії [5] показав, що у даної категорії дітей у 12 разів підвищений ризик смертності від інфекцій, особливо септицемії. Діти з трисомією за 21-ю хромосомою мають на 30 % вищий ризик смертності від вторинного сепсису порівняно з іншими госпіталізованими з приводу сепсису дітьми [6].
Захворювання пародонту є ще однією частою інфекційною патологією. У 58–96 % осіб із синдромом Дауна діагностувався гінгівіт [7]. Проте через складність визначення патофізіології гінгівіту внесок потенційних детермінантних факторів, таких як дисбаланс імунітету або погана гігієна порожнини рота, ще не визначений. Висока частота захворювання пародонту може бути частково пояснена дефіцитом секреторного IgA.
Синдром Дауна: фактори первинного та вторинного імунодефіциту
Kuster і співавт. узагальнено докази, що підтверджують природжений дефект імунної системи у дітей із синдромом Дауна на підставі низької кількості наївних Т- і В-клітин [8]. Генетичні механізми, що визначають імунологічні дефекти, пов’язані з трисомією за 21-ю хромосомою, досі не є чітко визначеними. Надмірна презентація двох генів — SOD1 (superoxide dismutase 1 gene, ген супероксиддисмутази 1) та ITGB2 (integrin subunit beta 2, інтегрин β2 субодиниці) на довгому плечі 21-ї хромосоми характерна для дітей із синдромом Дауна. Ген SOD1 індукує синтез супероксиддисмутази, яка зв’язує молекули міді та цинку і таким чином розкладає супероксидні радикали, сприяючи уникненню пошкодження клітин. Ген ITGB2 регулює синтез β2-інтегринів. β2-інтегрини, знаходячись в мембрані лейкоцитів, сприяють їх притоку у вогнища інфекції, розпізнають ознаки запалення, зв’язуються з лігандами на ендотелії судин та зчіплюють лімфоцити з судинною стінкою, а також сприяють транспортуванню лейкоцита через стінку судини. Можливо, гіперекспресія SOD1 та ITGB2 є копменсацією недостатньої кількості лейкоцитів у кровообігу у дітей із синдромом Дауна та обумовлює дефектний фагоцитоз.
Регулятор кальциневрину 1 (regulator of calcineurin 1, RCAN1) активує білок, що взаємодіє з кальциневрином А та інгібує кальциневринзалежні сигнальні шляхи, впливаючи на розвиток центральної нервової системи. Цей ген знаходиться в 21q22.12 регіоні у дітей з трисомією за 21-ю хромосомою і надмірно виражений у головному мозку. Перманентна надмірна експресія RCAN1, що є характерною для синдрому Дауна, веде до формування нейрофібрилярних клубків і втрати нейронів і синаптичних зв’язків у корі головного мозку, а також певних субкортикальних ділянках, що визначає схожість з хворобою Альцгеймера. Окрім того, RCAN1 є фактором транскрипції, що перешкоджає передачі сигналу через NFAT (nuclear factor of activated T cells, ядерний фактор активованих Т-клітин) і зменшує активність запалення через стабілізацію NF-kB (nuclear factor-kappa B cells, інгібітор ядерного фактор-каппа В-клітини) [9]. Інгібіція запалення визначає недостатність елімінації інфекції у пацієнтів з трисомією за 21-ю хромосомою.
На сьогодні розглядаються дві можливі причини вторинного імунодефіциту у дітей із синдромом Дауна: прискорене старіння клітин та дефіцит цинку. Внаслідок старіння в клітинах імунної системи, пов’язаного з надмірною експресією RCAN1, активується механізм збільшення апоптозу [10], що може обумовлювати лімфопенію та імунну дисфункцію. Дефіцит рівнів плазмового цинку, що спостерігається при синдромі Дауна, і підвищена потреба в цинку для активності SOD1 були запропоновані як механізми імунологічних аномалій. Cocchi та співавт. [11] перевірили, чи може дефіцит цинку бути минущим, і виявили, що рівень цинку в плазмі зменшується після 5-річного віку. Проте клінічні випробування цинкових добавок поки не показали вірогідного поліпшення імунної реактивності [10].
Дефіцит адаптивного імунітету у дітей із синдромом Дауна
Дефекти імунної системи описані та постулюються у дітей із синдромом Дауна як причина тяжкості перебігу захворювань (табл. 1) [12].
/136-1.jpg)
Частота респіраторної патології пояснюється аномалією гуморального імунітету [11]. Поряд із цим зменшення різних видів лімфоцитів — характерний маркер ураження імунної системи, що найбільш значно проявляється в дитинстві. У майже 90 % дітей з трисомією за 21-ю хромосомою субпопуляції Т- і В-клітин зменшуються нижче 10-го перцентиля, із них у 60 % — нижче 5-го перцентиля. У дітей від 1 до 5 років не спостерігається нормальне вікове відносне збільшення рівня лімфоцитів крові, в тому числі за рахунок зменшеного тимуса. Окрім того, має місце зменшення нативних Т-лімфоцитів та недостатність презентації Т-клітинного рецептора (T cell receptor (TCR)-ab) на їх поверхні, що призводить до легкої та помірної лімфопенії. Т-клітинний рецептор (TCR) відповідає за розпізнавання антигенів, приєднаних до білків головного комплексу гістосумісності, та визначає диференціацію нативних Т-лімфоцитів. За результатами досліджень Kuester та співавт., середній рівень наївних Т-клітин (CD4) у 5–10-річних дітей становив усього 280 клітин/мл (44 % CD4 T-клітин) у дітей з трисомією за 21-ю хромосомою і 730 клітин/мл (72 % CD4 T-клітин) — в інших спостережених відповідного віку.
Діти з синдромом Дауна мають зменшені кола видалення Т-клітинних рецепторів (T cell receptor excision circles, TREC), які створюються в Т-клітинах під час їх проходження через тимус та вказують на дозрівання Т-клітин [13]. Окрім того, виявлено зменшення кількості всіх субпопуляцій В-клітин, зокрема наївних В-клітин [14]. Проліферативна реакція лімфоцитів на фітогемаглютинін також була низькою [14].
Пацієнти з трисомією за 21-ю хромосомою частіше мають нормальний рівень IgG. У невеликої кількості спостережених з низьким загальним IgG знижена переважно субпопуляція IgG2 [15].
Дослідження дітей із синдромом Дауна продемонстрували недостатність як загальної концентрації IgA у слині, так і специфічного IgA до перора–льної патогенної флори порівняно з конт–ролем [16].
Характерною для синдрому Дауна є субоптимальна антитільна відповідь на імунізацію. Lopez та співавт. показали, що специфічні титри IgG до неоантигена бактеріофагу phi174 у дітей з трисомією за 21-ю хромосомою були нижчими за нормальний діапазон. Hawkes та співавт. повідомили про зменшення титру антитіл на пероральну вакцину проти поліомієліту більшості дітей з трисомією за 21-ю хромосомою, хоча дані статистично важливі лише для 1-го типу поліомієліту, але не для типів 2 та 3. Подібні результати повідомляють і про інші вакцини, такі як вакцини проти коклюшу, грипу, гепатитів А і В та пневмококові вакцини дітей [17, 18] при синдромі Дауна.
Дефекти вродженого імунітету у дітей із синдромом Дауна
Дефекти вродженого імунітету представлені порушенням хемотаксису нейтрофілів, відносно нормальним фагоцитозом та задовільними окисними реакціями перетравлювання. Окрім того, незважаючи на значну експресію інтегрину β2 (CD18; мембранний протеїн, продукт гена ITGB2) на поверхні, активність хемотаксису фагоцитів і лейкоцитів у дітей із синдромом Дауна знижена. У суб’єктів із трисомією за 21-ю хромосомою абсолютна кількість натуральних килерів в периферичній крові є зниженою [19], секреція інтерлейкінів (IL-2, -7 та -10) порушена, манозозв’язувальних білків недостатньо, що обумовлює підвищену сприйнятливість до інфекцій [20].
Алергія не є поширеною в дітей із синдромом Дауна, а сенсибілізація алергенів не є основним джерелом респіраторних захворювань [14].
Неімунні фактори, що підвищують ризик інфікування
Незважаючи на зазначені вище численні імунологічні аномалії, вони не єдині детермінанти підвищеного ризику інфікування у дітей з трисомією за 21-ю хромосомою. Сприйнятливість до інфекцій посилюється за рахунок інших супутніх захворювань, які послаблюють слизові бар’єри. Наприклад, мальформації серцево-судинної системи, дихальних шляхів та ушної раковини, макроглосія, а також недостатній мукоциліарний транспорт і бульбарні порушення.
Bertrand та співавт. описали аномалії дихальних шляхів у дітей з трисомією за 21-ю хромосомою, виявлені при фібробронхоскопії [21]. Найпоширенішими аномаліями була ларингомаляція (~ 50 % спостережених), трахеобронхомаляція та бронхомаляція. Характерною ознакою була наявність легеневої гіпоплазії, пов’язаної з синдромом Дауна.
Обструктивне апное та обструкція дихальних шляхів надзвичайно поширені у пацієнтів з трисомією за 21-ю хромосомою. Обструкція верхніх і нижніх дихальних шляхів спостерігалася в 63–80 % випадків гострої респіраторної інфекції [22]. На нашу думку, мальформація лицьового черепа та макроглосія обумовлюють невеликий «мертвий простір», що у поєднанні з відносно великими мигдаликами та аденоїдами сприяє обструкції дихальних шляхів і підвищує сприйнятливість до інфекцій.
Гастростравохідний рефлюкс у дітей із синдромом Дауна спричиняє аспірацію шлункового вмісту, бронхоспазм та збільшення частоти інфекцій нижніх дихальних шляхів [23]. Гіпотонія м’язів глотки, асоційована з трисомією за 21-ю хромосомою, підвищує ризик аспірації [24], що обумовлює необхідність виключати гастроезофагеальний рефлюкс при наявності рецидивуючих респіраторних інфекцій у даної категорії пацієнтів.
Доведено, що 40–50 % новонароджених з синдромом Дауна мають стеноз зовнішнього слухового каналу та вузьку євстахієву трубу, що сприяє частим отитам, втраті слуху та затримці розвитку мовлення [25].
Висновки
1. Раннє медичне втручання подовжило тривалість життя немовлят з синдромом Дауна, але на сьогодні важливою складовою диспансеризації вважається запобігання інфекції.
2. Тривалі тяжкі інфекції дихальних шляхів визначені як одна з найбільш значущих причин госпіталізації, потреби у механічній вентиляції та підвищеного ризику смертності від інфекцій дітей з синдромом Дауна.
3. Природжений імунний дефіцит, імовірніше прихований в генах хромосоми 21. Доведена роль SOD1 та RCAN1 у неповноцінній імунній відповіді. Дані гени, а можливо, і інші дефекти впливають на недостатність хемотаксису нейтрофілів, зменшення лімфоцитів і гуморальних імунних реакцій, пов’язаних з інфекціями. Мають теоретичні підстави постульовані фактори імунодефіциту, такі як дефіцит цинку та передчасний апоптоз в клітинах імунної системи, пов’язаний із надмірною експресією RCAN1. На додаток анатомічні та функціональні дефекти у дітей з синдромом Дауна можуть порушувати природні бар’єри та сприяти розвитку інфекційного захворювання, що необхідно враховувати при лікуванні пацієнтів.
4. Незалежно від того, чи пов’язані тривалі тяжкі інфекції з природженим дефектом в імунній системі, вторинним імунодефіцитом або неімунними факторами, подальші дослідження необхідні.
5. Отримані дані дали підставу для рекомендації ретельного дослідження імунних і неімунних факторів у кожному окремому випадку, оцінки титрів специфічних антитіл до вакцин та проведення додаткової бустерної імунізації всім дітям з трисомією за 21-ю хромосомою.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Canfield M.A. National estimates and race/ethnic-specific variation of selected birth defects in the United States, 1990–2001 / M.A. Canfield, M.A. Honein, N. Yuskiv et al. // Birth Defects. Res. A. Clin. Mol. Teratol. — 2006. — № 76. — P. 747-756.
2. Selikowitz M. Health problems and health checks in school-aged children with Down syndrome / M. Selikowitz // J. Pediatr. Child Health. — 1992. — № 28. — P. 383-386.
3. Hilton J.M. Respiratory morbidity of hospitalized children with trisomy 21 / J.M. Hilton, D.A. Fitzgerald, D.M. Cooper // J. Pediatr. Child Health. — 1999. — № 35. — P. 383-386.
4. Jovanovic S.V. Biomarkers of oxidative stress are significantly elevated in Down syndrome / S.V. Jovanovic, D. Clements, K. MacLeod Free // Radic. Biol. Med. — 1998. — № 25. — P. 1044-1048.
5. Jovanka R.K. Screening for Primary Immunodeficiency Disea–ses: History, Current and Future / R.K. Jovanka, L.Hammarström // Practice J. Clin. Immunol. — 2018. — № 38. — P. 56-66.
6. Dorsey M. Newborn Screening for Severe Combined Immunodeficiency in the US: Current Status and Approach to Management / M. Dorsey, J. Puck // Int. J. Neonatal Screen. — 2017. — № 3. — P. 15.
7. Contestabile A. The GABAergic Hypothesis for Cognitive Disabilities in Down Syndrome / A. Contestabile, S. Magara, L. Cancedda // Front. Cell. Neurosci. — 2017. — № 11. — P. 54.
8. Kusters M.A. Both normal memory counts and decreased naïve cells favor intrinsic defect over early senescence of Down syndrome lymphocytes / M.A. Kusters, E.F. Gemen, R.H. Vestergen et al. // Pediatr. Res. — 2010. — № 67. — P. 557-562.
9. Crow Y.J. Primary immunodeficiency associated with chromosomal aberration — an ESID survey / Y.J. Crow // Orphanet Journal of Rare Diseases. — 2016. — № 11. — P. 110.
10. Alexander M. Morbidity and medication in a large population of individuals with Down syndrome compared to the general population / M. Alexander // Dev. Med. Child Neurol. — 2016. — № 58. — P. 246-254.
11. Walus M. Widespread cerebellar transcriptome changes in Ts65Dn down syndrome mouse model after lifelong running / M. Walus, E. Kida, A. Rabe et al. // Brain Res. — 2015. — № 296. — P. 35-46.
12. Bloemers B.L. High incidence of recurrent wheeze in children with Down syndrome with and without previous respiratory syncytial virus lower respiratory tract infection / B.L. Bloemers, A.M. van Furth, M.E. Weijerman et al. // Pedatric. Inf. Dis. J. — 2010. — № 29. — P. 39-42.
13. Van Horn G.S.R. Interferon at the crossroads of allergy and viral infections / G.S.R. van Horn, J.D.J. Farrar // Leukoc. Biol. — 2015. — № 98. — P. 185-194.
14. Tripathi S. Meta- and Orthogonal Integration of Influenza ‘OMICs’ Data Defines a Role for UBR4 in Virus Budding / Tripathi S. et al. // Cell Host Microbe. — 2015. — № 18. — P. 723-735.
15. Szklarczyk D. STRINGv10: protein-protein interaction networks, integrated over the tree of life / D. Szklarczyk et al. // Nucleic Acids Res. — 2015. — № 43. — P. 447-452.
16. Li L. The Implication and Significance of β2-microglobulin: A Conservative Multifunctional Regulator / Li L., M. Dong, X.G. Wang // Chin. Med. J. (Engl.). — 2016. — № 129. — P. 448.
17. Hirayasu K. Functional and genetic diversity of leukocyte immunoglobulin-like receptor and implication for disease associations / K. Hirayasu, H. Arase // J. Hum. Genet. — 2015. — № 60. — P. 703-708.
18. Wang X. Significant Association Between Fc Receptor-Like 3 Polymorphisms (−1901A> G and −658C>T) and Neuromyelitis Optica (NMO) Susceptibility in the Chinese Population / X. Wang et al. // Mol. Neurobiol. — 2016. — № 53. — P. 686-694.
19. Sjolin-Goodfellow H. The catalytic activity of the kinase ZAP-70 mediates basal signaling and negative feedback of the T cell receptor pathway / H. Sjolin-Goodfellow et al. // Sci. Signal. — 2015. — № 8. — P. 49.
20. Cuvelier G.D.E. Long-Term Outcomes of Hematopoietic Stem Cell Transplantation for ZAP70 Deficiency / G.D.E. Cuvelier, T.S. Rubin, D.A. Wall et al. // J. Clin. Immunol. — 2016. — № 36. — P. 713-724.
21. Chan A.Y. A novel human autoimmune syndrome caused by combined hypomorphic and activating mutations in ZAP-70 / A.Y. Chan et al. // J. Exp. Med. — 2016. — № 213. — P. 155-165.
22. Ferreira G.A. Atorvastatin reduced soluble receptors of TNF-alpha in systemic lupus erythematosus / G.A. Ferreira, A.L. Teixeira, D.C. Calderaro et al. // Clin. Exp. Rheumatol. — 2016. — № 34. — P. 42-48.
23. Sheikh S. Chronic aspiration without gastroesophageal reflux as a cause of chronic respiratory symptoms in neurologically normal infants / S. Sheikh, E. Allen, R. Shell et al. // Chest. — 2001. — № 120. — P. 1190-1195.
24. Weir K. Oropharyngeal aspiration and pneumonia in children / K. Weir, S. McMahon, L. Barry // Pediatr. Pulmonol. — 2007. — № 42. — P. 1024-1031.
25. Thurman J.M. Targeting the complement cascade: novel treatments coming down the pike / J.M. Thurman, M. Le Quintrec // Kidney Int. — 2016. — № 90. — P. 746-752.
26. Infectious Diseases Society of America (IDSA)/American Thoracic Society (ATS). 2016. Supplemental material for the management of adults with hospital-acquired and ventilator-associated pneumonia: 2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society [Электронный ресурс] Organ_System. — 2017. Режим доступа: http://www.idsociety.org/Organ System/#Hospital AcquiredVentilatorAssociatedPneumoniaHAPVAP.

/135-1.jpg)
/136-1.jpg)