Введение
За последнее десятилетие распространенность аллергических заболеваний среди детского населения Украины выросла в несколько раз. Неуклонный рост заболеваемости в разных возрастных группах, значительное «омоложение» дебюта аллергической патологии является общемировой тенденцией, и Украина в данном случае не является исключением. Глобальные экологические проблемы, урбанизация, интенсивное и неконтролируемое загрязнение почвы, воды, атмосферы отходами промышленности и бытовой химии, необоснованное применение медикаментозных препаратов, тенденция к сокращению сроков естественного вскармливания, распространенность вредных привычек среди молодежи и населения в целом придают аллергопатологии масштаб общемировой медико-социальной проблемы [1, 5, 14].
Исследования показывают, что последние 30 лет в течение каждого десятилетия показатели заболеваемости аллергией во всем мире удваивались, и сегодня аллергические заболевания прочно заняли третье место по распространенности после сердечно-сосудистой и онкологической патологии [5, 6]. Темпы роста заболеваемости аллергическими заболеваниями приобретают характер эпидемии и обусловливают огромные медико-социальные и экономические потери. 50 % населения Европы страдают аллергическими заболеваниями, из них 30 % — дети разного возраста. В структуре аллергических заболеваний 20–40 % приходится на аллергический ринит (АР), 5–10 % — на бронхиальную астму (БА), 1–3 % составляет атопический дерматит (АД) [2–4].
Несмотря на фундаментальные открытия в области медицины и биологии, которые позволили раскрыть молекулярные механизмы развития аллергии, лечение аллергической патологии у детей остается глобальной проблемой педиатрии.
В развитии аллергии у детей актуален «атопический марш», означающий хронологическую последовательность формирования сенсибилизации и клинической трансформации симптомов от пищевой аллергии к бронхиальной астме [7, 8, 36, 38].
У детей первого года жизни дебют «атопического марша» наиболее часто обусловлен пищевой аллергией с последующими проявлениями атопического дерматита [16, 37]. Распространенность атопического дерматита среди детей составляет 5–10 %, среди взрослых — 2–10 %, наиболее высокие показатели заболеваемости атопическим дерматитом отмечаются в урбанизированных регионах экономически развитых стран. В старшем возрасте у детей с атопией может развиться аллергический ринит и бронхиальная астма [9, 30, 33]. Согласно современным представлениям, фактором высокого риска последующего развития бронхиальной астмы выступает тяжелое течение атопического дерматита в первые годы жизни ребенка.
Исследования бронхиальной астмы и аллергии у детей, в которых изучали распространенность атопического дерматита, аллергического ринита и бронхиальной астмы во всем мире с помощью валидизированных опросников, также показали связь между анализируемыми заболеваниями и их последовательную манифестацию. При этом была установлена сильная корреляция между распространенностью атопического дерматита и частотой аллергического ринита и бронхиальной астмы [22, 24, 26].
На конференции, проведенной в рамках ежегодной Всемирной недели аллергии (22–28 апреля 2018 года), профессор Мотохиро Эбисава (Motohiro Ebisawa, Национальная больница Сагамихара, Япония) в своем выступлении сказал: «У большинства атопических пациентов атопический дерматит наблюдается первым и обычно в первые месяцы и годы жизни. Раннее вмешательство может помочь пред–отвратить или изменить атопический марш» [28].
С учетом общности патогенетических механизмов развития заболеваний «атопического марша» основной задачей современной педиатрии и аллергологии является разработка новых методов лечения и профилактики аллергопатологии у детей раннего возраста, которые не только устраняют проявления болезни, но и с высокой вероятностью позволяют снизить риск развития тяжелой аллергической патологии в будущем. Особую актуальность в свете решения данной проблемы представляют результаты исследования, проведенного еще в 2001 году на базе 56 медицинских центров в 13 странах мира (ETACTM study), в котором изучали сроки манифестации атопических заболеваний у детей с факторами риска, а также анализировали возможность превентивной терапии заболеваний «атопического марша» длительным приемом препарата антигистаминного действия [39].
Многолетний клинический опыт использования антигистаминных препаратов (АГП) у данной категории больных не только не позволяет исключить их из комплексной терапии заболеваний «атопического марша», но и заставляет вновь убедиться в их высокой клинической эффективности и безопасности применения, особенно при лечении детей раннего возраста [13, 15, 25].
В патогенезе основных форм аллергических заболеваний ключевую роль играет гистамин — главный медиатор аллергических реакций. Гистамин — 5-(2-аминоэтил)-имидазол — образуется из аминокислоты гистидин при действии на нее фермента клеточной цитоплазмы — гистидиндекарбоксилазы. В организме гистамин содержится преимущественно в тучных клетках (около 90 %) и базофилах (около 10 %). Гистамин накапливается в гранулах тучных клеток, базофилов и находится в связанном состоянии. При активации тучных клеток и базофилов, приводящей к повышению проницаемости цитоплазматической и перигранулярных мембран, происходит высвобождение гистамина из клеток в экстрацеллюлярное пространство.
Свободный гистамин обладает высокой физиологической активностью, стимулируя гистаминовые рецепторы и участвуя во всех проявлениях аллергических реакций. Некоторое количество гистамина содержится в ЦНС, где он играет роль нейромедиатора. Биологический эффект гистамина осуществляется посредством активации клеточных поверхностных специфических рецепторов, сопряженных с G-белками (G protein-coupled receptors — GPCRs). На сегодняшний день известно 4 типа рецепторов гистамина (H1, H2, H3, H4-рецепторы) [17, 20, 32].
В развитии аллергических реакций принимают участие Н1-рецепторы. Локализация –Н1-рецепторов — гладкие мышцы бронхов, артерий, пищеварительной системы и мочевого пузыря, сердце и головной мозг. Активация Н1-рецептора сопровождается активацией ядерного фактора — NF-κB, ответственного за транскрипцию молекул межклеточной адгезии и цитокинов. Повышение уровня активированного NF-κВ обнаруживается у пациентов с аллергическими заболеваниями [2].
Через Н1-рецепторы гистамин вызывает сокращение гладкой мускулатуры бронхов, желудка, кишечника, желчного и мочевого пузыря, сосудов малого круга кровообращения, повышает проницаемость сосудов, увеличивает внутриклеточное содержание циклического гуанозинмонофосфата (цГМФ), усиливает секрецию слизи слизистыми железами носа, вызывает хемотаксис эозинофилов, нейтрофилов и усиливает образование простаноидов (простагландинов F2a, F2, D2, тромбоксана, простациклина) [11, 17, 34].
Антагонисты Н1-гистаминовых рецепторов блокируют их по принципу конкуренции с гистамином. Это действие носит обратимый характер. Сродство АГП к Н1-рецепторам значительно ниже, чем у гистамина. Поэтому данные лекарственные средства не способны вытеснить гистамин, связанный с рецептором, они только блокируют незанятые или высвобождаемые рецепторы. Соответственно, –Н1-блокаторы наиболее эффективны для преду–преждения аллергических реакций немедленного типа, а в случае развившейся реакции предупреждают воздействие новых порций гистамина [12, 21].
В 40-х годах ХХ столетия на фармацевтическом рынке Европы появился первый антигистаминный препарат — фенбензамин (phenbenzamine), а в 1957 году один из его создателей, Daniel Bovet, был удостоен Нобелевской премии за синтез и изучение свойств новых препаратов из этой группы. К сегодняшнему дню накоплен огромный экспериментальный и клинический опыт применения антигистаминных препаратов при лечении аллергических заболеваний у пациентов разного возраста.
Представленная группа подразделяется на препараты первого и второго поколения. Отличительной особенностью препаратов первого поколения является способность оказывать седативный эффект, т.к. они высоколипофильны и легко проникают через гематоэнцефалический барьер. Некоторые представители АГП первого поколения оказывают также умеренный антихолинергический эффект, что в некоторых ситуациях может быть использовано с пользой для больного. Антигистаминные препараты второго поколения обладают более высокой селективностью взаимодействия с Н1-рецепторами гистамина, а антихолинергические эффекты и побочное воздействие на ЦНС у этих препаратов практически отсутствуют [17, 18].
В арсенале современного врача имеется достаточное количество препаратов из группы блокаторов рецепторов гистамина, что позволяет сделать взвешенный и продуманный выбор в каждой конкретной ситуации. С учетом разнообразия клинических проявлений заболеваний аллергического генеза, возрастных особенностей пациентов и необходимости оказания как экстренной, так и плановой медицинской помощи в практической аллергологии каждое поколение препаратов — блокаторов гистаминовых рецепторов прочно заняло свою терапевтическую нишу, учитывающую основные преимущества и достоинства группы.
Так, использование препаратов первого поколения приоритетно за счет возможного парентерального введения при острых аллергических реакциях, оказании неотложной помощи, проведении премедикации перед хирургическими и диагностическими вмешательствами. Длительный и безопасный клинический стаж делает препараты этой группы возможными для применения у детей раннего возраста. Антигистаминные препараты первой генерации, оказывая седативный и антихолинергический эффект, способны устранить кожный зуд, нарушения сна, которые сопровождают различные поражения кожи аллергического генеза у детей раннего возраста.
Указанные преимущества, накопленный разносторонний клинический опыт применения в полной мере присущи появившемуся на фармацевтическом рынке Украины препарату Фенокит, который производится совместным испано-украинским фармацевтическим предприятием Sperco. Действующим веществом представленного препарата является диметиндена малеат — блокатор Н1-гистаминовых рецепторов первого поколения [10].
Краткая характеристика диметиндена малеата
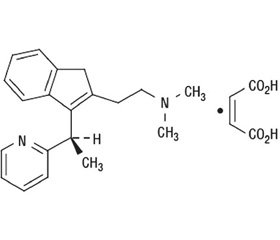
Химическое название диметиндена малеата — N,N-диметил-3-[1-(2-пиридинил)этил]-1H-ин–ден-2-этанамин (в виде малеата) (рис. 1).
Диметинден — производное алкиламина. Белый кристаллический порошок без запаха, горьковатого вкуса, малорастворим в воде и спирте. Температура плавления 157–159 °C. Кристаллическая форма вещества и его водные растворы стабильны неопределенное время при комнатной температуре.
Фармакодинамика и фармакокинетика диметиндена малеата
Диметиндена малеат быстро и практически полностью всасывается при пероральном приеме. Инициация выраженного антигистаминного эффекта начинается уже через 30 минут после приема, достигая максимальной выраженности в течение 5 часов. Длительность создаваемого антигистаминного действия достигает 8 часов. При пероральном приеме препарата в виде капель время достижения максимальной концентрации в плазме — 2 часа. Биодоступность препарата приближается к 70 %. Препарат хорошо проникает в ткани, связывание с белками плазмы составляет 90 %. Метаболизм препарата осуществляется в печени путем гидроксилирования и метоксилирования. Метаболизирование большинства блокаторов Н1-гистаминовых рецепторов происходит с участием изофермента системы цитохрома Р450, и значительная вариабельность экспрессии этого фермента в человеческой популяции обусловливает индивидуальные особенности метаболизма препаратов, которые развиваются при комбинированном использовании диметиндена с препаратами, которые тормозят оксигеназную активность ферментов системы цитохрома Р450 и способствуют накоплению неметаболизированной исходной формы препарата в крови [12, 17, 18]. Период полувыведения диметиндена малеата составляет 6 часов. Выводится из организма с желчью и мочой, 90 % — в виде метаболита, 10 % — в неизмененном виде.
Механизм действия диметиндена малеата
Антигистаминное действие
Согласно большинству исследований, диметиндена малеат — антигистаминный препарат І поколения, наиболее приближенный по своему терапевтическому действию к антигистаминным препаратам ІІ генерации. Диметиндена малеат является конкурентным ингибитором Н1-гистаминовых рецепторов и благодаря высокой селективности и афинности по отношению к рецепторам оказывает выраженный антигистаминный эффект. По химической структуре диметиндена малеат представляет собой рацемическую смесь, в которой один из энантиомеров, R(–)диметинден, обладает более мощным антигистаминным действием, способствуя снижению проницаемости мелких сосудов и капилляров при аллергических реакциях немедленного типа. Препарат также является мощным стабилизатором мембран тучных клеток, что способствует опосредованному противовоспалительному эффекту [10, 17, 29].
Антихолинергическое действие
В отличие от других представителей блокаторов H1 -гистаминовых рецепторов I поколения диметиндена малеат проявляет умеренный антихолинергический эффект, что обусловливает уменьшение секреции слизи и, как следствие, появление сухости слизистых оболочек носовой полости и глотки. Однако именно этот эффект обеспечивает успешное применение диметиндена малеата при ринитах и риносинуситах неаллергического генеза. Центральная холинолитическая активность препарата способствует снижению стимуляции вестибулярных рецепторов и угнетению функции лабиринта, что обеспечивает противорвотный и противоукачивающий эффект препарата. Выраженные холинолитические эффекты (тахикардия, тошнота, возбуждение) при применении препарата в терапевтических дозах практически не развиваются [23].
Антикининовое и антисеротониновое действие
Диметиндена малеат помимо гистаминовых рецепторов блокирует также эффекты других медиаторов аллергического воспаления (кининов, серотонина), что позволяет предотвратить повышение проницаемости капилляров, ограничить аллергическое воспаление, уменьшить отек и зуд [35].
Седативное и анксиолитическое действие
Диметиндена малеат, как и другие представители блокаторов H1 -гистаминовых рецепторов I поколения, высоколипофилен, что позволяет ему легко проникать через гематоэнцефалический барьер, связываться с H1-гистаминовыми рецепторами головного мозга и оказывать седативный эффект. Умеренное анксиолитическое действие препарата может быть обусловлено подавлением активности отдельных участков подкорковой области центральной нервной системы.
Местноанестезирующее действие
Диметиндена малеат оказывает умеренное местноанестезирующее действие. Механизм анестезирующего действия препарата развивается за счет блокирования потенциалзависимых натриевых каналов периферической нервной системы [17].
Возможность длительного применения
Весомым недостатком многих представителей блокаторов H1 -гистаминовых рецепторов I поколения является феномен тахифилаксии — реакция организма на повторное применение лекарственного препарата, заключающаяся в заметном снижении лечебного эффекта данного препарата. Именно снижение чувствительности к препарату обусловливает достаточно короткий курс лечения антигистаминными препаратами I поколения — 7–10 дней с последующей заменой на другого представителя этой группы I или II поколения. Диметиндена малеат показал высокую клиническую эффективность при курсе лечения 20 дней, что делает возможным длительное применение данного препарата при наличии клинического эффекта [31].
Взаимодействие диметиндена малеата с другими лекарственными средствами
Диметиндена малеат усиливает действие анксио–литиков и снотворных средств. При одновременном применении диметиндена малеата и этанола отмечается замедление скорости психомоторных реакций. Ингибиторы моноаминоксидазы (МАО) усиливают антихолинергическое и угнетающее действие на ЦНС. Трициклические антидепрессанты и M-холиноблокаторы увеличивают риск повышения внутриглазного давления.
Клиническое применение диметиндена малеата
Клиническое применение диметиндена малеата основано на его основных фармакологических свойствах и досконально изученных клинических эффектах. Длительное (более 70 лет) нахождение препарата на фармакологическом рынке и высокая клиническая эффективность обусловлены антиаллергическим, противозудным, противоотечным, антиэкссудативным, седативным, местноанестезирующим и противовоспалительным действием этого представителя блокаторов H1-гистаминовых рецепторов I поколения [10].
За длительный период наблюдений и применения диметиндена малеат неоднократно подтверждал свою клиническую эффективность.
Получены убедительные результаты клинического исследования применения диметиндена малеата у детей при различных заболеваниях кожи, сопровождающихся зудом. В группу наблюдения вошли дети с проявлениями крапивницы, атопического дерматита, ветряной оспы, папулезного акродерматита, инсектной аллергии. На основании объективных и субъективных критериев сделано заключение, что диметиндена малеат эффективен в 87 % случаев и не вызывает значимых побочных эффектов [21].
Подобное исследование проведено отечественными дерматологами в 2006 году на базе Национального университета им. А.А. Богомольца. Доказана высокая эффективность применения диметиндена малеата при лечении аллергических дерматозов у детей. Проявления дерматитов аллергического и инфекционного генеза нередко существенно нарушают качество жизни ребенка, являясь причиной мучительного кожного зуда с компонентами центрального генеза, приводящего к раздражительности ребенка, эмоциональной лабильности, беспокойному сну. Применение препаратов диметиндена малеата за счет развития седативного эффекта устраняет эти проявления заболеваний кожи и способствует улучшению общего состояния и самочувствия ребенка, нормализации режима сна и бодрствования. Исследования подтвердили целесообразность использования этих препаратов перед ночным сном ребенка в связи с усилением зуда в вечернее и ночное время [15].
Выраженное противозудное и противовоспалительное действие подтверждено многочисленными клиническими исследованиями в разных странах мира. Так, еще в 1997 году получены данные об эффективности использования диметиндена малеата при лечении зуда, вызванного герпетическим вирусом Varizella Zoster у детей первых шести лет жизни. Было показано, что препарат не только уменьшает проявления кожного зуда, но также снижает вероятность присоединения вторичной инфекции с развитием пиодермии в местах высыпаний. Препарат также улучшает репарацию кожи и уменьшает количество необратимых следов от расчесов на коже, что является косметическим дефектом и дополнительным стрессовым фактором для ребенка. Представленное исследование также помогло определить оптимальное дозирование препаратов диметиндена малеата при лечении кожного зуда у детей, продемонстрировав, что доза препарата 0,05 мг/кг/сутки по терапевтической эффективности не уступает дозе 0,1 мг/кг/сутки и практически исключает вероятность развития побочных эффектов [27].
По мнению аллергологов [19], благодаря быстро развивающемуся эффекту при пероральном приеме диметинден малеат является достойной альтернативой инъекционным формам антигистаминных препаратов для неотложной терапии острых аллергических реакций у детей, связанных с различными проявлениями инсектной аллергии. Получены убедительные данные об эффективности диметиндена малеата в лечении рецидивирующих стенозирующих ларинготрахеитов у детей с аллергическим анамнезом.
Проведенное отечественными учеными клиническое исследование эффективности диметиндена малеата при лечении пищевой аллергии у детей раннего возраста подтвердило приоритетность выбора препарата при лечении аллергических заболеваний у детей раннего возраста и высокий профиль его безопасности [17].
В составе симптоматической терапии препарат нашел широкое применение в лечении острых респираторных заболеваний у детей разного возраста, применяется с целью влияния на назальную секрецию: уменьшает воспалительный отек слизистой, зуд в носу, чихание. При гипертермическом синдроме применение препарата возможно благодаря его способности потенцировать действие антипиретиков.
Проблема рационального назначения антигистаминных препаратов актуальна для врачей многих специальностей. Препараты этой группы наиболее часто назначают педиатры (58,2 %), аллергологи (23,5 %), отоларингологи (15,3 %), реже — врачи других специальностей (иммунологи, инфекционисты, офтальмологи, хирурги) [19].
В практике педиатра и аллерголога, которые сталкиваются с заболеваниями «атопического марша» уже на первом году жизни ребенка, выбор оптимального антигистаминного препарата является наиболее сложной проблемой. Необходимо учесть все возможные терапевтические и побочные эффекты препарата, выбрать оптимальную дозу, определить путь введения препарата и длительность курса лечения.
Существует ряд клинических ситуаций в педиатрической практике, когда оптимальным выбором являются антагонисты Н1-рецепторов І поколения. Это прежде всего атопический дерматит, экзема, нейродермит, крапивница, сезонные аллергические риниты и конъюнктивиты, проявления инсектной аллергии.
Важнейшим критерием безопасности любого препарата является его возрастной ценз. Из всех антигистаминных препаратов І поколения только диметиндена малеат разрешен для применения детям с одного месяца жизни, что является показателем его высокой эффективности и безопасности.
Появление на фармацевтическом рынке Украины препарата Фенокит компании «Сперко» поможет решить проблему выбора эффективного препарата при лечении аллергических заболеваний у детей раннего возраста. Действующим веществом препарата является диметиндена малеат — блокатор Н1-гистаминовых рецепторов первого поколения.
Производители препарата (совместное испано-украинское фармацевтическое предприятие SPERCO) представили наиболее удобную форму его выпуска для детей раннего возраста — капли для орального применения. Препарат отличает не только оптимальная форма выпуска, но и простота расчета необходимой дозы. Во флаконе содержится 20 мл препарата, в 1 мл раствора содержится 1 мг действующего вещества. Флакон с капельницей-дозатором позволяет точно дозировать лекарственное средство при приеме внутрь самым маленьким пациентам.
Суточная доза препарата составляет 0,1 мг (т.е. 2 капли) на 1 кг массы тела. Кратность применения препарата — 3 раза в сутки. Детям от 1 месяца до 1 года рекомендуемая доза составляет 3–10 капель 3 раза в сутки. Детям от 1 года до 3 лет — 10–15 капель 3 раза в сутки. Детям от 3 до 12 лет — 15–20 капель 3 раза в сутки. Взрослым и детям старше 12 лет — 20–40 капель 3 раза в сутки.
К достоинствам препарата можно отнести приятный вкус, отсутствие в составе ароматических добавок. Капли можно добавлять в бутылочку с детским питанием непосредственно перед кормлением, не подвергая воздействию высоких температур. Возможен прием препарата в неразведенном виде, с ложечки, если ребенок находится на естественном вскармливании и такая форма приема препарата удобна ребенку.
Побочные эффекты терапии диметиндена малеатом
Анализ многочисленных исследований убедительно подтверждает высокий уровень безопасности препарата, что делает возможным его применение у детей с 1 месяца жизни. Из немногочисленных побочных явлений встречаются такие, как сонливость, раздражительность, вялость, фарингеальный отек, сыпь, сухость во рту, головокружение, тошнота.
Выводы
Таким образом, диметиндена малеат — –Н1 -антигистаминный препарат І поколения — обладает высоким профилем эффективности, безопасности и переносимости при лечении аллергических заболеваний у детей раннего возраста. Препарат Фенокит компании «Сперко» (действующее вещество — диметиндена малеат) способен оказывать антиаллергическое, противозудное, противоотечное, антиэкссудативное, седативное и противовоспалительное действие. Терапия с применением препарата Фенокит эффективно подавляет клинические проявления атопического дерматита, крапивницы, экземы, дерматологические проявления гастроинтестинальной и инсектной аллергии. Диметиндена малеат можно считать препаратом выбора для детей первого года жизни при лечении инфекционных и аллергических заболеваний кожи, сопровождающихся кожным зудом и нарушением общего состояния ребенка. Доступная цена, удобная форма выпуска, простота и точность дозирования препарата Фенокит позволят ему занять достойное место в арсенале лекарственных средств, применяемых в педиатрии.
Своевременное и обоснованное включение эффективного и безопасного блокатора –Н1-гистаминовых рецепторов в комплексное лечение детей с проявлениями аллергии не только позволит добиться нивелирования симптомов заболевания, но и может приостановить дальнейшее развитие «атопического марша».
Конфликт интересов. Не заявлен.

/69-1.jpg)