Препараты, ингибирующие синтез бактериальных сидерофоров
Считают, что препараты, ингибирующие биосинтез бактериальных сидерофоров, могут стать существенным компонентом антибактериальной терапии инфекционных заболеваний [22, 49]. В настоящее время разработаны лекарственные средства, подав–ляющие синтез ацинобактина бактерий Acinetobacter baumannii, микобактина бактерий Mycobacterium tuberculosis, энтеробактина бактерий Escherichia coli, иерсиниабактина бактерий Yersinia pestis и др. В основе данных лекарственных средств лежат соединения, подавляющие активность нерибосомальных пептидсинтетаз (nonribosomal peptide synthetases — NRPSs) [17].
В частности, продемонстрировано, что 6-фенил-1-(пиридин-4-илметил)-1Н-пиразоло[3,4-b]пиридин-4-карбоновой кислоты ингибирует активность аденилирующего домена NRPS — BasE, инициализирующего синтез ацинобактина бактерий Acinetobacter baumannii [15].
Ashootosh Tripathi и соавт. [46] разработали бауламицины A и B (рис. 1), которые, взаимодействуя с SbnE, подавляют синтез стафилоферрина B бактерий Staphylococcus aureus.
Препараты сидерофоров, конъюгированных с антибиотиками
Новым направлением этиологического лечения инфекционных заболеваний, вызванных антибиотикорезистентными бактериальными штаммами, представляется применение сидерофоров (катехолатов и гидроксаматов), конъюгированных с антибиотиками (сидеромицины). В морфологической основе сидеромицинов лежит гидроксаматный сидерофор, который состоит из трех мотивов N5-ацетил-N5-гидроксиорнитина. С-терминальный мотив данного трипептида содержит сериновый аминокислотный остаток, который связан с 4-тиоксилофуранозной боковой цепью непротеиногенной α-аминокислоты. Примерами натуральных сидеромицинов являются альбомицины, ферримицины, даномицины, сальмицины и микроцины (рис. 2). Сидеромицины активно поглощаются бактериями, что способствует снижению минимальной подавляющей концентрации антибиотика более чем в 100 раз [7, 21, 32, 38].
/189-2.jpg)
Первыми сидеромицинами были разработанные в 1960 году ферримицины, сидерофором которых является продукт бактерий Streptomyces griseoflavus. Ферримицины (A1, A2 и B) представляют собой конъюгат ферриоксамина В и антибиотиков [50]. Так, ферримицин A состоит из ферриоксамина B, связанного через линкерный 4-амино-5-гидроксибензоат с иминоэстрозамещенным лактамом. Ферримицины проявляют выраженную антибактериальную активность только против грамположительных бактерий, в частности против бактерий Staphylococcus aureus [23].
Альбомицины состоят из трис(N5-ацетил, N5-гидроксиорнитин)пептида и нуклеозиданалогического тиорибозилпиримидинового фрагмента, связанных сериновым спейсером [50]. Молекула трис(N5-ацетил, N5-гидроксиорнитин)пептида структурно подобна сидерофору, продуцируемому актиномицетами Streptomyces specie, и распознается рецептором FhuA- и FhuD-связывающим протеином [3]. Альбомицины активно переносятся вовнутрь бактерии АВС-транспортером, где токсичный тиорибозилпиримидиновый фрагмент высвобождается за счет активности сериновой протеазы и блокирует протеиновый синтез, ингибируя аминоацил-тРНК-синтетазу. Альбомицины ингибируют рост как грамположительных, так и грам–отрицательных бактерий [21].
Даномицины и сальмицины состоят из тригидроксаматного даноксамина (сидерофора) и аминогликозидного антибиотика. Эти соединения ингибируют синтез белка стафилококков и стрептококков [35].
Детальная структура даномицинов А и В до настоящего времени не изучена.
Сальмицины были выделены из штамма бактерий Streptomyces violaceus и содержат ферриоксамин, конъюгированный с аминодисахаридом [7]. В настоящее время идентифицировано четыре сальмицина: A, B, C и D. Сальмицины А и D представляют собой оксимы сальмицинов В и С соответственно. Предполагают, что аминодисахаридная единица сальмицинов ингибирует синтез протеинов подобно антибиотикам аминогликозидной группы [27].
Микроцины являются небольшими, рибосомально синтезированными антимикробными пептидами, которые продуцируются грамотрицательными бактериями и обладают узким спектром антимикробного действия [20].
Особую актуальность получили препараты сидерофоров, конъюгированных с β-лактамными антибиотиками, при их применении против бактерий Pseudomonas aeruginosa, пориновые каналы внешней мембраны которых настолько узки, что их малый просвет достоверно затрудняет проникновение молекул антибиотиков внутрь микроорганизма [9]. Поэтому сидерофоры, конъюгированные с антибиотиком, которые могут доставлять антибиотические лекарственные средства внутрь бактерий, не используя пориновые каналы, играют роль «троянского коня» [26]. Препараты данной группы BAL30072 (моносульфактам) [37, 44], MC-1 (монокарбам) [34], цефидерокол (Cefiderocol/S-649266) (цефалоспорин) (рис. 3) [16, 19, 51] и GSK3342830 (цефалоспорин) [12, 42] характеризуются высокой антибактериальной активностью против антибиотикорезистентных грам–отрицательных бактерий, в том числе Acinetobacter baumannii и Pseudomonas aeruginosa.
Препараты, содержащие галлий
Соединения галлия
Представитель группы легких металлов галлий (gallium — Ga) по химическим свойствам близок к железу, что позволяет ему функционировать в качестве железомиметика, способного нарушить железозависимый рост бактерий, грибов и опухолевых клеток [11]. В настоящее время разработано несколько препаратов галлия, которые преимущественно используются при лечении злокачественных опухолей (табл. 1).
/191-1.jpg)
/192-1.jpg)
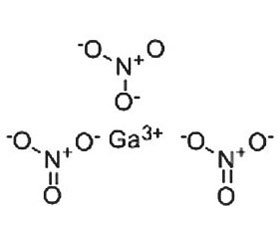
В отличие от трехвалентного железа (Fe3+), которое восстанавливается до двухвалентного состояния (Fe2+), в физиологических условиях трехвалентный галлий (Ga3+) не может принимать участие в окислительно-восстановительных реакциях. Учитывая, что трехвалентное железо является ключевым кофактором многочисленных протеинов, а Ga3+ может функционировать как аналог Fe3+, замещение ионом галлия иона железа приводит к нарушению функционирования многих жизненно важных путей метаболома клеток макроорганизма и бактерий [29]. Клинически нитрат галлия Ga(NO3)3 для внутривенного введения (Ganite®) одобрен для лечения гиперкальциемии при злокачественных новообразованиях [41].
Галлий оказывает антибактериальное действие за счет нескольких механизмов. Во-первых, галлий вытесняет железо из сидерофоров, блокируя поступление железа в бактерию; во-вторых, поглощенные сидерофоры, насыщенные галлием, подавляют у бактерий синтез сидерофоров и способность организовывать биопленки за счет механизма «троянского коня» [11]. Галлий-содержащие соединения модулируют экспрессию нескольких факторов вирулентности у бактерий Pseudomonas aeruginosa. В частности, галлий ингибирует экспрессию пиовердина [18]. Результаты научных исследований свидетельствуют о том, что соединения галлия обладают широким спектром антибактериальной активности. По мнению A.B. Kelson и соавт. [29], галлиевые комплексы представляют собой новый класс противоинфекционных средств, которые отличаются механизмом действия от обычных антибиотиков. Простые галлиевые соли, такие как тартрат галлия, мальтолат, цитрат галлия, показали хорошие антибактериальные свойства in vivo (табл. 2).
Галлий не чувствителен к классическим механизмам резистентности, ассоциированным с антибиотиками, таким как снижение поглощения лекарственного средства, усиление оттока препаратов из внутреннего континуума бактерии, синтез –ферментов, разрушающих молекулу антибактериального средства (в частности, бета-лактамаз). Наиболее изученным средством является цитрат галлия, который проявляет выраженную противобактериальную активность по отношению ко многим грам–отрицательным бактериям (МПК составляет примерно 1–5 мкг/мл) и противобиопленочную активность (табл. 3) [36].
В частности, показано, что цитрат галлия, применяемый местно для лечения ран кожи, инфицированных бактериями Klebsiella pneumoniae, снижает бактериальную нагрузку и способствует выздоровлению [45]. Лечение малтолатом галлия значительно уменьшает колонизацию бактериями Staphylococcus aureus и Acinetobacter basumannii термических ран у экспериментальных животных [13].
Yukihiro Kaneko и соавт. [28] показали, что галлий ингибирует рост колонии и формирование биопленки бактериями Pseudomonas aeruginosa. Ингаляционное применение галлия у мышей с пневмонией, вызванной Pseudomonas aeruginosa PA103, способствует выживанию экспериментальных животных. Так, ингаляционное введение через 3 часа после заражения одной дозы галлия (Ga(NO3)3) сопровождается достоверным уменьшением гистологических признаков воспаления легких и практически у всех зараженных мышей приводит к предотвращению летального исхода. Ингаляционное введение галлия предупреждает и формирование биопленки при хронической инфекции дыхательных путей. Авторы подчеркивают, что галлий как препарат, одобренный FDA (для внутривенного введения), является потенциально перспективным новым терапевтическим средством для лечения респираторных инфекций, вызванных Pseudomonas aeruginosa.
Продемонстрировано, что нитрат галлия обладает выраженной антимикробной активностью против штаммов бактерий Pseudomonas aeruginosa, выделенных от пациентов с муковисцидозом [6].
Прогресс в технологии доставки галлия позволил увеличить его доступность для бактерий. Так, S.P. Valappil и соавт. разработали новые препараты на основе фосфатного стекла, легированного галлием [47], и галлий-карбоксиметилцеллюлозы [48], которые обеспечивают контролируемое выделение галлия. Препараты, созданные на основе фосфатного стекла, легированного галлием, обладают высокой антибактериальной активностью против бактерий MRSA, а на основе галлий-карбоксиметилцеллюлозы — против бактерий Pseudomonas aeruginosa. Также разрабатываются такие носители галлия, как мезопористые биоактивные стеклянные каркасы, галлий-содержащее фосфоросиликатное стекло [40].
Галлий-содержащие сидерофоры
Применение галлий-содержащих сидерофоров представляет собой еще один подход к терапии инфекций, вызванных антибиотикорезистентными бактериями [25]. Так, было установлено, что Ga-DFO (галлий-десферриоксамин) обладает достаточной терапевтической активностью при лечении инфекций, вызванных Pseudomonas aeruginosa [4]. Сочетание деферипрона и галлий-протопорфирина (GaPP) обладает антибактериальным действием, и его назначение уменьшает бактериальную нагрузку в модели искусственной раны, инфицированной бактериями Staphylococcus aureus. Также применение сочетания деферипрона и GaPP усиливает уровень антибактериальной активности гентамицина и ципрофлоксацина [43].
Выводы
Существующие эффективные методы лечения, разработанные для осуществления контроля над уровнем обеспечения железом бактерии, основаны на применении препаратов, которые хелатируют ионы железа, подавляют механизмы синтеза сидерофоров, замещают трехвалентное железо трехвалентным галлием или действуют по принципу «троянского коня», доставляя в бактерию антимикробные средства или галлий. Однако необходимо отметить, что современное состояние управления механизмами, участвующими в обеспечении бактериальных патогенов железом, не исчерпало потенциал существующих методов терапии. В частности, практически не изучены штаммоспецифические механизмы ингибирования процесса поглощения нагруженных железом сидерофоров и способы выделения ионов железа из бактерий. Также исследование функционирования системы липокалина-2 позволит использовать данный эволюционный путь защиты от инфекционных агентов в медицинской практике.
Медикаментозное управление обеспечением патогенных бактерий железом с учетом высокой степени зависимости жизнедеятельности микроорганизмов и уровня бактериальной вирулентности от доступности пула железа открывает широкую перспективу для будущих научных исследований, которые, несомненно, приведут к разработке новых терапевтических подходов к лечению инфекционных заболеваний.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Arnold C. Pharmacokinetics of gallium maltolate after intragastric administration in adult horses / C. Arnold, M.K. Chaffin, N. Cohen et al. // Am. J. Vet. Res. — 2010 Nov. — 71(11). — Р. 1371-6. doi: 10.2460/ajvr.71.11.1371.
2. Atala A. Re: Cellular Uptake and Anticancer Activity of Carboxylated Gallium Corroles // J. Urol. — 2016 Nov. — 196(5). — Р. 1584-1585. doi: 10.1016/j.juro.2016.08.022.
3. Ballouche M., Cornelis P., Baysse C. Iron metabolism: a promi–sing target for antibacterial strategies // Recent Pat. Antiinfect. Drug Discov. — 2009 Nov. — 4(3). — Р. 190-205. PMID: 19594436.
4. Banin E. The potential of desferrioxamine-gallium as an anti-Pseudomonas therapeutic agent / E. Banin, A. Lozinski, K.M. Brady et al. // Proc. Natl Acad. Sci. USA. — 2008, Oct 28. — 105(43). — Р. 16761-6. doi: 10.1073/pnas.0808608105.
5. Bernstein L.R. Ga Therapeutic Gallium Compounds // https://www.gallixa.com/GAMReferences/MetallotherapeuticsChapter14.pdf
6. Bonchi C. Pyoverdine and proteases affect the response of Pseudomonas aeruginosa to gallium in human serum / C. Bonchi, E. Frangipani, F. Imperi, P. Visca // Antimicrob Agents Chemother. — 2015 Sep. — 59(9). — Р. 5641-6. doi: 10.1128/AAC.01097-15.
7. Braun V. Sideromycins: tools and antibiotics / V. Braun, A. Pramanik, T. Gwinner et al. // Biometals. — 2009 Feb. — 22(1). — Р. 3-13. doi: 10.1007/s10534-008-9199-7.
8. Chen M. Synthesis and molecular structure of an abnormal carbene-gallium chloride complex / M. Chen, Y. Wang, R.J. Gilliard Jr et al. // Dalton Trans. — 2014, Oct 14. — 43(38). — Р. 14211-4. doi: 10.1039/c4dt00933a.
9. Chevalier S. Structure, function and regulation of Pseudomonas aeruginosa porins / S. Chevalier, E. Bouffartigues, J. Bodilis et al. // FEMS Microbiol Rev. — 2017, Sep 1. — 41(5). — Р. 698-722. doi: 10.1093/femsre/fux020.
10. Chitambar C.R. Gallium and its competing roles with iron in biological systems // Biochim. Biophys. Acta. — 2016 Aug. — 1863(8). — Р. 2044-53. doi: 10.1016/j.bbamcr.2016.04.027.
11. Chitambar C.R. The therapeutic potential of iron-targeting gallium compounds in human disease: From basic research to clinical application // Pharmacol. Res. — 2017 Jan. — 115. — Р. 56-64. doi: 10.1016/j.phrs.2016.11.009.
12. Coates A.R., Halls G., Hu Y. Novel classes of antibiotics or more of the same? // Br. J. Pharmacol. — 2011 May. — 163(1). — Р. 184-94. doi: 10.1111/j.1476-5381.2011.01250.x.
13. DeLeon K. Gallium maltolate treatment eradicates Pseudomonas aeruginosa infection in thermally injured mice / K. DeLeon, F. Balldin, C. Watters et al. // Antimicrob. Agents Chemother. — 2009 Apr. — 53(4). — Р. 1331-7. doi: 10.1128/AAC.01330-08.
14. Despaigne A.A. 2-Acetylpyridine- and 2-benzoylpyridine-derived hydrazones and their gallium(III) complexes are highly cytotoxic to glioma cells / A.A. Despaigne, G.L. Parrilha, J.B. Izidoro et al. // Eur. J. Med. Chem. — 2012 Apr. — 50. — Р. 163-72. doi: 10.1016/j.ejmech.2012.01.051.
15. Drake E.J. Biochemical and structural characterization of bisubstrate inhibitors of BasE, the self-standing nonribosomal peptide synthetase adenylate-forming enzyme of acinetobactin synthesis / E.J. Drake, B.P. Duckworth, J. Neres et al. // Biochemistry. — 2010, Nov 2. — 49(43). — Р. 9292-305. doi: 10.1021/bi101226n.
16. Falagas M.E. Activity of cefiderocol (S-649266) against carbapenem-resistant Gram-negative bacteria collected from inpatients in Greek hospitals / M.E. Falagas, T. Skalidis, K.Z. Vardakas et al. // J. Antimicrob. Chemother. — 2017, Jun 1. — 72(6). — Р. 1704-1708. doi: 10.1093/jac/dkx049.
17. Foley T.L., Simeonov A. Targeting iron assimilation to develop new antibacterials // Expert Opin. Drug Discov. — 2012 Sep. — 7(9). — Р. 831-47. doi: 10.1517/17460441.2012.708335.
18. García-Contreras R. Gallium induces the production of virulence factors in Pseudomonas aeruginosa / R. García-Contreras, B. Pérez-Eretza, E. Lira-Silva et al. // Pathog. Dis. — 2014 Feb. — 70(1). — Р. 95-8. doi: 10.1111/2049-632X.12105..
19. Ghazi I.M. Pharmacodynamics of cefiderocol, a novel si–derophore cephalosporin, explored in a pseudomonas aeruginosa neutropenic murine thigh model / I.M. Ghazi, M.L. Monogue, M. Tsuji, D.P. Nicolau // Int. J. Antimicrob. Agents. — 2017, Oct 27. — pii: S0924-8579(17)30372-2. doi: 10.1016/j.ijantimicag.2017.10.008.
20. Ghequire M.G., De Mot R. Ribosomally encoded antibacterial proteins and peptides from Pseudomonas // FEMS Microbiol Rev. — 2014 Jul. — 38(4). — Р. 523-68. doi: 10.1111/1574-6976.12079.
21. Górska A., Sloderbach A., Marszałł M.P. Siderophore-drug complexes: potential medicinal applications of the 'Trojan horse' stra–tegy // Trends Pharmacol. Sci. — 2014 Sep. — 35(9). — Р. 442-9. doi: 10.1016/j.tips.2014.06.007.
22. Gulick A.M. Nonribosomal peptide synthetase biosynthetic clusters of ESKAPE pathogens // Nat. Prod. Rep. — 2017, Aug 2. — 34(8). — Р. 981-1009. doi: 10.1039/c7np00029d.
23. Hider R.C., Kong X. Chemistry and biology of siderophores // Nat. Prod. Rep. — 2010 May. — 27(5). — Р. 637-57. doi: 10.1039/b906679a.
24. Hijazi S., Visca P., Frangipani E. Gallium-Protoporphyrin IX Inhibits Pseudomonas aeruginosa Growth by Targeting Cytochromes // Front. Cell. Infect. Microbiol. — 2017, Jan 26. — 7. — Р. 12. doi: 10.3389/fcimb.2017.00012.
25. Huayhuaz J.A. Desferrioxamine and desferrioxamine-caffeine as carriers of aluminum and gallium to microbes via the Trojan Horse Effect / J.A. Huayhuaz, H.A. Vitorino, O.S. Campos et al. // J. Trace Elem. Med. Biol. — 2017 May. — 41. — Р. 16-22. doi: 10.1016/j.jtemb.2017.01.006.
26. Ji C., Juárez-Hernández R.E., Miller M.J. Exploiting bacterial iron acquisition: siderophore conjugates // Future Med. Chem. — 2012 Mar. — 4(3). — Р. 297-313. doi: 10.4155/fmc.11.191.
27. Johnstone T.C., Nolan E.M. Beyond iron: non-classical biological functions of bacterial siderophores // Dalton Trans. — 2015, Apr 14. — 44(14). — Р. 6320-39. doi: 10.1039/c4dt03559c.
28. Kaneko Y. The transition metal gallium disrupts Pseudomonas aeruginosa iron metabolism and has antimicrobial and antibiofilm activity / Y. Kaneko, M. Thoendel, O. Olakanmi et al. // J. Clin. Invest. — 2007 Apr. — 117(4). — Р. 877-88. doi: 10.1172/JCI30783.
29. Kelson A.B., Carnevali M., Truong-Le V. Gallium-based anti-infectives: targeting microbial iron-uptake mechanisms // Curr. Opin. Pharmacol. — 2013 Oct. — 13(5). — Р. 707-16. doi: 10.1016/j.coph.2013.07.001.
30. Kubista B. Distinct activity of the bone-targeted gallium compound KP46 against osteosarcoma cells - synergism with autophagy inhibition / B. Kubista, T. Schoefl, L. Mayr et al. // J. Exp. Clin. Cancer Res. — 2017, Apr 12. — 36(1). — Р. 52. doi: 10.1186/s13046-017-0527-z.
31. Kumar K. A novel approach of 67-Gallium-citrate three-phase bone scan to diagnose bone infection: A report of three cases // Indian J. Nucl. Med. — 2016 Oct — Dec. — 31(4). — Р. 260-266. DOI: 10.4103/0972-3919.190801.
32. Kurth C., Kage H., Nett M. Siderophores as molecular tools in medical and environmental applications // Org. Biomol. Chem. — 2016, Sep 21. — 14(35). — Р. 8212-27. doi: 10.1039/c6ob01400c.
33. Machado I. Bioactivity of pyridine-2-thiolato-1-oxide metal complexes: Bi(III), Fe(III) and Ga(III) complexes as potent anti-Mycobacterium tuberculosis prospective agents / I. Machado, L.B. Marino, B. Demoro et al. // Eur. J. Med. Chem. — 2014, Nov 24. — 87. — Р. 267-73. doi: 10.1016/j.ejmech.2014.09.067.
34. McPherson C.J. Clinically relevant Gram-negative resistance mechanisms have no effect on the efficacy of MC-1, a novel siderophore-conjugated monocarbam / C.J. McPherson, L.M. Aschenbrenner, B.M. Lacey et al. // Antimicrob. Agents Chemother. — 2012 Dec. — 56(12). — Р. 6334-42. doi: 10.1128/AAC.01345-12.
35. Miethke M., Marahiel M.A. Siderophore-based iron acquisition and pathogen control // Microbiol. Mol. Biol. Rev. — 2007 Sep. — 71(3). — Р. 413-51. doi: 10.1128/MMBR.00012-07.
36. Minandri F. Promises and failures of gallium as an antibacterial agent / F. Minandri, C. Bonchi, E. Frangipani et al. // Future Microbiol. — 2014. — 9(3). — Р. 379-97. doi: 10.2217/fmb.14.3.
37. Moynié L. Structure and Function of the PiuA and PirA Side–rophore-Drug Receptors from Pseudomonas aeruginosa and Acinetobacter baumannii / L. Moynié, A. Luscher, D. Rolo et al. // Antimicrob. Agents Chemother. — 2017, Mar 24. — 61(4). pii: e02531-16. doi: 10.1128/AAC.02531-16.
38. Page M.G. Siderophore conjugates // Ann. N.Y. Acad. Sci. — 2013 Jan. — 1277. — Р. 115-26. doi: 10.1111/nyas.
39. Qi J. Synthesis, crystal structure and antiproliferative mechanisms of 2-acetylpyridine-thiosemicarbazones Ga(III) with a greater selectivity against tumor cells / J. Qi, Y. Zheng, K. Qian et al. // –J. –Inorg. Biochem. — 2017 Dec. — 177. — Р. 110-117. doi: 10.1016/j.jinorgbio.2017.09.012.
40. Rangel-Vega A. Drug repurposing as an alternative for the treatment of recalcitrant bacterial infections / A. Rangel-Vega, L.R. Bernstein, E.A. Mandujano-Tinoco et al. // Front. Microbiol. — 2015, Apr 9. — 6. — Р. 282. doi: 10.3389/fmicb.2015.00282.
41. Reagan P., Pani A., Rosner M.H. Approach to diagnosis and treatment of hypercalcemia in a patient with malignancy // Am. J. Kidney Dis. — 2014 Jan. — 63(1). — Р. 141-7. doi: 10.1053/j.ajkd.2013.06.025..
42. Rhomberg P.R. Multilaboratory broth microdilution MIC reproducibility study for GSK3342830, a novel catecholcephem / Rhomberg P.R., Shortridge D., Huband M.D. et al. // American Society for Microbiology (ASM Microbe), 1–5 June 2017. North Liberty (IA): JMI Laboratories, 2017 (https://www.jmilabs.com/data/posters/ASMMicrobe17-GSKreproduce).
43. Richter K. Deferiprone and Gallium-Protoporphyrin Have the Capacity to Potentiate the Activity of Antibiotics in Staphylococcus aureus Small Colony Variants / K. Richter, N. Thomas, G. Zhang et al. // Front. Cell. Infect. Microbiol. — 2017, Jun 22. — 7. — Р. 280. doi: 10.3389/fcimb.2017.00280.
44. Tan L. Discovery of Novel Pyridone-Conjugated Monosulfactams as Potent and Broad-Spectrum Antibiotics for Multidrug-Resistant Gram-Negative Infections / L. Tan, Y. Tao, T. Wang et al. // J. Med. Chem. — 2017, Apr 13. — 60(7). — Р. 2669-2684. doi: 10.1021/acs.jmedchem.6b01261.
45. Thompson M.G. Evaluation of Gallium Citrate Formulations against a Multidrug-Resistant Strain of Klebsiella pneumoniae in a Murine Wound Model of Infection / M.G. Thompson, V. Truong-Le, Y.A. Alamneh et al. // Antimicrob. Agents Chemother. — 2015 Oct. — 59(10). — Р. 6484-93. doi: 10.1128/AAC.00882-15.
46. Tripathi A. Baulamycins A and B, broad-spectrum antibio–tics identified as inhibitors of siderophore biosynthesis in Staphylococcus aureus and Bacillus anthracis / A. Tripathi, M.M. Schofield, G.E. Chlipala et al. // J. Am. Chem. Soc. — 2014, Jan 29. — 136(4). — Р. 1579-86. doi: 10.1021/ja4115924.
47. Valappil S.P. Controlled delivery of antimicrobial gallium ions from phosphate-based glasses / S.P. Valappil, D. Ready, E.A. Abou Neel et al. // Acta Biomater. — 2009 May. — 5(4). — Р. 1198-210. doi: 10.1016/j.actbio.2008.09.019.
48. Valappil S.P. Effect of novel antibacterial gallium-carboxymethyl cellulose on Pseudomonas aeruginosa / S.P. Valappil, H.H. Yiu, L. Bouffier et al. // Dalton Trans. — 2013, Feb 7. — 42(5). — Р. 1778-86. doi: 10.1039/c2dt32235h.
49. Vila-Farres X. Antimicrobials Inspired by Nonribosomal Peptide Synthetase Gene Clusters / X. Vila-Farres, J. Chu, D. Inoyama et al. // J. Am. Chem. Soc. — 2017, Feb 1. — 139(4). — Р. 1404-1407. doi: 10.1021/jacs.6b11861.
50. Wang W. Siderophore production by actinobacteria / W. Wang, Z. Qiu, H. Tan, L. Cao // Biometals. — 2014 Aug. — 27(4). — Р. 623-31. doi: 10.1007/s10534-014-9739-2.
51. Wright H., Bonomo R.A., Paterson D.L. New agents for the treatment of infections with Gram-negative bacteria: restoring the miracle or false dawn? // Clin. Microbiol. Infect. — 2017 Oct. — 23(10). — Р. 704-712. doi: 10.1016/j.cmi.2017.09.001.
52. Zanias S. Synthesis, Structure, and Antiproliferative Activity of Three Gallium(III) Azole Complexes / S. Zanias, G.S. Papaefstathiou, C.P. Raptopoulou et al. // Bioinorg. Chem. Appl. — 2010. — pii: 168030. doi: 10.1155/2010/168030.

/189-1.jpg)
/189-2.jpg)
/190-1.jpg)
/191-1.jpg)
/192-1.jpg)
/193-1.jpg)