Введение
В предыдущих публикациях представлены современные данные о таких группах антиоксидантных лекарственных средств, как ингибиторы активности NOX, активаторы фактора транскрипции NRF2, миметики антиоксидантных ферментов [1, 2]. Наиболее многочисленным антиоксидантным классом медикаментозных средств, влияющих на окислительно-восстановительное состояние биологических систем, является группа скавенджерных антиоксидантов, которая включает в себя тиолсодержащие соединения, индукторы биосинтеза глутатиона, антиоксидантные витамины (витамины А, Е, С), β-каротин, коэнзим Q10, спиновые ловушки.
Тиолсодержащие антиоксиданты
Краткая характеристика тиолсодержащих антиоксидантных лекарственных средств представлена в табл. 1.
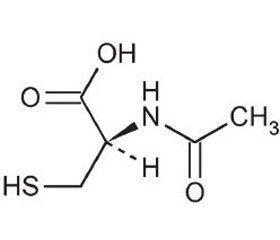
N-ацетилцистеин
В клинической практике N-ацетилцистеин используется более 30 лет при лечении заболеваний органов дыхания в качестве муколитического средства [12, 35]. В 1990-е годы были выявлены антиоксидантные свойства N-ацетилцистеина. После приема внутрь он быстро всасывается в пищеварительном тракте — максимальная концентрация в плазме крови достигается через 2–3 часа. Период полувыведения N-ацетилцистеина составляет приблизительно 6,3 часа [13].
Антиоксидантное и противовоспалительное –действие
Антиоксидантная активность N-ацетилцистеи–на связана с тем, что препарат является производ–ным аминокислоты цистеина, и его тиольные группы напрямую взаимодействуют с электрофильными группами свободных радикалов. Кроме того, являясь предшественником глутатиона, N-ацетилцистеин обладает и непрямыми антиоксидантными свойствами, усиливая активность глутатион-S-трансферазы и ряда других ферментов, участвующих в поддержании баланса в системе «оксиданты — антиоксиданты» [3, 13, 34]. Терапия N-ацетилцистеином сопровождается восстановлением дисбаланса редокс-состояния в респираторном тракте. Пероральное применение препарата способствует увеличению концентрации уровня глутатиона (GSH) в сыворотке крови за счет дотации цистеина и усиления синтеза GSH. Пероральное назначение N-ацетилцистеина взрослым людям в дозе 600 мг/сут сопровождается увеличением уровня GSH в жидкости бронхоальвеолярного лаважа, снижением генерации активных кислородсодержащих метаболитов (АКМ) альвеолярными макрофагами. Применение N-ацетилцистеина способствует уменьшению активности воспаления в легочной ткани. На фоне лечения N-ацетилцистеином происходит увеличение содержания нейтрофилов в периферической крови на фоне уменьшения их представительства в ткани респираторного тракта, снижения активности фактора транскрипции NF-κB в клетках респираторного тракта и снижения концентрации эозинофильных катионных белков в мокроте [6, 13, 23, 33]. Кроме того, что N-ацетилцистеин модулирует активность NF-κB, он оказывает влияние и на другие факторы транскрипции и редокс-чувствительные внутриклеточные сигнальные каскады, в частности, на p38-, ERK1/2-, SAPK/JNK-ассоциированные пути [23].
Влияние на активность эластазы
Лечение N-ацетилцистеином приводит к ингибированию активности эластазы и улучшению вентиляционной функции легких [19, 34].
Ингибирование развития фиброза легкого
N-ацетилцистеин предотвращает действие TGF-β1, которое способствует эпителиально-мезенхимальной трансдифференцировке и индуцирует фиброзирование. Показано, что N-ацетил–цистеин уменьшает активность TGF-β1-индуцированной продукции фибронектина, VEGF и коллагена. Также N-ацетилцистеин подавляет фосфорилирование фактора Smad 2/3, препятствует димеризации мономеров TGF-β1, ингибирует функционирование TGF-β1-индуцированного гена-репортера [39].
Клиническая эффективность
Пероральный прием N-ацетилцистеина сопровождается уменьшением частоты обострений хронического бронхита [40]. Однако, согласно результатам крупного рандомизированного плацебо-контролируемого исследования, ежедневное пероральное применение N-ацетилцистеина (600 мг в сутки) у больных с хронической обструктивной болезнью легких (ХОБЛ) не сопровождалось ни улучшением функции легких, ни снижением частоты обострений заболевания [15]. E.F. Nash и соавт. [24] не обнаружили существенных отличий в течении муковисцидоза у больных, получавших ингаляционно и не принимавших тиолсодержащие муколитики. P.J. Poole и P.N. Black в 2006 году [27] на основании данных Кокрановского метаанализа 26 плацебо-контролируемых рандомизированных клинических исследований, в которых приняли участие 7335 пациентов, показали, что применение муколитических препаратов, исключая эрдостеин, при ХОБЛ не уменьшает частоту обострений заболевания и достоверно не влияет на вентиляционную функцию легких. Авторы не выявили существенных различий в эффективности между муколитическими препаратами. Те же авторы в 2010 и 2012 годах [27, 28] показали, что применение муколитических средств у пациентов с хроническим бронхитом и ХОБЛ сопровождается незначительным снижением обострений заболевания и общего числа дней нетрудоспособности. Данные авторы рекомендуют назначение муколитических средств, особенно в зимнее время года, больным с умеренным или тяжелым течением ХОБЛ, которые не используют ингаляционные кортикостероиды. В настоящее время проводится стратифицированное рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование PANTHEON, целью которого является изучение клинической эффективности и безопасности применения высоких доз (1200 мг/сут) N-ацетилцистеина [28].
N-ацистелин
N-ацистелин является производным N-аце–тилцистеина и обладает, подобно своему предшественнику, муколитическим, антиоксидантным и противовоспалительным действием. Однако, будучи нейтральным, в отличие от N-ацетилцистеина, N-ацистелин не вызывает побочных явлений при интрабронхиальном введении. В связи с этим N-ацистелин может быть более перспективным антиоксидантным препаратом, чем N-ацетилцистеин, при лечении хронических воспалительных заболеваний органов дыхания [25, 30].
Процистеин
Процистеин (L-2-оксотиазолидин-4-карбоновая кислота) является цистеинсодержащим соединением, которое способствует увеличению содержания цистеина в клетке и обладает более высокой степенью биодоступности, чем N-ацетилцистеин. Применение данного лекарственного средства, содержащего тиольные группы, способствует увеличению уровня GSH в митохондриях альвеолярных клеток II типа [11].
Мукоактивные тиолы
К группе мукоактивных тиольных соединений относятся карбоцистеин, эрдостеин, фудостеин. Данные лекарственные средства также обладают способностью снижать уровень бактериальной адгезии.
Карбоцистеин
Карбоцистеин (S-карбоксиметилцистеин) обладает антиоксидантным и противовоспалительным действием. Карбоцистеин впервые синтезирован в 1930 году как мукорегулирующее лекарственное средство, рекомендованное для использования при лечении заболеваний органов дыхания. Однако препарат был разрешен для применения в клинической практике только в 1960 году. Карбоцистеин хорошо всасывается в пищеварительном тракте, достигая максимальной концентрации в сыворотке крови через 1–1,7 часа после приема внутрь, период его полувыведения составляет 1,33 часа. Препарат легко проникает в ткань легкого и бронхиальный секрет [26].
Антиоксидантное и противовоспалительное –действие
Карбоцистеин, несмотря на то, что его молекула не обладает свободными тиольными группами, может окисляться АКМ с образованием цистеинсульф–оксида. В эксперименте показано, что введение карбоцистеина в жидкость бронхоальвеолярного лаважа больных ХОБЛ сопровождается достоверным снижением уровня разрушения ДНК лимфоцитов. Функционально карбоцистеин проявляет себя как активный скавенджер по отношению к АКМ: H2O2, HOCl, OH•, ONOO–. Также карбоцистеин подавляет активность генерации АКМ ксантиноксидазой эндотелиоцитов [4, 7]. Он ингибирует миграцию нейтрофилов, макрофагов и эозинофилов в очаг поражения легкого. Кроме этого, под влиянием карбоцистеина увеличивается бактериальный клиренс из респираторного тракта. Продемонстрировано, что терапия карбоцистеином, которая продолжалась на протяжении шести месяцев, привела к значительному снижению 8-изопростана и провоспалительных цитокинов (интерлейкин (IL)-8 и IL-6) в выдыхаемом воздухе у больных с ХОБЛ [21, 36]. Доклинические и клинические исследования продемонстрировали, что терапевтическую эффективность пролонгированной терапии карбоцистеином в большей степени определяет его антиоксидантное и противовоспалительное действие, чем муколитическая активность [8].
Клиническая эффективность
Исследования терапевтической эффективности карбоцистеина показали, что его пролонгированное применение у больных с ХОБЛ является целесообразным, позволяющим снизить частоту обострений заболевания [8, 14, 29].
Эрдостеин
Эрдостеин (2-[(2-оксотиолан-3-ил)карбамоилметилсульфанил]уксусная кислота) является лекарственным средством с выраженным антиоксидантным и противовоспалительным действием [8, 16]. Согласно данным метаанализа, эрдостеин по своей терапевтической эффективности превосходит другие муколитические средства [9]. Рандомизированное двойное слепое плацебо-контролируемое исследование EQUALIFE эффективности непрерывной пролонгированной (8 месяцев) терапии больных с умеренной тяжестью ХОБЛ эрдостеином (300 мг два раза в сутки) показало, что данное лекарственное средство обеспечивает снижение частоты обострений, уменьшение продолжительности обострений и способствует повышению качества жизни пациентов [37]. Также установлено, что после 10-дневной терапии эрдостеином (300 мг два раза в сутки) у больных с ХОБЛ происходит достоверное увеличение значений объема форсированного выдоха за первую секунду (ОФВ1) и снижение уровня 8-изопростана, лейкотриена В4 (LTB4) и LTE4 [11].
Фудостеин
Фудостеин ([(-)-(R)-2-амино-3-(3-гидроксипро–пилтиол)]пропионовая кислота) используется в качестве мукоактивного лекарственного средства при лечении хронических респираторных заболеваний, таких как бронхиальная астма, хронический бронхит, ХОБЛ, эмфизема легких, бронхоэктатическая болезнь. Фудостеин отличается от N-ацетилцистеина более высокой степенью биодоступности [29]. Важной особенностью фудостеина является его способность ингибировать экспрессию гена MUC5AC [5]. Считают, что фудостеин может использоваться как антиоксидантное лекарственное средство при лечении больных с бронхиальной астмой или ХОБЛ [30].
Глутатион
Дотационная терапия глутатионом
Многие патологические состояния сопровож–даются снижением концентрации GSH. Низкий уровень GSH может быть обусловлен различными причинами: оксидативным стрессом, который приводит к окислению GSH; дефицитом экзогенного поступления GSH или аминокислот; нарушением его синтеза или усилением его потребления. Поскольку при целом ряде заболеваний (остром респираторном дистресс-синдроме, ХОБЛ, идиопатическом фиброзирующем альвеолите, муковисцидозе) наблюдается низкий уровень GSH в бронхоальвеолярной жидкости, дотационная терапия глутатионом может стать важнейшим терапевтическим направлением лечения [17]. Показано, что уровень содержания GSH в респираторном тракте изменяется как при его пероральном приеме, так и при ингаляционном введении, в частности у больных муковисцидозом (табл. 2) [18].
/200-1.jpg)
Однако пероральное применение GSH у больных муковисцидозом, несмотря на положительные результаты, полученные Alfredo Visca и соавт. [22, 32], из-за нарушения его транспорта во внеклеточное пространство, по всей вероятности, не имеет достаточных терапевтических перспектив. Несмотря на полученные некоторыми авторами результаты, свидетельствующие о положительном влиянии ингаляционно введенного GSH на течение муковисцидоза и идиопатического фиброзирующего альвеолита, N.S. Gould и B.J. Day [18], учитывая тот факт, что ингаляционно введенный GSH сопровож–дается повышением уровня концентрации GSSG в бронхоальвеолярной жидкости больных, считают, что данный способ лечения сопряжен с риском развития гиперреактивности бронхиального дерева.
Рекомбинантный человеческий TRX1 (тиоредоксин)
В настоящее время фирмой Redox Bio Science Inc. разрабатывается лекарственное средство, основой которого является рекомбинантный человеческий TRX1, для применения в терапии больных ХОБЛ и с острым респираторным дистресс-синдромом [11, 31, 38].
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Абатуров А.Е. Медикаментозное управление окислительно-восстановительным состоянием организма при заболеваниях органов дыхания (часть 1) / А.Е. Абатуров, А.П. Волосовец, Т.П. Борисова // Здоровье ребенка. — 2018. — № 2(13). — С. 232-240. — DOI: 10.22141/2224-0551.13.2.2018.129558.
2. Абатуров А.Е. Медикаментозное управление окислительно-восстановительным состоянием организма при заболеваниях органов дыхания (часть 2) / А.Е. Абатуров, А.П. Волосовец, Т.П. Борисова // Здоровье ребенка. — 2018. — № 3(13). — С. 334-337. — DOI: 10.22141/2224-0551.13.3.2018.132918.
3. Моногарова Н.Е. Перспективы применения ацетилцистеина в комплексной терапии идиопатических интерстициальных пневмоний // Український пульмонологічний журнал. — 2007. — № 3. — C. 56-58.
4. Antioxidant activity of carbocysteine lysine salt monohydrate / S. Pinamonti, L. Venturoli, M. Leis et al. // Panminerva Med. — 2001. — Vol. 43, № 3. — P. 215-220. — PMID: 11579333.
5. Antonela Antoniu S. Fudosteine effects on mucin production // Expert. Opin. Investig. Drugs. — 2009. — Vol. 18, № 1. — P. 105-107. — doi: 10.1517/13543780802623863.
6. Antipyretic activity of N-acetylcysteine / S. Wrotek, T. Jedrzejewski, E. Potera-Kram, W. Kozak // J. Physiol. Pharmacol. — 2011. — Vol. 62, № 6. — P. 669-675. — PMID: 22314570.
7. Carbocisteine can scavenge reactive oxygen species in vitro / H. Nogawa, Y. Ishibashi, A. Ogawa et al. // Respirology. — 2009. — Vol. 14, № 1. — P. 53-59. — doi: 10.1111/j.1440-1843.2008.01424.x.
8. Carbocysteine: clinical experience and new perspectives in the treatment of chronic inflammatory diseases / A. Macciò, C. Madeddu, F. Panzone, G. Mantovani // Expert. Opin. Pharmacother. — 2009. — Vol. 10, № 4. — P. 693-703. — doi: 10.1517/14656560902758343.
9. Cazzola M. The therapeutic efficacy of erdosteine in the treatment of chronic obstructive bronchitis: a meta-analysis of individual patient data / M. Cazzola, I. Floriani, C.P. Page // Pulm. Pharmacol. Ther. — 2010. — Vol. 23, № 2. — P. 135-144. — doi: 10.1016/j.pupt.2009.10.002.
10. Dal Negro R.W. Erdosteine: antitussive and anti-inflammatory effects // Lung. — 2008. — Vol. 186, Suppl. 1. — P. S70-S73. — doi: 10.1007/s00408-007-9065-3.
11. De Boer W.I. Future therapeutic treatment of COPD: struggle between oxidants and cytokines/ W.I. de Boer, H. Yao, I. Rahman // Int. J. Chron. Obstruct. Pulmon. Dis. — 2007. — Vol. 2, № 3. — P. 205-228. — PMID: 18229560.
12. De Vries N. N-acetyl-l-cysteine / N. De Vries, S. De Flora // J. Cell. Biochem. Suppl. — 1993. — Vol. 17F. — P. 270-277. — PMID: 8412205.
13. Dekhuijzen P.N. The role for N-acetylcysteine in the management of COPD / P.N. Dekhuijzen, W.J. van Beurden // Int. J. Chron. Obstruct. Pulmon. Dis. — 2006. — Vol. 1, № 2. — P. 99-106. — PMID: 18046886.
14. Effect of carbocisteine on acute exacerbation of chronic obstructive pulmonary disease (PEACE Study): a randomised placebo-controlled study / J.P. Zheng, J. Kang, S.G. Huang et al. // Lancet. — 2008. — Vol. 371, № 9629. — P. 2013-2018. — doi: 10.1016/S0140-6736(08)60869-7.
15. Effects of N-acetylcysteine on outcomes in chronic obstructive pulmonary disease (Bronchitis Randomized on NAC Cost-Utility Study, BRONCUS): a randomised placebo-controlled trial / M. Decramer, M. Rutten-van Mölken, P.N. Dekhuijzen et al. // Lancet. — 2005. — Vol. 365, № 9470. — P. 1552-1560. — DOI: 10.1016/S0140-6736(05)66456-2.
16. Erdosteine affects eicosanoid production in COPD / R.W. Dal Negro, M. Visconti, S. Tognella, C. Micheletto // Int. J. Clin. Pharmacol. Ther. — 2011. — Vol. 49, № 1. — P. 41-45. — PMID: 21176724.
17. Ghezzi P. Role of glutathione in immunity and inflammation in the lung // Int. J. Gen. Med. — 2011. — Vol. 4. — P. 105-113. — doi: 10.2147/IJGM.S15618.
18. Gould N.S. Targeting maladaptive glutathione responses in lung disease / N.S. Gould, B.J. Day // Biochem. Pharmacol. — 2011. — Vol. 81, № 2. — P. 187-193. — doi: 10.1016/j.bcp.2010.10.001.
19. High-dose oral N-acetylcysteine, a glutathione prodrug, mo–dulates inflammation in cystic fibrosis / R. Tirouvanziam, C.K. Conrad, T. Bottiglieri et al. // Proc. Natl. Acad. Sci. USA. — 2006. — Vol. 103, № 12. — P. 4628-4633. — DOI: 10.1073/pnas.0511304103.
20. High-Dose N-Acetylcysteine in the Prevention of COPD Exacerbations: Rationale and Design of the PANTHEON Study / J.P. Zheng, F.Q. Wen, C.X. Bai et al. // COPD. — 2012 Oct 12. — Vol. 10, № 2. — P. 164-171. — doi: 10.3109/15412555.2012.732628.
21. Hooper C. The role for S-carboxymethylcysteine (carbocisteine) in the management of chronic obstructive pulmonary disease / C. Hooper, J. Calvert // Int. J. Chron. Obstruct. Pulmon. Dis. — 2008. — Vol. 3, № 4. — P. 659-669. — PMID: 19281081.
22. Improvement in clinical markers in CF patients using a reduced glutathione regimen: an uncontrolled, observational study / A. Visca, C.T. Bishop, S.C. Hilton, V.M. Hudson // J. Cyst. Fibros. — 2008. — Vol. 7, № 5. — P. 433-436. — doi: 10.1016/j.jcf.2008.03.006.
23. Molecular mechanisms of N-acetylcysteine actions / M. Zafarullah, W.Q. Li, J. Sylvester, M. Ahmad // Cell. Mol. Life Sci. — 2003. — Vol. 60, № 1. — P. 6-20. — PMID: 12613655.
24. Nebulized and oral thiol derivatives for pulmonary disease in cystic fibrosis / E.F. Nash, A. Stephenson, F. Ratjen, E. Tullis // Cochrane Database Syst. Rev. — 2009. — Vol. 1. — № CD007168. — doi: 10.1002/14651858.CD007168.pub2.
25. Pharmacologial and Dietary Antioxidant Therapies for Chronic Obstructive Pulmonary Disease / S. Biswas, J.W. Hwang, P.A. Kirkham, I. Rahman // Curr. Med. Chem. — 2013. — № 20(12). — Р. 1496-530. — PMID: 22963552.
26. Pharmacokinetic behavior of S-carboxymethylcysteine-Lys in patients with chronic bronchitis / P.C. Braga, M. Borsa, L. De Angelis et al. // Clin. Ther. — 1982. — Vol. 4, № 6. — P. 480-488. — PMID: 7093981.
27. Poole P.J. Mucolytic agents for chronic bronchitis or chronic obstructive pulmonary disease / P.J. Poole, P.N. Black // Cochrane Database Syst. Rev. — 2006. — Vol. 3. — № CD001287. — DOI: 10.1002/14651858.CD001287.pub2.
28. Poole P. Mucolytic agents for chronic bronchitis or chronic obstructive pulmonary disease / P.J. Poole, P.N. Black, C.J. Cates // Cochrane Database Syst. Rev. — 2012. — Vol. 8. — № CD001287. — doi: 10.1002/14651858.CD001287.pub4.
29. Rahman I. Antioxidant therapeutic advances in COPD // Ther. Adv. Respir. Dis. — 2008. — Vol. 2, № 6. — P. 351-374. — doi: 10.1177/1753465808098224.
30. Rahman I. Antioxidant pharmacological therapies for COPD / I. Rahman, W. Macnee // Curr. Opin. Pharmacol. — 2012. — Vol. 12, № 3. — P. 256-265. — doi: 10.1016/j.coph.2012.01.015.
31. Role of thioredoxin in lung disease / J. Xu, T. Li, H. Wu, T. Xu // Pulm. Pharmacol. Ther. — 2012. — Vol. 25, № 2. — P. 154-162. — doi: 10.1016/j.pupt.2012.01.002.
32. Rottner M. Mechanisms of the noxious inflammatory cycle in cystic fibrosis / M. Rottner, J.M. Freyssinet, M.C. Martínez // Respir. Res. — 2009. — Vol. 10. — P. 23. — doi: 10.1186/1465-9921-10-23.
33. Sadowska A.M. Antioxidant and anti-inflammatory efficacy of NAC in the treatment of COPD: discordant in vitro and in vivo dose-effects: a review / A.M. Sadowska, B. Manuel-Y-Keenoy, W.A. De Backer // Pulm. Pharmacol. Ther. — 2007. — Vol. 20, № 1. — P. 9-22. — DOI: 10.1016/j.pupt.2005.12.007.
34. Sadowska A.M. N-Acetylcysteine mucolysis in the ma–nagement of chronic obstructive pulmonary disease // Ther. Adv. Respir. Dis. — 2012. — Vol. 6, № 3. — P. 127-135. — doi: 10.1177/1753465812437563.
35. Taéron C. N-Acetylcysteine // Rev. Infirm. — 2010. — Vol. 160. — P. 47-49. — PMID: 20461991.
36. The effect and mechanism of action of carbocysteine on airway bacterial load in rats chronically exposed to cigarette smoke / L. Sun, L. Tang, Y. Xu et al. // Respirology. — 2010. — Vol. 15, № 7. — P. 1064-1071. — doi: 10.1111/j.1440-1843.2010.01816.x.
37. The effect of long-term treatment with erdosteine on chronic obstructive pulmonary disease: the EQUALIFE Study / M. Moretti, P. Bottrighi, R. Dallari et al. // Drugs Exp. Clin. Res. — 2004. — Vol. 30, № 4. — P. 143-152. — PMID: 15553660.
38. Thioredoxin prevents the development and progression of elastase-induced emphysema / T. Kinoshita, T. Hoshino, H. Imaoka et al. // Biochem. Biophys. Res. Commun. — 2007. — Vol. 354, № 3. — P. 712-729. — DOI: 10.1016/j.bbrc.2007.01.053.
39. Todd N.W. Molecular and cellular mechanisms of pulmonary fibrosis / N.W. Todd, I.G. Luzina, S.P. Atamas // Fibrogenesis Tissue Repair. — 2012. — Vol. 5, № 1. — P. 11. — doi: 10.1186/1755-1536-5-11.
40. Update on pharmaceutical and minimally invasive management strategies for chronic obstructive pulmonary disease / R. Rafii, T.E. Albertson, S. Louie, A.L. Chan // Pulm. Med. — 2011. — Vol. 2011. — № 257496. — doi: 10.1155/2011/257496.

/198-1.jpg)
/200-1.jpg)