Резюме
Актуальність. Вторинна панкреатична недостатність у педіатричній практиці зустрічається частіше і може проявлятися в будь-якому віці як на фоні аліментарних порушень харчування, так і при різноманітних запальних захворюваннях верхніх відділів травного каналу. Мета. Дослідження функціонального стану підшлункової залози (ПЗ) у дітей при хронічній гастродуоденальній патології. Матеріали та методи. Дослідження проведено на базі гастроентерологічного відділення Чернівецької обласної клінічної дитячої лікарні впродовж 2013–2018 років. Основну клінічну групу становили 64 дитини віком 8–18 років із хронічною гастродуоденальною патологією: у 29 осіб — хронічний гастрит, у 30 осіб — хронічний гастродуоденіт, у 5 осіб — виразкова хвороба цибулини дванадцятипалої кишки. Всім дітям проводили загальноклінічні дослідження, ультразвукове дослідження (УЗД) органів черевної порожнини, фіброгастродуоденоскопію, Ph-метрію, 3-кратне копрологічне дослідження; визначали активність α-амілази, ліпази сироватки крові, діастази сечі, концентрацію фекальної еластази-1 (ФЕ-1) у калі, С-пептиду в сироватці крові, рівень глюкози в крові; проводили пероральний глюкозотолерантний тест. Статистичну обробку отриманих даних здійснено за допомогою програм «Статистика 6.0». Результати. Провідними були больовий (93,7 %), диспептичний (90,6 %) і астеноневротичний синдроми (57,8 %), порушення моторно-евакуаторної функції шлунка та дванадцятипалої кишки у вигляді гастроезофагеального та дуоденогастрального рефлюксів. У 35,9 ± 3,7 % осіб виявлено ознаки ураження ПЗ: потовщення хвоста залози та підвищення її ехогенності при УЗД, амілорея, креаторея, стеаторея І та ІІ типу, зміни рівня α-амілази, ФЕ-1, «плоскі» криві глюкозотолерантного тесту, що вказувало на початкові порушення вуглеводного обміну. Медіана рівня С-пептиду для дітей основної групи становила 1,29 нг/мл (довірчий інтервал (ДІ) 1,11–3,42), для дітей групи порівняння — 0,89 нг/мл (ДІ 0,23–1,12). Тенденція до підвищення рівня С-пептиду зареєстрована у 12 дітей із надмірною масою тіла, в яких виявлено «плоску» цукрову криву, а також порушення екзокринної функції ПЗ на тлі ультразвукових її змін. Висновки. Зміни функціонального стану ПЗ, що виявлені в обстежених дітей, вказують на необхідність визначення функціонального стану залози та його контроль у динаміці лікування гастродуоденальної патології.
Актуальность. Вторичная панкреатическая недостаточность в педиатрической практике возникает чаще и может проявляться в любом возрасте как на фоне алиментарных нарушений, так и при различных воспалительных заболеваниях верхних отделов пищеварительного тракта. Цель. Исследование функционального состояния поджелудочной железы (ПЖ) у детей при хронической гастродуоденальной патологии. Материалы и методы. Исследование проведено на базе гастроэнтерологического отделения Черновицкой областной клинической детской больницы в течение 2013–2018 гг. Основную клиническую группу составили 64 ребенка в возрасте 8–18 лет с хронической гастродуоденальной патологией: у 29 детей — хронический гастрит, у 30 детей — хронический гастродуоденит, у 5 детей — язвенная болезнь луковицы двенадцатиперстной кишки. Всем детям проводили общеклинические исследования, ультразвуковое исследование (УЗИ) органов брюшной полости, фиброгастродуоденоскопию, Ph-метрию, 3-кратное копрологическое исследование, определяли активность α-амилазы, липазы сыворотки крови, диастазы мочи, концентрацию фекальной эластазы-1 (ФЕ-1) в кале, С-пептида в сыворотке крови, уровень глюкозы в крови, пероральный глюкозотолерантный тест. Статистическая обработка полученных данных осуществлена с помощью программ «Статистика 6.0». Результаты. Ведущими были болевой (93,7 %), диспептический (90,6 %) и астеноневротический синдромы (57,8 %), нарушение моторно-эвакуаторной функции желудка и двенадцатиперстной кишки в виде гастроэзофагеального и дуоденогастрального рефлюксов. У 35,9 ± 3,7 % лиц выявлены признаки поражения ПЖ: утолщение хвоста железы и повышение ее эхогенности при УЗИ, амилорея, креаторея, стеаторея I и II типа, изменения уровня α-амилазы, ФЕ-1, «плоские» кривые глюкозотолерантного теста, что указывало на начальные нарушения углеводного обмена. Медиана уровня С-пептида для детей основной группы составила 1,29 нг/мл (доверительный интервал (ДИ) 1,11–3,42), для детей группы сравнения — 0,89 нг/мл (ДИ 0,23–1,12). Тенденция к повышению уровня С-пептида зарегистрирована у 12 детей с избытком массы тела, у которых выявлена «плоская» сахарная кривая, а также нарушение экзокринной функции ПЖ на фоне ультразвуковых ее изменений. Выводы. Выявленные изменения функционального состояния ПЖ у обследованных детей указывают на необходимость определения функционального состояния железы и его контроль в динамике лечения гастродуоденальной патологии.
Background. Secondary pancreatic insufficiency in pediatric practice happens increasingly frequently and can occur at any age, both against the background of nutritional deficiencies, and various inflammatory diseases of the upper parts of the digestive tract. The purpose was to investigate the pancreatic functional state in children with chronic gastroduodenal pathology. Materials and methods. The study was conducted on the basis of the gastroenterology unit of the Chernivtsi Regional Clinical Children’s Hospital during 2013–2018. The basic clinical group consisted of 64 children aged 8–18 years with chronic gastroduodenal pathology: 29 patients had chronic gastritis, 30 persons had chronic gastroduodenitis, 5 people had peptic ulcer. All children underwent general clinical studies, ultrasound of the abdominal organs, fibrogastroduodenoscopy, pH-metry, 3-fold coprologic examination; there were determined the activity of α-amylase, serum lipase, urine diastase, feces elastase (FE-1) concentration in feces, serum C-peptide, blood glucose level, and an oral glucose-tolerant test was performed. Statistical processing of the obtained data was carried out by means of the programs Statistics 6.0. Results. The key manifestations were pain (93.7 %), dyspepsia (90.6 %), astheno-neurotic syndromes (57.8 %), a violation of the motor-evacuation function of the stomach and duodenum as a gastroesophageal and duodenogastric reflux. 35.9 ± 3.7 % of the patients developed the signs of pancreatic lesion: thickening of the tail of the pancreas and ultrasonic hyperechoic, amylorrhea, creatorrhoea, type I and II steatorrhoea, changes in the α-amylase level, FE-1, ‘flat’ curves of glucose tolerance test, that indicated the initial disturbances of carbohydrate metabolism. Median C-peptide for children of the basic group was 1.29 ng/ml (CI 1.11–3.42), for children of the comparison group 0.89 ng/ml (CI 0.23–1.12). The tendency to C-peptide level increasing was registered in 12 over-weighted children. These children have a ‘flat’ glucose test curve, as well as a violation of the exocrine function of pancreas manifested with ultrasonic changes. Conclusions. The revealed changes in the pancreatic functional state in the examined children indicate the need to determine the functional state of the gland and its control in the dynamics of treatment of gastroduodenal pathology.
Вступ
Останнім часом функціональні та органічні зміни підшлункової залози (ПЗ) все частіше виявляють у дітей і підлітків. На думку дитячих гастроентерологів, типовий для дорослих симптомокомплекс панкреатиту в педіатричній практиці зустрічається досить рідко [1]. Найчастіше мова йде про патологію ПЗ реактивного характеру щодо захворювань гастродуоденальної зони [2], пов’язану з розладами панкреатичної секреції, кровообігу, підвищенням тиску в протоковій системі, дуоденостазом. Порушення функції ПЗ може виникати при багатьох патологічних станах. Вторинне порушення панкреатичної функції спостерігається частіше, ніж первинне, і переважно виникає при захворюваннях травного каналу, що зумовлено особливостями анатомічного розташування ПЗ і функціональними взаємозв’язками між нею та органами гастродуоденальної ділянки, що сприяють виникненню патології поєднаного характеру [3]. Саме вторинна панкреатична недостатність у педіатричній практиці виникає частіше і може проявлятися в будь-якому віці як на фоні аліментарних порушень харчування, так і при різноманітних запальних захворюваннях верхніх відділів травного каналу [4–10]. Відзначено, що у пацієнтів із цукровим діабетом часто спостерігається зниження екскреторної функції ПЗ [11]. І навпаки, у пацієнтів із захворюваннями ПЗ (хронічним панкреатитом, травмою ПЗ, інфекційними й онкологічними ураженнями ПЗ та іншою патологією) виникають порушення інкреторної функції [12].
Мета дослідження: дослідити функціональний стан ПЗ у дітей при хронічній гастродуоденальній патології.
Матеріали та методи
Дослідження проведено на базі гастроентерологічного відділення Чернівецької обласної клінічної дитячої лікарні впродовж 2013–2018 років. Основну клінічну групу становили 64 дитини віком 8–18 років із хронічною гастродуоденальною патологією: у 29 осіб — хронічний гастрит, у 30 осіб — хронічний гастродуоденіт, у 5 осіб — виразкова хвороба цибулини дванадцятипалої кишки (ДПК).
Діагноз встановлювався згідно з клінічною класифікацією захворювань органів травлення відповідно до Міжнародної класифікації хвороб 10-го перегляду, клас «хвороби органів травлення», та наказу Міністерства охорони здоров’я України № 59 від 29.01.2013 р. «Про затвердження уніфікованих клінічних протоколів медичної допомоги дітям із захворюваннями органів травлення».
Критерії включення дитини в дослідження: 1. Місце проживання (м. Чернівці та Чернівецька область). 2. Вік (8–18 років). 3. Стать (кількість хлопчиків і дівчаток). 4. Однотипність клінічного діагнозу. 5. Однотипний характер порушень функції шлунка. 6. Єдина діагностична програма. 7. Наявність інформованої згоди на участь у дослідженнях.
Критерії виключення дитини з дослідження: 1. Наявність декомпенсованої супутньої патології. 2. Вік до 8 років. 3. Обстеження в інших лікувально-профілактичних закладах. 4. Проживання за межа–ми Чернівецької області.
Групу порівняння становили 25 практично здорових дітей, порівнянних за віком і статтю з основ–ною клінічною групою; всі обстежені діти були в задовільному стані, фізичний і нервово-психічний розвиток відповідав віку.
Усім дітям проведено: загальноклінічні дослідження, ультразвукове дослідження (УЗД) органів черевної порожнини на апараті «Система ультразвукової діагностики SSA-550A» фірми Toshiba з вимірюванням розмірів ПЗ натще та після прийому їжі, фіброгастродуоденоскопію, рh-метрію, 3-кратне копрологічне дослідження.
Для первинного скринінгу екзокринної функції ПЗ у всіх дітей визначали активність α-амілази амілокластичним методом Каравея за допомогою фотометра «SolarPM 2111» (Білорусь) і ліпази сироватки крові кінетичним колориметричним методом із використанням набору реактивів фірми Dialab (Німеччина), активність діастази сечі. Концентрацію фекальної еластази (ФЕ-1) у калі визначали твердофазним імуноферментним методом за принципом «сендвіча» (ELISA), використовуючи набір реактивів для кількісного імуноферментного аналізу виробництва Bioserv (Німеччина). За нормальний рівень ФЕ-1 у калі вважали 200 мкг/г калу і вище; 100–200 мкг/г вказували на легкий, 50–100 мкг/г — на середній і менше 50 мкг/г — на тяжкий ступінь екзокринної недостатності ПЗ. Визначення глюкози крові проводили за допомогою глюкозооксидазного методу. Порушення толерантності до глюкози виявляли, використовуючи пероральний глюкозотолерантний тест. Навантаження глюкозою проводили з розрахунку 1,75 г/кг маси тіла, але не більше 75 г на прийом. Рівень глюкози визначали через 1 та 2 години, концентрацію С-пептиду в сироватці крові — твердофазним імуноферментним методом за принципом «сендвіча» (ELISA), використовуючи набір реактивів для кількісного імуноферментного аналізу виробництва DRG (Німеччина).
Усі дослідження проводили за письмової згоди батьків чи офіційних опікунів дітей і самих дітей. У роботі дотримано етичні принципи щодо людей, які є суб’єктами дослідження, з урахуванням основних положень GCР ІCH та Гельсінської декларації Всесвітньої медичної асоціації з біомедичних досліджень, де людина є їх об’єктом (World Medical Association Declaration of Helsinki 1964, 2000, 2008), Конвенції Ради Європи про права людини та біомедицину (2007).
Статистичну обробку отриманих даних проведено за допомогою програм «Статистика 6.0». Для кожної з ознак обчислювалися середні значення, середня помилка середнього. Для визначення вірогідності відмінностей використано ранговий критерій Вілкоксона — Манна — Уїтні.
Результати та обговорення
Аналіз нозологічної структури захворювань органів травлення серед дітей Чернівецької області за останні 5 років показав, що перше місце посідають хронічні гастродуоденіти, однак без вірогідної різниці з функціональними розладами шлунка та біліарного тракту, що знаходяться на другому місці у структурі патології дигестивної системи. Третє місце займають хронічні холецистити, холангіти, а четверте — стабільно виразкова хвороба ДПК (табл. 1).
Хронічний дифузний гастродуоденіт є однією з основних форм захворювання серед патології гастродуоденальної зони, з приводу якого пацієнти зверталися за медичною допомогою в гастроентерологічний стаціонар. При цьому досить високою залишається кількість дітей, які мають ерозивно-виразкові ураження шлунка та ДПК.
Провідними були больовий (93,7 %), диспептичний (90,6 %) та астеноневротичний синдроми (57,8 %). Біль частіше локалізувався в епігастральній ділянці (48,4 %) та лівому підребер’ї (35,5 %). Найбільш частим проявом диспептичного синдрому в пацієнтів була нудота (62,5 %). Несформовані випорожнення реєструвалися у 9,3 % осіб, схильність до запорів — у 7,8 % осіб, чергування запорів із проносами — у 10,9 % осіб.
Під час ендоскопічного дослідження у 40 (62,5 %) дітей основної групи та у 7 (25,0 %) (р < 0,05) дітей групи порівняння спостерігалися супутні порушення моторно-евакуаторної функції шлунка та ДПК у вигляді гастроезофагеального та дуоденогастрального рефлюксів (табл. 2).
Результати проведеної інтрагастральної рН-метрії показали, що більшість обстежених дітей мали підвищену кислотність, зокрема: базальну абсолютну виражену гіперацидність — у 24 (37,5 %) випадках, базальну абсолютну помірну гіперацидність — у 4 (6,2 %), базальну селективну виражену гіперацидність — у 2 (3,1 %), базальну селективну помірну гіперацидність — в 11 (17,1 %).
Серед госпіталізованих у гастроентерологічне відділення дітей із патологією верхніх відділів шлунково-кишкового тракту у 35,9 ± 3,7 % осіб виявлено ознаки ураження ПЗ.
За даними УЗД [13], зміни у ПЗ реєструються в основному через потовщення хвоста залози та підвищення її ехогенності (рис. 1).
Вищевказані зміни, очевидно, зумовлені набряком ПЗ, який виникає при спазмі сфінктера Одді та при підвищеному внутрішньопротоковому тиску.
Патологічні зміни копрограми, від мінімальних до виражених, виявлено практично в усіх дітей (62; 96,8 %) із гастродуоденальною патологією. Ступінь вираженості патологічних змін, які оцінювали за кількістю плюсів, був вірогідно вищим у пацієнтів зі змінами у ПЗ, виявленими при УЗД (р < 0,01). Зокрема, амілорею спостерігали у 23 (35,9 %) пацієнтів основної групи, переварені м’язові волокна — у 15 (23,4 %), креаторею — у 26 (40,6 %), стеаторею І типу — у 28 (43,7 %), стеаторею ІІ типу — у 5 (7,8 %) пацієнтів. У 33 (51,5 %) дітей основної групи виявлено йодофільну флору.
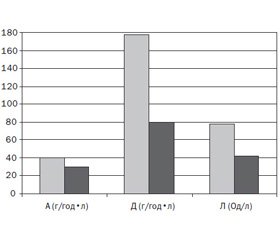
Середня активність α-амілази сироватки крові у пацієнтів основної групи становила 24,92 ±
± 6,70 г/год•л. У 20 дітей (31,2 %) спостерігалося підвищення (11 осіб; 55 %) чи зниження (9 осіб; 45 %) цього показника. У дітей групи порівняння рівень амілази в сироватці крові реєструвався в межах нормальних значень. Змінений рівень діастази сечі спостерігався у 18 (28,1 %) обстежених пацієнтів основної групи та в 1 (4 %) пацієнта групи порівняння (р < 0,01). Підвищення рівня ліпази сироватки крові виявлено у 23 (35,9 %) дітей основної групи при середньому значенні 66,8 ± 3,9 Од/л (рис. 2).
Рівень ФЕ-1 у дітей основної групи в середньому становив 217,8 ± 39,2 мкг/г, у дітей групи порівняння — 267,2 ± 24,6 мкг/г (р < 0,05). У 4 дітей основ–ної групи зареєстрований рівень ФЕ-1, нижчий за референтні значення (161,3 мкг/г, 166,7 мкг/г, 172,8 мкг/г, 169,5 мкг/г).
Отже, у дітей із гастродуоденальною патологією реєструються порушення функції ПЗ, які можуть бути зумовлені різними факторами, зокрема інактивацією ферментів внаслідок зниження рН у ДПК, яке часто спостерігається при кислотозалежних захворюваннях. Ці зміни можна розглядати як дисфункцію сфінктера Одді за панкреатичним типом.
Незважаючи на те, що рівень глюкози натще не перевищував референтні значення 6,1 ммоль/л у жодної дитини, у 10 (15,6 %) дітей основної групи визначена тенденція до гіпоглікемії натще. Медіана рівня глюкози для дітей основної групи становила 4,42 ± 0,63 ммоль/л (довірчий інтервал (ДІ) 4,03–4,67 ммоль/л), для дітей групи порівняння — 4,49 ± 0,57 ммоль/л (ДІ 4,12–4,69 ммоль/л) (р < 0,05). У жодної дитини за результатами проведеного перорального тесту толерантності до глюкози не було встановлено діагнозу порушення глікемії натще, порушення толерантності до глюкози або цукрового діабету. Однак у 10 дітей основної групи та у 2 дітей групи порівняння спостерігали окремі особливості побудови кривих навантаження глюкозою, зокрема: у 5 дітей — сповільнене підвищення глюкози через 1 годину після навантаження та у 7 дітей — сповільнене зниження рівня глюкози через 2 години. Такі криві розцінені нами як «плоскі», що вказувало на початкові порушення вуглеводного обміну.
Медіана рівня С-пептиду для дітей основної групи становила 1,29 нг/мл (ДІ 1,11–3,42), для дітей групи порівняння — 0,89 нг/мл (ДІ 0,23–1,12). Тенденція до підвищення рівня С-пептиду заре–єстрована у 12 дітей із надмірною масою тіла, в яких виявлено також зміни екзокринної функції ПЗ на тлі ультразвукових її змін і «плоску» цукрову криву.
Висновки
1. Дані лабораторних та інструментальних обстежень дітей із хронічною гастродуоденальною патологією вказують на залучення ПЗ у патологічний процес.
2. Преморбідні порушення вуглеводного обміну майже в усіх випадках виявлялися на фоні порушеної зовнішньосекреторної функції ПЗ і/або змін, виявлених за допомогою УЗД, та надмірної маси тіла дітей.
3. Виявлені зміни функціонального стану ПЗ в обстежених дітей вказують на необхідність визначення функціонального стану залози та його конт–роль у динаміці лікування гастродуоденальної патології.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Николаева О.В. Патогенез экзокринной дисфункции поджелудочной железы у детей с хроническими заболеваниями гастродуоденальной зоны // Таврический медико-биологический вестник. 2012; Т. 15, № 3, ч. 2: 187-190. (In Russ.).
2. Сорокман Т.В., Сокольник С.В., Гінгуляк М.Г., Підвисоцька Н.І. Клінічно-психологічні та параклінічні особливості хронічного гастродуоденіту в дітей // Клінічна та експериментальна патологія. 2014; Т. 13, № 2: 127-130. (In Ukrainian).
3. Della Corte C., Faraci S., Majo F. [et al.]. Pancreatic disorders in children: New clues on the horizon // Dig. Liver Dis. 2018; 27: S1590-8658(18)30803-X. doi: 10.1016/j.dld.2018.06.016.
4. Coffey M.J., Nightingale S., Ooi C.Y. Predicting a biliary aetiology in paediatric acute pancreatitis // Arch. Dis. Child. 2013 Dec; 98(12): 965-9. doi: 10.1136/archdischild-2013-304462.
5. Párniczky A., Abu-El-Haija M., Husain S. [et al.]. EPC/HPSG evidence-based guidelines for the management of pediatric pancreatitis // Pancreatology. 2018; 18(2): 146-160.
6. Pancreatic disorders in children: New clues on the horizon // Dig. Liver Dis. 2018; 2: S1590-8658(18)30803-X. doi: 10.1016/j.dld.2018.06.016.
7. Conwell D.L., Lee L.S., Yadav D. [et al.] American Pancreatic Association Practice Guidelines in Chronic Pancreatitis: evidence-based report on diagnostic guidelines // Pancreas. 2014; 43(8): 1143-62. doi: 10.1097/MPA.0000000000000237.
8. Bian Y., Wang L., Chen C. [et al.]. Quantification of pancreatic exocrine function of chronic pancreatitis with secretin-enhanced MRCP // World J. Gastroenterol. 2013, 7; 19(41): 7177-82. doi: 10.3748/wjg.v19.i41.7177.
9. Mekitarian Filho E., Carvalho W.B., Silva F.D. Acute pancreatitis in pediatrics: a systematic review of the literature // J. Pediatr. (Rio J.). 2012 Mar-Apr; 88(2): 101-14. doi: 10.2223/JPED.2163.
10. Su W.J., Chen H.L., Lai H.S. [et al.]. Chang MH. Pancreaticobiliary anomalies is the leading cause of childhood recurrent pancreatitis // J. Formos. Med. Assoc. 2007 Feb; 106(2): 119-25. doi: 10.1016/S0929-6646(09)60227-8.
11. Alam U., Asghar O., Azmi S., Malik R.A. General aspects of diabetes mellitus // Handb Clin. Neurol. 2014; 126: 211-22. doi: 10.1016/B978-0-444-53480-4.00015-1.
12. Párniczky A., Mosztbacher D., Zsoldos F. [et al.]. Analysis of Pediatric Pancreatitis (APPLE Trial): Pre-Study Protocol of a Multinational Prospective Clinical Trial // Digestion. 2016; 93(2): 105-10. doi: 10.1159/000441353.
13. Trout A.T., Preet-Singh K., Anton C.G. [et al.]. Normal pancreatic parenchymal thickness by CT in healthy children // Pediatr. Radiol. 2018 Jun 27. doi: 10.1007/s00247-018-4190-0.

/28-1.jpg)
/28-2.jpg)
/29-1.jpg)