Резюме
У статті надані дані літератури та власний досвід диференціальної діагностики атопічного дерматиту. Відзначені діагностичні труднощі на прикладі аналізу спостереження за 57 дітьми з атопічним дерматитом (віком 1–5 років) і запропоновано діагностичний алгоритм, що включав три етапи: клінічний (детальний збір скарг та анамнестичних даних), лабораторний (загальний аналіз крові, біохімічне та копрологічне обстеження, визначення загального IgE та специфічних IgE до глютену та різних фракцій молока, серологічних біомаркерів целіакії) та інструментальний (нашкірне тестування в період досягнення контролю захворювання та за потреби — ендоскопія з подальшим гістологічним дослідженням біоптатів слизової оболонки тонкої кишки). Спостереження за пацієнтами проводилося в умовах Львівського міського дитячого алергологічного центру на базі комунального некомерційного підприємства «Міська дитяча клінічна лікарня м. Львова». Дітей оглядали на старті дослідження та в динаміці через 1, 2, 3 міс. Оцінка ефективності лікування проводилася на підставі клінічних симптомів, характеру та поширеності висипу та інтенсивності свербежу. Результати дослідження показали, що в досліджуваній групі виявлено наступні причини рефрактерності до лікування дітей з атопічним дерматитом: 36,84 % — коморбідні алергічні захворювання (в 71,43 % — з неконтрольованим перебігом); 24,56 % — харчова алергія, 12,28 % — алергія до білка коров’ячого молока; 7,02 % — лактазна недостатність; 7,02 % — гельмінтози; 5,25 % — стрептодермія; 3,51 % — алергія на глютен; 3,51 % — целіакія; 3,51 % — короста; 1,75 % — гіперчутливість до харчових добавок (E102), та у 3,51 % дітей причину ідентифікувати не вдалося (проводиться подальший пошук). Описано потребу індивідуального підходу до лабораторно-інструментального алгоритму діагностики атопічного дерматиту та показано результати власного шляху до постановки діагнозу.
В статье представлены данные литературы и собственный опыт дифференциальной диагностики атопического дерматита. Отмечены диагностические сложности на примере анализа наблюдения за 57 детьми с атопическим дерматитом (в возрасте 1–5 лет) и предложен диагностический алгоритм, который включал три этапа: клинический (детальный сбор жалоб и анамнестических данных), лабораторный (общий анализ крови, биохимическое и копрологическое обследования, определение общего IgE и специфических IgE к глютену и различным фракциям молока, серологических биомаркеров целиакии), а также инструментальный (накожное тестирование в период достижения контроля заболевания и при необходимости — эндоскопическое с последующим гистологическим исследованием биоптатов слизистой оболочки тонкой кишки). Наблюдение за пациентами проводилось в условиях Львовского городского детского аллергологического центра на базе коммунального некоммерческого предприятия «Городская детская клиническая больница г. Львова». Детей осматривали на старте исследования и в динамике через 1, 2, 3 мес. Оценка эффективности лечения проводилась на основании клинических симптомов, характера и распространенности сыпи, а также интенсивности зуда. Результаты исследования показали, что в исследуемой группе выявлены следующие причины рефрактерности к лечению детей с атопическим дерматитом: 36,84 % — коморбидные аллергические заболевания (у 71,43 % — с неконтролируемым течением); 24,56 % — пищевая аллергия 12,28 % — аллергия к белку коровьего молока 7,02 % — лактазная недостаточность 7,02 % — гельминтозы; 5,25 % — стрептодермия; 3,51 % — аллергия к глютену; 3,51 % — целиакия; 3,51 % — чесотка; 1,75 % — гиперчувствительность к пищевым добавкам (E102), и у 3,51 % детей причину идентифицировать не удалось (проводится дальнейший поиск). Описана потребность персонифицированного подхода к лабораторно-инструментальному алгоритму диагностики атопического дерматита и показаны результаты собственного пути в постановке диагноза.
The article presents a literature review and our own experience in differential diagnosis of atopic dermatitis. Diagnostic difficulties were described on the example of the analysis of the observation of 57 children with atopic dermatitis (aged 1–5 years), and a diagnostic algorithm was offered that included three stages: clinical (detailed collection of complaints and anamnestic data), laboratory (general blood test, biochemical and coprological examination, determination of total IgE and specific IgE to gluten, and different milk fractions, serological biomarkers of celiac disease) and instrumental (skin test at the time of achieving the disease control and, if necessary, endoscopy with subsequent histological examination of biopsy specimen of the small intestinal mucosa). Patients’ observation was conducted in the Lviv Municipal Children’s Allergology Center at the premises of the Non-Profit Commercial Enterprise “Lviv Municipal Children’s Clinical Hospital”. Children were examined at baseline and dynamically after 1, 2, and 3 months. Treatment effectiveness was evaluated based on the clinical symptoms, the nature and prevalence of rash, and severity of itching. The results of the study showed that in the study group, the following causes of resistance to treatment were detected in children with atopic dermatitis: 36.84 % — comorbid allergic diseases (71.43 % with uncontrolled course); 24.56 % — food allergy: 12.28 % — allergy to cow’s milk protein; 7.02 % — lactase insufficiency; 7.02 % — helminthiasis; 5.25 % — streptodermia; 3.51 % — allergy to gluten; 3.51 % — celiac disease; 3.51 % — scabies; 1.75 % — hypersensitivity to food additives (E102), and in 3.51 % of children, the cause was not identified (further research is being carried out). The need for an individual approach to the laboratory and instrumental algorithm for the diagnosis of atopic dermatitis has been described, and the results of a particular approach to diagnosis have been shown.
Вступ
Проблема алергічних захворювань у світовій педіатричній практиці залишається пріоритетною впродовж багатьох років [5]. З 2010 року, згідно з даними ВООЗ, поширеність алергічної патології набула рис епідемії та характеризується погіршенням її клінічної структури [6]. В Україні спостерігається тенденція до пізньої діагностики алергічних захворювань, зокрема атопічного дерматиту. Слід відзначити, що така ситуація зустрічається навіть у сім’ях, де реєструється обтяжена атопією спадковість [1].
Аналіз основних причин алергічної епідемії показав, що основними тригерними чинниками є вплив мегаполісів, погіршення стану довкілля, нераціональне харчування, стресові навантаження, безконтрольне застосування медикаментів, пасивне та активне тютюнопаління [3, 6].
Атопічний дерматит характеризується поліморфними змінами на шкірі, що зумовлює серйозні труднощі диференцііальної діагностики. Під час діагностичного пошуку клінічна практика потребує проведення диференціації не лише з іншими захворюваннями алергічного характеру (харчова алергія, кропив’янка, інсектна алергія), але й із хворобами неалергічного генезу: вірусні інфекції з ураженням шкіри (герпетична, вітряна віспа, кір, інфекційна еритема, синдром «рот — руки — стопи»), бактеріальні інфекції шкіри (стрепто- та стафілодермії) та інші (іхтіоз, короста, псоріаз тощо) [5, 7]. На межі алергічних та неалергічних захворювань в контексті диференцііальної діагностики знаходиться харчова гіперчутливість, що клінічно може проявлятися шкірним висипом й об’єднує імунні та неімунні реакції.
На сьогодні існує наступна класифікація харчової гіперчутливості:
І. Імунні реакції (алергічна гіперчутливість):
— IgE-залежні (анафілаксія, гостра кропив’янка, оральний алергічний синдром);
— IgE-незалежні клітинні (целіакія);
— IgE-залежні та IgE-незалежні змішаного типу (еозинофільний гастрит й ентероколіт, атопічний дерматит);
ІІ. Неімунні реакції — неалергічна гіперчутливість (харчова непереносимість):
— метаболічні (непереносимість лактози);
— фармакологічні (тирамін — сири, мариновані оселедці; кофеїн; теобромін — шоколад, чай, кола; гістамін — риба, квашена капуста; триптамін — помідори, сливки; серотонін — банани, помідори);
— токсичні (токсини риб родини скумбрієвих);
— інші ідіопатичні нескласифіковані (сульфіти) [5].
Дуже часто практичному лікарю важко відразу визначити вид харчової гіперчутливості, що потребує проведення ряду додаткових обстежень. Водночас на сьогодні не існує чітких критеріїв, які б дозволили відповісти на питання, з яких досліджень треба починати діагностичний пошук і в який спосіб розширювати спектр обстежень.
Викладена вище ситуація визначила актуальність і мету нашого дослідження.
Мета: оптимізація алгоритму диференціальної діагностики атопічного дерматиту в дітей.
Матеріали та методи
Проведено обстеження 60 дітей з атопічним дерматитом. Критеріями включення в дослідження були: прояви атопічного дерматиту (тривалість понад 3 міс.); вік дитини (1–5 років); тривалість загострення понад 4 тижні; можливість проведення елімінаційної проби (перебування на гіпоалергенній та безглютеновій дієті впродовж 2 тижнів); згода батьків на участь дитини у дослідженні. Критерії виключення: тяжкі супутні захворювання, відмова від проведення елімінаційної проби чи забору крові.
Діагностичний алгоритм включав три етапи: клінічний, лабораторний та інструментальний. На першому (клінічному) етапі проводився ретельний збір анамнезу. Детально аналізувалися скарги пацієнта з акцентом не лише на шкірні зміни, але й на проблеми з боку травного каналу, вивчався сімейний анамнез.
Другий (діагностичний) етап включав комплексне лабораторне обстеження. Проводився загальний аналіз крові та біохімічне обстеження (загальний білок, АЛТ, АСТ, глюкоза, загальний білірубін, креатинін, сечовина), імуноферментний аналіз з визначенням загального IgE і специфічних IgE до глютену та різних фракцій молока (молоко, α-лактальбумін, β-лактоглобулін, казеїн, бичачий сироватковий альбумін), а також специфічних серологічних біомаркерів целіакії (антитіла до гліадину IgA; антитіла до гліадину IgG; антитіла до тканинної трансглутамінази IgА; антитіла до тканинної трансглутамінази IgG) з використанням реактивів Biocheck GmbH (Німеччина). Здійснювали копрологічне обстеження.
Третій (інструментальний) етап включав нашкірне алерготестування у період досягнення контролю захворювання та можливості відміни антигістамінних засобів на 5–7 днів. В осіб з позитивними результатами серологічного дослідження на целіакію (високі титри антитіл в сироватці крові) проводили ендоскопію з подальшим гістологічним дослідженням біоптатів слизової оболонки тонкої кишки.
Усім пацієнтам призначалася елімінаційна проба, яка полягала в застосуванні гіпоалергенної та безглютенової дієти впродовж 14 днів. Дитині в раціоні харчування рекомендували споживати овочі (морква, картопля, броколі, кабачок, цвітна капуста, цибуля, бобові), фрукти, крупи (рис, гречка, кукурудзянка), м’ясо кролика, сіль, цукор, олію без консервантів, кисломолочну продукцію (без смакових добавок), негазовану мінеральну воду, узвар, чорний неароматизований чай [2, 4].
Досліджувану групу становили 60 дітей. Спостереження за пацієнтами проводилося в умовах комунального некомерційного підприємства «Міська дитяча клінічна лікарня м. Львова». Дітей оглядали на старті дослідження та в динаміці через 1, 2, 3 міс. Оцінка ефективності лікування проводилася на підставі клінічних симптомів, характеру та поширеності висипу та інтенсивності свербежу.
Під час дослідження в 12 (20 %) пацієнтів виникла потреба додатково провести певні лабораторні дослідження. У 9 (15 %) пацієнтів не вдалося провести нашкірні алергопроби через персистуюче загострення, тому дітям було проведене визначення специфічних IgE до побутових, епідермальних та харчових алергенів у сироватці крові. Деяким дітям проводилися бактеріологічний посів із шкіри (n = 7; 11,67 %), зскрібок шкірного покриву для мікроскопічного аналізу (n = 5; 8,33 %), визначення антитіл до гельмінтів (n = 4; 6,67 %), ендомізію IgA (n = 4; 6,67 %), антитіл IgM та IgG до Herpes simplex 1/2 (n = 2; 3,33 %), антитіл IgM та IgG до Borrelia burgdorferi (n = 1; 1,67 %), рівня діаміноксидази (n = 1; 1,67 %).
Результати та обговорення
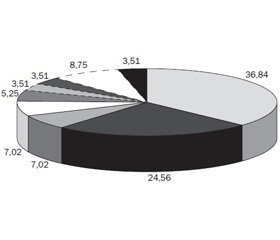
На момент завершення дослідження вибуло троє дітей: одна відмовилася, одна змінила місце проживання й одна дитина захворіла на кір. Серед 57 дітей проведено пошук причин неефективності лікування та встановлено фактори, що зумовили рефрактерність до лікування атопічного дерматиту, а саме: 21 (36,84 %) — коморбідні алергічні захворювання; 7 (12,28 %) — алергія до білка коров’ячого молока; 5 (8,77 %) — алергія до інших груп алергенів (яйця, соя, риба, арахіс, кліщ домашнього пилу, пушні тварини); 4 (7,02 %) — лактазна недостатність; 4 (7,02 %) — гельмінтози; 3 (5,25 %) — стрептодермія; 2 (3,51 %) — алергія на глютен; 2 (3,51 %) — целіакія; 2 (3,51 %) — короста; 1 (1,75 %) — гіперчутливість до харчових добавок (E102); 2 (3,51 %) — причину ідентифікувати не вдалося (ведеться подальший пошук).
Структурний розподіл причин рефрактерності до лікування дітей з атопічним дерматитом подано на рис. 1.
У 21 (36,84 %) дитини було виявлено коморбідні алергічні захворювання, із них у 11 — бронхіальну астму, у 7 — алергічний риніт, 3 — бронхіальну астму та алергічний риніт. Слід зазначити, що у 71,43 % випадків супутні захворювання характеризувалися неконтрольованим перебігом і потребували корекції лікування.
Харчова алергія в дітей досліджуваної групи була підтверджена у 24,56 % випадків й об’єднала алергію до білка коров’ячого молока, яєць, сої, риби, горіхів та глютену.
Окремої уваги заслуговує алергія до білка коров’ячого молока, оскільки вона вважається найбільш значимою у віковій групі 1–5 років (рис. 2). Сенсибілізація до алергенів білка коров’ячого молока була виявлена у 46,67 % дітей із групи з харчовою алергією.
Усім дітям даної групи проводилися оральні провокаційні проби та компонентна алергодіагностика. Молекулярна характеристика основних білків молока подана у табл. 1 [5]. Істинна алергія до білка коров’ячого молока була підтверджена у 7 (12,28 %) пацієнтів і була пов’язана в основному з казеїном (Bos d8), що є термостабільним і найважчим білком в молоці. У більшості дітей алергія на молоко мала перехресний характер за рахунок бичачого сироваткового альбуміну (Bos d6).
/47-3.jpg)
Сьогодні не викликає сумніву той факт, що в дітей із стійкими до лікування формами атопічного дерматиту необхідно проводити визначення серологічних маркерів целіакії [4, 7]. Саме завдяки проведеному обстеженню нами було виявлено двоє серопозитивних дітей за обома біомаркерами целіакії. Пацієнтам провели ендоскопічне обстеження з біопсією і підтвердили діагноз целіакії. Загалом титр антитіл до гліадину IgA/IgG був сумнівним у 7 (12,28 %) і позитивним у 1 (1,75 %) пацієнта досліджуваної групи. Проте у цих дітей тканинна транс–глутаміназа IgA/IgG та антитіла до ендомізію IgA були від’ємними. Така ситуація свідчить про непереносимість глютену без целіакії. Алергія на глютен виявлена у 2 (3,51 %) пацієнтів, що підтверджено оральною провокаційною пробою.
У табл. 2 надана диференційна діагностика різних станів, пов’язаних з непереносимістю глютену [1, 8].
Після ідентифікації причини захворювання пацієнтам призначалися дієтотерапія та відповідне медикаментозне лікування. 38 (66,67 %) дітей отримували антигістамінні препарати, 7 (12,28 %) — антибактеріальну терапію, 6 (10,53 %) — протипаразитарну, 1 (1,75 %) — противірусну терапію. Для місцевого лікування застосовувалися протизапальні, антибактеріальні, протигрибкові, противірусні препарати та емолієнти.
Під час дослідження було встановлено, що лише 39 (68,42 %) пацієнтів дотримувалися призначеної лікарем дієти, характер якої залежав від причини захворювання (гіпоалергенна, безмолочна, безглютенова тощо).
Результати на момент завершення дослідження: 32 (56,14 %) пацієнти продовжують лікування з позитивною динамікою, 23 (40,35 %) досягли ремісії та в 2 (3,51 %) стан без суттєвих динамічних змін, діагностичний пошук і лікування тривають.
Підсумовуючи результати діагностичного пошуку, ми згрупували основні діагностичні критерії ураження шкіри алергічного і неалергічного генезу в табл. 3 [5, 6].
Висновки
Таким чином, діагностичний пошук у разі стійкого до лікування атопічного дерматиту потребує розширення. В діагностичний алгоритм слід включати:
1) клінічні особливості;
2) проведення елімінаційної проби (визначення причинно-наслідкового зв’язку між прийомом конкретної їжі та клінічними симптомами, що є важливим для попередньої ідентифікації шкідливих харчових продуктів) та при потребі — оральної провокаційної проби;
3) лабораторні дані (еозинофілія — в підгострий період алергічного процесу або під час ремісії, підвищення рівня загального і алергенспецифічного IgE у сироватці), нашкірне алерготестування в період ремісії (негативні результати дозволяють виключити IgE-залежну харчову алергію);
4) додаткові специфічні обстеження залежно від характеру скарг. При неефективності лікування або неможливості верифікації діагнозу в контексті шкірних алергозів слід пам’ятати про визначення серологічних біомаркерів целіакії, виключення інфекційного чинника (вірусного, бактеріального, паразитарного тощо).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/47-1.jpg)
/47-2.jpg)
/47-3.jpg)
/48-1.jpg)