Вступ
Гострі респіраторні інфекції (ГРІ) — група найбільш поширених хвороб дихальних шляхів. За даними офіційної статистики, щорічно в Україні реєструється до 4–4,5 млн випадків захворювання на грип і гострі респіраторно-вірусні інфекції в дітей. Порівняно з дорослим населенням діти хворіють на ГРІ в 1,5–3 рази частіше. Більше за інших схильні до респіраторних інфекцій діти, які відвідують дитячі (шкільні й дошкільні) установи. Так, на першому році відвідування дошкільного дитячого закладу понад 50 % дітей хворіють на ГРІ понад 6 разів на рік, на другому році — 25 % дітей, на третьому році 10 % дітей залишаються такими, що часто хворіють на ГРІ [1].
Безумовно, основним проявом ГРІ є катаральний синдром, який у першу чергу проявляється запальними змінами в глотці. Останніми роками захворюваність з ураженням глотки зросла, і відзначається тенденція до її подальшого зростання [2]. За даними ВООЗ, під час епідемій ГРІ у 6–8 % випадків ураження глотки мають бактеріальну природу, у позаепідемічний період кількість хворих зменшується, але число бактеріальних уражень залишається досить високим — 2–3 % [3]. Ці дані свідчать про необхідність адекватної роботи нативного імунітету під час елімінації вірусу з організму, а також для протидії бактеріальному ураженню ротоглотки. Тому для лікування запальних захворювань глотки бажано застосовувати місцеві антисептичні протизапальні препарати, які можна використовувати як у вигляді монотерапії, так і у складі комплексного лікування. Перевага надається препаратам, що можуть доповнювати або стимулювати роботу нативного імунітету. У захисті респіраторного тракту від бактеріальних патогенних агентів значна роль належить лізоциму (Lyz, мурамідаза, N-ацетилмурамілгідролаза; EC 3.2.1.17) — лужному ферменту з молекулярною масою 14 kDa, що міститься в тканинних рідинах людини — у сльозах, слині, перитонеальній рідині, плазмі й сироватці крові тощо [2, 4–6].
Мета дослідження: вивчити клінічні особливості уражень глотки й гортані при ГРІ в різних регіонах України, оцінити ефективність і безпеку застосування препарату Лізак і його здатність впливати на активність нативного імунітету.
Характеристика дослідницької програми: проспективне багатоцентрове наглядове клініко-імунологічне дослідження.
Дослідження проведено у 24 регіонах України (Вінницька, Волинська, Дніпропетровська, Донецька, Житомирська, Закарпатська, Запорізька, Івано-Франківська, Київська, Кіровоградська, Луганська, Львівська, Миколаївська, Одеська, Пол–тавська, Рівненська, Сумська, Тернопільська, Харківська, Херсонська, Хмельницька, Черкаська, Чернівецька,Чернігівська області).
Критеріями включення в дослідження хворих на ГРІ були:
— вік від 4 років до 17 років 11 міс.;
— наявність уражень глотки й гортані з показаннями для місцевої/поєднаної терапії;
— можливість лікування в амбулаторних умовах;
— інформована згода пацієнта та/або батьків на участь у дослідженні.
Критеріями виключення були:
— наявність у пацієнта бактеріальної інфекції, що потребує системного застосування антибактеріальних препаратів;
— наявність захворювань легенів (астма, хронічне обструктивне захворювання легенів), що потребують лікування, а також кістозний фіброз, недостатність альфа-1-антитрипсину, саркоїдоз, бронхоектатична хвороба, алергічний альвеоліт, туберкульоз;
— наявність серцево-судинної, гематологічної, печінкової, ниркової, шлунково-кишкової патології, порушень обміну речовин та інших патологічних змін, що могли б вплинути на рівень безпеки препарату, його переносимість і/або фармакокінетику;
— онкологічні захворювання (супутні або в анамнезі);
— наявність у пацієнта первинного або вторинного імунодефіциту;
— явні ознаки алергії (наприклад, шкірні або респіраторні прояви).
Матеріали та методи
У дослідженні взяли участь 25 229 пацієнтів обох статей із 24 регіонів України віком від 4 років до 17 років 11 місяців.
Проводилось клінічне й імунологічне обстеження хворих. Клінічне обстеження включало: збір основних скарг, анамнезу життя й хвороби, огляд шкіри й слизових оболонок пацієнта, орофаринго–скопію, аускультацію серця й легенів, вимірювання частоти серцевих скорочень, артеріального тиску й температури тіла.
Як лабораторні дослідження всім пацієнтам до лікування було проведено загальний аналіз крові, загальний аналіз сечі, бактеріологічне дослідження матеріалу, що був отриманий із поверхні глотки. Вміст інтерферону гамма (IFN-γ) у сироватці крові й ротоглотковій рідині визначався за допомогою імуноферментного аналізу ELISA в сертифікованій імунологічній лабораторії лікувально-діагностичного центру «Аптека медичної академії», ліцензія АЕ № 459359 від 18.09.2014, зі застосуванням набору «Гамма-інтерферон-ІФА-БЕСТ А-8752» фірми «Вектор-Бест». Враховували побічні ефекти у вигляді алергічних реакцій. Оцінка ефективності лікування визначалася лікарем і пацієнтом. Оцінку скарг і орофарингоскопії проводили в день звернення, на 3-й і 7-й день хвороби. Для оцінки даних у динаміці використовували візуально-аналогову 4-бальну шкалу: 0 — відсутність ознаки, 3 — максимальний ступінь її вираженості. Бактеріологічне дослідження проводили в день звернення до лікаря.
Результати та обговорення
Результати обстеження хворих у 24 регіонах України подано в табл. 1.
Віковий і гендерний розподіл пацієнтів подано в табл. 2.
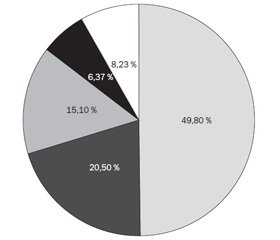
Наведені дані свідчать про те, що найбільш поширеною формою ГРІ був фарингіт. Ця клінічна форма ГРІ як показання для призначення оральних антисептиків домінувала у Винницькій, Дніпропетровській і Київській областях. Гострий тонзиліт був найчастішою причиною звернення до лікаря у Харківській, Тернопільській, Івано-Франківській, Хмельницькій і Чернівецькій областях. У той же час гострий ларингіт був причиною призначення оральних антисептиків переважно у Львівській та Одеській областях, а стоматит — у Дніпропетровському й Волинському регіонах.
За результатами обстеження 25 229 пацієнтів із ГРІ, які мали ураження ротоглотки, можна подати структуру клінічних форм (рис. 1).
Більшість пацієнтів, включених у дослідження, хворіли протягом року епізодично, але 6632 (26,3 %) дитини часто хворіли на ГРІ.
При вивченні кореляційних зв’язків між клініко-анамнестичними даними було встановлено, що найбільш сильні взаємозв’язки відзначалися між тонзилітом і вираженістю температурної реакції в першу й третю добу від начала лікування (r = 0,43 і r = 0,69 відповідно), наявність тонзиліту корелювала також з інтенсивністю болю в горлі (r = 0,46) й наявністю кашлю на 7-му добу захворювання (r = 0,39). У той же час вираженість кашлю в першу й третю добу захворювання корелювала з гострим ларингітом (r = 0,51 і r = 0,36 відповідно). Охриплість корелювала зі ступенем сухості в ротоглотці (r = 0,47) й була притаманна ларингіту.
Бактеріологічні дослідження вмісту ротоглотки в обстежених дітей показали пригнічення зростання індигенної флори (Streptococcus viridans, Neisseria mucosa, Lactobacillus). У той же час відзначалось надлишкове зростання Haemophilus influenzae, Staphylococcus aureus і Candida albicans.
У широкій клінічній практиці при лікуванні фарингітів, тонзилітів і стоматитів використовується комплексний препарат Лізак (ПАТ «Фармак»), що містить: лізоцим і деквалінію хлорид (в 1 таблетці міститься 10 мг лізоциму гідрохлориду в перерахунку на суху речовину і 0,25 мг деквалінію хлориду в перерахунку на 100% суху речовину). Препарат використовується для місцевого застосування й має виражену антисептичну, фунгіцидну й антибактеріальну активність [14–18].
Встановлено, що препарат Лізак підвищує активність фагоцитозу in vitro щодо інертного матеріалу типу латекс. При впливі препарату на клітини мигдаликів відзначається виражена тенденція до зниження вмісту як IFN-α, так і IFN-γ, що, ймовірно, свідчить про зниження вірусного навантаження на клітини мигдаликів. Також показано, що препарат Лізак має виражену противірусну активність щодо аденовірусу 2-го типу [19]. М.С. Пухлик і співавт. відзначають [3], що при гострому тонзилофарингіті як у дорослих, так і в дітей вже у перші години після застосування препарату Лізак відбувається усунення або значне зменшення інтенсивності клінічних проявів хвороби. Автори вважають, що препарат Лізак може бути рекомендований для лікування гострих і хронічних запальних захворювань глотки, а також як профілактичний засіб після перенесених оперативних втручань у порожнині рота й глотки. Згідно з даними Ю.В. Марушка і співавт. [20], лікування компенсованої форми хронічного тонзиліту в дітей препаратом Лізак супроводжується вірогідним покращанням стану слизової оболонки ротоглотки, зниженням рівня колонізації слизової оболонки ротоглотки патогенною й умовно-патогенною флорою, підвищенням вмісту β-дефензинів і лактоферину.
У результаті лікування препаратом Лізак дітей із гострими респіраторними інфекціями відбувається відновлення еубіотичного стану мікробіоценозу ротоглотки. Після курсу терапії препаратом Лізак повністю елімінуються колонії бактерій Staphylococcus aureus і грибів Candida albicans [18].
Клінічна оцінка ефективності препарату Лізак
Препарат Лізак застосовувався за призначенням лікаря згідно з інструкцією із застосування.
Динаміка симптомів оцінювалась за бальною шкалою. При аналізі даних було встановлено, що на момент звернення до лікаря 13 599 (53,9 %) пацієнтів відчували сильний біль у горлі, 10 743 (42,6 %) скаржились на помірний біль.
На 3-тю добу лікування препаратом Лізак кількість пацієнтів з інтенсивним болем зменшилась до 6716 (26,7 %), а на 7-й день лікування інтенсивний біль зберігався тільки в 1004 (3,9 %) дітей. Слід відзначити, що це були хворі, які мали гострий тонзиліт, наліт на мигдаликах і потребували системного застосування антибактеріальної терапії.
Сухість у горлі відзначали 12 228 (48,5 %) пацієнтів. Зазвичай це були діти з гострим фарингітом. На 3-тю добу лікування помірна сухість у горлі була присутня у 8469 (33,5 %) дітей, а під час останнього візиту до лікаря (7-ма доба лікування) незначну сухість у горлі відзначали тільки в 674 (2,7 %) пацієнтів.
Зміна голосу, що була в основному характерна для хворих із гострим ларингітом, фіксувалась у 9770 (38,7 %) дітей, на 3-й день лікування — у 2998 (11,9 %), а на 7-й день охриплість голосу була відсутня в усіх пацієнтів (рис. 2).
Температурна крива на тлі лікування препаратом Лізак знижувалась літично, і до 7-го дня температура тіла нормалізувалась у всіх пацієнтів. Повторних підйомів температури не спостерігалось у жодного пацієнта.
Гіперемія зіва є проявом запального процесу в ротоглотці, її динаміка відображає інтенсивність запалення. На початку лікування гіперемія зіва різної інтенсивності була присутня в 100 % відсотків обстежених пацієнтів, при цьому інтенсивна гіперемія зіва була в 13 899 (55,1 %), помірна — у 10 213 (40,5 %), на 3-тю добу лікування інтенсивну гіперемію спостерігали в 7857 (31,1 %) пацієнтів, на 7-му добу лікування інтенсивну гіперемію не фіксували в жодного хворого, але помірна гіперемія зіва зберігалась у 4178 (16,6 %) хворих (рис. 3).
Зернистість задньої стінки глотки є клінічною ознакою фарингіту. Цей симптом мали 11 995 (47,5 %) пацієнтів, на 3-тю добу лікування їх кількість зменшилась до 6853 (27,1 %) (рис. 4).
У хворих на гострий тонзиліт у 63 % випадків спостерігався наліт на мигдаликах, що значно зменшувався на 3-тю добу лікування (до 36,5 %), а на 7-му добу лікування зберігався тільки в 7 % хворих.
Збільшення лімфатичних вузлів ми спостерігали в 9933 (39,3 %) хворих, на 7-му добу лікування їх кількість зменшилась до 4236 (16,8 %). Лімфаденопатія є однією з ознак дитини, яка часто хворіє на ГРІ.
Отже, застосування препарату Лізак у клінічній практиці є ефективним і призводить до зменшення інтенсивності клінічних ознак запалення в ротоглотці, купірує сухість ротоглотки, больовий синдром, відновлює голосову функцію.
Бактеріологічна ефективність препарату Лізак
При проведенні бактеріологічного дослідження мікрофлори ротоглотки в пацієнтів, які брали участь у дослідженні, до початку лікування було виявлено підвищення числа патогенних і умовно-патогенних мікроорганізмів. У більшості випадків на слизовій оболонці глотки виявляли стафілококи: Staphylococcus aureus, Staphylococcus epidermidis, Staphylococcus haemolyticus (25,3–37,1 %), а також Moraxella catarrhalis (3,6 %), Haemophilus influenzae (7,9 %), Candida albicans (7,4 %). У 16,7 % обстежених пацієнтів була виявлена резистентність бактерій до цефтріаксону, цефуроксиму й кларитроміцину, що є ознакою неконтрольованого застосування антибіо–тиків у пацієнтів із запаленням ротоглотки. Це засвідчує, що в більшості випадків слід застосовувати локальні препарати антибактеріальної, фунгіцидної й антисептичної дії.
Позаклітинно розташований Lyz викликає деградацію мультимерного бактерійного пептидоглікану (PG) з утворенням солютабних фрагментів, які активують Nod-подібні рецептори (NLR) епітеліальних клітин слизових оболонок, що призводить до секреції чинників, які мають властивості викликати хемотаксис і активацію нейтрофілів і макрофагів [7]. Проте Lyz-опосередкована деградація бактерій призводить до збільшення концентрації не лише дериватів PG, але й інших PAMP, які активують Toll-подібні рецептори та NLR, що індукує продукцію прозапальних цитокінів. Цікавим є факт, що навіть у випадках відсутності помітного впливу Lyz на життєздатність бактерій функціонування Lyz призводить до вірогідного підвищення концентрації дериватів PG. Відомо, що основною молекулярною мішенню Lyz є PG бактеріальної стінки. Імовірно, що Lyz, деградуючи PG, призводить до підвищення рівня концентрації його дериватів, які активують механізми елімінації бактерій з макроорганізму, але активність руйнування бактеріальної стінки може бути недостатньою для того, щоб викликати руйнування бактерії [8].
Контрольні посіви зі слизових ротоглотки дітей після закінчення курсу лікування препаратом Лізак показали відновлення стану еубіозу в 37 % наших спостережень. Відновлення мікробіоценозу відбувалося в основному за рахунок зменшення кількості патогенної й умовно-патогенної флори (Staphylococcus aureus, Candida albicans та ін.) і збільшення кількості індигенної флори. Слід зазначити, що навіть у разі неповного відновлення еубіозу, що мало місце в дітей із частими повторними респіраторними захворюваннями, після лікування препаратом Лізак кількість індигенної флори значно збільшувалася (табл. 3).
Імунологічна ефективність препарату Лізак
Для визначення імунологічної ефективності препарату Лізак були обстежені 124 дитини віком 7–12 років, які мали ГРІ з ураженням ротоглотки. Діти були розподілені на дві групи. Основна група пацієнтів (94 дитини), які хворіли на ГРІ, отримувала стандартну терапію відповідно до протоколів лікування ГРІ, що рекомендовані МОЗ України, і препарат Лізак. Діти другої групи (30 дітей) отримували тільки стандартну терапію. Вплив стандартної терапії й стандартної терапії в поєднанні з препаратом лізоциму на вміст IFN-γ у сироватці крові і ротоглотковій рідині в дітей, які мали ознаки запалення в ротоглотці, подано в табл. 4.
/58-1.jpg)
Слід зазначити, що перед початком лікування концентрація IFN-γ як у сироватці крові, так і в ротоглотковій рідині не мала виражених відмінностей в групах, що отримували/не отримували терапію з додаванням препарату Лізак. На початку захворювання рівень IFN-γ у сироватці крові становив 1,43 ± 0,16 нг/мл і 1,48 ± 0,12 нг/мл в обох групах відповідно; а на період реконвалесценції відбувалось вірогідне зниження його рівня до 1,13 ± 0,12 нг/мл (t-критерій = 1,50; p = 0,14) і 0,76 ± 0,09 нг/мл (t-критерій = 4,80; p = 0,00001) відповідно. Рівень IFN-γ у ротоглотковій рідині на тлі лікування препаратом Лізак також знижувався з 1,33 ± 0,10 нг/мл до 0,98 ± 0,12 нг/мл (t-критерій = 2,24; p = 0,03), що свідчить про конт–роль активності мукозального імунітету в ротоглотці й підкреслює імуномоделюючу дію препарату Лізак. Неконтрольована активність імунної системи може викликати бурхливий розвиток запального процесу й призвести до розвитку ускладнень (у тому числі алергічних і автоімунних реакцій).
Відомо, що лізоцим обмежує активність запального процесу. Використання препаратів екзогенного лізоциму призводить до зменшення хемотаксису й активності нейтрофілів [9]. Лізоцим може безпосередньо зв’язувати й нейтралізувати позаклітинні, прооксидантні біореактивні похідні [10]. Ідентифіковано п’ять протизапальних бактерицидних пептидів, що є похідними лізоциму людини. Ці пептиди зменшують LPS-індуковану експресію прозапальних цитокінів: фактора некрозу пухлини α, інтерлейкіну-6, інтерлейкіну-1β і IFN-γ у макрофагах мишей [11]. Вивчення вмісту INF-γ і впливу лізоциму на його секрецію є важливим, бо цей фактор як впливає на запуск запальної інфекції, так і знижує ризик розвитку бактеріальних ускладнень.
Лізоцим сприяє активації NLRP3-інфламасоми і, як наслідок, посиленню продукції інтерлейкіну-1β. Активація NLRP3-інфламасоми може сприяти вивільненню інших антибактеріальних чинників [7]. Також лізоцим чинить імуностимулюючу дію за рахунок фрагменту Thr-Leu-Lys-Arg, що індукує фагоцитоз і хемотаксис лейкоцитів [12, 13].
Отже, препарат Лізак, зменшуючи інтенсивність запального процесу в ротоглотці, здатен впливати на рівень прозапальних цитокінів, зокрема IFN-γ.
Переносимість препарату Лізак
Препарат Лізак не мав побічної дії в більшості пацієнтів, хоча в невеликої кількості хворих (0,76 %) спостерігались ознаки алергічної реакції (першіння в горлі, набряклість язичка, незвичний смак).
Ефективність препарату Лізак була оцінена лікарями й пацієнтами в 99 % випадків як добра.
Висновки
1. Застосування препарату Лізак у клінічній практиці є ефективним і призводить до зменшення інтенсивності клінічних ознак запалення в ротоглотці, купірує сухість ротоглотки, больовий синдром, відновлює голосову функцію.
2. Застосування препарату Лізак у комплексній терапії ГРІ сприяє зменшенню інтенсивності запального процесу в ротоглотці й знижує рівень прозапальних цитокінів, зокрема IFN-γ.
3. Препарат Лізак сприяє відновленню мікробіоценозу ротоглотки за рахунок зменшення кількості патогенної й умовно-патогенної флори (Staphylococcus aureus, Candida albicans та ін.) і збільшення кількості індигенної флори.
4. Препарат Лізак має добру переносимість і є ефективним у 99 % випадків застосування.
Конфлікт інтересів. Не заявлений.
Дослідження проводилося лікарями у 24 регіонах України:
Абатуров О.Є., Агафонова О.О., Токарева Н.М., Хамун К.К., Луценко Н.Т., Кожухар О.М., Албур О.Ф., Терлецький О.С., Лінкевич С.М., Карасевич Л.П., Калохіна І.В., Бахчеван О.М., Катаула Н.І., Максимович І.О., Бердега С.Д., Разумович Т.П., Ружевич С.В., Триморуш Т.О., Толстенко Т.З., Соловйова І.В., Міріц Л.О., Владі М.І., Коротка Н.Я., Жуковська Г.М., Мордух С.Ф., Іванова Т.В., Костильова І.Ю., Ткаченко І.В., Коваленко М.В., Тимчишина Л.Б., Мамедова Л.А., Винокурова О.Д., Фіронова О.О., Дем’яненко І.І., Фомичова Л.Д., Яцик В.М., Зайченко С.М., Бузинна А.С., Мелаш І.В., Лисянська В.В., Вавенко І.І., Лизогуб Р.Л., Бердюгова Н.С., Положай М.О., Павлова Т.В., Рузіч Ю.В., Зіміна Н.А., Нестоянова О.С., Бессонова О.О., Воронцова Л.А., Мамедова С.А., Овсепян Ю.Є., Парчинська І.В., Расулова С.А., Семеряк О.В., Смоляк-Смєткі С.П., Воронюк М.О., Голубова Т.О., Дудник Н.П., Булавіна І.М., Николайчук Ю.П., Козенева І.В., Лацков С.С., Сирбу Т.В., Писарева Г.В., Гиль О.О., Одинцова Т.М., Храпач Л.І., Колодяжна Н.В., Іоніна Н.В., Полич Т.М., Собко Н.А., Кишань Т.П., Макаренко Н.М., Корнієнко М.В., Михайлець Л.І., Курчак Л.М., Назаренко І.В., Ірха Г.Р., Адамів Г.В., Курдибаха О.В., Шумада Л.П., Галагань К.Т., Голуб Г.І., Попович С.В., Савіна Т.А., Палагнюк І.О., Кузьменко В.А., Гаращук Л.Л., Ганіна І.М., Лісова П.М., Дерепа О.В., Щурик Ю.В., Агатій С.І., Іщук Л.І., Скалецька О.М., Левчук І.О., Андрух В.С., Нескоромна О.В., Кириченко Ю.Г., Шульгіна Т.П., Мельник Т.П., Закаблук Н.А., Старицька О.Р., Качмар С.О., Мацюра Н.О., Пида Г.О., Яндьо І.Я., Лелик В.В., Галас В.О., Гануляк О.Ю., Дубляк О.Й., Яцканич В.М., Бортновська В.А., Борщинський І.Л., Подвацятник О.І., Гнатів С.В., Гуцал Г.І., Єгер В.А., Синюк О.П., Юрко М.С., Штін В.Г., Шкода І.В.
Список литературы
1. Юлиш Е.И., Чернышева О.Е. Этиопатогенетическая терапия острых респираторных вирусных инфекций у детей // Здоровье ребенка. — 2014. — № 1. — С. 129-133.
2. Ткаченко В.Н. Дифференциальная диагностика обострений хронического фарингита // Журнал вушних, носових та горлових хвороб. — 2011. — № 3. — С. 27-28.
3. Пухлик М.С., Тагунова И.К., Андреев А.В. Оценка эффективности применения препарата Лизак при тонзиллофарингитах // Здоровье Украины. — 2012. — № 4. — С. 1-2.
4. Абатуров А.Е. Антимикробные энзимы системы неспе–цифической защиты респираторного тракта // Здоровье ребенка. — 2009. — № 3(18). — С. 122-125.
5. Барер Г.М. Кристаллографический метод изучения слюны / Г.М. Барер. — 2008. — 191 с.
6. Hung C.R. Protective effect of lysozyme chloride on gastric oxidative stress and hemorrhagic ulcers in severe atherosclerotic rats / C.R. Hung, W.H. Chen, P.S. Wang // Med. Sci. Monit. — 2007. — № 13(12). — Р. 271-279.
7. Ragland S.A., Criss A.K. From bacterial killing to immune modu–lation: Recent insights into the functions of lysozyme // PLoS Pathog. — 2017 Sep 21. — 13(9). doi: 10.1371/journal.ppat.1006512.
8. Davis K.M., Nakamura S., Weiser J.N. Nod2 sensing of lysozyme-digested peptidoglycan promotes macrophage recruitment and clearance of S.рneumoniae colonization in mice // J. Clin. Invest. — 2011 Sep. — 121(9). — 3666-76. doi: 10.1172/JCI57761.
9. Derbise A., Pierre F., Merchez M., Pradel E., Laouami S., Ricard I., Sirard J.C., Fritz J., Lemaître N., Akinbi H., Boneca I.G., Sebbane F. Inheritance of the lysozyme inhibitor Ivy was an important evolutionary step by Yersinia pestis to avoid the host innate immune response // J. Infect. Dis. — 2013 May 15. — 207(10). — 1535-43. doi: 10.1093/infdis/jit057.
10. Dainin K., Ide R., Maeda A., Suyama K., Akagawa M. Pyridoxamine scavenges protein carbonyls and inhibits protein aggregation in oxidative stress-induced human HepG2 hepatocytes // Biochem. Biophys. Res Commun. — 2017 May 6. — 486(3). — 845-851. doi:10.1016/j.bbrc.2017.03.147.
11. Ibrahim H.R., Hamasaki K., Miyata T. Novel peptide motifs from lysozyme suppress pro-inflammatory cytokines in macrophages by antagonizing toll-like receptor and LPS-scavenging action // Eur. J. Pharm. Sci. — 2017 Sep 30. — 107. — 240-248. doi: 10.1016/j.ejps.2017.07.005.
12. Абатуров А.Е., Агафонова Е.А. Интерферонотерапия острых респираторных вирусных инфекций у детей // Здоровье ребенка. — 2017. — № 3(12). — С. 81-85.
13. Абатуров А.Е., Волосовец А.П., Юлиш Е.И. Индукция молекулярных механизмов неспецифической защиты респираторного тракта. — К.: Приватна друкарня ФОП Сторожук О.В., 2012. — 240 с.
14. Марушко Ю.В. Местная терапия острых фарингитов / Ю.В. Марушко, О.Ф. Мельников, Н.А. Зелена, О.С. Мовчан // Современная педиатрия. — 2011. — № 4(38). — С. 107.
15. Дегтяренко Е.В. Эффективность применения препарата «Лізак» при лечении катарального гингивита у подростков / Е.В. Дегтяренко, С.В. Першин, М.С. Юрина, С. Хода // Питання експериментальної та клiнiчної медицини. — 2012. — Вип. 16, т. 2. — С. 267-270.
16. Кудрявцев И.В., Полевщиков А.В. Эволюция каскада комплемента: ранние этапы // Цитокины и воспаление. — 2005. — Т. 4, № 1. — С. 11-21.
17. Суеркулов Э.С. Возможности применения препарата Лизак и других средств, усиливающих местный иммунитет, при лечении детей с хроническими рецидивирующими афтозными стоматитами (обзор литературы) // Э.С. Суеркулов, Э.Ш. Алымбаев, И.М. Юлдашев и др. // Медицина Кыргызстана. — 2014. — Т. 1. № 4. — С. 50-53.
18. Марушко Ю.В., Гавриленко Ю.В. Санація ротоглотки при інфекційній патології у дітей / Ю.В. Марушко, Т.В. Гищак // Современная педиатрия. — 2017. — № 1. —
С. 20-25.
19. Мельников О.Ф. Исследование действия лизоцимсодержащего антисептика на механизмы противовирусного иммунитета клеток тонзилл in vitro / О.Ф. Мельников, Л.Д. Кривохатская, В.Н. Писанко и др. // Журнал вушних, носових і горлових хвороб. — 2015. — № 4. — C. 22-26.
20. Марушко Ю.В. Актуальні проблеми терапії хронічного тонзиліту нестрептококової етіології / Ю.В. Марушко, О.Ф. Мельников, О.С. Мовчан, Н.А. Зелена // Здоров’я України. Тематичний номер «Пульмонологія. Алергологія. Риноларингологія». — Лютий 2013. — № 1. — C. 58-59.

/55-1.jpg)
/56-1.jpg)
/56-2.jpg)
/57-1.jpg)
/58-1.jpg)