Резюме
Метою роботи було підвищення ефективності лікування дітей і підлітків із синдромом біологічно неактивного гормона росту (СБНГР) на основі вивчення вмісту есенціальних мікроелементів (ЕМ) у плазмі крові. Матеріали та методи. В дослідження включено 206 дітей і підлітків з різними формами низькорослості. Діти, хворі на СБНГР, увійшли до групи з 29 осіб (14,08 %): 21 хлопчик (72,41 %) і 8 дівчаток (27,59 %), відставання у зрості яких становило від –2,0 до –4,6 SD. Середній вік дітей — 9,01 ± 0,60 року. Діагноз СБНГР підтверджений наявністю нормальних/підвищених показників гормона росту (ГР) на тлі проведення стимуляційних тестів, різким зниженням рівня інсуліноподібного фактора росту 1 (ІФР-1) та позитивною пробою на чутливість до ГР. Мікроелементний статус оцінювали шляхом визначення рівнів ЕМ (цинку, селену, марганцю, хрому, міді) у плазмі крові методом рентгенофлуоресцентної спектрометрії за допомогою спектрометра ElvaX-med (Україна). Рівні ІФР-1 в плазмі крові визначали імунорадіометричним методом за допомогою стандартних наборів IRMA IGF-1 (Immunotech® kit, Чеська Республіка). Результати. В групі дітей з СБНГР рівень цинку становив 0,57 ± 0,04 мкг/мл, селену — 0,05 ± 0,01 мкг/мл, що вірогідно нижче, ніж у загальній групі дітей з низькорослістю (р < 0,001 та р < 0,05 відповідно). Середні рівні хрому та міді в плазмі крові були зниженими порівняно з показниками дітей з іншими формами низькорослості й становили 0,040 ± 0,003 мкг/мл і 0,79 ± 0,05 мкг/мл відповідно, та були вірогідно нижчими, ніж у дітей контрольної групи (р < 0,001). Середній рівень марганцю в плазмі крові становив 0,06 ± 0,02 мкг/мл, що дещо нижче, ніж у контрольній групі, але невірогідно (р > 0,01). Висновки. У пацієнтів із СБНГР встановлено вірогідне зниження рівнів цинку, селену, хрому та міді у плазмі крові. Отже, на наш погляд, до комплексу обстеження дітей з низькорослістю доцільно включати визначення рівнів ЕМ. При виявленні знижених рівнів ЕМ рекомендовано комбіноване лікування препаратами рекомбінантного ГР та такими, які містять відповідні ЕМ, що значно підвищує ефективність ріст-корегуючої терапії.
Целью работы было повышение эффективности лечения детей и подростков с синдромом биологически неактивного гормона роста (СБНГР) на основе изучения содержания эссенциальных микроэлементов (ЭМ) в плазме крови. Материалы и методы. В обследование включено 206 детей и подростков с различными формами низкорослости. Дети, страдающие СБНГР, вошли в группу из 29 человек (14,08 %): 21 мальчик (72,41 %) и 8 девочек (27,59 %), отставание в росте составляло от –2,0 до –4,6 SD. Средний возраст детей — 9,01 ± 0,60 года. Диагноз СБНГР подтвержден наличием нормальных/повышенных показателей гормона роста (ГР) на фоне проведения стимулирующих тестов, резким снижением показателей инсулиноподобного фактора роста 1 (ИФР-1), положительной пробой на чувствительность к ГР. Микроэлементный статус оценивали путем определения уровней ЭМ (цинка, селена, марганца, хрома, меди) в плазме крови методом рентгенофлуоресцентной спектрометрии с помощью спектрометра ElvaX-med (Украина). Уровни ИФР-1 в плазме крови определяли иммунорадиометрическим методом с помощью стандартных наборов IRMA IGF-1 (Immunotech® kit, Чешская Республика). Результаты. В группе детей с СБНГР уровень цинка составлял 0,57 ± 0,04 мкг/мл, селена — 0,05 ± 0,01 мкг/мл, что достоверно ниже показателей в общей группе детей с низкорослостью (р < 0,001 и р < 0,05 соответственно). Средние уровни хрома и меди в плазме крови были сниженными по сравнению с показателями у детей с другими формами низкорослости и составляли 0,040 ± 0,003 мкг/мл и 0,79 ± 0,05 мкг/мл соответственно, и были достоверно более низкими, чем у детей контрольной группы (р < 0,001). Средний уровень марганца в крови составил 0,06 ± 0,02 мкг/мл, что несколько ниже по сравнению с контрольной группой, однако недостоверно (р > 0,01). Выводы. У пациентов с СБНГР установлено достоверное снижение уровней цинка, селена, хрома и меди в плазме крови. Таким образом, на наш взгляд, в комплекс обследования детей с низкорослостью целесообразно включать определение уровней ЭМ. При обнаружении сниженных уровней ЭМ рекомендовано комбинированное лечение препаратами рекомбинантного ГР и такими, которые содержат соответствующие микроэлементы, что значительно повышает эффективность рост-корригирующей терапии.
Background. The purpose was to increase the effectiveness of treatment in children and adolescents with biologically inactive growth hormone syndrome (BIGHS) based on studying the content of essential microelements (EM) in the blood plasma. Materials and methods. The study included 206 children and adolescents with different forms of short stature. Group with BIGHS consisted of 29 children (14.08 %): 21 boys (72.41 %) and 8 girls (27.59 %), with growth retardation from –2.0 to –4.6 SD. The average age of children was 9.01 ± 0.60 years. Diagnosis of BIGHS was confirmed by the presence of normal/elevated growth hormone parameters against the background of stimulation tests, a sharp decrease in the level of insulin-like growth factor-1 (IGF-1), and positive test for growth hormone sensitivity. The microelement status was assessed by determining the levels of EM (zinc, selenium, manganese, chromium, copper) in the blood plasma by X-ray fluorescence spectrometry using the ElvaX-med spectrometer (Ukraine). Plasma levels of IGF-1 were evaluated by immunoradiometric assay (IRMA) using standard IRMA IGF-1 kits (Immunotech® kit, Czech Republic). Results. In the group of children with BIGHS, the levels of zinc and selenium were 0.57 ± 0.04 μg/ml and 0.05 ± 0.01 μg/ml, respectively, that is significantly lower than in the general group of children with short stature (p < 0.001 and p < 0.05, respectively). The average plasma levels of chromium and copper were lower than those in children with other forms of short stature and amounted to 0.040 ± 0.003 μg/ml and 0.79 ± 0.05 μg/ml, respectively, but were significantly lower than in the control group (р < 0.001). The average level of manganese in the blood plasma was 0.06 ± 0.02 μg/ml, which is somewhat lower than in the control group, but not significantly (p > 0.01). Conclusions. Patients with BIGHS were found to have potentially lower levels of zinc, selenium, chromium and copper in the blood plasma. Thus, in our opinion, it is advisable to include the determination of EM levels in a comprehensive examination of children with short stature. When detecting lower levels of EM, a combined treatment with recombinant growth hormone preparations and those containing appropriate EM is recommended that significantly increases the effectiveness of growth-correction therapy.
Вступ
Наукові дослідження вказують на важливу роль мікроелементного статусу організму людини в функціонуванні всіх органів і систем [1]. Особлива увага приділяється вивченню впливу есенціальних мікроелементів (ЕМ) на здоров’я людини, зокрема дітей і підлітків [2]. Дефіцит тільки одного мікроелемента — явище досить рідкісне, зазвичай він багатоелементний. Порушення балансу елементів у дитинстві та в період статевого дозрівання обов’язково позначається також і на здоров’ї в зрілому віці. Дефіцит ЕМ може поглиблювати патологічні стани, які вже спостерігаються у дитини. Є свідчення про тісний взаємозв’язок ЕМ з системою «гормон росту/ростові фактори». Так, дефіцит цинку призводить до швидкого зниження циркулюючого інсуліноподібного фактора росту 1 (ІФР-1) та білка, що його зв’язує (ІФР-ЗБ-3) [3]. Зниження рівня цинку в плазмі порушує сигнальну систему передачі інформації, необхідної для координації процесу клітинної проліферації у відповідь на вплив ІФР-1. Нестача цинку призводить до пригнічення лужної фосфатази в хондроцитах епіфізарного хряща, що уповільнює процеси росту кісткової тканини. Цинк має безпосередній (синтез ДНК, РНК, білків) та опосередкований (через ГР і ІФР-1) вплив на процеси росту. Дефіцит цинку, що може занадто швидко розвиватись у дитячому віці, гальмує процеси росту, нормального статевого та розумового розвитку дитини [4–6]. Встановлено наявність дефіциту цинку в організмі дітей з доведеною соматотропною недостатністю, а також вплив дефіциту цинку на ефективність лікування рекомбінантним ГР (рГР) [7–9]. Дослідженнями R. Rising et al. встановлено, що дефіцит цинку пов’язаний з відставанням у зрості та резистентністю до ГР [10]. Мідь має значення для підтримання нормальної структури кісток, хрящів, сухожиль (колагену), еластичності стінок кровоносних судин, шкіри (еластину) [11]. Щодо впливу селену на зріст, то, згідно з даними R.G. Freitas et al., діти, які мали недостатність селену, частіше народжувались недоношеними або з меншими показниками росту для свого гестаційного віку [12]. Результати генетичного обстеження пацієнтів зі спадковими мутаціями в гені селен–протеїну N довели фізіологічне значення селену для функціонування м’язів [13]. Крім того, у пацієнтів з мутаціями в гені селенцистеїн-зв’язуючого білка спостерігали затримку дозрівання кісткової тканини, а при де–яких фенотипах — ще й аномальний обмін гормонів щитоподібної залози. Висловлено припущення, що селен є особливо важливим для біоактивності ІФР-1 [14, 15], крім того, модулює соматичний зріст та є надважливим антиоксидантом [16]. Дефіцит інших ЕМ, зокрема марганцю, призводить до розвитку анемії, патології сполучної та кісткової систем (деформації скелета, затримка росту) [17, 18]. Недостатній вміст хрому може призводити до погіршення утилізації глюкози та сприяти розвитку цукрового діабету. Довготривалий дефіцит хрому часто асоціюється із затримкою росту.
Однак залишається практично не вивченим велике коло питань щодо вмісту ЕМ у пацієнтів з різними формами порушення росту, зокрема при синдромі біологічно неактивного гормона росту (СБНГР), характерними рисами якого є значне відставання в рості, нормальний/підвищений рівень ГР на тлі нормального вмісту ІФР-1 в плазмі крові. Не розроблені схеми корекції виявлених порушень. В Україні подібні дослідження не проводились.
Мета роботи: підвищення ефективності лікування дітей і підлітків із синдромом біологічно неактивного гормона росту на основі вивчення вмісту есенціальних мікроелементів у плазмі крові.
Матеріали та методи
В дослідження включено 206 дітей і підлітків з різними формами низькорослості (соматотропна недостатність, синдром біологічно неактивного гормона росту, сімейно-конституціональна та генетично-детермінована низькорослість): 144 хлопчики (69,9 %) та 62 дівчинки (30,1 %), середній вік — 10,06 ± 0,20 року. Діти, хворі на СБНГР, увійшли до групи з 29 осіб: 21 хлопчик (72,41 %) та 8 дівчаток (27,59 %); відставання у зрості становило від –2,0 до –4,6 SD, індекс маси тіла (ІМТ) дорівнював 16,0 ± 0,4 кг/м2, відставання рентгенологічного віку від хронологічного — на 2–4 роки. Середній вік дітей — 9,01 ± 0,60 року. Діагноз СБНГР підтверджений лабораторно: нормальні або підвищені показники гормона росту на тлі проведення стимуляційних тестів з інсуліном і клонідіном та значно знижені показники ІФР-1. З метою диференціальної діагностики СБНГР та рецепторної нечутливості до ГР пацієнтам проводили чотириденну пробу із введенням препарату рГР та подальшим визначенням ІФР-І у плазмі крові. У всіх дітей, які включені в дослідження, проба була позитивною, тобто збільшення ІФР-1 було більшим ніж удвічі.
Для вивчення показників фізичного розвитку використовували антропометричні методи (вимірювання росту за допомогою стадіометра System Dr. Keller J., вимірювання маси тіла (МТ) за допомогою електронних ваг SECA). Визначали: коефіцієнт стандартного відхилення (SDS) для росту та МТ за допомогою перцентильних кривих росту та МТ. Також визначали швидкість росту; кістковий вік (КВ), відставання КВ, розраховували ІМТ.
Контрольну групу становили 34 дитини віком 3–18 років, середній вік — 9,08 ± 0,5 року, хлопчиків було 22 (64,71 %), дівчаток — 12 (35,29 %). Ці пацієнти не мали відставання у рості та статевому розвитку, соматична, генетична та ендокринна патології були відсутні.
Мікроелементний статус оцінювали шляхом визначення рівнів ЕМ (цинку, селену, марганцю, хрому, міді) у плазмі крові методом рентгенофлуоресцентної спектрометрії за допомогою спектрометра ElvaX-med (Україна) за методикою виконання вимірювань вмісту хімічних елементів у плазмі крові (МВВ 081/12-0468-07), атестованою Українським державним комітетом із стандартизації, метрології та сертифікації (свідоцтво від 12.10.2007) і затвердженою Державною санітарно-епідеміологічною службою України (Постанова № 8 від 05.10.2000) (табл. 1).
Рівні ІФР-1 у плазмі крові визначали імунорадіометричним методом за допомогою стандартних наборів IRMA IGF-1 (Immunotech® kit, Чеська Республіка).
Статистичну обробку результатів дослідження виконували із використанням статистичних програм Microsoft Excel та застосуванням методів варіаційної статистики. Результати надано у вигляді середніх значень та їх стандартної похибки (M ± m). Статистичну вірогідність оцінювали за параметричним t-критерієм Стьюдента. Різниця в результатах вважалась вірогідною при р < 0,05; при 0,05 < р < 0,1 відзначали тенденцію до вірогідності. Для вивчення кореляційного зв’язку використовували метод прямої кореляції, розраховуючи коефіцієнт кореляції (r).
Результати
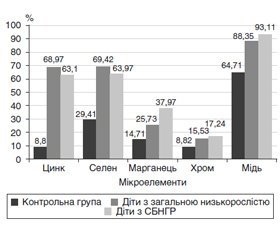
Середній рівень цинку в сироватці крові у дітей з низькорослістю в цілому по групі становив 0,69 ± 0,02 мкг/мл і був вірогідно нижчий, ніж показники цинку у дітей контрольної групи (1,06 ± 0,03 мкг/мл, р < 0,001). В групі дітей із СБНГР середній рівень цинку становив 0,57 ± 0,04 мкг/мл, що вірогідно нижче, ніж показники у дітей конт–рольної групи (р < 0,001), та несуттєво нижче, ніж показники у дітей загальної групи з низькорослістю. Дефіцит цинку в сироватці крові зареєстровано у 130 дітей (63,1 %) з різними видами затримки росту, з них у 34 дітей (26,2 %) спостерігали екстремально низький рівень цинку в плазмі крові — нижчий від 0,4 мкг/мл. У контро–льній групі зниження рівня цинку встановлено тільки у трьох дітей (8,8 %), екстремально низьких показників не зафіксовано. Дефіцит цинку спостерігали у 20 дітей з СБНГР (68,97 %), з них 12 пацієнтів (60 %) мали екстремально низький рівень. Середній рівень цинку у хлопчиків з СБНГР був нижчим, ніж у дівчаток, — 0,54 ± 0,09 мкг/мл та 0,65 ± 0,02 мкг/мл відповідно, але вірогідної різниці між ними не виявлено (р > 0,1). Вірогідне зниження рівня цинку (р < 0,05) спостерігали у хлопчиків з СБНГР порівняно з показниками цинку у хлопчиків контрольної групи; а у дівчаток — тенденцію до зниження рівня цинку порівняно з показниками у дівчат контрольної групи (0,05 < р < 0,1). Дефіцит цинку у хлопчиків з СБНГР спостерігали у 14 пацієнтів (66,67 %), з них екстремально низький рівень цинку — у 8 дітей (57,14 %); у дівчаток дефіцит цинку встановлено у 6 дітей (75 %), а наднизький рівень — у 3 (37,5 %).
Показники середнього рівня ЕМ в дітей з СБНГР надані в табл. 2, частота дефіциту ЕМ у дітей з СБНГР — на рис. 1.
Середній рівень селену в плазмі крові у дітей з низькорослістю становив 0,06 ± 0,01 мкг/мл, у дітей контрольної групи — 0,08 ± 0,01 мкг/мл, що є вищим, ніж показники в плазмі крові дітей з низькорослістю, але невірогідно (р > 0,1). В групі дітей з СБНГР середній рівень селену в крові становив 0,05 ± 0,01 мкг/мл, що вірогідно нижче, ніж у конт–рольній групі (р < 0,05), тобто дефіцит селену в дітей з СБНГР значно більше виражений порівняно з показником у дітей загальної групи з низькорослістю.
Дефіцит селену в сироватці крові у дітей з різними видами затримки росту виявили у 143 дітей (69,42 %), у той час як у контрольній групі зниження рівня селену спостерігалося лише у 10 дітей (29,41 %). Селен-дефіцитний стан мали 20 дітей (68,97 %) з СБНГР: 16 хлопчиків та 4 дівчаток, що дорівнює 76,19 та 50 % відповідно. Середній рівень селену в плазмі крові хлопчиків з СБНГР був нижчим, ніж у дівчаток, — 0,05 ± 0,01 мкг/мл та 0,06 ± 0,01 мкг/мл відповідно, але невірогідно (р > 0,1).
Середній рівень марганцю в плазмі крові у дітей з низькорослістю становив 0,050 ± 0,002 мкг/мл. В контрольній групі середній рівень марганцю в плазмі — 0,07±0,003 мкг/мл, що вірогідно вище, ніж показники марганцю в плазмі крові дітей з низькорослістю (р < 0,001). В групі дітей з СБНГР середній рівень марганцю в плазмі крові становив 0,06 ± 0,02 мкг/мл, що дещо нижче, ніж у контрольній групі, але невірогідно (р > 0,01). Дефіцит марганцю в сироватці крові у дітей з різними видами затримки росту спостерігався у 53 дітей (25,73 %), а у 2 дітей (0,97 %) був підвищеним. В той ж час у контрольній групі зниження рівня марганцю мало місце тільки у п’яти дітей (14,71 %). Рівень марганцю в крові залежно від статі не відрізнявся (0,050 ± 0,003 мкг/мл у хлопчиків і 0,050 ± 0,002 мкг/мл у дівчаток) і був вірогідно нижчим, ніж у відповідній контрольній групі (р < 0,01). Марганець-дефіцитний стан виявлений в 11 дітей з СБНГР (37,93 %). Середній рівень марганцю у хлопчиків з СБНГР був дещо вищим, ніж у дівчаток, — 0,06 ± 0,02 мкг/мл та 0,05 ± 0,01 мкг/мл відповідно. Дефіцит марганцю мали 9 (38,09 %) із 21 хлопчика та 2 дівчинки із 8 (25 %).
Середній рівень хрому в плазмі крові дітей з низькорослістю становив 0,050 ± 0,001 мкг/мл, але статевих відмінностей не виявлено (0,050 ± 0,005 мкг/мл у хлопчиків та 0,050 ± 0,006 мкг/мл у дівчаток відповідно). У контрольній групі середній рівень хрому в плазмі — 0,070 ± 0,003 мкг/мл, що вірогідно вище, ніж показники хрому в плазмі крові дітей з низькорослістю (р < 0,001). В групі дітей з низькорослістю, зумовленою СБНГР, середній рівень хрому в плазмі крові був найнижчим і становив 0,040 ± 0,003 мкг/мл, що вірогідно нижче, ніж у контрольній групі (р < 0,001). Дефіцит хрому в сироватці крові у дітей з різними видами затримки росту спостерігали у 32 дітей (15,53 %), тоді як у контро–льній групі зниження рівня хрому відзначалося лише у 3 дітей (8,82 %). П’ятеро дітей (17,24 %) із СБНГР мали хром-дефіцитний стан. Дефіцит хрому встановлено у 4 хлопчиків (19,04 %) та в 1 дівчинки (12,5 %). Середній рівень хрому у хлопчиків був нижчим, ніж у дівчаток, — 0,040 ± 0,004 мкг/мл та 0,05 ± 0,01 мкг/мл відповідно (р > 0,1), але невірогідно. Підвищений рівень мікроелемента при низькорослості не траплявся.
Середній рівень міді в плазмі крові у дітей з низькорослістю становив 0,89 ± 0,03 мкг/мл, у конт–рольній групі — 1,06 ± 0,05 мкг/мл (р < 0,01). В групі дітей з СБНГР середній рівень міді в плазмі крові був найнижчим — 0,79 ± 0,05 мкг/мл, що вірогідно нижче, ніж показники в контрольній групі (р < 0,001) та в усіх дітей з низькорослістю. Дефіцит міді в сироватці крові у дітей з різними видами затримки росту спостерігали у 182 дітей (88,35 %), підвищений рівень не відмічався. В контрольній групі зниження рівня міді відзначалося у 22 дітей (64,71 %). Пацієнти із СБНГР мали мідь-дефіцитний стан у 27 випадках (93,11 %), тобто дефіцит міді виявляли значно частіше, ніж дефіцит інших ЕМ (рис. 1). В результаті вивчення концентрації міді у пацієнтів з СБНГР залежно від статі встановлено, що у хлопчиків вона була вірогідно нижчою, ніж у дівчаток (0,85 ± 0,03 мкг/мл та 0,95 ± 0,04 мкг/мл відповідно, р < 0,05). Дефіцит міді зафіксовано у 19 (90,47 %) хлопчиків та всіх 8 (100 %) дівчаток.
При проведенні кореляційного аналізу між рівнями ІФР-1 і певного елемента пряма залежність була вірогідно відзначена тільки між рівнем ІФР-1 і вмістом цинку в організмі дітей як з СБНГР, так і в пацієнтів з низькорослістю у загальній групі.
Обговорення
Синдром біологічно неактивного гормона росту (вперше описаний польським лікарем Коварські в 1978 році) віднесений до дефіциту гормона росту визначеного походження вродженої форми [19]. З того часу були отримані докази генетичної природи захворювання, започаткувалось вивчення характеру секреції ІФР-1, ІФР-ЗБ-3 і ГР та особливостей фенотипу пацієнтів залежно від клінічних ознак захворювання [20–22]. Однак відомості про мікроелементний стан у дітей з низькорослістю вельми обмежені [23], а у пацієнтів з СБНГР це питання зовсім не вивчалось. Наші попередні дослідження [24] свідчать про наявність суттєвого мікроелементного дисбалансу у дітей із соматотропною недостатністю, а саме — зниження вмісту цинку, селену, міді, хрому і марганцю в плазмі крові у більшості пацієнтів. В першу чергу нашу увагу привертає вміст цинку, оскільки він є одним з найсуттєвіших мікроелементів, який бере участь не тільки у процесах росту, а й в роботі ендокринної системи в цілому, а також має пряму кореляційну залежність від дефіциту ІФР-1. Згідно з отриманими нами результатами дослідження встановлено, що різке зниження рівня ІФР-1 при СБНГР асоціюється з вірогідним різким зниженням рівня цинку в плазмі крові пацієнтів, що підтверджує тісний взаємозв’язок цинку та системи ГР/ростові фактори. Найбільша частота екстремально низьких значень вмісту цинку серед усіх пацієнтів з низькорослістю встановлена саме у дітей з СБНГР. Дефіцит селену також був більш виражений в групі дітей з СБНГР, ніж у пацієнтів загальної групи з затримкою росту.
Переважна більшість дітей з низькорослістю (88,35 %) мали дефіцит міді. У переважної більшості дітей з СБНГР (93,11 %) захворювання супроводжувалось найнижчими рівнями міді в плазмі крові порівняно як з показниками дітей загальної групи, так і в групі контролю — дефіцит міді в такій групі пацієнтів траплявся значно частіше, ніж дефіцит інших ЕМ.
Суттєве зниження рівнів таких ЕМ, як цинк, селен, мідь, свідчить про значне порушення системи антиоксидантного захисту у пацієнтів з СБНГР. Можна припустити, що одночасне різке зниження вмісту цинку і міді асоціюється зі зміною активності та рівня гіпоталамічної каталази й активністю Cu/Zn супероксиддисмутази [25], однак це потребує подальших досліджень.
Висновки
Для пацієнтів з СБНГР характерним є вірогідне зниження рівнів цинку, селену, хрому та міді у плазмі крові. Отже, до комплексу обстеження дітей з низькорослістю доцільно включати визначення рівнів ЕМ у плазмі крові, пацієнтам з СБНГР в першу чергу необхідно визначати рівні цинку, міді й селену.
При виявленні знижених рівнів ЕМ рекомендовано комбіноване лікування препаратами рГР та такими, що містять відповідні ЕМ, з метою підвищення ефективності ріст-корегуючої терапії. При встановленні наявності дефіциту ЕМ рекомендовано розширення дієти за рахунок включення харчових продуктів, збагачених відповідним мікроелементом.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Погорєлов М.В. Макро- та мікроелементи (обмін, патологія та методи визначення): Монографія / М.В. Погорєлов, В.І. Бумейстер, Г.Ф. Ткач [та ін.]. — Суми: Вид-во СумДУ, 2010. — 147 с.
2. Concentration of selected metals in whole blood, plasma, and urine in short stature and healthy children / M. Klatka, A. Błażewicz, M. Partyka [et al.] // Biol. Trace Elem. Res. — 2015. — Vol. 166, № 2. — P. 142-148.
3. Growth hormone-releasing factor affects macronutrient intake during the anabolic phase of zinc repletion: total hypothala–mic growth hormone-releasing factor content and growth hormone-releasing factor immunoneutralization during zinc repletion / T.M. Rains, H.F. Mangian, T. Liang [et al.] // Nutr. Neurosci. — 2001. — Vol. 4, № 4. — P. 283-293.
4. Zinc supplementation for preventing mortality, morbidity, and growth failure in children aged 6 months to 12 years of age / Mayo-Wilson J.A. Junior, A. Imdad [et al.] // Cochrane Database Syst. Rev. — 2014. — 5. — CD009384.
5. Козаренко В. Дефицит цинка у детей. Влияние на темпы роста и полового развития / В. Козаренко. — Изд-во: LAP Lambert Academic Publishing, 2011. — 156 с.
6. Біологічна роль цинку і необхідність забезпечення адекватного рівня його споживання людиною / М.Д. Тронько, М.О. Полумбрик, В.М. Ковбаса [та ін.] // Вісник НАН України. — 2013. — № 6. — С. 21-31.
7. Zinc deficiency: a contributing factor of short stature in growth hormone deficient children / Z. Siklar, C. Tuna, Y. Dallar, G. Tanyer // J. Trop. Pediatr. — 2003. — Vol. 49, № 3. — P. 187-188.
8. Большова О.В. Вміст есенціальних мікроелементів у волоссі дітей з низькорослістю внаслідок соматотропної недостатності / О.В. Большова, В.Г. Пахомова // ScienceRise: Medical Science. — 2016. — № 4/3(21). — С. 58-64.
9. Большова О.В. Вміст інсуліноподібного фактора росту 1 та есенціальних мікроелементів у плазмі крові в дітей із різними формами низькорослості / О.В. Большова, В.Г. Пахомова // Міжнародний ендокринологічний журнал. — 2016. — № 3(75). — С. 70-75.
10. Exogenous recombinant human growth hormone effects during suboptimal energy and zinc intake / R. Rising, J.F. Scaglia, C. Cole [et al.] // Nutr. Metab. (Lond.). — 2005. — Vol. 7, № 2(1). — P. 10.
11. Copper availability contributes to iron perturbations in human nonalcoholic fatty liver disease / E. Aigner, I. Theurl, H. Haufe [et al.] // Gastroenterology. — 2008. — Vol. 35, № 2. — P. 680-688.
12. Selenium deficiency and the effects of supplementation on preterm infants / R.G. Freitas, R.J. Nogueira, M.A. Antonio [et al.] // Rev. Paul Pediatr. — 2014. — Vol. 32, № 1. — P. 126-135.
13. Schweizer U. Disorders of selenium metabolism and selenoprotein function / U. Schweizer, N. Dehina, L. Schomburg // Curr. Opin. Pediatr. — 2011. — P. 23, № 4. — P. 429-435.
14. Association of plasma selenium concentrations with total IGF-1 among older community-dwelling adults: the InCHIANTI study / M. Maggio, G.P. Ceda, F. Lauretani [et аl.] // Clin. Nutr. — 2010. — Vol. 29, № 5. — P. 674-677.
15. Diet, body composition, and physical fitness influences on IGF-I bioactivity in women / K.J. Philip, J.A. Alemany, C. Koenig [et al.] // Growth Horm. IGF Res. — 2009. — Vol. 19, № 6. — P. 491-496.
16. Selenium deficiency-induced growth retardation is associated with an impaired bone metabolism and osteopenia / R. Moreno-Reyes, D. Egrise, J. Nève [et al.] // J. Bone Miner. Res. — 2001. — Vol. 16, № 8. — P. 1556-1563.
17. Скальная М.Г. Микроэлементы: биологическая роль и значение для медицинской практики. Сообщение 3. Марганец / М.Г. Скальная, А.В. Скальный // Вопросы биологической, медицинской и фармацевтической химии. — 2015. — № 3. — С. 14-25.
18. Wood R.J. Manganese and birth outcome / R.J. Wood // Nutr. Rev. — 2009. — Vol. 67, № 7. — P. 416-420.
19. Wit J.M. ESPE classification of paediatric endocrine diagnosis. 1. Short stature / J.M. Wit, M.B. Ranke, C.J.H. Kelnar // Horm. Res. — 2007. — Vol. 68(Suppl. 2). — P. 1-5.
20. Takahashi Y. Clinical significance and molecular me–chanisms of bioinactive growth hormone (review) / Y. Takahashi, K. Chihara // Int. J. Mol. Med. — 1998. — Vol. 2, № 3. — P. 287-291.
21. Wit J.M. Spectrum of insulin-like growth factor deficiency / J.M. Wit, W. Oostdijk, M. Losekoot // Endocr. Dev. — 2012. — Vol. 23. — P. 30-41.
22. Спринчук Н.А. Клініко-діагностичні особливості та лікування синдрому біологічно неактивного гормону росту / Н.А. Спринчук, О.Я. Самсон // Клінічна ендокринологія та ендокринна хірургія. — 2010. — № 3. — С. 58-61.
23. Вміст есенціальних мікроелементів в організмі дітей з відставанням у зрості в залежності від ступеня низькорослості / О.В. Большова, В.Г. Пахомова // ScienceRise: Medical Science — 2016. — № 6(2). — С. 50-56.
24. Большова О.В. Вміст цинку в організмі дітей та підлітків з соматотропною недостатністю / О.В. Большова, В.Г. Пахомова, Н.А. Спринчук // Лікарська справа. — 2013. — № 5. — С. 70-75.
25. Hauck S.J. Effects of growth hormone on hypothalamic catalase and Cu/Zn superoxide dismutase / S.J. Hauck, A. Bartke // Free Radic. Biol. Med. — 2000. — Vol. 28, № 6. — P. 970-978.

/550-1.jpg)
/551-1.jpg)
/551-2.jpg)