Журнал «Здоровье ребенка» Том 13, №7, 2018
Вернуться к номеру
Актуалізація застосування інтерферону при гострому простому бронхіті в дітей
Авторы: Абатуров О.Є., Токарєва Н.М.
ДУ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. Основними етіологічними факторами гострого простого бронхіту у дітей є респіраторнотропні віруси, у зв’язку з чим препарати інтерферону можуть бути використані при лікуванні відповідних респіраторних захворювань. Мета: вивчення клініко-імунологічної ефективності рекомбінантного інтерферону альфа-2b при лікуванні гострого простого бронхіту в дітей. Матеріали та методи. Під наглядом перебувало 49 дітей віком від двох до шести років, хворих на гострий простий бронхіт, 23 дитини отримували препарат Лаферобіон®, що містить рекомбінантний інтерферон альфа-2b. При проведенні роботи використовувалися клінічні й лабораторні методи дослідження. Тяжкість стану хворого оцінювалася за Bronchitis severity score (шкалою BSS). Лабораторне дослідження включало загальний аналіз крові, сечі, застосовувались імуноферментні методи. Етіологічний діагноз встановлювався на підставі вірусологічних методів дослідження. При визначенні концентрації інтерферону гамма використовувався набір «Гамма-інтерферон-ІФА-БЕСТ А-8752» фірми «Вектор Бест»; лактоферину — набір Нuman Lactoferrin NK 329 Edition 06-16 виробництва компанії Hycult Biotech (USA), нейтрофільних α-дефензинів 1–3 — реактиви Нuman HNP NK317 Edition 08-16 виробництва компанії Hycult Biotech (USA). Результати. У всіх дітей, хворих на гострий простий бронхіт, захворювання почалося гостро й проявлялося катаральним і загальнозапальним синдромами. Згідно з оцінкою ознак гострого простого бронхіту за шкалою BSS на початку захворювання і в періоді реконвалесценції, застосування в терапії рекомбінантного інтерферону альфа-2b сприяє більш швидкому зменшенню всіх клінічних проявів захворювання й збільшенню вмісту лактоферину в ротоглотковій рідині до періоду реконвалесценції. Висновки. Ректальне призначення рекомбінантного інтерферону альфа-2b Лаферобіон® є етіопатогенетичним методом лікування гострого простого бронхіту в дітей.
Актуальность. Основными этиологическими факторами острого простого бронхита у детей являются респираторнотропные вирусы, в связи с чем препараты интерферона могут быть использованы при лечении соответствующих респираторных заболеваний. Цель: изучение клинико-иммунологической эффективности рекомбинантного интерферона альфа-2b при лечении острого простого бронхита у детей. Материалы и методы. Под наблюдением находилось 49 детей в возрасте от двух до шести лет, больных острым простым бронхитом, 23 ребенка получали препарат Лаферобион®, содержащий рекомбинантный интерферон альфа-2b. При проведении работы использовались клинические и лабораторные методы исследования. Тяжесть состояния больного оценивалась по Bronchitis severity score (шкале BSS). Лабораторное исследование включало общий анализ крови, мочи, применялись иммуноферментные методы. Этиологический диагноз устанавливался на основании вирусологических методов исследования. При определении концентрации интерферона гамма использовался набор «Гамма-интерферон-ИФА-БЕСТ А-8752» фирмы «Вектор Бест»; лактоферрина — набор Нuman Lactoferrin NK 329 Edition 06-16 производства компании Hycult Biotech (USA), нейтрофильных α-дефензинов 1–3 — реактивы Нuman HNP NK317 Edition 08-16 производства компании Hycult Biotech (USA). Результаты. У всех детей с острым простым бронхитом заболевание началось остро и проявлялось катаральным и общевоспалительным синдромами. Согласно оценке признаков острого простого бронхита в начале заболевания и в периоде реконвалесценции по шкале BSS, применение в терапии рекомбинантного интерферона альфа-2b способствует более быстрому уменьшению всех клинических проявлений заболевания и увеличению содержания лактоферрина в ротоглоточной жидкости к периоду реконвалесценции. Выводы. Ректальное назначение рекомбинантного интерферона альфа-2b Лаферобион® является этиопатогенетическим методом лечения острого простого бронхита у детей.
Background. The main etiological factors of acute simple bronchitis in children are respiratory viruses, and therefore interferon preparations can be used in the treatment of these respiratory diseases. The purpose of the work was to study the clinical and immunological efficacy of recombinant alpha 2b interferon in the treatment of acute simple bronchitis in children. Materials and methods. We have examined 49 children aged 2 to 6 years with acute simple bronchitis; 23 children received Laferobion® containing recombinant alpha 2b interferon. During the work, clinical and laboratory methods of investigation were used. The severity of the patient’s condition was assessed according to the Bronchitis severity score. The laboratory study included: general blood and urine test, nasocytological, immunoassay methods. The etiological diagnosis was established using virological methods of investigation. When determining the concentration of interferon gamma, “Gamma interferon-IFA-BEST A-8752” set manufactured by Vector Best was used; lactoferrin — Нuman Lactoferrin NK 329 Edition 06-16 set manufactured by Hycult Biotech (USA), neutrophil α-defensins 1-3 — Нuman HNP NK317 Edition 08-16 reagents manufactured by Hycult Biotech (USA). Results. In all children with acute simple bronchitis, the disease began acutely and manifested itself with catarrhal and general inflammatory syndromes. According to the evaluation of acute simple bronchitis signs at the onset of the disease and in the period of convalescence using Bronchitis severity score, the administration of recombinant alpha 2b interferon promotes a faster reduction of all clinical manifestations of the disease and an increase in the lactoferrin content in the oropharyngeal fluid until the period of convalescence. Conclusions. The rectal administration of recombinant alpha 2b interferon Laferobion® is an etiopathogenetic method for the treatment of acute simple bronchitis in children.
гострий простий бронхіт; діти; імунітет; інтерферон альфа-2b; інтерферон гамма; лактоферин; α-дефензини
острый простой бронхит; дети; иммунитет; интерферон альфа-2b; интерферон гамма; лактоферрин; α-дефензины
acute simple bronchitis; children; immunity; interferon alpha 2b; interferon gamma; lactoferrin; α-defensins
Вступ
Незважаючи на відносно сприятливі прояви гострого простого бронхіту (ГПБ) у дітей, останнім часом дане захворювання характеризується схильністю до розвитку затяжного й ускладненого перебігу хвороби [1, 2].
З огляду на те, що основними етіологічними факторами ГПБ є респіраторнотропні віруси, у клінічній практиці при лікуванні хворих із ГПБ широко застосовують препарати інтерферону [3–8]. У дітей при гострих захворюваннях респіраторного тракту, викликаних вірусними агентами, переважно використовують препарати рекомбінантного інтерферону I типу. Однією з форм випуску препаратів рекомбінантного інтерферону є ректальні супозиторії, що містять рекомбінантний інтерферон альфа-2b. Препарати рекомбінантного інтерферону альфа-2b рекомендують починати використовувати при перших проявах ГПБ [9, 10]. Проте до цього часу механізм саногенетичної дії ректальних форм рекомбінантних інтерферонів залишається недостатньо вивченим.
Метою роботи було вивчення клініко-імунологічної ефективності рекомбінантного інтерферону альфа-2b при лікуванні гострого простого бронхіту в дітей.
Матеріали та методи
Під нашим спостереженням перебували 49 дітей віком від двох до шести років, хворих на ГПБ, які знаходились на стаціонарному лікуванні в КЗ «Дніпровська міська клінічна лікарні № 1», м. Дніпро. Основна група дітей, хворих на ГПБ, отримувала стандартну терапію (оральна регідратація, вітамінотерапія, симптоматична терапія), що відповідала протоколу, затвердженому МОЗ України щодо ведення дітей, хворих на гострий простий бронхіт. Група з 23 дітей отримувала поряд зі стандартною терапією препарат рекомбінантного інтерферону альфа-2b для ректального застосування Лаферобіон®, що містить рекомбінантний інтерферон альфа-2b, токоферолу ацетат, аскорбінову кислоту. Перевагою використання супозиторіїв у дітей є краща біодоступність препарату. Засоби, що всмоктуються в прямій кишці, меншою мірою трансформуються в печінці, тобто знижується ризик розвитку побічних реакцій. Препарат Лаферобіон® застосовувався в дітей із ГПБ у вигляді ректальних супозиторіїв у дозі 500 000 МО інтерферону альфа-2b 2 рази на добу з інтервалом 12 годин протягом 5 діб.
При проведенні роботи використовувалися клінічні й лабораторні методи дослідження. Загальноклінічне дослідження включало вивчення скарг хворих, анамнезу життя, захворювання й клінічне обстеження органів і систем організму.
При клінічній оцінці стану тяжкості хворого використовувалася запропонована L. Dome, R. Schuster у 1996 році Bronchitis severity score (шкала BSS) [11]. Шкала BSS інтегрує вираженість проявів п’яти клінічних ознак ГПБ: кашлю, мокротиння, хрипів, болю в грудній клітці при кашлі й диспное. Вираженість цих ознак оцінюється за п’ятибальною шкалою Likert: 0 — відсутня; 1 — помірна; 2 — середньої тяжкості; 3 — тяжка; 4 — дуже тяжка. Сумарна кількість балів коливається від 0 до 20 [4].
Лабораторне дослідження включало: загальний аналіз крові, сечі, застосування назоцитологічних, імуноферментних методів. Етіологічний діагноз встановлювався на підставі вірусологічних методів дослідження.
Вміст інтерферону гамма (IFN-g) в сироватці крові й ротоглотковій рідині, антимікробних факторів у ротоглотковій рідині досліджувався шляхом імуноферментного аналізу ELISA в сертифікованій імунологічній лабораторії лікувально-діагностичного центру «Аптеки медичної академії» за адресою: м. Дніпро, пл. Соборна, 4; ліцензія АЕ № 459359 від 18.09.2014, ldc@dialab.dp.ua. При визначенні концентрації IFN-g використовувався набір «Гамма-інтерферон-ІФА-БЕСТ А-8752» фірми «Вектор Бест»; лактоферину — набір Нuman Lactoferrin NK 329 Edition 06-16 виробництва компанії Hycult Biotech (USA), нейтрофільних a-дефензинів (Human Neutrophil Peptides, HNP) 1–3 — реактиви Нuman HNP NK317 Edition 08-16 виробництва компанії Hycult Biotech (USA).
Статистична обробка даних проводилася за допомогою методів варіаційної статистики з використанням програм StatGraf. Вірогідність відмінностей статистичних сукупностей у випадках нормального розподілу оцінювалася за допомогою t-критерію Стьюдента (t), у випадках ненормального розподілу — за допомогою критерію Манна — Уїтні (U).
Результати
У всіх дітей, які перебували під спостереженням, ГПБ був викликаний вірусними агентами. Гострий простий бронхіт у всіх хворих починався гостро й проявлявся катаральним і загальнозапальним синдромами. У симптоматичній структурі проявів ГПБ переважали кашель (2,4–2,7 бала) і вологі різнокаліберні розсіяні хрипи (2,3–2,9 бала). Згідно з оцінкою ознак ГПБ за шкалою BSS на початку захворювання і в періоді реконвалесценції, застосування в терапії препарату рекомбінантного інтерферону альфа-2b у хворих на ГПБ сприяло більш швидкому зменшенню всіх клінічних проявів захворювання. За шкалою BSS загальна сума балів, що характеризує тяжкість проявів захворювання на період реконвалесценції в дітей, які отримували стандартну терапію, становила 5,2 ± 0,5, а на тлі терапії з включенням препарату рекомбінантного інтерферону альфа-2b — 3,4 ± 0,4 (t = 6,25; p = 0,000002) (табл. 1).
Встановлено, що на час одужання у хворих із ГПБ, які отримували стандартну терапію в поєднанні з препаратом рекомбінантного інтерферону альфа-2b, спостерігалася вірогідно менша вираженість таких проявів хвороби, як кашель (t = 4,92; p = 0,00005), аускультативне визначення хрипів (t = 4,95; p = 0,00005 ), диспное (t = 4,02; p = 0,0005), ніж у хворих, які отримували тільки стандартну терапію. У жодного хворого з ГПБ, який отримував препарат рекомбінантного інтерферону альфа-2b, не було виявлено навіть тенденції до формування затяжного перебігу захворювання.
Ректальне призначення препарату рекомбінантного інтерферону альфа-2b супроводжувалося вірогідним зменшенням тривалості загальнозапального синдрому. Зокрема, тривалість періоду лихоманки на тлі стандартної терапії й терапії з включенням препарату рекомбінантного інтерферону альфа-2b становила 3,5 ± 0,4 дня і 2,3 ± 0,3 дня відповідно.
У 85 % хворих, які отримували стандартну терапію в поєднанні з препаратом рекомбінантного інтерферону альфа-2b, спостерігалося одужання на 7-му добу захворювання, на той час як у хворих, які отримували тільки стандартну терапію, одужання на 7-му добу відзначено тільки в 46 % випадків. Застосування препарату рекомбінантного інтерферону альфа-2b при лікуванні ГПБ у дітей не призводило до істотних змін у назоцитограмі (табл. 2).
Вплив стандартної терапії й терапії із застосуванням препарату рекомбінантного інтерферону альфа-2b на вміст IFN-g у сироватці крові й ротоглотковій рідині та антимікробних факторів у ротоглотковій рідині при ГПБ у дітей відображено в табл. 3.
Згідно з отриманими даними, зміна концентрації IFN-g в сироватці крові й ротоглотковій рідині до періоду реконвалесценції не залежала від застосування препарату рекомбінантного інтерферону альфа-2b під час лікування дітей, хворих на ГПБ. У гострий період захворювання рівень IFN-g у сироватці крові становив 1,38 ± 0,15 нг/мл
у хворих, які не отримували ректально рекомбінантний інтерферон альфа-2b, і 1,48 ± 0,12 нг/мл — у тих, які його отримували; а до періоду реконвалесценції відбувалося вірогідне зниження його рівня до 0,93 ± 0,12 нг/мл (t = 2,34; p = 0,0282) і 1,05 ± 0,11 нг/мл (t = 2,64; p = 0,0146) відповідно.
Концентрація IFN-g у ротоглотковій рідині не змінювалася упродовж усього періоду захворювання незалежно від типу медикаментозної терапії.
Застосування рекомбінантного інтерферону альфа-2b запобігало збільшенню вмісту a-дефензинів 1–3 у ротоглотковій рідині. У хворих на ГПБ, які отримували стандартну терапію, спостерігалося збільшення рівня a-дефензинів 1–3 у ротоглотковій рідині до 1,88 ± 0,18 нг/мл (t = 2,67; p = 0,0131).
Терапія дітей, хворих на ГПБ, із використанням препарату рекомбінантного інтерферону альфа-2b вірогідно (t = 2,32; p = 0,0297) сприяла збільшенню вмісту лактоферину до 2,32 ± 0,13 мкг/мл у ротоглотковій рідині до періоду реконвалесценції ГПБ, що не спостерігалося у хворих дітей, які не отримували даний препарат.
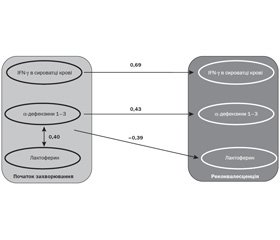
Під впливом терапії препаратом рекомбінантного інтерферону альфа-2b відбувалася зміна співвідношення вмісту IFN-g, a-дефензинів 1–3 і лактоферину. На тлі стандартної терапії відзначався прямий зв’язок вмісту a-дефензинів 1–3 і лактоферину в гострому періоді ГПБ (r = 0,40), концентрацій IFN-g у сироватці крові (r = 0,69) і a-дефензинів 1–3 (r = 0,43) у ротоглотковій рідині в гострому періоді й у періоді реконвалесценції захворювання й обернено пропорційний зв’язок між концентраціями a-дефензинів 1–3 у ротоглотковій рідині на початку хвороби і лактоферину в ротоглотковій рідині в періоді реконвалесценції (r = –0,39) (рис. 1).
У хворих, які отримували ректально препарат рекомбінантного інтерферону альфа-2b, відзначалося значне збільшення сили залежності вмісту IFN-g (до r = 0,98) у сироватці крові й з’являлася негативна залежність вмісту IFN-g (r = –0,49) у ротоглотковій рідині в періоді реконвалесценції від рівня IFN-g в сироватці крові на початку захворювання. Зникла позитивна залежність концентрації лактоферину в період реконвалесценції від рівня a-дефензинів 1–3 у ротоглотковій рідині на початку захворювання (рис. 2).
Обговорення
Призначення ректального інтерферону альфа-2b дітям, хворим на ГПБ, призводить до скорочення тривалості як катарального й загальнозапального синдромів, так і всього захворювання. Призначення ректального інтерферону альфа-2b дітям, хворим на ГПБ, супроводжується більш швидким зникненням кашлю, аускультативних хрипів, диспное. Більш швидкий регрес катарального синдрому був пов’язаний із підвищенням концентрації лактоферину в ротоглотковій рідині в періоді реконвалесценції. На нашу думку, підвищення продукції лактоферину клітинами слизової оболонки на тлі терапії із застосуванням інтерферону альфа-2b сприяє кліренсу вірусних агентів і завершенню запального процесу. Більш високий вміст IFN-g, що спостерігався в гострому періоді захворювання, порівняно з періодом реконвалесценції у хворих на ГПБ є закономірним феноменом на тлі гострих респіраторних захворювань [12, 13]. Підвищення рівня залежності концентрації IFN-g у сироватці крові на початку й у кінці захворювання на тлі терапії ректальним рекомбінантним інтерфероном альфа-2b, ймовірно, демонструє здатність препарату пролонгувати певний рівень активності функціонування механізмів продукції IFN-g до періоду завершення інфекційного процесу. Враховуючи, що з IFN-g асоційована активність натуральних кілерів і цитотоксичних CВ8+-клітин [14–16], ми вважаємо, що даний механізм дії рекомбінантного інтерферону альфа-2b зумовлює ефективність кліренсу вірусних антигенів при ГПБ у дітей.
Ймовірно, вплив терапії рекомбінантним інтерфероном альфа-2b на процес одужання при ГПБ реалізується через індукцію активності синтезу лактоферину в респіраторному тракті. Відомо, що лактоферин має антибактеріальну, противірусну, протигрибкову й антипаразитарну дію (табл. 4).
У протиінфекційному захисті лактоферин відіграє істотну роль, особливо в ранній період захворювання. Так, продемонстровано, що лактоферин-дефіцитні миші мали низьку активність нейтрофілів [18] і високу чутливість до бактеріальних інфектів [19]. Завдяки своїм антимікробним властивостям лактоферин вважається ключовим компонентом першої ланки протиінфекційного захисту організму [20].
На ранніх етапах інфекційного процесу лактоферин має досить виражену противірусну активність щодо респіраторнотропних вірусів — грипу, респіраторно-синцитіального, аденовірусу [11]. Вважають, що лактоферин, зв’язуючись із вірусними структурними поліпептидами або їх клітинними рецепторами макроорганізму, просторово роз’єднує інфекційний агент і рецептор [21, 22]. Противірусна активність лактоферину обумовлена здатністю його молекули зв’язуватися з глікозаміногліканами, гепарансульфатами й вірусними частками. Ядерна локалізація лактоферину, виявлена в різних типах епітеліальних клітин людини, свідчить про те, що лактоферин чинить противірусну дію не лише на ранній стадії взаємодії вірусу з поверхневими рецепторами клітини, але й після проникнення вірусу в клітину [11]. Лактоферин також підсилює активність NK-клітин і Th1-асоційовану відповідь, функціонування яких визначає ефективність саногенезу при вірусних інфекціях [21].
Висновки
Гострий простий бронхіт у дітей останнім часом характеризується схильністю до затяжного й ускладненого перебігу, що вимагає розробки терапевтичних заходів, які знижують ймовірність розвитку пролонгованого перебігу захворювання. Враховуючи, що гострі прості бронхіти в більшості випадків викликані вірусними агентами, призначення препаратів рекомбінантних інтерферонів I типу можна вважати патогенетично обґрунтованим. Ректальне призначення рекомбінантного інтерферону альфа-2b, зокрема препарату Лаферобіон®, дітям, хворим на ГПБ, супроводжується вірогідно більш швидким одужанням і підвищенням концентрації лактоферину в ротоглотковій рідині до періоду реконвалесценції захворювання. Ймовірно, саме підвищення концентрації лактоферину сприяє елімінації інфекційних агентів і більш швидкому регресу запального процесу при ГПБ у дітей на тлі лікування препаратом Лаферобіон®. Ми вважаємо, що ректальне призначення рекомбінантного інтерферону альфа-2b є етіопатогенетичним методом лікування гострого простого бронхіту в дітей.
Конфлікт інтересів. Не заявлений.
1. Джумагазиев А.А. Применение иммуномодуляторов и метаболитов для профилактики острого бронхита и острой пневмонии у детей // Новая наука: Теоретический и практический взгляд. — 2016. — № 117-3. — С. 44-45.
2. Сухорукова Д.Н., Кузнецова Т.А. Эпидемиология острого бронхита и бронхиолита у детей // Евразийский союз ученых. — 2016. — № 32. — С. 19-21.
3. Булгакова В.А. Респираторные инфекции у детей: диагностика, лечение и профилактика // Практика педиатра. — 2012. — № 6. — С. 16-28.
4. Горелов А.В. Экзогенная интерферонизация как аспект этиопатогенетической терапии острых респираторных вирусных инфекций / А.В. Горелов, Л.В. Феклисова, Н.М. Грачева, Д.Н. Алпенидзе // Фарматека. — 2011. — № 15. — С. 73-81.
5. Зайцев А.А. Острые респираторные вирусные инфекции: актуальные вопросы диагностики, лечения и профилактики: Практические рекомендации. — М., 2017.
6. Лысенко И.М. Этиопатогенетические аспекты терапии заболеваний респираторного тракта у детей и подростков / И.М. Лысенко, Г.К. Баркун, Л.Н. Журавлева и др. // Охрана материнства и детства. — 2016. — № 2(28). — С. 35-57.
7. Симованьян Э.Н., Харабаджахян Э.А., Денисенко В.Б. Эффективность использования рекомбинантного интерферона a2b (Виферона) при остром обструктивном бронхите у детей // Педиатрия. Журнал им. Г.Н. Сперанского. — 2008. — Т. 87, № 1. — С. 19.
8. Юлиш Е.И. Противовирусная терапия в лечении острых респираторных заболеваний у детей // Современная педиатрия. — 2013. — № 5(53). — С. 1-4.
9. Абатуров А.Е., Волосовец А.П., Юлиш Е.И. Индукция молекулярных механизмов неспецифической защиты респираторного тракта (монография). — К.: Приватна друкарня ФО-II Сторожук О.В., 2012. — 240 с.
10. Чернышева О.Е. Применение рекомбинантного a-2b-интерферона в лечении острых респираторных вирусных заболеваний у детей // Здоровье ребенка. — 2016. — 6(74). — С. 69-73.
11. Berlutti F. Antiviral properties of lactoferrin — a natural immunity molecule / F. Berlutti, F. Pantanella, T. Natalizi et al. // Molecules. — 2011 Aug 16. — 16(8). — 6992-7018. doi: 10.3390/molecules16086992.
12. Drajac C. Pulmonary Susceptibility of Neonates to Respiratory Syncytial Virus Infection: A Problem of Innate Immunity? / C. Drajac, D. Laubreton, S. Riffault, D. Descamps // J. Immunol. Res. — 2017. — 2017. — 8734504. doi: 10.1155/2017/8734504.
13. Schmidt M.E., Varga S.M. Cytokines and CD8 T cell immunity during respiratory syncytial virus infection // Cytokine. — 2018 Jul 18. — pii: S1043-4666(18)30297-7. doi: 10.1016/j.cyto.2018.07.012.
14. Abboud G. Natural Killer Cells and Innate Interferon Gamma Participate in the Host Defense against Respiratory Vaccinia Virus Infection / G. Abboud, V. Tahiliani, P. Desai et al. // J. Virol. — 2015 Oct 14. — 90(1). — 129-41. doi: 10.1128/JVI.01894-15..
15. Molloy C.T. Contributions of CD8 T cells to the pathogenesis of mouse adenovirus type 1 respiratory infection / C.T. Molloy, J.S. Andonian, H.M. Seltzer et al. // Virology. — 2017 Jul. — 507. — 64-74. doi: 10.1016/j.virol.2017.04.005.
16. Zhao M. Prolonged evolution of virus-specific memory T cell immunity post severe avian influenza A (H7N9) virus infection / M. Zhao, J. Chen, S. Tan et al. // J. Virol. — 2018 Jun 20. — pii: JVI.01024-18. doi: 10.1128/JVI.01024-18.
17. Siqueiros-Cendón T. Immunomodulatory effects of lactoferrin / T. Siqueiros-Cendón, S. Arévalo-Gallegos, B.F. Iglesias-Figueroa et al. // Acta Pharmacol. Sin. — 2014 May. — 35(5). — 557-66. doi: 10.1038/aps.2013.200.
18. Ward P.P. Stimulus-dependent impairment of the neutrophil oxidative burst response in lactoferrin-deficient mice / P.P. Ward, M. Mendoza-Meneses, P.W. Park, O.M. Conneely // Am. J. Pathol. — 2008 Apr. — 172(4). — 1019-29. doi: 10.2353/ajpath.2008.061145.
19. Velusamy S.K. Protective effects of human lactoferrin during Aggregatibacter actinomycetemcomitans-induced bacteremia in lactoferrin-deficient mice / S.K. Velusamy, R. Poojary, R. Ardeshna et al. // Antimicrob. Agents Chemother. — 2014. — 58(1). — 397-404. doi: 10.1128/AAC.00020-13.
20. Mayeur S. Lactoferrin, a Pleiotropic Protein in Health and Disease / S. Mayeur, S. Spahis, Y. Pouliot, E. Levy // Antioxid. Redox Signal. — 2016 May 10. — 24(14). — 813-36. doi: 10.1089/ars.2015.6458.
21. Wakabayashi H. Lactoferrin for prevention of common viral infections / H. Wakabayashi, H. Oda, K. Yamauchi, F. Abe // J. Infect. Chemother. — 2014 Nov. — 20(11). — 666-71. doi: 10.1016/j.jiac.2014.08.003.
22. Gualdi L. Lack of effect of bovine lactoferrin in respiratory syncytial virus replication and clinical disease severity in the mouse model / L. Gualdi, S. Mertz, A.M. Gomez et al. // Antiviral Res. — 2013 Aug. — 99(2). — 188-95. doi: 10.1016/j.antiviral.2013.05.013.
23. Moawad E.M. Cross-sectional evaluation of the Bronchitis Severity Score in Egyptian children: A move to reduce antibiotics / E.M. Moawad, M.A. Haron, R.M. Maher et al. // S. Afr. Med. J. — 2017 Mar 29. — 107(4). — 342-345. doi: 10.7196/SAMJ.2017.v107i4.11428.
24. Крючко Т.О. Пріоритетність застосування фітопрепаратів у лікуванні вірусних респіраторних інфекцій у дітей / Крючко Т.О., Абатуров О.Є., Ткаченко О.Я., Токарева Н.М. // Здоровье ребенка. — 2018. — № 1(13). — С. 59-65. DOI: 10.22141/2224-0551.13.1.2018.127062.

/40-1.jpg)
/41-1.jpg)
/42-1.jpg)
/43-1.jpg)