Журнал «Здоровье ребенка» Том 13, №7, 2018
Вернуться к номеру
Медикаментозна корекція ендотеліальної дисфункції в дітей із хронічним пієлонефритом
Авторы: Вакуленко Л.І.
Державний заклад «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. Своєчасна й достатня медикаментозна корекція ендотеліальної дисфункції в дітей із хронічним пієлонефритом визначає ефективність запобігання його прогресуванню, покращення серцево-судинного й ниркового прогнозу. Мета: вивчення ефективності різних схем медикаментозної корекції ендотеліальної дисфункції в дітей із хронічним пієлонефритом. Матеріали та методи. Обстежено 37 дітей віком 11–17 років із хронічним пієлонефритом поза періодом загострення. Перша група (17 пацієнтів) отримувала базисну терапію хронічного пієлонефриту, що включала інгібітор ангіотензинперетворюючого ферменту (іАПФ) еналаприл; друга група (20 пацієнтів) крім стандартної терапії з іАПФ отримувала внутрішньовенну інфузію L-аргініну, а потім його пероральний розчин. Результати. У пацієнтів першої групи зареєстровано тенденцію до збільшення без вірогідної відмінності від стану до лікування значень діаметра плечової артерії в спокої (2,4 ± 0,1 мм), у фазу максимальної вазодилатації (2,9 ± 0,1 мм). Приріст діаметра плечової артерії після лікування вірогідно збільшився порівняно зі значенням до лікування (12,00 ± 0,39 мм). Лінійна швидкість кровотоку в стані спокою зменшувалась статистично незначуще (146,90 ± 1,13 см/с). У пацієнтів другої групи зареєстровано вірогідне збільшення порівняно з вихідним значенням діаметра плечової артерії в спокої (2,80 ± 0,13 мм) і у фазу максимальної вазодилатації (3,40 ± 0,14 мм). Приріст діаметра плечової артерії після лікування вірогідно не відрізнявся від фізіологічної норми (17,20 ± 0,41 мм). Лінійна швидкість кровотоку в стані спокою наближалась до значення в групі контролю без вірогідної різниці (141,20 ± 1,16 см/с). У цілому покращання функціонального стану ендотелію судин відбулося в групах на 26,9 і 47,8 % відповідно. Висновки. У хворих на хронічний пієлонефрит без проявів хронічної ниркової недостатності є ефективною монотерапія іАПФ еналаприлом. Для хворих, які мають прояви хронічної ниркової недостатності І–ІІ ступеня, доцільною є комбінована терапія з L-аргініном.
Актуальность. Своевременная и достаточная медикаментозная коррекция эндотелиальной дисфункции у детей с хроническом пиелонефритом определяет эффективность предупреждения его прогрессирования, улучшает сердечно-сосудистый и почечный прогноз. Цель: изучение эффективности различных схем медикаментозной коррекции эндотелиальной дисфункции у детей с хроническим пиелонефритом. Материалы и методы. Обследовано 37 детей в возрасте 11–17 лет с хроническим пиелонефритом вне периода обострения. Первая группа (17 пациентов) получала базисную терапию, включая ингибитор ангиотензинпревращающего фермента (иАПФ) эналаприл; вторая группа (20 пациентов) помимо стандартной терапии с иАПФ получала инфузию L-аргинина, а потом его пероральный раствор. Результаты. У пациентов первой группы зарегистрирована тенденция к увеличению без достоверного отличия от состояния до лечения значений диаметра плечевой артерии в покое (2,4 ± 0,1 мм), в фазу максимальной вазодилатации (2,9 ± 0,1 мм). Прирост диаметра плечевой артерии достоверно увеличился по сравнению со значением до лечения (12,00 ± 0,39 мм). Линейная скорость кровотока в состоянии покоя уменьшалась статистически незначимо (146,90 ± 1,13 см/с). У пациентов второй группы зарегистрировано достоверное увеличение по сравнению с исходным значением диаметра плечевой артерии в покое (2,80 ± 0,13 мм) и в фазу максимальной вазодилатации (3,40 ± 0,14 мм). Прирост диаметра плечевой артерии после лечения достоверно не отличался от физиологической нормы (17,20 ± 0,41 мм). Линейная скорость кровотока в покое приближалась к значению в группе контроля без достоверной разницы (141,20 ± 1,16 см/с). В целом проявления эндотелиальной дисфункциии уменьшились на 26,9 и 47,8 % в первой и второй группе соответственно. Выводы. У больных хроническим пиелонефритом без проявлений хронической почечной недостаточности эффективна монотерапия иАПФ эналаприлом. Для больных, имеющих проявления хронической почечной недостаточности I–II степени, целесообразна комбинированная терапия с L-аргинином.
Background. Timely and sufficient drug correction of endothelial dysfunction in children with chronic pyelonephritis determines the effectiveness of preventing its progression, improves cardiovascular and renal prognosis. The purpose of the study was to examine the effectiveness of various regimens of drug correction for endothelial dysfunction in children with chronic pyelonephritis. Materials and methods. Thirty seven children aged 11–17 years with non-acute chronic pyelonephritis were examined. Thus, the first group of 17 patients received baseline therapy of chronic pyelonephritis, including angiotensin-converting enzyme (ACE) inhibitor enalapril; the second group of 20 patients in addition to standard therapy with ACE inhibitor received the intravenous infusion of L-arginine and then took its oral solution. Results. Patients in the first group had a tendency to increase in the diameter of the brachial artery at rest (2.4 ± 0.1 mm), in the phase of maximal vasodilation (2.9 ± 0.1 mm), without a significant difference from the state before the treatment. An increment of the brachial artery diameter after the treatment had significantly increased in comparison with the level before the treatment (12.00 ± 0.39 mm). Moreover, the reduction of linear blood flow velocity at rest was not statistically significant (146.90 ± 1.13 cm/s). In the second group, there was a significant increase in the brachial artery diameter at rest (2.80 ± 0.13 mm) and in the phase of maximal vasodilation (3.40 ± 0.14 mm) as compared to the baseline. Meanwhile, an increase in the brachial artery diameter after treatment was not significantly different from the physiological norm (17.20 ± 0.41 mm). The linear blood flow velocity at rest was close to the value in the control group, with no significant difference (141.20 ± 1.16 cm/s). In general, the manifestations of endothelial dysfunction decreased by 26.9 and 47.8 % in the first and second groups, respectively. Conclusions. In patients with chronic pyelonephritis without manifestations of chronic renal failure, monotherapy with ACE inhibitor enalapril is effective. In patients with manifestations of chronic renal failure degree I–II, it is advisable to use combined therapy with L-arginine.
ендотеліальна дисфункція; хронічний пієлонефрит; діти; інгібітори ангіотензинперетворюючого ферменту; L-аргінін
эндотелиальная дисфункция; хронический пиелонефрит; дети; ингибитор ангиотензинпревращающего фермента; L-аргинин
endothelial dysfunction; chronic pyelonephritis; children; angiotensin-converting enzyme inhibitors; L-arginine
Вступ
Важко переоцінити внесок дисфункції ендотелію судин у розвиток і прогресування різноманітних захворювань, включно з патологією нирок [1–4]. Ендотеліальна дисфункція (ЕД) визначає несприятливий перебіг патології нирок і є визнаним винуватцем серцево-судинних порушень, які розвиваються в пацієнтів із хронічною хворобою нирок (ХХН) зі значною частотою [4–6]. Корекція ЕД багато в чому визначає ефективність запобігання органним ураженням, покращання серцево-судинного й ниркового прогнозу [5, 7, 8].
Визнаними засобами модуляції ЕД є інгібітори ангіотензинперетворюючого ферменту (іАПФ) [9–11]. Останнім часом з’являються роботи, присвячені використанню інших засобів, зокрема L-аргініну. Важливо не тільки зменшити вираженість проявів ЕД, але й, наскільки це можливо, сприяти зворотному розвитку ЕД [4, 6, 12, 13].
Вазопротективний, антипроліферативний, антисклеротичний і вазодилататорний ефекти іАПФ забезпечуються ендотелійзалежними реакціями, пов’язаними з властивостями іАПФ [11, 14]. Запобігаючи розщепленню брадикініну, іАПФ приводять до збільшення кількості останнього в тканинах, а він, у свою чергу, є потужним стимулятором вивільнення ендотелійзалежних розслаблюючих факторів, зокрема оксиду азоту (NО), ендотелійзалежного фактора гіперполяризації й простацикліну [10, 15]. Іншим механізмом впливу іАПФ на ендотеліальну функцію є блокада утворення ангіотензину II, що розглядається як індуктор оксидантного стресу. Вірогідно доведено, що іАПФ покращують ацетилхолін-опосредковану й брадикінін-зумовлену дилатацію артерій різної локалізації [14, 16].
Аргінін — амінокислота, що належить до класу умовно незамінних і може надходити з їжею або синтезуватися в проксимальних канальцях нирки. L-аргінін, як активний донатор NO, відіграє величезну роль у клінічній практиці при різноманітній патології, і в першу чергу при патології нирок і серцево-судинної системи [6, 17]. Аргінін активує гуанілатциклазу й підвищує рівень циклічного гуанідинмонофосфату в ендотелії судин, зменшує активацію й адгезію лейкоцитів і тромбоцитів до ендотелію судин, пригнічує синтез протеїнів адгезії. Важливою щодо усунення ЕД є здатність аргініну пригнічувати синтез ендотеліну-1 й асиметричного диметиларгініну (ДМА): перший є потужним вазоконстриктором і стимулятором проліферації й міграції гладких міоцитів судинної стінки, другий — ендогенним стимулятором оксидативного стресу. Оскільки L-аргінін є одним із субстратів у циклі синтезу сечовини в печінці, у нефрологічній практиці є важливою його властивість здійснювати гіпоамоніємічний ефект шляхом активації перетворення аміаку в сечовину. Отже, L-аргінін є активним і різнобічним клітинним регулятором численних життєво важливих функцій організму, він чинить антигіпоксичну, мембраностабілізуючу, цитопротекторну, антиоксидантну, антирадикальну, дезінтоксикаційну дію, проявляє себе як активний регулятор проміжного обміну й процесів енергозабезпечення.
Метою дослідження було вивчення ефективності різних схем медикаментозної корекції порушень судинного ендотелію в дітей із хронічним пієлонефритом.
Матеріали та методи
Нами обстежено 37 дітей віком 11–17 років із хронічним вторинним пієлонефритом (ХПН) із проявами хронічної ниркової недостатності (ХНН) 0–ІІ ступеня поза періодом загострення запального процесу, в стадії часткової або повної клініко-лабораторної ремісії. Хворі були розподілені на дві групи: перша (17 дітей) отримувала базисну терапію ХПН, включаючи іАПФ еналаприл. Друга група (20 хворих) крім стандартної терапії з іАПФ отримувала аргініну гідрохлорид. Контрольну групу становили 30 умовно здорових дітей.
Доза еналаприлу титрувалась індивідуально до максимально дозволеної з урахуванням віку, маси тіла, частоти серцевих скорочень, артеріального тиску (АТ), рівня калію в сироватці крові, індивідуальної переносимості препарату. Пацієнти отримували іАПФ не менше від 6 місяців поспіль із контролем добового моніторування АТ і електрокардіограми.
Аргініну гідрохлорид хворі на ХПН отримували у вигляді внутрішньовенної інфузії 4,2% розчину: дітям до 12 років — 10 мл/кг/добу, після 12 років — 100 мл 1 один раз на день протягом 7 днів. Після проведення довенних інфузій терапію продовжували пероральним розчином, 1 мл якого містить 200 мг L-аргініну аспартату: дітям до 12 років — по 4 мл, після 12 років — по 5 мл (1,0 г) 3–4 рази на день упродовж 8–14 днів.
Контроль вихідного стану й ефективності терапії здійснювали шляхом вимірювання потокозалежної дилатації плечової артерії за даними ультразвукового дослідження. Використовували пробу з реактивною гіперемією, адаптовану для дитячого віку (Патент № 32359 «Спосіб діагностики ендотелійзалежної вазодилятації у дітей», МПК(8): А61В8/00 від 12.05.2008 р., автори Волосовець О.П., Кривопустов С.П., Мороз Т.С.). Проба з ендотелійзалежною вазодилатацією (ЕЗВД) є неінвазивною, доступною, що значно спрощує й прискорює діагностику ЕД у дітей із різноманітною патологією [18–21].
Проводилось сканування правої плечової артерії на апараті Toshiba Xario (Japаn) за допомогою лінійного датчика 7,5 МГц. Враховували вихідні показники артеріального тиску, діаметра плечової артерії (ДПА1) і лінійної швидкості кровотоку (ЛШК1), потім накачували манжету на 50 мм рт.ст. вище від систолічного АТ пацієнта протягом 1,5–2 хв (час оклюзії залежав від появи болю, поколювання, заніміння пальців). За 30 с до декомпресії вимірювали діаметр плечової артерії (ДПА2), через 15 с після декомпресії реєстрували лінійну швидкість кровотоку (ЛШК2), через 60 с — діаметр плечової артерії (ДПА3). ЕЗВД розраховували за величиною приросту ДПА за формулою: ∆d, % = 100 (ДПА3 – ДПА1) / ДПА1.
Залежно від динаміки ДПА під час проведення проби визначали чотири типи реакції: нормоергічний тип — при збільшенні ДПА на 10–20 %; гіперергічний тип — при збільшення ДПА на 20–40 %; гіпоергічний тип — при збільшенні ДПА менше від 10 % або за відсутності реакції; парадоксальний тип — при зменшенні ДПА порівняно з вихідним. ЕД діагностували у випадку гіпоергічного або парадоксального типів реакції.
Крім того, визначали кількісні кутозалежні показники: максимальну швидкість кровотоку в систолу, мінімальну швидкість кровотоку в діастолу, усереднену за часом максимальну швидкість кровотоку.
Статистичну обробку даних, отриманих у дослідженнях, проводили за допомогою прикладних програм Microsoft Office 2010, інтегрованих у системі Windows 7. Вірогідність відмінностей середніх величин перевіряли з використанням параметричного критерію Стьюдента, c2 і критерію Фішера. Відмінності вважалися значущими при р < 0,05.
Результати та обговорення
До проведення лікування в дітей із ХПН були виявлені ознаки ЕД. Зокрема, у хворих на ХПН значення ДПА під час проведення проби з реактивною гіперемією були вірогідно меншими від фізіологічної норми: в стані спокою за показником ДПА1 (2,20 ± 0,12 мм; р1 < 0,001), за 30 с до декомпресії за показником ДПА2 (1,80 ± 0,14 мм; р1 < 0,05), через 60 с після декомпресії за показником ДПА3 (2,60 ± 0,17 мм; р1 < 0,001) (табл. 1).
Виявлено, що приріст ДПА за показником ∆d у хворих на ХПН був статистично значуще меншим порівняно з контрольною групою (8,2 ± 0,2 мм; р1 < 0,001).
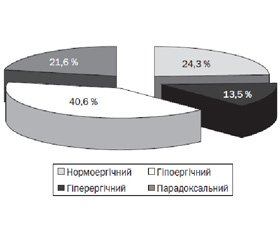
У групі дітей із ХПН лише 37,8 % пацієнтів мали нормо- та гіперергічний типи реакції на пробу з ЕЗВД (рис. 1).
Нормоергічний тип реєструвався у 24,3% хворих (р < 0,05 порівняно з контрольною групою), гіперергічний тип — у 13,5 % (р > 0,05). Тобто більшість пацієнтів мали патологічні варіанти реакції: гіпоергічний тип, що реєструвався в переважної більшості (40,6 % випадків), вірогідно більше порівняно зі здоровими (р < 0,05), парадоксальний тип — 21,6 % (р < 0,05). Це підтверджувало значні порушення балансу вазорегуляторних механізмів у судинному ендотелії цих пацієнтів.
Значення ЛШК1 у дітей, які мали хронічний запальний процес в нирках, було вірогідно більшим (142,10 ± 1,18 см/с; р < 0,05) за значення в контрольній групі (табл. 2). Через 15 с після декомпресії, у фазі реактивної гіперемії, показник ЛШК2 у дітей із ХПН, маючи лише тенденцію до збільшення порівняно з вихідним, вірогідно перевищував фізіологічну норму порівняно з групою контролю (148,70 ± 0,14 см/с; р < 0,001).
Виявлені зміни свідчили про наявність ЕД у дітей з ХПН, що характеризувалася переважанням механізмів вазоконстрикції. На думку О.П. Волосовця та співавт. [22], порушення вазодилатації зумовлює зміну вазомоторного тонусу, міграцію й інфільтрацію лейкоцитів у стінку судини, ріст і проліферацію лейоміоцитів, посилення впливу прокоагулянтних факторів, генерації кисеньвмісних вільних радикалів. Тобто порушення функціонального стану ендотелію в пацієнтів з ХХН впливає на різноманітні патологічні процеси.
Одним із факторів формування ЕД при хронічній хворобі нирок є зниження здатності ендотелію судин синтезувати й вивільняти оксид азоту [6, 12, 13, 23]. NO, утворюючись з умовно незамінної амінокислоти L-аргініну за участю NO-синтази (NOS), має особливе значення в клінічній патофізіології нирок. Є дані про постійний синтез NO в ендотеліальних і гладком’язових клітинах ниркових судин, мезангіальних і епітеліальних канальцевих клітинах, завдяки чому він відіграє важливу роль у регуляції ниркового кровотоку, екскреторної функції нирок, тубулогломерулярного балансу [24, 25]. Ці ефекти частково реалізуються шляхом взаємодії NO з ренін-ангіотензиновою системою й іншими біорегуляторами функцій нирок.
Одним із механізмів дефіциту NO є обмеження доступності L-аргініну внаслідок зниження його синтезу в нирках або порушення транспорту в клітину, порушення ниркової тубулярної регенерації аргініну, утилізація аргініну аргіназою [2, 6, 13, 24–26]. Низький рівень сироваткового аргініну та його диметилових похідних може сприяти розвитку і/або прогресуванню ХХН у дітей [27]. Крім того, накопичення кінцевих продуктів глікозування при прогресуванні ХХН знижує доступ NO до його мішеней [23, 24].
Наявність запального процесу в нирках на тлі оксидантного стресу спричиняє інактивацію NO активними формами кисню (reactive oxygen species — ROS), що не тільки призводить до втрати вазодилататорних, антиагрегаційних, антиадгезивних ефектів NO, але і створює умови для реалізації цитотоксичних властивостей NO і подальшого пошкодження ниркової тканини [3, 6, 12, 24, 28].
При ЕД спостерігається кореляція між рівнем загальної продукції NO та концентрацією в плазмі крові асиметричного диметиларгініну — ендогенного інгібітору NO-синтази, що запобігає перетворенню аргініну в цитрулін, тобто порушує синтез NO [2, 13, 15]. Підвищений рівень симетричного ДМА у сироватці сильно корелює з порушеною функцією нирок у дітей і може розглядатися як предиктор погіршення функції нирок і прогресування ХХН [26].
Під час застосування різних схем лікування пацієнтів із ХПН ми отримали динаміку, яка в обох групах дещо відрізнялась (табл. 3).
У стані спокою значення ДПА1 у 1-й групі становило 2,4 ± 0,1 мм (р > 0,05), маючи лише тенденцію до збільшення порівняно з вихідним станом до лікування, на той час як у 2-й групі ДПА1 вірогідно збільшувався (2,80 ± 0,13 мм; р > 0,05).
Значення ДПА2 в обох групах після лікування нормалізувалися й не мали вірогідної відмінності з показниками групи контролю (р > 0,05).
Динаміка значень показника ДПА3 у групах відрізнялася: у 1-й групі вона було недостатньою, значення ДПА3 вірогідно не відрізнялось від показника до лікування (2,9 ± 0,1 мм; р > 0,05). На відміну від 1-ї групи, у 2-й групі спостерігалась більш значна динаміка, і значення показника ДПА3 у цій групі було статистично значуще більшим, ніж вихідне значення, але не мало вірогідної відмінності від значення в контрольній групі (3,40 ± 0,14 мм; р2 > 0,05). Більш значна позитивна динаміка лікування пацієнтів 2-ї групи пояснюється впливом L-аргініну, що має цілу низку ефектів. Додавання аргініну відновлювало продукцію NO, покращувало функцію нирок і зменшувало запалення, знижувало індуковане асиметричним диметиларгініном інгібування синтезу NO, покращуючи функцію ендотелію [2].
Приріст ДПА за показником ∆d демонстрував позитивні зміни в обох групах під час лікування, при цьому динаміка у 2-й групі була більш істотною: реєструвався приріст ДПА, що вірогідно не відрізнявся від групи контролю (17,20 ± 0,41 мм; р1 > 0,05). О.В. Курята та Є.О. Фролова [29] зареєстрували у хворих на ХХН ІІ–ІІІ стадії, які отримували L-аргінін, покращення ендотеліальної функції судин за показником ЕЗВД на 56,6 %. У 1-й групі, хоча показник ∆d і збільшився вірогідно порівняно зі значенням до лікування, приріст ДПА був вірогідно меншим порівняно з контролем (12,00 ± 0,39; р1 < 0,001).
Динаміка розподілу варіантів реакції на пробу з ЕЗВД у дітей із хронічним пієлонефритом у процесі лікування була такою (табл. 4).
У 1-й групі більше ніж у 2 рази збільшилась кількість випадків з нормоергічним, гіперергічним варіантом реакції на пробу з ЕЗВД. Зміни відбувалися в основному за рахунок зменшення випадків парадоксального варіанту й меншою мірою — гіпоергічного. Проте результати не були статистично значущими порівняно з показниками до лікування, і жоден варіант не мав з ними вірогідної відмінності. У цілому позитивні зміни відбулися в 26,9 % випадків.
У пацієнтів 2-ї групи динаміка була більш вагомою, позитивні зміни відбувалися за рахунок вірогідного збільшення нормоергічного варіанту реакції на пробу з ЕЗВД порівняно зі станом до лікування (р < 0,05). Частота гіпоергічного варіанту реакції на пробу з ЕЗВД наближалась до значень у контрольній групі й не мала вірогідної відмінності від них (р > 0,05). Порівняно з вихідним станом реєструвалось зменшення у 2,7 раза частоти гіпоергічного варіанту. Після лікування не було зареєстровано жодного випадку парадоксального варіанту реакції на пробу з ЕЗВД. У цілому позитивні зміни в цій групі відбулися в 47,8 % пацієнтів, що більше ніж у 2 рази перевищувало ефективність лікування в 1-й групі.
Аналізуючи ефективність різних схем терапії, ми дійшли висновку, що лікування монопрепаратом іАПФ еналаприлом було ефективним у хворих на ХПН, які не мали проявів ХНН. Комбінована терапія з додаванням L-аргініну була доцільна у хворих, які мали прояви ХНН І–ІІ ступеня.
Динаміка значень показника ЛШК1 у пацієнтів відповідала динаміці значень ДПА1: у відповідь на зменшення вазоконстрикції під час лікування швидкість кровотоку зростала (табл. 5).
У 1-й групі зміни були вірогідно значущими порівняно з групою контролю, проте реєструвалась тенденція до покращення (146,90 ± 1,13 см/с, р1 < 0,05). У 2-й групі динаміка ЛШК1 була більш вагомою, значення наближались до показника групи контролю, вірогідно не відрізняючись від нього (141,20 ± 1,16 см/с, р1 > 0,05). ЛШК1 у цій групі вірогідно значуще зменшувалася порівняно зі станом до лікування й показником 1-ї групи. Динаміка показника ЛШК2 в обох групах була позитивною, але вірогідно не значущою (127,30 ± 0,26 — у 1-й і 112,60 ± 1,11 — у 2-й групах, в обох випадках р1 < 0,001). Проте значення показника ЛШК2 у 2-й групі було вірогідно меншим порівняно зі значенням ЛШК2 у 1-й групі, р3 < 0,001.
Висновки
1. Період ремісії хронічного пієлонефриту у 62,2 % хворих супроводжується ознаками ендотеліальної дисфункції, яка характеризується перевагою активності факторів вазоконстрикції, що є ризик-фактором несприятливого перебігу хронічної хвороби нирок із розвитком і прогресуванням хронічної ниркової недостатності, формуванням ускладнень із боку серцево-судинної системи.
2. Використання схем лікування з включенням до базисної терапії еналаприлу або еналаприлу з внутрішньовенною інфузією аргініну гідрохлориду з подальшим переходом на пероральний прийом у комплексній терапії дітей із хронічним пієлонефритом дозволяє здійснити диференційований підхід.
3. У хворих на хронічний пієлонефрит без проявів хронічної ниркової недостатності ефективною є монотерапія іАПФ еналаприлом, а у хворих, які мають прояви хронічної ниркової недостатності І–ІІ ступеня, доцільно використовувати комбіновану терапію еналаприлом із L-аргініном.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Абатуров А.Е. Антиоксидантная система респираторного тракта. Внутриклеточная антиоксидантная защита в респираторном тракте (часть 4) / А.Е. Абатуров, А.П. Волосовец, Т.П. Борисова // Здоровье ребенка. — 2016. — № 8. — С. 94-100.
2. Aldámiz-Echevarría L. Asymmetric Dimethylarginine, Endothelial Dysfunction and Renal Disease / L. Aldámiz-Echevarría, F.Andrade // Int. J. Mol. Sci. — 2012. — № 13. — Р. 11288-11311. doi: 10.3390/ijms130911288.
3. Drożdż D. Thrombomodulin as a New Marker of Endothelial Dysfunction in Chronic Kidney Disease in Children / D. Drożdż, M. Łątka, T. Drożdż, K. Sztefko, P. Kwinta // Oxid. Med. Cell Longev. — 2018. — 1619293. doi: 10.1155/2018/1619293.
4. Goligorsky M.S. Pathogenesis of endothelial cell dysfunction in chronic kidney disease: a retrospective and what the future may hold / S.M. Goligorsky // Kidney Res. Clin. Pract. — 2015. — № 34(2). — Р. 76-82. doi: 10.1016/j.krcp.2015.05.003.
5. Fliser D. The dysfunctional endothelium in CKD and in cardiovascular disease: mapping the origin(s) of cardiovascular problems in CKD and of kidney disease in cardiovascular conditions for a research agenda / D. Fliser, A. Wiecek, G. Suleymanlar et al. // Kidney Int. Suppl. — 2011. — № 1(1). — Р. 6-9. doi: 10.1038/kisup.2011.6.
6. Martens C.R. The Vascular Endothelium in Chronic Kidney Disease: A Novel Target for Aerobic Exercise / C.R. Martens, D.L. Kirkman, D.G. Edwards // Exerc. Sport Sci Rev. — 2016. — № 44(1). — Р. 12-19. doi: 10.1249/JES.0000000000000065.
7. Перцева Н.О. Динамика эндотелиальной дисфункции, нефропатических и дислипидемических нарушений у больных с недостаточной компенсацией сахарного диабета 2 типа в течение 1 года применения блокаторов рецепторов ангиотензина II для коррекции артериальной гипертензии / Н.О. Перцева // Медичні перспективи. — 2014. — Т. ХІХ, № 4. —
С. 89-97.
8. Tian J. Cardiovascular risks in chronic kidney disease pediatric patients / J. Tian, L. Niu, X. An // Exp. Ther. Med. — 2017. — № 14(5). — Р. 4615-4619. doi: 10.3892/etm.2017.
9. Жаринова В.Ю. Эндотелильная дисфункция как мультидисциплинарная проблема / В.Ю. Жаринова // Кровообіг і гомеостаз. — 2015. — № 1–2. — С. 9-14.
10. Чернявская Т.К. Современные подходы к диагностике и коррекции эндотелиальной дисфункции у пациентов с артериальной гипертонией / Т.К. Чернявская // Лечебное дело. — 2013. — № 2. — С. 118-130.
11. Turner J.M. Treatment of chronic kidney disease / J.М. Turner, С. Bauer, M.K. Abramowitz, M.L. Melamed, T.H. Hostetter // Kidney Int. — 2012. — № 81(4). — Р. 351-362. doi: 10.1038/ki.2011.380. — https://www.ncbi.nlm.nih.gov/pubmed/?term=Turner%20JM%5BAuthor%5D&cauthor=true&cauthor_uid=22166846.
12. Оксенюк О.С. Роль окислительного стресса в развитии хронической болезни почек и способы его оценки / О.С. Оксенюк, Ю.А. Калмыкова, О.Б. Смирнова, Д.Г. Пасечник // Журнал фундаментальной медицины и биологии. — 2016. — № 1. —
С. 15 -24.
13. Reddy Y.S. Nitric oxide status in patients with chronic kidney disease / Reddy Y.S., Kiranmayi V.S., Bitla A.R., Krishna G.S., Rao P.V., Sivakumar V. // Indian J. Nephrol. — 2015. — № 25(5). — Р. 287-291. doi: 10.4103/0971-4065.147376.
14. Shahin Y. Angiotensin converting enzyme inhibitors effect on endothelial dysfunction: a meta-analysis of randomised controlled trials / Y. Shahin, J.A. Khan, N. Samuel, I. Chetter // Atherosclerosis. — 2011. — Vol. 216. — P. 7-16. doi: 10.1016/j.atherosclerosis.2011.02.044.
15. Загородний М.І. Ендотеліальна дисфункція при артеріальній гіпертензії: сучасні погляди на причини й механізми розвитку, діагностику та корекцію / М.І. Загородний, І.А. Свінціцький // Практикуючий лікар. — 2013. — № 2. —
С. 17-27.
16. Tomasoni L. Effects of treatment strategy on endothelial function / L. Tomasoni, S. Sitia, C. Borghi et al. // Autoimmun. Rev. — 2010. — Vol. 9. — P. 840-844.
17. Popolo A. L-Arginine and its metabolites in kidney and cardiovascular disease / A. Popolo, S. Adesso, A. Pinto, G. Autore, S. Marzocco // Amino Acids. — 2014. — № 46(10). — Р. 2271-2286. doi: 10.1007/s00726-014-1825-9.
18. Бережний В.В. Вивчення функціонального стану ендотелію за допомогою комплексу показників проби з реактивною гіперемією / В.В. Бережний, І.В. Романкевич // Современная педиатрия. — 2016. — № 2(74). — С. 112-116.
19. Квашнина Л.В. Профілактика порушень ендотеліальної функції у дітей у період переходу від здоров’я до синдрому вегетативної дисфункції / Л.В. Квашніна, Т.Б. Ігнатова // Современная педиатрия. — 2016. — № 5(77). — С. 16-24.
20. Higashi Y. Assessment of endothelial function. History, methodological aspects, and clinical perspectives / Y. Higashi // Int. Heart J. — 2015. — № 56(2). — Р. 125-134. doi: 10.1536/ihj.14-385.
21. Si D. A new method for the assessment of endothelial function with peripheral arterial volume / D. Si, L. Ni, Y. Wang, J. Liu, J. Yang, P. Yang // BMC Cardiovasc. Disord. — 2018. — № 18(1). — Р. 81. doi: 10.1186/s12872-018-0821-5.
22. Волосовець О.П. Ендотеліальна дисфункція як системна патологія у дітей / О.П. Волосовець, С.П. Кривопустов, Т.С. Мороз, В.Є. Досенко // Здоров’я України. — 2011. — № 5(46). — С. 48-49.
23. Протопопов А.А. Гипергомоцистеинемия как предиктор прогрессирования хронического пиелонефрита / А.А. Протопопов, О.В. Нестеренко, В.Б. Бородулин, О.В. Шевченко // Клиническая нефрология. — 2013. — № 6. — С. 33-36.
24. Бабушкина А.В. L-аргинин с точки зрения доказательной медицины / А.В. Бабушкина // Укр. мед. часопис. — 2009. — Т. 6, № 74. — С. 43-48.
25. Дзугкоев С.Г. Механизмы развития эндотелиальной дисфункции и перспективы коррекции / Дзугкоев С.Г., Можаева И.В., Такоева Е.А., Дзугкоева Ф.С., Маргиева О.И. // Фундаментальные исследования. — 2014. — № 4, ч. 1. — С. 198-204.
26. El-Sadek A.E. Arginine dimethylation products in pediatric patients with chronic kidney disease / A.E. El-Sadek, E.G. Behery, A.A. Azab // Ann. Med. Surg. (Lond.). — 2016. — № 9. — Р. 22-27. doi: 10.1016/j.amsu.2016.05.017.
27. Chen J. Interrelationship of Multiple Endothelial Dysfunction Biomarkers with Chronic Kidney Disease / J. Chen, L.L. Hamm, E.R. Mohler et al. // PLoS ONE. — 2015. — № 10(7). — e0132047. doi: 10.1371/journal.pone.0132047.
28. Топчий И.И. Перекисное окисление липидов и метаболизм оксида азота у больных хронической болезнью почек в динамике лечения / И.И. Топчий, А.Н. Кириенко, Т.Н. Бондарь, А.В. Лесовая, Е.Н. Щенявская // Український журнал нефрології та дiалiзу. — 2012. — № 1. — С. 3-8.
29. Курята О.В. Застосування інфузійної форми L-аргініну в комплексному лікуванні хворих з хронічним захворюванням нирок II і III ступеня у поєднанні з ішемічною хворобою серця / О.В. Курята, Є.О. Фролова // Клін. та експер. дослідж. — 2012. — № 3. — С. 235-238.

/69-1.jpg)
/69-2.jpg)
/70-1.jpg)
/71-1.jpg)