Журнал «Здоровье ребенка» Том 13, №7, 2018
Вернуться к номеру
Антибиопленочная терапия при лечении респираторных инфекционных заболеваний, вызванных бактериальными патогенами
Авторы: Абатуров А.Е.(1), Крючко Т.А.(2)
(1) — ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
(2) — ВГУЗУ «Украинская медицинская стоматологическая академия», г. Полтава, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
У колонізованому середовищі патогенні бактерії переходять з планктонної форми існування до мікробіосоціальної шляхом формування своєрідної структури — біоплівки. Формування біоплівки є ключовим фактором вірулентності широкого кола патогенних бактерій, які викликають як гострі, так і хронічні інфекції. Толерантність до антибактеріальних засобів бактерій біоплівки лежить в основі більшості рецидивуючих і хронічних інфекційних захворювань. На даний час для вирішення даної проблеми розробляються терапевтичні стратегії, що спрямовані на пригнічення життєдіяльності біоплівок. Лікарські засоби, створені для боротьби з патогенними бактеріальними біоплівками, діляться на дві великі групи: сполуки, що пригнічують їх формування, і сполуки, що дестабілізують або руйнують структуру зрілої сформованої біоплівки. Існують експериментально підтверджені дані, що застосування даних лікарських засобів стане ефективним методом лікування захворювань, асоційованих з формуванням біоплівок.
В колонизированной среде патогенные бактерии переходят из планктонной формы существования к микробиосоциальной, формируя своеобразную структуру — биопленку. Формирование биопленки является ключевым фактором вирулентности широкого круга патогенных бактерий, которые вызывают как острые, так и хронические инфекции. Толерантность к антибактериальным средствам бактерий биопленки лежит в основе большинства рецидивирующих и хронических инфекционных заболеваний. В настоящее время для решения данной проблемы разрабатываются терапевтические стратегии, которые направлены на подавление жизнедеятельности биопленок. Лекарственные средства, созданные для борьбы с патогенными бактериальными биопленками, делятся на две большие группы: соединения, ингибирующие их формирование, и соединения, дестабилизирующие или разрушающие структуру зрелой сформированной биопленки. Существуют экспериментально подтвержденные данные, что применение данных лекарственных средств станет эффективным методом лечения заболеваний, ассоциированных с формированием биопленок.
In a colonized environment, pathogenic bacteria change the form of existence from the planktonic to the microbiosocial, forming a peculiar structure, the so-called biofilm. The formation of biofilm is a key factor in the virulence of a wide range of pathogenic bacteria that cause both acute and chronic infections. The tolerance of biofilm bacteria to antibacterial agents underlies the majority of recurrent and chronic infectious diseases. Currently, therapeutic strategies are being developed to solve this problem. These strategies are aimed at suppressing the vital activity of biofilms. The therapeutic agents for protection against pathogenic bacterial biofilms are divided into two large groups. The first group are compounds that inhibit the formation of biofilms, and the second group are compounds that destabilize or destroy the structure of a mature formed biofilm. There is experimental evidence that the use of these drugs will be effective in the treatment of diseases associated with the formation of biofilms.
бактеріальні біоплівки; респіраторні інфекційні захворювання
бактериальные биопленки; респираторные инфекционные заболевания
bacterial biofilms; respiratory infections
Введение
Патогенные бактерии, достигая определенной плотности в колонизированной среде, из планктонной формы существования переходят к оседлой или микробиосоциальной форме жизнедеятельности, формируя своеобразную структуру — биопленку, которая располагается на открытых поверхностях органов макроорганизма [21]. Биопленка представляет собой образование, содержащее бактерии, которые заключены в состоящий из полисахаридов, протеинов и экстрабактериальной ДНК экзополимерный матрикс, который предохраняет бактерии от действия антимикробных агентов [4, 14, 23]. С формированием бактериальной биопленки, по мнению современных микробиологов, связано развитие хронических воспалительных заболеваний, ассоциированных с бактериальным инфекционным процессом. Предупреждение формирования или разрушение бактериальной биопленки является перспективным методом медикаментозного лечения бактериальных инфекционных болезней человека.
Краткое представление об архитектуре и функциях бактериальной биопленки
Матрикс функционирует как биологический каркас, стабилизирующий сложную трехмерную структуру биопленки, и как коммуникативная система. Матрикс биопленки состоит из внеклеточных полимерных веществ (extracellular polymeric substances — EPS). Основными компонентами матрикса биопленки являются: протеины (> 2 %); полисахариды (1–2 %); молекулы ДНК (< 1 %), РНК (< 1 %); ионы (связанные и свободные) и, наконец, вода (около 97 %) [16]. Доставка необходимых питательных веществ бактериям внутри биопленки требует высокого содержания воды в матриксе. Компоненты матрикса формируют устойчивую высокогидратированную структуру, которая удерживает бактерии в непосредственной близости друг от друга, что позволяет им осуществлять межбактериальные коммуникации и обмен ДНК. Матрикс защищает бактериальную массу от дегидратации, антимикробных веществ, антибиотиков, активных радикалов, радиации и других агентов, обладающих антибактериальной активностью. Бактерии в ответ на изменения уровня обеспеченности питательными веществами продуцируют ферменты, которые модифицируют композицию внеклеточных полимерных веществ, адаптируя архитектуру биопленки к конкретной окружающей микросреде [7].
Внутри биопленки бактерии коконированы во внеклеточном матриксе. Обычно 5–35 % объема биопленки составляют микроорганизмы, а оставшийся объем приходится на внеклеточный матрикс [11]. Пленкообразующие патогенные бактерии, заключенные в матриксе, отличаются высокой степенью толерантности к действию традиционных антибиотиков и влиянию иммунной реакции организма (табл. 1) [24]. Результаты многочисленных экспериментальных in vitro и in vivo исследований показали, что значения минимальной подавляющей концентрации (МПК) и минимальной бактерицидной концентрации (МБК) антибиотиков для бактерий, находящихся в биопленке, намного выше (примерно в 10–10 000 раз), чем их уровни для планктонных форм бактерий [22]. Таким образом, невозможно создать антибиотик, который бы оказывал эффективное бактерицидное действие на бактерии, локализованные в биопленке, и не приводил к развитию токсических или побочных эффектов.
Биопленки не только способствуют толерантности бактерий к действию антибиотиков, но и участвуют в ингибировании иммунного ответа макроорганизма. Формирование бактериальных биопленок лежит в основе многочисленных хронических инфекций, возбудители которых не чувствительны к традиционной антибактериальной терапии [2, 32].
Вместе с тем в настоящее время установлено, что и некоторые антибиотики обладают противобиопленочной активностью (табл. 2).
Стадии формирования бактериальной биопленки
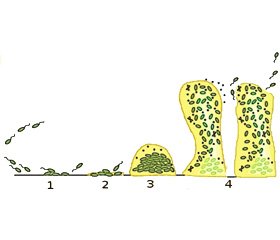
Формирование биопленки является сложным процессом, в котором различают несколько этапов: 1) начальный контакт/адгезия бактерии с поверхностью; 2) образование микроколоний; 3) матурация и формирование зрелой архитектуры биопленки; 4) дисперсия биопленки [9, 27].
Заболевания, ассоциированные с формированием бактериальных биопленок
Согласно мнению Muhsin Jamal и соавт. [16], приблизительно 65 % всех бактериальных инфекций ассоциированы с формированием бактериальных биопленок.
Формирование биопленок в качестве важнейшего патогенетического компонента характерно для развития не только хронических, но и острых инфекционных заболеваний респираторного тракта (табл. 3) [8].
Терапия, направленная на подавление формирования или разрушение бактериальной биопленки
В связи с высоким удельным весом в патогенезе бактериальных инфекций потребность в разработке противобиопленочных лекарственных средств приобретает особую актуальность. Учитывая, что в образовании биопленки участвуют механизмы межбактериальной коммуникации, полагают, что малые молекулы, которые способны нарушать функционирование quorum-sensing-ассоциированных сигнальных путей, могут быть использованы как противобиопленочные средства [3]. Так как при ограничении ресурсов питания или превышении допустимого уровня концентрации токсических продуктов во внутренних архитектурных образованиях индуцируются механизмы диспергирования биопленки, считают, что потенциальным методом противобиопленочного лечения является применение соединений, способствующих диспергированию биопленки [26, 31]. В частности, полагают, что лечение с применением ферментов может быть одним из подходов к ликвидации патологической биопленки, так как активное диспергирование биопленки сопровождается индукцией ферментов, разрушающих компоненты матрицы [33].
Также разработаны специфические рекомбинантные фаги, которые способны атаковать бактерии биопленки и продуцировать матрикс-разрушающий фермент [17, 19].
По механизму действия различают следующие группы противобиопленочных средств, влияющих:
1) на системы межбактериальной коммуникации, в частности, на аутоиндуктор AI-2 (грамотрицательных бактерий), диффузный фактор сигнала (diffusible signal factor — DSF);
2) транскрипционную активность грамотрицательных бактерий (например, деценовая кислота);
3) механизмы обеспечения железом (например, лактоферрин, препараты галлия, пиовердин);
4) на молекулы стенки бактерии (например, D-аминокислоты, которые препятствуют закреплению белковых амилоидных волокон; сарагозиновая кислота (zaragozic acid), нарушающая архитектуру микродоменов в клеточных мембранах);
5) антиматриксные молекулы (например, норспермидин (norspermidine), AA-861, партенолид (parthenolide), рамнолипид (rhamnolipid) и другие бактериальные поверхностно-активные вещества, уменьшающие межбактериальные взаимодействия);
6) молекулы, способствующие гибели клеток (индукторы синтеза оксида азота, вызывающего гибель бактерий) [25].
Выбор терапевтических методов лечения зависит от степени зрелости патологической биопленки (рис. 1).
Выводы
Формирование биопленки является ключевым фактором вирулентности широкого круга патогенных бактерий, которые вызывают как острые, так и хронические инфекции. Толерантность к антибактериальным средствам бактерий биопленки лежит в основе большинства малокурабельных рецидивирующих и хронических бактериальных инфекционных заболеваний. В настоящее время для решения данной проблемы разрабатываются терапевтические стратегии, которые направлены на подавление жизнедеятельности биопленок [18]. Лекарственные средства, созданные для борьбы с патогенными бактериальными биопленками, составляют две большие группы: 1) соединения, ингибирующие формирование биопленки; 2) соединения, дестабилизирующие или разрушающие структуру зрелой сформированной биопленки [3, 29]. Существует экспериментально подтвержденная надежда, что применение данных лекарственных средств станет эффективным методом лечения заболеваний, ассоциированных с формированием биопленок.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
1. Madsen J.S., Sørensen S.J., Burmølle M. Bacterial social interactions and the emergence of community-intrinsic properties // Curr. Opin. Microbiol. — 2017. — 42. — Р. 104-109. — doi: 10.1016/j.mib.2017.11.018.
2. Brouse L., Brouse R., Brouse D. Natural Pathogen Control Chemistry to Replace Toxic Treatment of Microbes and Biofilm in Cooling Towers // Pathogens. — 2017. — 6(2). — E14. — doi: 10.3390/pathogens6020014.
3. Gupta P. Biofilm, pathogenesis and prevention — a journey to break the wall: a review / P. Gupta, S. Sarkar, B. Das et al. // Arch. Microbiol. — 2016. — 198(1). — Р. 1-15. — doi: 10.1007/s00203-015-1148-6.
4. Moser C. Biofilms and host response — helpful or harmful / C. Moser, H.T. Pedersen, C.J. Lerche et al. // APMIS. — 2017. — 125(4). — Р. 320-338. — doi: 10.1111/apm.12674.
5. Jamal M. Bacterial biofilm and associated infections / M. Jamal, W. Ahmad, S. Andleeb et al. // J. Chin. Med. Assoc. — 2017. — S1726-4901, № 17. — Р. 30258-7. — doi: 10.1016/j.jcma.2017.07.012.
6. Dragoš A., Kovács Á.T. The Peculiar Functions of the Bacterial Extracellular Matrix // Trends Microbiol. — 2017. — 25(4). — Р. 257-266. — doi: 10.1016/j.tim.2016.12.010.
7. Flemming H.C., Wingender J. The biofilm matrix // Nat. Rev. Microbiol. — 2010. — 8(9). — Р. 623-33. — doi: 10.1038/nrmicro2415.
8. Olsen I. Biofilm-specific antibiotic tolerance and resistance // Eur. J. Clin. Microbiol. Infect. Dis. — 2015. — 34(5). — Р. 877-86. — doi: 10.1007/s10096-015-2323-z.
9. Marquès C. Effects of antibiotics on biofilm and unattached cells of a clinical Staphylococcus aureus isolate from bone and joint infection / C. Marquès, J. Tasse, A. Pracros et al. // J. Med. Microbiol. — 2015. — 64(9). — Р. 1021-6. — doi: 10.1099/jmm.0.000125.
10. Batoni G., Maisetta G., Esin S. Antimicrobial peptides and their interaction with biofilms of medically relevant bacteria // Biochim. Biophys. Acta. — 2016 May. — 1858(5). — Р. 1044-60. — doi: 10.1016/j.bbamem.2015.10.013.
11. Taraszkiewicz A. Innovative strategies to overcome biofilm resistance / A. Taraszkiewicz, G. Fila, M. Grinholc, J. Nakonieczna // Biomed. Res. Int. — 2013. — 150653. — doi: 10.1155/2013/150653.
12. Ciofu O. Antibiotic treatment of biofilm infections / O. Ciofu, E. Rojo-Molinero, M.D. Macià, A. Oliver // APMIS. — 2017. — 125(4). — Р. 304-319. — doi: 10.1111/apm.12673.
13. Gbejuade H.O., Lovering A.M., Webb J.C. The role of microbial biofilms in prosthetic joint infections // Acta Orthop. — 2015. — 86(2). — Р. 147-58. — doi: 10.3109/17453674.2014.966290.
14. Zeng J. Mechanism of azithromycin inhibition of HSL synthesis in Pseudomonas aeruginosa / Zeng J., Zhang N., Huang B. et al. // Sci. Rep. — 2016. — 6. — 24299. — doi: 10.1038/srep24299.
15. Feraco D. Host environmental signals and effects on biofilm formation / D. Feraco, M. Blaha, S. Khan et al. // Microb. Pathog. — 2016. — 99. — Р. 253-263. — doi: 10.1016/j.micpath.2016.08.015.
16. Palanisamy N.K. Antibiofilm properties of chemically synthesized silver nanoparticles found against Pseudomonas aeruginosa / N.K. Palanisamy, N. Ferina, A.N. Amirulhusni et al. // J. Nanobiotechnology. — 2014. — 12. — Р. 2. — doi: 10.1186/1477-3155-12-2.
17. Dua K. Whether a novel drug delivery system can overcome the problem of biofilms in respiratory diseases / K. Dua, S.D. Shukla, R.K. Tekade, P.M. Hansbro // Drug. Deliv. Transl. Res. — 2017. — 7(1). — Р. 179-187. — doi: 10.1007/s13346-016-0349-0.
18. Priftis K.N. Bacterial bronchitis caused by Streptococcus pneumoniae and nontypable Haemophilus influenzae in children: the impact of vaccination / K.N. Priftis, D. Litt, S. Manglani et al. // Chest. — 2013. — 143(1). — Р. 152-7. — doi: 10.1378/chest.12-0623.
19. Fernández-Barat L., Torres A. Biofilms in ventilator-associated pneumonia // Future Microbiol. — 2016. — 11. — Р. 1599-1610. — doi: 10.2217/fmb-2016-0040.
20. Gil-Perotin S. Implications of endotracheal tube biofilm in ventilator-associated pneumonia response: a state of concept / S. Gil-Perotin, P. Ramirez, V. Marti et al. // Crit. Care. — 2012. — 16(3). — R93. — doi: 10.1186/cc11357.
21. Ciofu O. Antimicrobial resistance, respiratory tract infections and role of biofilms in lung infections in cystic fibrosis patients / O. Ciofu, T. Tolker-Nielsen, P.Ø. Jensen et al. // Adv. Drug. Deliv. Rev. — 2015. — 85. — Р. 7-23. — doi: 10.1016/j.addr.2014.11.017.
22. Ahearn C.P. Insights on Persistent Airway Infection by Nontypeable Haemophilus influenzae in Chronic Obstructive Pulmonary Disease / C.P. Ahearn, M.C. Gallo, T.F. Murphy // Pathog. Dis. — 2017. — doi: 10.1093/femspd/ftx042.
23. Ishak A., Everard M.L. Persistent and Recurrent Bacterial Bronchitis-A Paradigm Shift in Our Understanding of Chronic Respiratory Disease // Front Pediatr. — 2017. — 5. — Р. 19. — doi: 10.3389/fped.2017.00019.
24. Rogers G.B., van der Gast C.J., Serisier D.J. Predominant pathogen competition and core microbiota divergence in chronic airway infection // ISME J. — 2015. — 9(1). — Р. 217-25. — doi: 10.1038/ismej.2014.124.
25. Brackman G., Coenye T. Quorum sensing inhibitors as anti-biofilm agents // Curr. Pharm. — 2015. — 21(1). — Р. 5-11. — doi: 10.2174/1381612820666140905114627.
26. Oppenheimer-Shaanan Y., Steinberg N., Kolodkin-Gal I. Small molecules are natural triggers for the disassembly of biofilms // Trends Microbiol. — 2013. — 21(11). — Р. 594-601. — doi: 10.1016/j.tim.2013.08.005.
27. Romero D., Kolter R. Will biofilm disassembly agents make it to market? // Trends Microbiol. — 2011. — 19(7). — Р. 304-6. — doi: 10.1016/j.tim.2011.03.003.
28. Xu D. Advances in the treatment of problematic industrial biofilms / D. Xu, R. Jia, Y. Li, T. Gu // World J. Microbiol. Biotechnol. — 2017. — 33(5). — Р. 97. — doi: 10.1007/s11274-016-2203-4.
29. Kaistha S.D., Umrao P.D. Bacteriophage for Mitigation of Multiple Drug Resistant Biofilm Forming Pathogens // Recent. Pat. Biotechnol. — 2016. — 10(2). — Р. 184-194. — doi: 10.2174/1872208310666160919122155.
30. Latka A. Bacteriophage-encoded virion-associated enzymes to overcome the carbohydrate barriers during the infection process / A. Latka, B. Maciejewska, G. Majkowska-Skrobek et al. // Appl. Microbiol. Biotechnol. — 2017. — 101(8). — Р. 3103-3119. — doi: 10.1007/s00253-017-8224-6.
31. Omar A. Microbial Biofilms and Chronic Wounds / A. Omar, J.B. Wright, G. Schultz et al. // Microorganisms. — 2017. — 5(1). — E9. — doi: 10.3390/microorganisms5010009.
32. Lebeaux D., Ghigo J.M., Beloin C. Biofilm-related infections: bridging the gap between clinical management and fundamental aspects of recalcitrance toward antibiotics // Microbiol. Mol. Biol. Rev. — 2014. — 78(3). — Р. 510-43. — doi: 10.1128/MMBR.00013-14.
33. Koo H. Targeting microbial biofilms: current and prospective therapeutic strategies / H. Koo, R.N. Allan, R.P. Howlin et al. // Nat. Rev. Microbiol. — 2017. — 15(12). — Р. 740-755. — doi: 10.1038/nrmicro.2017.99.
34. Richter K., Van den Driessche F., Coenye T. Innovative approaches to treat Staphylococcus aureus biofilm-related infections // Essays Biochem. — 2017. — 61(1). — Р. 61-70. — doi: 10.1042/EBC20160056.

/127-1.jpg)
/128-1.jpg)
/129-1.jpg)