Журнал «Здоровье ребенка» Том 13, №8, 2018
Вернуться к номеру
Особливості цитопротекції слизової оболонки шлунка та дванадцятипалої кишки у підлітків з хронічним гастродуоденітом на фоні харчової гіперчутливості
Авторы: Березенко В.С.(1, 4), Кротевич М.С.(2), Богданова Т.А.(1), Замула В.В.(3), Козинкевич Г.Е.(1)
(1) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
(2) — Національний інститут раку МОЗ України, м. Київ, Україна
(3) — Київська дитяча клінічна лікарня № 9, м. Київ, Україна
(4) — ДУ «Інститут педіатрії, акушерства і гінекології імені академіка О.М. Лук’янової НАМН України», м. Київ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. В наш час залишаються недостатньо вивченими цитопротективні властивості шлунково-кишкового тракту у дітей з хронічним гастродуоденітом на фоні харчової гіперчутливості. Метою нашого дослідження стало оцінити стан цитопротективного потенціалу слизових оболонок (СО) шлунка та дванадцятипалої кишки у підлітків з хронічним гастродуоденітом на фоні харчової гіперчутливості шляхом визначення рівня трефоїлового фактора 1 (TFF-1) у слизовій оболонці шлунка і TFF-2 слизової оболонки шлунка та дванадцятипалої кишки імуногістохімічним методом. Матеріали та методи. Дослідження проведено 50 підліткам (віком від 12 до 17 років), з яких у I групі було 64 % (n = 32) з хронічним гастродуоденітом, поєднаним з харчовою гіперчутливістю, у II групі — 36 % (n = 18) дітей з хронічним гастродуоденітом без харчової гіперчутливості. Всім дітям виконано морфологічне та імуногістохімічне дослідження біоптату з визначенням TFF-1 та TFF-2. Оцінка експресії TFF-1 та TFF-2 пептидів проводилась за бальною шкалою за кількістю забарвлених клітин епітелію залоз антрального відділу та келихоподібних клітин у полі зору при збільшенні в 40 разів: 0 балів — відсутнє забарвлення, 1 бал — 30 % забарвлених клітин, 2 бали — 30–70 % забарвлених клітин, 3 бали — 70–100 % забарвлених клітин. Результати. Виражена експресія TFF-1 (3 бали) у слизовій шлунка мала місце у підлітків обох груп. За результатами проведеного дослідження, у 62,5 % (n = 20) дітей І групи та у 22 % (n = 4) підлітків ІІ групи в СО дванадцятипалої кишки було відсутнє забарвлення келихоподібних клітин (0 балів) (χ2 = 7,5; p = 0,008). Слабка експресія (1 бал) мала місце у 34,5 % (n = 11) дітей І групи та у 67 % (n = 12) дітей II групи (χ2 = 4,84; p = 0,03). За результатами статистичного аналізу група дітей з харчовою гіперчутливістю має в 17 разів вищі шанси на виникнення атрофічних зміни слизової дванадцятипалої кишки. Висновки. У дітей з харчовою гіперчутливістю знижені цитопротективні властивості слизової оболонки дванадцятипалої кишки, про що свідчить відсутність експресії TFF-2 пептиду. Також вірогідно частіше виникають мікроерозії, зменшення кількості крипт та бруннерових залоз в СО дванадцятипалої кишки у групі дітей з харчовою гіперчутливістю при відсутній або слабкій експресії TFF-2 пептиду (р < 0,05).
Актуальность. В наше время остаются недостаточно изученными цитопротективные свойства желудочно-кишечного тракта у детей с хроническим гастродуоденитом на фоне пищевой гиперчувствительности. Целью нашего исследования стало оценить состояние цитопротективного потенциала слизистых оболочек (СО) желудка и двенадцатиперстной кишки у подростков с хроническим гастродуоденитом на фоне пищевой гиперчувствительности путем определения уровня трефоилового фактора 1 (TFF-1) в слизистой оболочке желудка и TFF-2 слизистой оболочки желудка и двенадцатиперстной кишки иммуногистохимическим методом. Материалы и методы. Исследование проведено 50 подросткам (от 12 до 17 лет), из которых в I группе было 64 % (n = 32) с хроническим гастродуоденитом на фоне пищевой гиперчувствительности, во II группе — 36 % (n = 18) детей с хроническим гастродуоденитом без пищевой гиперчувствительности. Всем детям выполнено морфологическое и иммуногистохимическое исследование биоптатов с определением TFF-1 и TFF-2. Оценка экспрессии TFF-1 и TFF-2 пептидов проводилась по балльной шкале по количеству окрашенных клеток эпителия желез антрального отдела и бокаловидных клеток в поле зрения при увеличении в 40 раз: 0 баллов — отсутствует окрас, 1 балл — 30 % окрашенных клеток, 2 балла — 30–70 % окрашенных клеток, 3 балла — 70–100 % окрашенных клеток. Результаты. Выраженная экспрессия TFF-1 (3 балла) в слизистой желудка имела место у подростков обеих групп. По результатам проведенного исследования, у 62,5 % (n = 20) детей первой группы и у 22 % (n = 4) подростков II группы в СО двенадцатиперстной кишки отсутствовала окраска бокаловидных клеток (0 баллов) (χ2 = 7,5; p = 0,008). Слабая экспрессия (1 балл) имела место у 34,5 % (n = 11) детей I группы и у 67 % (n = 12) детей II группы (χ2 = 4,84; p = 0,03). По результатам статистического анализа группа детей с пищевой гиперчувствительностью имеет в 17 раз выше шансы на возникновение атрофических изменений слизистой двенадцатиперстной кишки. Выводы. У детей с пищевой гиперчувствительностью снижены цитопротективные свойства слизистой оболочки двенадцатиперстной кишки, о чем свидетельствует отсутствие экспрессии TFF-2 пептида. Также достоверно чаще возникают микроэрозии, уменьшение количества крипт и бруннеровых желез в СО двенадцатиперстной кишки в группе детей с пищевой гиперчувствительностью при отсутствии или слабой экспрессии TFF-2 пептида (р < 0,05).
Background. The cytoprotective properties of the gastrointestinal tract in children with chronic gastroduodenitis on the background of food hypersensitivity remain understudied. The purpose is to assess the state of the cytoprotective potential of gastric and duodenal mucosa in adolescents with chronic gastroduodenitis on the background of food hypersensitivity by determining the level of trefoil factor (TFF) 1 in gastric mucosa and TFF-2 — in gastric and duodenal mucosa by immunohistochemistry method. Materials and methods. Fifty adolescents (aged 12 to 17 years) were observed and divided into two groups. The first group consisted of 64 % (n = 32) of patients with chronic gastroduodenitis and food hypersensitivity; the second group included 36 % (n = 18) of children with chronic gastroduodenitis without food hypersensitivity. All children underwent morphological and immunohistochemical studies of biopsy specimens with the determination of TFF-1 and TFF-2. Evaluation of TFF-1 and TFF-2 expression was carried out on a point-scale according to the number of stained epithelial cells of the glands of the antrum and goblet cells in the field of view with a 40-fold magnification: 0 points — no color, 1 point — 30 % of stained cells, 2 points — 30–70 % of stained cells, 3 points — 70–100 % of stained cells. Results. A significant expression of TFF-1 (3 points) in the gastric mucosa occurred in adolescents of both groups. According to the results of the study, 62.5 % (n = 20) of children in the first group and 22 % (n = 4) of adolescents in the second group did not have staining of goblet cells (0 points) in duodenal mucosa, (χ2 = 7.5; p = 0.008). Weak expression (1 point) occurred in 34.5 % (n = 11) of children in the first group and in the majority of children (67 % (n = 12)) in the second group (χ2 = 4.84; p = 0.03). According to the results of statistical analysis, a group of children with food hypersensitivity has 17 times higher risk of atrophic changes in the duodenal mucosa. Conclusions. In children with food hypersensitivity, the cytoprotective properties of the duodenal mucosa are reduced, as evidenced by the absence of TFF-2 expression. In addition, microerosions, a decrease in the number of crypts and Brunner’s glands in the duodenal mucosa are significantly more frequent in the group of children with food hypersensitivity in the absence or weak expression of TFF-2 (p < 0.05).
підлітки; хронічна гастродуоденальна патологія; трефоїловий фактор; харчова гіперчутливість; келихоподібні клітини
подростки; хронический гастродуоденит; трефоиловый фактор; пищевая гиперчувствительность; бокаловидные клетки
adolescents; chronic gastroduodenitis; trefoil factor; food hypersensitivity; goblet cells
Вступ
В основі патогенезу хронічного гастродуоденіту лежить дисбаланс між місцевими факторами агресії з порушенням слизової оболонки (CО) та факторами захисту. Поверхневому епітелію належить провідна роль в системі захисного слизового бар’єра шлунка та дванадцятипалої кишки (ДПК). Захисна система шлунка та ДПК поділяється на преепітеліальний, епітеліальний та постепітеліальний бар’єри. До преепітеліального бар’єра відносяться слиз, бікарбонати, вода, іони водню, секреторний IgА. Епітеліальний бар’єр складають безпосередньо клітини слизової оболонки. Постепітеліальний захист здійснюється за рахунок власної пластинки слизової оболонки, яка має унікальну місцеву імунну систему [1]. Важливу роль у цитопротекції СО шлунка та дванадцятипалої кишки відіграє хороша здатність клітин до репарації, задовільний стан мікроциркуляторного русла та достатня секреція хімічних медіаторів захисту: простагландини, дефензини, гастрокін-2, епідермальний фактор росту (EGF), трансформуючий фактор росту альфа (TGF-a), трефоїловий фактор (TFF), фактор каппа-В та ін. [2, 3].
За даними літератури, сімейство трефоїлових білків є невеликими, компактними пептидами, що містять одну або дві трефоїлові ділянки, які складаються з 42–43 амінокислотних залишків і утворюють три- та дисульфідні зв’язки з шістьма залишками цистеїну, створюючи тим самим характерну структуру у вигляді трьох аркушів. За рахунок такої структури TFF стійкі до теплового та ферментативного розщеплення. Це група пептидів, що синтезуються з муцинами, клітинами мукозального епітелію [5, 10]. Взаємодіючи з муцинами, вони формують так званий захисний мукозальний бар’єр, стабілізують його і сприяють процесу реституції шляхом посилення міграції клітин з сусідніх ділянок, полімеризації муцинів. Процес відновлення починається у перші хвилини пошкодження. При цьому початкові фази репарації не вимагають проліферації клітин або біосинтезу білка. У своїй статті W. Hoffmann зазначає, що реституція — це багатоступінчатий процес раннього відновлення слизового епітелію, який характеризується зменшенням клітинних контактів у вигляді епітеліально-мезенхімальної міграції, реполяризацією та утворенням щільних сполучень (морфологічна реституція) і відновленням бар’єрної функції (функціональна реституція) [4, 9, 11]. У людини ідентифіковано три трефоїлових фактори: TFF-1 (поліпептид шлунка), TFF-2 (спазмолітичний поліпептид SP шлунка та тонкого кишечника) і TFF-3 (переважно поліпептид товстого кишечника). TFF-1 синтезується, головним чином, в шлункових ямках антрального та фундального відділів шлунка, де відкриваються протоки розгалужених трубчастих залоз, в той час як TFF-2 виділяється слизовою оболонкою фундальних залоз та базальних клітин антральних і пілоричних залоз, також залозами дванадцятипалої кишки — клітинами Бруннера, келихоподібними клітинами епітелію. За даними літератури, рівень трефоїлових пептидів підвищується при дефектах епітеліальної пластинки (ерозій та виразок) та при хронічних запальних захворюваннях шлунково-кишкового тракту [6, 7].
Дослідження експресії TFF-2 та муцинів (Muc2) в слизовій оболонці дітей з хворобою Крона (ХК) та виразковим колітом (ВК) показали, що у дітей з загостренням ХК їх вміст був нижчим в зразках слизової оболонки дванадцятипалої кишки та термінального відділу клубової кишки порівняно зі здоровими та вищим у хворих без загострення ХК. Такі ж результати автори отримали й у групі дітей з ВК [8, 12].
Метою нашого дослідження було оцінити стан цитопротективного потенціалу слизових оболонок шлунка та дванадцятипалої кишки у підлітків з хронічним гастродуоденітом на фоні харчової гіперчутливості шляхом визначення рівня TFF-1 у слизовій оболонці шлунка і TFF-2 СО шлунка та дванадцятипалої кишки імуногістохімічним методом.
Матеріали та методи
Морфологічне дослідження та вивчення стану захисного слизового бар’єра проведено 50 підліткам 12–17 років, які перебували на стаціонарному лікуванні в гастроентерологічному відділенні ДКЛ № 9 міста Києва. Середній вік дітей становив 14,30 ± 0,23 року. Діти були розділені на дві групи: I група — це пацієнти з хронічною гастродуоденальною патологією, поєднаною з харчовою гіперчутливістю (64 %, n = 32), і II група — пацієнти з хронічною гастродуоденальною патологією без харчової гіперчутливості (36 %, n = 18). Для верифікації діагнозу всім підліткам проводили фіброезофагогастродуоденоскопію верхніх відділів травного каналу з біопсією СО антрального відділу шлунка і низхідної частини дванадцятипалої кишки фіброскопом Gif-РЗ фірми OLYMPUS. Біоптати фіксували в 10% розчині нейтрального забуференого формаліну і обробляли за загальноприйнятою гістологічною методикою із забарвленням зрізів гематоксилін-еозином за ван Гізоном. Імуногістохімічне дослідження проводили в біоптатах СО шлунка та дванадцятипалої кишки на зрізах товщиною 4 µм, оцінка здійснена мікроскопом (Olympus СХ30) із комп’ютерною приставкою та фотодокументуванням. Як первинні антитіла використовували кролячі поліклональні антитіла TFF-1 та TFF-2 (Thermo Fisher Scientific, США), а також систему візуалізації TL-015-QHD (Thermo Scientific, США). Експресію трефоїлового фактора ідентифікували за коричневим забарвленням клітин епітелію залоз антрального відділу та келихоподібних клітин. Оцінка експресії TFF-1 та TFF-2 пептидів проводилась за бальною шкалою за кількістю забарвлених клітин у полі зору при збільшенні в 40 разів: 0 балів — відсутнє забарвлення, 1 бал — 30 % забарвлених клітин, 2 бали — 30–70 % забарвлених клітин, 3 бали — 70–100 % забарвлених клітин. Біопсію виконали відповідно до загальної декларації з біоетики та прав людини, прийнятої Генеральною конференцією ЮНЕСКО 19 жовтня 2005 року. Протокол дослідження ухвалений локальним етичним комітетом всіх зазначених у роботі установ. На проведення досліджень було отримано поінформовану згоду батьків дітей (або їх опікунів).
Статистична обробка отриманих результатів проводилася з використанням програми SPSS 23,0 (IBM SPSS Statistics 23, USA) та MS Excel 2010. Різниця показників була розрахована за оцінкою критерію c2 Пірсона і вважалася вірогідною при значенні р < 0,05. Вірогідність значення вибірки при значенні менше 5 визначалась завдяки двосторонньому точному критерію Фішера. Визначення лінійно-лінійного зв’язку (Linear-by-Linear Association) між досліджуваними факторами проводилось за таблицями спряженості, зв’язок вважався значимим при р < 0,05. Для оцінки ризиків використовували показник OR (відношення шансів) та його 95% довірчий інтервал і значення p.
Результати
Особливості експресії TFF-1 та TFF-2 в СО шлунка у досліджуваних групах наведено у табл. 1.
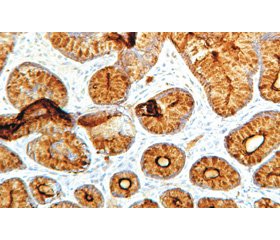
Наведені в табл. 1 дані свідчать, що у переважної більшості обстежених пацієнтів обох груп: 84,4 % (n = 27) підлітків першої групи та 94,4 % (n = 17) — другої (c2 = 5,9; p = 0,1) — мала місце виражена експресія TFF-1 (3 бали) у слизовій оболонці шлунка (рис. 1). Це може свідчити про підвищення цитопротективного потенціалу слизової оболонки антрального відділу шлунка у відповідь на хронічне запалення. Також, за даними літератури, в нормі рівень TFF-1 в шлунку завжди високий, його експресія знижується лише при деяких онкологічних захворюваннях шлунка [14].
Дослідження експресії TFF-2 у СО шлунка (рис. 2) показало, що у більшості дітей обох груп: у 84,3 % (n = 27) дітей першої групи та 66,6 % (n = 12) — другої (р > 0,05) — експресія цього пептиду є відсутньою (0 балів) та слабкою (1 бал), що може свідчити про фізіологічно низький синтез цього пептиду в СО антрального відділу шлунка та більш активний його синтез у фундальному [15]. Також за іншими дослідженнями зазначається, що TFF-2 краще асоціюється з муцинами і вірогідніше вказує на зниження цитопротективних властивостей слизового бар’єра антрального відділу шлунка [5].
Враховуючи той факт, що цитопротективний потенціал в тонкому кишечнику забезпечується переважно TFF-2 пептидами, в досліджуваних групах дітей ми оцінювали лише експресію цього фактора (табл. 2).
За результатами проведеного дослідження у 62,5 % (n = 20) дітей І групи та у 22 % (n = 4) підлітків ІІ групи в СО дванадцятипалої кишки було відсутнє забарвлення келихоподібних клітин (0 балів) (c2 = 7,5; p = 0,006). Слабка експресія (1 бал) мала місце у 34,5 % (n = 11) дітей І групи та у 67 % (n = 12) дітей II групи (c2 = 4,84; p = 0,03). Помірна експресія (2 бали) (рис. 3) спостерігалась лише у двох підлітків обох груп: 3 % (n = 1) у першій та 5,6 % (n = 1) — у ІІ групі.
Ми встановили лінійно-лінійну асоціацію між експресією TFF-2 та частотою алергії (p = 0,008) в обстежених пацієнтів: відсутність експресії TFF-2 характерна для дітей з харчовою гіперчутливістю. Під час оцінки ризиків бачимо, що підлітки І групи мають у 5,8 раза вищі шанси відсутності експресії TFF-2 у СО дванадцятипалої кишки (OR = 5,83 (1,56–21,9)).
Нами був визначений асоціативний зв’язок між експресією TFF-2 в СО ДПК та наявністю кишкових крипт (p = 0,004). Варто зазначити, що в групі дітей без харчової гіперчутливості (94,4 %, n = 17) частота виявлення крипт в СО дванадцятипалої кишки була вірогідно вищою, ніж у І групі пацієнтів (68,8 %, n = 22) (p = 0,037).
Мікроерозії слизової оболонки ДПК, за результатами гістологічного дослідження, виявлені лише у дітей з харчовою гіперчутливістю (22 %, n = 7), у дітей ІІ групи вони були відсутні. Характерно, що у 9,4 % (n = 3) хворих першої групи відмічали відсутність TFF-2 (0 балів), а у 12,5 % (n = 4) експресія цього пептиду була слабкою (1 бал). За результатами гістологічного дослідження атрофічні зміни СО ДПК вірогідно частіше зустрічалися у дітей першої групи (50 %, n = 16) на відміну від дітей (6 %, n = 1) другої групи спостереження (c2 = 10,14; p = 0,002). Ми не встановили взаємозв’язку експресії TFF-2 з атрофічними змінами в СО дванадцятипалої кишки. За результатами статистичного аналізу, група дітей з харчовою гіперчутливістю має в 17 разів вищі шанси на виникнення атрофічних змін слизової дванадцятипалої кишки (OR = 17 (2,015–143,41)).
Встановлено лінійно-лінійну асоціацію між кількістю бруннерових залоз та рівнем експресії TFF-2: чим нижчий рівень TFF-2, тим менша кількість нормальних бруннерових залоз у слизовій ДПК (p = 0,009). За нашими даними, візуалізація нормальних залоз Бруннера у підлітків другої групи (66,6 %, n = 12) зустрічається частіше, ніж у дітей (34,5 %, n = 11) першої групи (c2 = 4,8; p = 0,028).
Обговорення
У науковій літературі ми не знайшли публікацій, присвячених імуногістохімічному дослідженню рівня експресії TFF-1 та TFF-2 у СО шлунка та дванадцятипалої кишки у дітей. Оцінка стану цитопротекції СО у дітей з хронічним гастродуоденітом з використанням трефоїлових пептидів, за даними літератури, проводилася шляхом визначення концентрації TFF-1 та TFF-2 у сироватці крові та слині дітей з хронічним гастродуоденітом методом імуноферментного аналізу [13]. Це опосередковано відображає стан захисного бар’єра у цих хворих, оскільки на концентрацію ТFF-1 та TFF-2 пептидів у сироватці крові можуть впливати багато інших факторів: гормональний, імунний та ін. Рівень експресії TFF-1 та TFF-2 в СО шлунка та дванадцятипалої кишки, за даними іноземних видань, визначався зазвичай при онкологічних захворюваннях у дорослих [4, 5, 14].
Отримані нами результати свідчать, що визначення TFF-1 та TFF-2 у СО шлунка та ДПК є показовим і більш точним методом оцінки цитопротективних властивостей слизової оболонки гастродуоденальної зони. Під час імуногістохімічного дослідження TFF-1 та TFF-2 бачимо відмінності експресії в СО шлунка та дванадцятипалої кишки у підлітків обох груп та різницю показників рівня експресії TFF-1 та TFF-2 у пацієнтів з хронічним гастродуоденітом на фоні харчової гіперчутливості та у дітей з хронічним гастродуоденітом без харчової гіперчутливості.
Висновки
1. Виражена експресія TFF-1 в СО шлунка дітей з гастродуоденальною патологією свідчить про підвищене у них муциноутворення у відповідь на хронічне запалення слизової шлунка.
2. У дітей з харчовою гіперчутливістю знижені цитопротективні властивості СО дванадцятипалої кишки, про що свідчить відсутність експресії TFF-2 пептиду.
3. У групі дітей з харчовою гіперчутливістю при відсутній або слабкій експресії TFF-2 пептиду вірогідно частіше виникали мікроерозії, зменшення кількості крипт та бруннерових залоз в СО дванадцятипалої кишки.
4. Підлітки з харчовою гіперчутливістю мають в 17 разів вищі шанси мати атрофічні зміни слизової дванадцятипалої кишки на відміну від дітей без алергії.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Боброва В.І. Захворювання органів гастродуоденальної зони у дітей: навч.-метод. посіб. для студентів ВНЗ МОЗ України, лікарів-інтернів і лікарів. — Харків: Золоті сторінки, 2015. — 160 с.
2. Kjellev S. The trefoil factor family — small peptides with multiple functionalities // Cell. Mol. Life Sciences. — 2009. — 66. — P. 1350-69. doi: 10.1007/s00018-008-8646-5.
3. Kim Y.S., Ho S.B. Intestinal goblet cells and mucins in health and disease: recent insights and progress // Curr. Gastroenterol. Rep. — 2010. — 12. — Р. 319-30. doi: 10.1007/s11894-010-0131-2.
4. Werner Hoffmann. TFF2, a MUC6-binding lectin stabilizing the gastric mucus barrier and more (Review) // International journal of oncology. — 2015. — 47. — Р. 806-16. doi: 10.3892/ijo.2015.3090.
5. Kouznetsova Irina, Werner Laubinger, Hubert Kalbacher, Thomas Kalinski. Biosynthesis of Gastrokine-2 in the Human Gastric Mucosa: Restricted Spatial Expression along the Antral Gland Axis and Differential Interaction with TFF1, TFF2 and Mucins // Cell. Physiol. Biochem. — 2007. — 20. — Р. 899-908. doi: 10.1159/000110450.
6. Aihara E., Engevik K.A., Montrose M.H. Trefoil factor peptides and gastrointestinal function // Annu. Rev. Physiol. — 2017. — 79. — Р. 357-380. doi: 10.1146/annurev-physiol-021115-105447.
7. Xiao P., Ling H., Lan G., Liu J., Hu H. Trefoil factors: Gastrointestinal-specific proteins associated with gastric cancer // Clin. Chim. Acta. — 2015. — 450. — Р. 127-134. doi: 10.1016/j.cca.2015.08.004.
8. Aamann L., Vestergaard E.M., Gronbaek H. Trefoil factors in inflammatory bowel disease // World J. Gastroenterol. — 2014. — 20. — Р. 3223-30. doi: 10.3748/wjg.v20.i12.3223.
9. Du T.Y., Zhang Y., Zhang Y. Trefoil factor: from laboratory to clinic // Dongwuxue Yanjiu. — 2010. — 31(1). — Р. 17-26. PubMed ID: 20446449.
10. Lebherz-Eichinger D., Tudor B., Ankersmit H.J., Reiter T., Haas M., Roth-Walter F. et al. Trefoil Factor 1 Excretion Is Increased in Early Stages of Chronic Kidney Disease // PLoS One. — 2010. — 10(9). — Р. e0138312. doi: 10.1371/journal.pone.0138312.
11. Busch M., Dünker N. Trefoil factor family peptides — friends or foes // Biomol. Concepts. — 2015. — 6(5–6). — Р. 343-359. doi: 10.1515/bmc-2015-0020.
12. Hensel K.O., Boland V., Postberg J., Zilbauer M. Differential expression of mucosal trefoil factors and mucins in pediatric inflammatory bowel diseases // Sci Rep. — 2014. — 4. — Р. 7343. doi: 10.1038/srep07343.
13. Шестопалов А.В., Трофименко О.В., Шестопалова М.А. Уровень трефоиловых пептидов (TFF-1 И TFF-2) у детей с хроническими гастродуоденитами // Фундаментальные исследования. — 2012. — № 10(2). — С. 363-366.
14. Im S., Yoo C., Jung J.H. Reduced expression of TFF1 and increased expression of TFF3 in gastric cancer: correlation with clinicopathological parameters and prognosis // Int. J. Med. Sci. — 2013. — 10(2). — Р. 133-140. doi: 10.7150/ijms.5500.
15. Roberta Esposito, Silvana Morello, Megi Vllahu, Daniela Eletto, Amalia PortaGastric TFF1 Expression from Acute to Chronic Helicobacter Infection // Front. Cell. Infect. Microbiol. — 2017. — 7. — 434. doi: 10.3389/fcimb.2017.00434. 160с.

/9-2.jpg)
/9-1.jpg)
/10-1.jpg)