Журнал «Здоровье ребенка» Том 14, №1, 2019
Вернуться к номеру
Мукоактивна терапія в дітей із бронхіальною астмою: ефективність і переносимість крапель і сиропу Проспан
Авторы: Уманець Т.Р., Лапшин В.Ф., Пустовалова О.І.
ДУ «Інститут педіатрії, акушерства і гінекології НАМН України», м. Київ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
У статті подано сучасний погляд на застосування мукоактивних препаратів при бронхіальній астмі в дітей і результати клінічного дослідження ефективності й переносимості двох форм оригінального екстракту плюща EA 575® у дітей із даною патологією. Метою нашого дослідження було вивчення ефективності й безпеки застосування крапель і сиропу Проспан у дітей із загостренням бронхіальної астми. Під спостереженням перебували 73 дитини віком від 6 до 12 років із легким і середньотяжким загостренням бронхіальної астми. Критеріями ефективності проведеного лікування були регрес основних клінічних проявів хвороби, динаміка показників спірометрії, зміни клітинного складу індукованого мокротиння. Застосування двох форм препарату Проспан у дітей із бронхіальною астмою сприяло більш швидкому регресу основних клінічних проявів загострення, покращенню функції зовнішнього дихання й показників клітинного складу індукованого мокротиння.
В статье представлен современный взгляд на применение мукоактивных препаратов при бронхиальной астме у детей и результаты клинического исследования эффективности и переносимости двух форм оригинального экстракта плюща EA 575® у детей с данной патологией. Целью нашего исследования было изучение эффективности и безопасности применения капель и сиропа Проспан у детей с обострением бронхиальной астмы. Под наблюдением находились 73 ребенка в возрасте от 6 до 12 лет с легким и среднетяжелым обострением бронхиальной астмы. Критериями эффективности проводимого лечения была регресс основных клинических проявлений болезни, динамика показателей спирометрии, изменение клеточного состава индуцированной мокроты. Применение препарата Проспан у детей с бронхиальной астмой способствовало более быстрому регрессу основных клинических проявлений обострения, улучшению функции внешнего дыхания и показателей клеточного состава индуцированной мокроты.
The article presents a modern view on the use of mucoactive drugs in bronchial asthma in children and the results of clinical study on the effectiveness and tolerability of two forms of the original ivy extract EA 575® in children with this pathology. The objective of our study was to evaluate the efficacy and safety of Prospan drops and syrup in children with acute exacerbation of bronchial asthma. We have examined 73 children aged 6 to 12 years with mild and moderate-to-severe exacerbation of bronchial asthma. The criteria for the effectiveness of the treatment were the regression of the main clinical manifestations of the disease, the dynamics of spirometry parameters, changes in the cellular composition of induced sputum. The use of two forms of Prospan in children with bronchial asthma contributed to a more rapid regression of the main clinical manifestations of exacerbation, improvement of external respiration and indicators of cellular composition of induced sputum.
бронхіальна астма; діти; екстракт плюща EA 575®
бронхиальная астма; дети; экстракт плюща EA 575®
bronchial asthma; children; ivy extract EA 575®
Вступ
До цього часу хвороби органів дихання залишаються найпоширенішою патологією в структурі дитячої захворюваності [1, 2]. Серед хронічних запальних захворювань органів дихання в дітей, що супроводжуються порушенням мукоциліарного кліренсу (МЦК), гіперсекрецією бронхіального слизу, провідне місце посідає бронхіальна астма (БА) [2–6].
Результати досліджень свідчать, що в пацієнтів із БА, особливо під час загострення, бронхіальний секрет має дуже високу в’язкість унаслідок збільшення муцинів зі зміненою вторинною структурою, що може призводити до мукостазу й асоціюється з тяжким перебігом і фатальними наслідками хвороби [5–7].
Відомо, що БА — гетерогенне захворювання з різними клітинними й молекулярними механізмами, що обумовлюють клінічні особливості перебігу захворювання й відповідь на лікування. Так, хворі з так званою вологою БА мають хронічний малопродуктивний або продуктивний кашель, у них відзначається неконтрольований перебіг захворювання зі збільшенням частоти його загострень [6]. Даний фенотип супроводжується резистентністю до інгаляційних кортикостероїдів (ІГКС), а за певних обставин стероїди можуть посилювати продукцію змінених муцинів [8].
Утворення трахеобронхіального секрету є важливим захисним механізмом, що порушується при дії на слизову оболонку респіраторного тракту різноманітних алергічних, інфекційних, хімічних, фізичних та інших чинників. Унаслідок персистуючого запалення у хворих на БА відбувається ремоделювання дихальних шляхів, що характеризується гіперплазією й гіпертрофією келихоподібних клітин і субслизових залоз із гіперсекрецією бронхіального секрету зі зміненими властивостями слизу, а саме в’язкості й еластичності. Гіперпродукцію бронхіального слизу й гіперплазію келихоподібних клітин при цьому пов’язують із впливом цитокінів Т-хелперів 2-го типу, зокрема інтерлейкінів (IЛ) 13 і 9. При цьому IЛ-9 впливає на епітеліальні клітини безпосередньо, а також непрямим шляхом взаємодії з ІЛ-13 [3, 5].
На сьогодні молекулярні механізми гіперсекреції бронхіального слизу остаточно не з’ясовані. Tyner та співавтори запропонували двоступеневу модель, що пояснює механізми гіперсекреції бронхіального слизу при БА, вона подана на рис. 1 [5, 8]. Згідно з цією теорією, війковий епітелій дихальних шляхів, у тому числі клітини Клара, трансформується в келихоподібні клітини за участю двох сигнальних механізмів: 1) із залученням активації рецепторів епітеліального ростового фактора, що призводить до пригнічення процесів апоптозу (клітинної смерті) війкового епітелію, з їх подальшою здатністю до активації рецептора ІЛ-13; 2) у результаті взаємодії внутрішньоклітинних сигнальних систем, продукції муцинів (MUC5AC, головного гель-формуючого муцину), втрати війкової структури клітин. У хворих із БА до 20–25 % усіх епітеліальних клітин становлять келихоподібні клітини, навіть при легкому персистучому перебігу. У цих умовах війковий епітелій працює з надлишковим навантаженням і не може забезпечити адекватний мукоциліарний транспорт бронхіального слизу.
Отже, зміна кількості й реологічних властивостей бронхіального секрету в результаті хронічного запального процесу в бронхах при БА розглядається як один із головних компонентів бронхіальної обструкції, вентиляційно-перфузійних порушень, гіпоксемії, що веде до візингу, диспное та кашлю. Тому контроль запалення залишається головною стратегією лікування БА.
Однак останніми роками запропонована стратегія персоніфікованого підходу до лікування хворих з БА, у якій обговорюються можливості застосування моноклональних антитіл, спрямованого на конт–роль гіперсекреції бронхіального слизу, і додаткової мукоактивної терапії [3].
Призначення мукоактивної терапії у хворих з БА є предметом дискусії до цього часу. З одного боку, дані препарати патогенетично обґрунтовані. З іншого боку, більшість відхаркувальних і муколітичних засобів збільшують об’єм бронхіального секрету, посилюючи обструкцію, що обтяжує стан хворого. Тому вони призначаються за індивідуальними показаннями, важливим є раціональний вибір мукоактивного препарату для даної категорії хворих, що залежить від особливостей перебігу й фази хвороби, механізму дії препарату.
Класифікація мукоактивних препаратів за даними міжнародних медичних публікацій подана в табл. 1 [3].
У лікуванні обструктивних станів у дітей і дорослих привертає увагу рослинний препарат з оригінального екстракту листя плюща EA 575® Проспан, який має комбіновану дію: відхаркувальну, бронхолітичну й протизапальну. Головними активними компонентами препарату є сапоніни, особливо a-гедерин, з яким пов’язані вищезазначені терапевтичні ефекти. Дані експериментальних, молекулярних досліджень in vitro дозволили зробити висновок про наявність b2-адреноміметичної дії, ініційованої a-гедерином. Доведено, що a-гедерин перешкоджає зануренню й руйнуванню b2-адренорецепторів (інтерналізації рецепторів). У результаті збільшується площа активних рецепторів на поверхні клітини й чутливість її до адреналіну. Це призводить до зменшення концентрації внутрішньоклітинного Ca2+ у м’язах бронхів і розслаблення бронхів. Одночасно з цим процесом у результаті стимулювання b2-активності епітеліальні альвеолярні клітини легень II типу продукують більшу кількість сурфактанту, отже, зменшується в’язкість слизу й полегшується відходження мокротиння при кашлі [9, 10].
Вивчення ефективності й безпеки препарату Проспан у клінічних дослідженнях дозволило визначити додаткові його ефекти: мукокінетичний, протизапальний, протимікробний, протигрибковий, агніопротекторний і гепатопротекторний.
Важливим є протизапальний ефект, обумовлений пригніченням синтезу медіаторів запалення. Зокрема, a-гедерин зменшує рівень IЛ-4, IЛ-6, IЛ-17 у сироватці крові й підвищує концентрацію інтерферону гамма, що було показано в експериментальних роботах. Автори зробили висновок, що a-гедерин може успішно застосовуватись при захворюваннях, що асоційовані з Т-хелпер-2-запальною відповіддю [11].
Високий профіль безпеки й ефективності препарату Проспан доведений у 18 клінічних дослідженнях, у яких взяли участь 65 383 дитини і дорослих із різними гострими й хронічними запальними захворюваннями дихальних шляхів, включно з БА [10]. Так, у двох подвійних сліпих плацебо-конт–рольованих рандомізованих дослідженнях з вивчення ефективності й безпеки застосування препарату Проспан у формі крапель і сиропу в дітей із БА доведено позитивний вплив на функцію зовнішнього дихання [10, 12]. Зростаючий інтерес до можливості застосування препарату Проспан у дітей з БА з огляду на його бронхолітичний, секретолітичний і протизапальний ефекти обумовлює необхідність продовження подальших клінічних досліджень з вивчення ефективності, переносимості препарату й уточнення показань до його призначення.
Метою нашого дослідження було вивчення ефективності й безпеки застосування двох форм (краплі, сироп) препарату Проспан у дітей із легким та середньотяжким загостренням БА легкого персистуючого перебігу.
Матеріали та методи
Під нашим спостереженням перебували 73 дитини віком 6–12 років, які знаходились на лікуванні в ДУ «Інститут педіатрії, акушерства і гінекології НАМН України» з приводу легкого й середньотяжкого загострення БА. Ступінь тяжкості й період захворювання оцінювалися відповідно до міжнародних і національних рекомендацій з діагностики й лікування БА у дітей [2, 13]. Критерії включення пацієнтів у дослідження: діти відповідного віку з установленим діагнозом БА, у яких отримано інформовану згоду на участь, а також у їх батьків; відповідність критеріям загострення легкого й середнього ступеня тяжкості; здатність виконувати спірометричні дослідження; діти отримували базисну терапію із застосуванням ІГКС у низьких дозах і не застосовували системні глюкокортикостероїди. Критеріями виключення були: тяжкі супутні захворювання серцево-судинної системи, печінки, центральної нервової системи; застосування інших муколітичних і відхаркувальних засобів, індивідуальна непереносимість фруктози й компонентів препарату.
Для оцінки ефективності й переносимості крапель і сиропу Проспан діти основної групи були розподілені методом пар-копій на дві підгрупи (1а, n = 20; 1b, n = 19). Діти основної групи отримували лікування відповідно до наказу МОЗ України № 868 [13] і додатково Проспан у вигляді крапель (1а підгрупа) і сиропу (1b підгрупа). Проспан сироп призначався по 5 мл, краплі — по 16 крапель (дітям 6–9 років) і 24 краплі (дітям 10–12 років) 3 рази на добу. Дітям групи порівняння (2-га група, n = 34) призначалась стандартна терапія. Контрольну групу становили 20 практично здорових дітей відповідного віку.
Усі діти, взяті під спостереження, були ідентичні за віком, статтю й тяжкістю перебігу БА.
Дизайн дослідження відповідав моделі відкритого рандомізованого проспективного порівняльного дослідження і включав візити: скринінгу, лікувального періоду (на 3–4-й і 8–10-й день лікування) й етапу спостереження протягом 2 тижнів. Дослідження було проведене за період із лютого по жовтень 2016 року.
Критеріями ефективності проведеного лікування були: регрес основних клінічних проявів хвороби (задишка, частота і характер кашлю, кількість мокротиння, аускультативні дані в легенях, потреба в b2-агоністах короткої дії), динаміка показників спірометрії з використанням бронхолітичної проби із сальбутамолом (200–400 мкг), зміни клітинного складу індукованого мокротиння (ІМ).
Одночасно з ретельним вивченням анамнезу захворювання й життя, даних клінічного огляду проводився комплекс клініко-функціональних досліджень, що включав оцінку загальноклінічних аналізів крові, сечі, біохімічних досліджень і даних 12-канальної електрокардіографії (ЕКГ).
Клінічні прояви захворювання були ранжирувані залежно від їх інтенсивності за бальною шкалою: 0 балів — відсутність ознаки, 1 бал — незначна інтенсивність ознаки або симптому, 2 бали — помірна, 3 бали — виражена.
Дослідження функції зовнішнього дихання (ФЗД) проводилось на спірографі BTL Type № 2003110660 на основі Mіcro Quark. За допомогою спірографії вивчались загальноприйняті статистичні (легеневі об’єми) та функціональні показники легеневої вентиляції. Реєстрація показників здійснювалась у відсотках від належних значень згідно з нормативом Європейського респіраторного товариства (1993), що обчислювалось автоматично комп’ютерною програмою спірографа. Нормальними вважались показники, що становили 80–120 % від належних.
З метою оцінки запальних змін дихальних шляхів проводили цитологічне дослідження індукованого мокротиння за спрощеною методикою, яка була нами розроблена й запатентована («Спосіб діагностики запальних змін дихальних шляхів у дітей із захворюваннями органів дихання» [14]).
Статистична обробка отриманих результатів дослідження здійснювалася з використанням статистичних програм.
Результати та обговорення
Серед обстежених дітей переважали діти 8–12 років (73,9 %), за статтю — хлопчики (69,8 %). Середня тривалість захворювання становила 3,90 ± 0,50 року.
Особливостями перебігу загострення БА в обстежених дітей була наявність: зв’язку з гострою респіраторною інфекцією, диспное — у 100,0 % хворих, субфебрилітету — у 14 (19,2 %), сухого кашлю — 61 (83,6 %) і малопродуктивного кашлю — 12 (16,4 %), аускультативних змін у легенях у вигляді сухих свистячих хрипів — 33 (45,2 %) і сухих і різнокаліберних вологих хрипів — 40 (54,8 %). Вірусологічними дослідженнями встановлено, що в 62 (84,9 %) обстежених хворих мала місце інфікованість респіраторними вірусами (аденовірус, парагрип, RS-вірус).
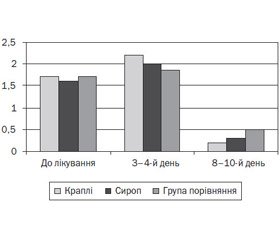
Згідно з результатами проведених досліджень, у дітей основної групи, які отримували краплі й сироп Проспан, мала місце більш виражена позитивна динаміка основних клінічних проявів загострення захворювання порівняно з другою групою (рис. 2).
Так, на 3-тю — 4-ту добу від початку лікування реєструвались зменшення частоти кашлю й зміна його характеру на продуктивний, відсутність диспное порівняно з дітьми 2-ї групи (р < 0,05). На 8–10-й день лікування в дітей основної групи (підгрупи 1а, 1b) відмічався епізодичний продуктивний кашель, аускультативно вислуховувалось жорстке дихання. У 18 (52, 9 %) дітей групи порівняння протягом лікувального етапу реєструвався малопродуктивний кашель, при аускультації легень вислуховувались сухі й вологі хрипи. З огляду на збереження клінічних проявів бронхообструкції ці діти потребували корекції лікування (призначення більш тривалого застосування b2-агоністів короткої дії, бронхолітика комбінованої дії, збільшених доз ІГКС, муколітичних засобів).
Відповідно до покращення основних симптомів хвороби в дітей обох підгруп основної групи зменшувалась частота застосування b2-агоністів короткої дії, що може пояснюватись збільшенням доступних b2-рецепторів і бронхолітичним ефектом мукоактивного препарату Проспан. Потреба в призначенні b2-агоністів короткої дії в обстежених дітей відображена в табл. 2.
Згідно з отриманими даними, на 3-тю — 4-ту добу лікування лише 5 (25,0 %) дітей підгрупи 1а і 4 (21,1 %) дитини підгрупи 1b застосовували бронхолітичну терапію. Діти групи порівняння потребували більш тривалого застосування даної терапії.
Проведене спірометричне дослідження встановило, що у 8 (40,0 %) дітей підгрупи 1а, 6 (31,6 %) пацієнтів підгрупи 1b і 11 (32,4 %) хворих 2-ї групи спостереження реєструвались легкі обструктивні порушення (FEV1/FVC по групах — 87,4 ± 1,4 %, 87,5 ± 1,3 %, 82,7 ± 2,6 % відповідно). У третини дітей усіх груп спостереження з нормальними показниками легеневої функції на початку лікування при проведенні бронходилатаційної проби з сальбутамолом визначався латентний бронхоспазм.
Про адекватність проведеного лікування в обстежених дітей свідчила позитивна динаміка показників ФЗД (табл. 3).
Так, у дітей усіх груп спостереження після лікування реєструвались нормальні показники ФЗД. При цьому не встановлено вірогідних відмінностей у динаміці лікування дітей усіх груп, окрім показника пікової об’ємної швидкості потоку при проведенні пікфлоуметрії в дітей підгрупи 1а. Відсутність значимих відмінностей у динаміці основних спірометричних показників можна пояснити вихідними нормальними середньостатистичними показниками легеневої функції в обстежених дітей і коротким терміном спостереження. Слід зазначити, що в 9 (26, 5 %) дітей групи порівняння після лікування зберігались ознаки латентного бронхо–спазму (проти 2 (10,0 %) дітей підгрупи 1а і 2 (10,5 %) дітей підгрупи 1b, p < 0,05). Отримані дані щодо динаміки показників ФЗД у дітей основної групи можуть свідчити про посилення бронхолітичного ефекту комплексного лікування із застосуванням препарату Проспан як у формі крапель, так і у формі сиропу.
З метою оцінки динаміки запальних змін дихальних шляхів у обстежених дітей нами вивчався цитологічний склад індукованого мокротиння. У табл. 4 подано клітинний склад індукованого мокротиння обстежених дітей на тлі лікування.
Згідно з результатами проведених досліджень у дітей з БА відмічалося вірогідне збільшення загальної абсолютної кількості ефекторних клітин (нейтрофілів, лімфоцитів, еозинофілів, базофілів, епітеліальних клітин), що беруть участь у запаленні дихальних шляхів. При оцінці типів цитограм було встановлено, що для дітей із БА характерним був е–озинофільний субтип запалення. При аналізі клітин бронхіального епітелію в більшості обстежених дітей виявлено відносне збільшення келихоподібних і зменшення війкових клітин при збільшенні їх дистрофії до 78,50 ± 3,50 % (у конт–ролі — 23,45 ± 1,21 %, р < 0,05). Це вказує на структурно-функціональну перебудову війкових клітин слизової оболонки респіраторного тракту й збільшену продукцію муцинів за рахунок посилення запалення, що значно порушує роботу мукоциліарного транспорту при загостренні БА у дітей.
На тлі комплексної терапії із застосуванням препарату Проспан у дітей підгрупи 1а порівняно із хворими підгрупи 1b і пацієнтами 2-ї групи спостереження вірогідно зменшувалася відносна кількість епітеліоцитів, еозинофілів, базофілів і підвищувалась кількість лімфоцитів, що свідчило про зменшення інтенсивності алергічного запалення. У дітей підгрупи 1b і 2-ї групи спостерігалась позитивна динаміка щодо кількості зазначених клітин в ІМ, але не реєструвалось вірогідних відмінностей. Більш виражена динаміка кількості еозинофілів і базофілів ІМ дітей підгрупи 1а може бути пояснена більшою біодоступністю форми крапель Проспан і свідчить про посилення протизапального ефекту проведеного лікування.
Клінічна ефективність проведеного лікування в дітей основної групи оцінена як «значне покращення» (контроль симптомів загострення) у 76,7 % хворих, «покращення» — у 15,1 % і «без покращення» — у 6,8 %. Моніторинг клініко-біохімічних, ЕКГ-показників на тлі лікування із застосуванням двох форм препарату Проспан у досліджуваних дітей не виявив вірогідно значущих побічних реакцій, що свідчило про добру його переносимість. Усі діти відмітили добрі смакові якості як сиропу, так і крапель.
Отже, застосування як додаткової мукоактивної терапії двох форм (крапель або сиропу) препарату Проспан сприяло більш швидкому регресу основних клінічних симптомів загострення БА у дітей за рахунок посилення бронхолітичного й протизапального ефекту стандартного лікування, покращення мукоциліарного транспорту й мукокінетичного ефекту.
Висновки
1. Загострення БА у дітей легкого й середьотяжкого ступеня характеризується вираженими запальними змінами в слизовій оболонці бронхів, легкими обструктивними порушеннями легеневої функції або латентним бронхоспазмом у третини хворих.
2. Застосування двох форм препарату Проспан (краплі, сироп) у комплексному лікуванні дітей із загостренням БА легкого й середьотяжкого ступеня позитивно впливає на клінічний перебіг захворювання, сприяє більш швидкому регресу основних клінічних проявів бронхообструкції, знижує потребу в застосуванні b2-агоністів короткої дії, що пов’язано з його бронхолітичним, мукокінетичним і непрямим протизапальним ефектом.
3. Ефективність і добра переносимість препарату в обстежених дітей дозволяє рекомендувати Проспан для широкого застосування в клінічній практиці при лікуванні дітей із бронхообструктивними захворюваннями.
Конфлікт інтересів. Не заявлений.
1. Аналіз захворюваності та поширеності бронхіальної астми в дітей різних вікових груп по регіонах України / Ю.Г. Антипкін [та ін.] // Перинатология и Педитария. — 2016. — № 1(65). — С. 95-99.
2. Global strategy for asthma management and prevention. National institutes of health. National Heart, lung and Blood Institute. Revised 2016 [Електронний ресурс]. — Режим доступу: http://www.ginasthma.org.
3. Bruce K. Rubin Secretion properties, clearance, and therapy in airway disease [Електронний ресурс] / K.R. Bruce // Translational Respiratory Medicine. — 2014. — 2. — 6. — Режим доступу: http://www.transrespmed.com/content/2/1/6.
4. Evans C.M. Mucus hypersecretion in ashma: causes and effects / C.M. Evans [et al.] // Curr. Opin. Pulm. Med. — 2009. — Vol. 15(1). — P. 4-11.
5. Lauren C. Mucus in chronic airway diseases: sorting out the sticky details / C. Lauren // The Journal of Clinical Investigation. — 2006. — Vol. 116. — P. 306-308.
6. Rogers D.F. Airway mucus hypersecretion in asthma: an undervalued pathology? / D.F. Rogers // Curr. Opin. Pharmacol. — 2004. — Vol. 4. — P. 241-250.
7. Chronic cough and sputum production are associate with wors clinical outcomes in stable asthma / N.C. Thomson [et al.] // Respiratory Medicine. — 2013. — Vol. 107. — P. 1501-1508.
8. Increased sputum and bronchial biopsy IL-13 expression in severe asthma / S.K. Saha [et al.] // J. Allergy Clin. Immunol. — 2008. — Vol. 121. — P. 685-691.
9. a-Hederin inhibits G protein-coupled receptor kinase 2-mediated phosphorylation of b2-adrenergic receptors / J. Schulte-Michels [et al.] // Phytomedicine. — 2016. — Vol. 23. — P. 52-57.
10. Lang C. A Valuable Option for the Treatment of Respiratory Diseases: Review on the Clinical Evidence of the Ivy Leaves Dry Extract EA 575® / C. Lang, P. Röttger-Lüer, C. Staiger // Planta Med. — 2015. — Vol. 81. — P. 968-974.
11. Ivy Leaves dry extract EA 575 decreases LPS-induced IL-6 release from murine macripohges / J. Schulte-Michels [et al.] // Pharmazie. — 2016. — Vol. 71. — P. 158-161.
12. Zeil S. Tolerance and effect of an add-on treatment with a cough medicine containing ivy leaves dry extract on lung function in children with bronchial asthma / S. Zeil, U. Schwanebeck, C. Vogelberg // Phyto medicine. — 2014. — Vol. 21b. — P. 1216-1220.
13. Наказ МОЗ України від 08.10.2013 № 868 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при бронхіальній астмі». Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) медичної допомоги «Бронхіальна астма у дітей» [Електронний ресурс]. — 2013. — Режим доступу: http://www.dec.gov.ua/mtd/reestr.html.
14. Патент № 67055. МПК (2011.01) А61В10/00 Спосіб діагностики запальних змін дихальних шляхів у дітей з захворюваннями органів дихання / Антипкін Ю.Г. [та ін.]. — № 2011 09545 від 29.07.2011, заявл. 29.07.11; опубл. 25.01.12, Бюл. № 2.

/19-1.jpg)
/20-1.jpg)
/22-1.jpg)
/23-1.jpg)