Журнал «Здоровье ребенка» Том 14, №1, 2019
Вернуться к номеру
Хронічна Helicobacter pylori-асоційована інфекція у дітей, парацелюлярна проникність слизової оболонки шлунка та харчова алергія
Авторы: Абатуров О.Є., Ликова А.Е.
ДЗ «Дніпропетровська медична академія», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Питання, пов’язані з дисфункцією щільних контактів, протягом останніх років є одними з найбільш актуальних і таких, що вивчаються, у науковому світі. Незважаючи на вагомі досягнення, на сьогодні все ще залишаються відкритими багато проблем. У цьому огляді обговорюється молекулярна структура та регуляція щільних контактів слизової оболонки шлунка, роль бактерії Helicobacter pylori у розвитку харчової алергії у дітей, а також можливість медикаментозної регуляції парацелюлярної проникності слизової оболонки шлунка. Для написання статті здійснювався пошук інформації з використанням баз даних Scopus, Web of Science, MedLine, PubMed, Google Scholar.
Вопросы, связанные с дисфункцией плотных контактов, на протяжении последних лет являются одними из самых актуальных и изучаемых в научном мире. Несмотря на значительные достижения, на сегодняшний день все еще остаются открытыми многие проблемы. В этом обзоре обсуждается молекулярная структура и регуляция плотных контактов слизистой оболочки желудка, роль бактерии Helicobacter pylori в развитии пищевой аллергии у детей, а также возможность медикаментозной регуляции парацеллюлярной проницаемости слизистой оболочки желудка. Для написания статьи осуществлялся поиск информации с использованием баз данных Scopus, Web of Science, MedLine, PubMed, Google Scholar.
Currently, issues related to tight junction dysfunction, are one of the most relevant and studied in scientific world. In spite of significant achievements, many problems are still open today. This review discusses the molecular structure and regulation of stomach tight junctions, the relationship between Helicobacter pylori and food allergy in children and the possibility of pharmacological regulation of paracellular permeability of the gastric mucosa. To write the article, information was searched using Scopus, Web of Science, MEDLINE, PubMed and Google Scholar databases.
Helicobacter pylori; діти; харчова алергія; клаудини; щільні контакти; парацелюлярна проникність
Helicobacter pylori; дети; пищевая аллергия; клаудины; плотные контакты; парацеллюлярная проницаемость
Helicobacter pylori; children; food allergy; claudins; tight junctions; paracellular permeability
Вступ
Однією з актуальних проблем сучасної педіатрії є лікування й профілактика хронічних захворювань органів травлення. За поширенням хвороби шлунково-кишкового тракту займають друге місце після хвороб респіраторної системи у дітей. У структурі хронічних захворювань органів травлення дітей переважає патологія гастродуоденальної зони. Хронічний гастрит і гастродуоденіт — найпоширеніші форми хронічної гастродуоденальної патології у дітей, які становлять в структурі захворювань шлунка і дванадцятипалої кишки 58–74 % [1]. Основна частина хронічних гастритів (80–85 %) у дітей асоційована з інфікуванням бактерією Helicobacter pylori (Нр) [2, 3].
Профілактика, своєчасне виявлення та лікування вищезазначених патологій у дітей набуває все більшої актуальності з кожним днем. Це тісно пов’язано з такими проблемами. По-перше, відсутня тенденція до зниження захворюваності, що обумовлено толерантністю бактерії Helicobacter pylori до загальноприйнятих методів ерадикаційної терапії [4–6]. Наприклад, в Європейському педіатричному реєстрі лікування повідомили результати використання 27 різних схем у 518 дітей з Hр-інфекцією. Загальний рівень ерадикації бактерії Hр становить 65,6 % [7]. По-друге, це розвиток алергічної патології, пов’язаної з інфікованістю бактеріями Hр [8]. Наукові дослідження вказують на те, що бактерія Hр підвищує парацелюлярну проникність для харчових алергенів [9] за рахунок порушення щільних контактів слизової оболонки травного каналу [10].
1. Парацелюлярна проникність слизової оболонки шлунка
Ключовим механізмом, що регулює рівень парацелюлярної проникності слизової оболонки шлунка, є щільні міжклітинні контакти [11].
1.1. Щільні міжклітинні контакти слизової оболонки шлунка
Щільні контакти (TJ — tight junctions) являють собою мультипротеїнові комплекси, які складаються з численних трансмембранних і цитоплазматичних протеїнів, що утворюють безперервну структуру навколо апікальної поверхні плазматичної мембрани епітеліальних клітин слизової оболонки шлунка [12]. TJ демонструють широку варіабельність щільності в різних органах, починаючи від майже повного затягування параклітинної щілини для розчинених речовин, наприклад в сечовому міхурі, до формування параклітинних пор для специфічних катіонів (і аніонів), наприклад специфічні сегменти ниркових канальців [13].
Щільні контакти є захоплюючими структурами з точки зору їх функції і морфології. В 1963 році, використовуючи електронну мікроскопію ультратонкого розрізу, Farquhar і Palade описали структуру TJ разом з адгезивними контактами та десмосомами найближчої до просвіту сторони латеральної мембрани. З моменту відкриття щільні контакти піддавалися інтенсивному аналізу дослідників. Об’єднання морфологічних спостережень і фізіологічних вимірювань в різних типах епітеліальних клітин дало можливість обговорювати кореляцію між структурою і бар’єрною функцією щільних контактів. Однак у деяких випадках кореляція не була ідеальною. У той час не було ніякої інформації про молекулярну природу щільних контактів, і дослідники припустили, що кожен ланцюг щільного контакту в різних типах клітин є однаковим. На даний час ми знаємо, що комбінація типів клаудинів є важливим фактором для визначення бар’єрних властивостей щільних контактів [14].
1.2. Будова щільних міжклітинних контактів слизової оболонки шлунка
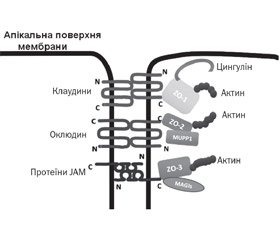
TJ являють собою розгалужену сітку білкових ниток на поверхні клітини, що з’єднують між собою розташовані поруч клітини. Кожна нитка утворена рядом трансмембранних протеїнів, вбудованими у плазматичні мембрани клітин, що прилягають одна до одної. На даний час ідентифіковано щонайменше 40 білків, що входять до складу щільних контактів (рис. 1) [15].
Ці білки поділяють на 4 групи: трансмембранні, полярні, протеїни цитоскелета і сигнальні білки. Трансмембранні білки TJ — це оклюдини, клаудини, трицелюлін, marvelD3 і молекули адгезії JAM (junctional adhesion molecule). Вони з’єднуються з різними протеїнами периферичної мембрани, які розташовані на внутрішньоклітинній стороні плазматичної мембрани та фіксують нитки з актиновим компонентом цитоскелета [15]. Трансмембранні білки в щільних контактах стабілізовані за допомогою периферичних каркасних білків: zonula occludens (ZO-1, ZO-2, ZO-3), цингулін, афадин, мембранозв’язана гуанілаткіназа з інвертованою орієнтацією 1 (білки MAG) і мульти-PDZ доменний протеїн 1 (MUPP-1), який пов’язаний з актиновим цитоскелетом та мікротрубочками [12, 17, 18].
1.3. Трансмембранні протеїни
Оклюдин (молекулярна маса близько 60 кДа) був першим інтегральним мембранним білком, який ідентифікували (вперше описаний Shoichiro Tsukita в 1993 році) [19], відноситься до TJ-асоційованої родини білків Marvel. Оклюдин має 4 трансмембранних та 3 цитоплазматичних домени. Обидва кінці білка (N та C) є внутрішньоклітинними. Цей протеїн утворює дві позаклітинні, а також одну внутрішньоклітинну петлю. Ці петлі допомагають регулювати параклітинну проникність [20]. Надекспресія оклюдину знижує проникність епітелію. У мишей з нокаутом гена оклюдину (occludin–/–) спостерігається збільшена проникність слизової оболонки і розвиток хронічного запалення [21]. Оклюдин є початковим рецептором для передачі сигналів ГТФази, а збільшення фосфорилювання оклюдину зменшує проникність TJ. Оклюдин пов’язаний з декількома клітинними білками і може модулювати активність апоптозу, зростання і проліферацію клітин [16]. На прикладі епітелію респіраторного тракту продемонстровано, що серинова протеаза Per a 10 — основний алерген тарганів — збільшує проникність епітелію за рахунок руйнування TJ-білків: ZO-1, оклюдину, що підсилює міграцію попередників дендритних клітин до епітеліального шару [22].
Клаудини належать до суперродини протеїнів, яка у людини налічує 27 невеликих трансмембранних білків з молекулярною масою від 20 до 27 кДа [23]. Молекули клаудинових протеїнів утворюють дві позаклітинних і одну внутрішньоклітинну петлю [24–26]. Перша позаклітинна петля складається в середньому з 53 амінокислот, а друга — трохи менша, з 24 амінокислот. N-кінець, як правило, дуже короткий (4–10 амінокислот), С-кінець змінюється в довжині від 21 до 63 і необхідний для локалізації цих білків у щільних контактах [27].
Вперше клаудини були названі в 1998 році японськими дослідниками M. Furuse і K. Tsukita з Кіотського університета. Назва «клаудин» походить від латинського слова claudere («закрити»), що свідчить про бар’єрну роль цих білків [28].
Клаудини зв’язуються з безліччю інших цитоплазматичних і позаклітинних протеїнів і беруть участь у регуляції параклітинної проникності, передачі клітинних сигналів, регуляції цикла клітини та підтримці полярності клітин [29].
Нещодавно було визначено кристалічну структуру клаудинів ссавців, яка виявила чотири трансмембранні спіралі, що лежать в основі та скріплюють унікальну бета-листову складку з першої та другої позаклітинних петель [30, 31].
Ці позаклітинні петлі містять 5 бета-ниток, які при правильному вирівнюванні в 2 безперервних антипаралельних ряди слугують для утворення структур «напівпари», кожна з яких містить дві варіабельні ділянки, які при вирівнюванні з сусідніми клітинами утворюють пори щільних контактів [31]. Модель, описана Suzuki і співавторами [31], передбачає, що заряди, які містяться у двох варіабельних ділянках у кожному димері клаудину, визначають характеристики селективної проникності. Функціонування клаудинів 1, 5, 3, 4, 8, 11, 14 і 19 посилює епітеліальний бар’єр, в той час як активність клаудинів 2, 7, 12 та 15 збільшує проникність епітелію, утворюючи іонні пори [29, 32].
Клаудини експресуються в усіх відомих епітеліальних тканинах. Крім того, у всіх епітеліях, імовірно, велика кількість різних клаудинів експресується одночасно. У шлунку щурів досліджували експресію клаудинів 2–5. Клаудин 3 найбільш сильно експресується в поверхневих епітеліальних клітинах шлунка, переважно вздовж базолатеральної мембрани, в той час як клаудин 4 експресується головним чином у щільних контактах в проксимальних шлункових залозах, а клаудин 5 однорідно експресується від основи залоз до їх поверхні і, подібно клаудину 3, розташовується на базолатеральной мембрані. Клаудин 2 не був виявлений у тканині шлунка. Крім того, відомо, що клаудини 12 і 23, а також клаудин 18 добре експресуються в шлунку людини [29].
На сьогодні саме клаудини домінують у наших уявленнях про регуляцію парацелюлярної проникністі [12], хоча раніше вважалося, що «герметичність» або «нещільність» щільного контакту залежить від кількості ниток у щільному контакті [26]. Хоча оклюдин експресується в епітеліальних клітинах шлунка та є трансмембранним протеїном TJ, однак він не бере участь у регуляції парацелюлярної проникності в шлунку [21].
Продемонстровано, що клаудинзалежне порушення функціонування щільних контактів призводить до транслокації алергенів, зокрема арахісу, через епітелій травного тракту [33].
Контактні адгезивні молекули (JAM) є частиною суперродини імуноглобулінів. Вони мають молекулярну масу ~ 40 кДа. Їх структура відрізняється від структури інших інтегральних білків мембрани тим, що вони мають лише один трансмембранний домен замість чотирьох. Це допомагає регулювати функцію парацелюлярного шляху щільних контактів і також бере участь у підтримці полярності клітин [34].
2. Порушення парацелюлярної проникності слизової оболонки шлунка, викликані бактеріями Helicobacter pylori
Два різні шляхи залучені до регуляції парацелюлярної проникності в щільних контактах. Перший шлях — у вигляді «пори», який дозволяє переміщення невеликих молекул, іонів і поживних речовин через щільний контакт разом з водою. «Поровий» шлях дозволяє зарядженим або незарядженим молекулам розмірами менше ніж приблизно 4 ангстреми перетинати щільні контакти, що регулюється експресією молекул клаудину. Другий шлях, або шлях «витоку», пропускає молекули розмірами понад 4 ангстреми крізь щільні контакти [15].
Доповіді, що описують бар’єрну дисфункцію при хелікобактерній інфекції, припускають, що уражені обидва шляхи. Доведено, що бактерія Helicobacter pylori:
— збільшує проникність, впливаючи таким чином на «поровий» шлях, враховуючи експресію молекул клаудину, композицію клаудинів у щільних контактах і величину парацелюлярного потоку;
— викликає невеликі розриви у нитках щільних контактів і таким чином збільшує потік сахарози (5,2 ангстрема) та інших молекул під час інфекції;
— пошкоджує епітеліальні клітини шлунка, що порушує цілісність щільних контактів [12].
Дослідники оцінили роль факторів вірулентності бактерії Hр у дисфункції щільних контактів. Так, на думку Tyler J. Caron та співавторів [12], найбільш надійні результати отримані в експерименті з уреазою та аміаком, які, як вважається, викликають перебудову цитоскелета TJ.
Крім того, дослідження Х. Song та співавторів [35] демонструє, що СagA(+) штами бактерії Hр мають більший руйнівний вплив на цілісність TJ слизової оболонки гастроінтестиналного тракту порівняно зі штамами бактерії Hр, які не мають у своєму геномі гена цитотоксина Cag A.
3. Активність щільних контактів і харчова алергія
На думку Duane R. Wesemann та Cathryn R. Nagler [36], алергічні захворювання можна розглядати як наслідок дисрегуляции епітеліального бар’єра слизової оболонки травного тракту, викликаної екзогенними факторами. Автори вважають, що підвищений вміст IgE, специфічних для харчових алергенів, виявляються у людей з атопією, що є віддзеркаленням зниження бар’єрної функції травного тракту. Підвищення проникності слизової оболонки травного тракту призводить до збільшення проникнення алергенів у системний кровообіг. Порушення бар’єрної функції в експериментальних мишей забезпечує зниження продукування IgA в слизовій оболонці і збільшенні синтезу IgE. Дефекти бар’єрної функції забезпечують посилення реакції на харчові алергени [37].
Підвищена парацелюлярна проникність корелює з тяжкістю клінічних симптомів алергічних захворювань. На моделі харчової алергії у мишей, викликаної овоальбуміном, продемонстровано, що підвищена проникність слизової оболонки травного тракту розвивається після стимуляції алергеном і супроводжується вираженою дегрануляцією тучних клітин слизової оболонки [38].
4. Медикаментозна регуляція активності щільних контактів
На сьогодні пробіотики є унікальним медикаментозним засобом, з клінічно показаним впливом на регулювання парацелюлярної проникності (табл. 1).
Останні дослідження показують, що бактерії Lactobacillus rhamnosus збільшують цілісність щільних контактів слизової оболонки органів травлення [39–45]. У сучасних роботах описується збільшення експресії протеїнів щільних контактів слизової оболонки травного каналу як результат впливу бактерій Lactobacillus rhamnosus [39].
Ми вважаємо, що існує можливість використання препаратів, які містять бактерії Lactobacillus rhamnosus, для медикаментозної регуляції парацелюлярної проникності слизової оболонки шлунка. Передбачається збільшення ефективності ерадикаційної терапії хронічної Helicobacter pylori-асоційованої інфекції у дітей, а також зменшення ефективності проявів харчової алергії.
Висновки
1. Дані сучасних досліджень свідчать, що бактерія Helicobacter pylori порушує цілісність щільних контактів. Це призводить до збільшення парацелюлярної проникності, зокрема для харчових алергенів.
2. Бактерії Lactobacillus rhamnosus збільшують щільність TJ, чим, вірогідно, зменшують парацелюлярну проникність слизової оболонки травного тракту.
3. Для медикаментозної регуляції активності парацелюлярної проникності слизової оболонки травного тракту і зниження ризику розвитку алергічних захворювань можливо клінічне використання препаратів, що містять бактерії Lactobacillus rhamnosus.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Уніфікований клінічний протокол медичної допомоги дітям із захворюваннями органів травлення: Наказ МОЗ України № 59 від 29.01.2013 // Современная педиатрия. — 2013. — № 4. — С. 20-31. doi: 10.15574/SP.
2. Абатуров О.Є., Герасименко О.М. Модуляція активності TLR4 епітеліоцитів слизової оболонки шлунка при хелікобактерній інфекції // Современная педиатрия. — 2009. — № 6(28). — С. 141-146.
3. Абатуров А.Е., Герасименко О.Н., Завгородняя Н.Ю. Хронические CagA(+) Helicobacter pylori-ассоциированные гастриты у детей (монография) — Х.: С.А.М., 2014. — 412 с.
4. Нехаєнко М.І. Сучасні уявлення про хронічні захворювання гастродуоденальної зони у дітей підліткового віку // Збірник наукових праць співробітників НМАПО ім. П.Л. Шупика. — 2016. — Вип. 25. — С. 638-644.
5. Бекетова Г.В. Хронічний гастродуоденіт у дітей і підлітків: епідеміологія, етіологія, патогенез, діагностика (частина І) // Дитячий лікар. — 2012. — №6. — С. 20-24.
6. Бекетова Г.В. Лікування хронічних гастродуоденітів у дітей і підлітків (частина ІІ) // Дитячий лікар. — 2012. — № 8. — С. 13-15.
7. Шадрин О.Г. Helicobacter pylori у детей: современные подходы к диагностике и пути оптимизации терапии // Современная педиатрия. — 2014. — № 5(61). — С. 119-127. doi:10.15574/SP.2014.61.119.
8. Shabrawy R.M., Gharib K. Helicobacter pylori infection as a risk factor in patients suffering from food allergy and urticaria // Egypt J. Immunol. — 2016 Jan. — № 23(1). — Р. 67-75. — PMID: 28502154.
9. Ma Z.F., Majid N.A., Yamaoka Y., Lee Y.Y. Food allergy and Helicobacter pylori infection: a systematic review // Front Microbiol. — 2016. — 7. — 368. doi: 10.3389/fmicb.2016.00368.
10. Roxas J.L., Viswanathan V.K. Modulation of intestinal paracellular transport by bacterial pathogens // Compr. Physiol. — 2018 Mar. — 8(2). — Р. 823-842. doi: 10.1002/cphy.c170034.
11. Zeisel M.B., Dhawan P., Baumert T.F. Tight junction proteins in gastrointestinal and liver disease // Gut. — 2018 Oct 8. — gutjnl-2018-316906. doi: 10.1136/gutjnl-2018-316906.
12. Tyler J. Caron, Kathleen E. Scott, James G. Fox, Susan J. Hagen Tight junction disruption: Helicobacter pylori and dysregulation of the gastric mucosal barrier // World J. Gastroenterol. — 2015 Oct 28. — 21(40). — Р. 11411-11427. doi: 10.3748/wjg.v21.i40.11411.
13. Gerd Krause, Lars Winkler, Sebastian L. Mueller, Rei–ner F. Haseloff, Jörg Piontek, Ingolf E. Blasig. Structure and function of claudins // Biochimica et Biophysica Acta (BBA) — Biomembranes. — 2008 March. — 3 — Р. 631-645. doi: 10.1016/j.bbamem.2007.10.018.
14. Mikio Furuse. Molecular Basis of the Core Structure of Tight Junction // Cold Spring Harb. Perspect Biol. — 2010 Jan. — 2(1). doi: 10.1101/cshperspect.a002907.
15. Anderson M. James, Christina M. Van Itallie. Physiology and function of the tight junction // Cold Spring Harbor Perspectives in Bio–logy. — 2009. — 1(2). doi: 10.1101/cshperspect.a002584.
16. Shi J., Barakat M., Chen D., Chen L. Bicellular Tight Junctions and Wound Healing // Int. J. Mol. Sci. — 2018 Dec. — 19(12). — 3862. doi: 10.3390/ijms19123862.
17. Christina M. Van Itallie, Anderson M. James. Architecture of tight junctions and principles of molecular composition // Semin. Cell Dev. Biol. — 2014 Dec. — Р. 157-65. doi: 10.1016/j.semcdb.2014.08.011.
18. Vermette D., Hu P., Canarie M.F., Funaro M., Glover J., Pierce R.W. Tight junction structure, function, and assessment in the critically ill: a systematic review // Intensive Care Med. Exp. — 2018 Sep. — 6(1). — 37. doi: 10.1186/s40635-018-0203-4.
19. Furuse M., Hirase T., Itoh M. et al. Occludin: a novel integral membrane protein localizing at tight junctions // J. Cell Biol. — 1993 Dec. — 123(6). — Р. 1777-1788.
20. Wolburg H., Lippoldt A. Tight junctions of the blood-brain barrier: development, composition and regulation // Vascul. Pharmacol. — 2002 Jun. — 38(6). — Р. 323-37. doi.org/10.1016/S1537-1891(02)00200-8.
21. Saitou M., Furuse M., Sasaki H. et al. Complex phenotype of mice lacking occludin, a component of tight junction strands // Mol. Biol. Cell. — 2000 Dec. — 11(12). — Р. 4131-42. doi: 10.1091/mbc.11.12.4131.
22. Kale S.L., Agrawal K., Gaur S.N., Arora N. Cockroach protease allergen induces allergic airway inflammation via epithelial cell activation // Sci Rep. — 2017 Feb 15. — 7. — 42341. doi: 10.1038/srep42341.
23. Günzel D. Claudins: vital partners in transcellular and paracellular transport coupling // Pflugers Arch. — 2017 Jan. — 469(1). — Р. 35-44. doi: 10.1007/s00424-016-1909-3.
24. Eveline E. Schneeberger, Robert D. Lynch. The tight junction: a multifunctional complex // Am. J. Physiol. Cell Physiol. — 2004 Jun. — 286(6). — Р. 1213-1228. doi: 10.1152/ajpcell.00558.2003.
25. Fanning Alan S., Mitic Laura L., Anderson J.M. Occludin and claudins: transmembrane proteins of the tight junction // J. Am. Soc. Nephrol. — 1999. — 10(6). — Р. 1337-1345. — PMID: 10361874.
26. Tsukita S., Furuse M., Itoh M. Multifunctional strands in tight junctions // Nat. Rev. Mol. Cell Biol. — 2001. — 2(4). — Р. 285-293. doi: 10.1038/35067088.
27. Rüffer C., Gerke V., The C-terminal cytoplasmic tail of claudins 1 and 5 but not its PDZ-binding motif is required for apical localization at epithelial and endothelial tight junctions // Eur. J. Cell Biol. — 2004 May. — 83(4). — Р. 135-44. doi: 10.1078/0171-9335-00366.
28. Furuse M., Fujita K., Hiiragi T., Fujimoto K., Tsukita K. Claudin-1 and -2: novel integral membrane proteins locali–zing at tight junctions with no sequence similarity to occludin // J. Cell Biol. — June 1998. — 141(7). — Р. 1539-50. doi: 10.1083/jcb.141.7.1539.
29. Günzel D., Yu S.A. Claudins and the modulation of tight junction permeability // Physiol. Rev. — 2013 Apr. — 93(2). — Р. 525-569. doi: 10.1152/physrev.00019.2012.
30. Suzuki H., Tani K., Tamura A., Tsukita S., Fujiyoshi Y. Model for the architecture of claudin-based paracellular ion channels through tight junctions // J. Mol. Biol. — 2015 Jan. — 427(2). — Р. 291-7. doi: 10.1016/j.jmb.2014.10.020.
31. Suzuki H., Nishizawa T., Tani K. et al. Crystal structure of a claudin provides insight into the architecture of tight junctions // Science. — 2014 Apr. — 344(6181). — Р. 304-7. doi: 10.1126/science.1248571.
32. Suzuki T. Regulation of intestinal epithelial permeability by tight junctions // Cell Mol. Life Sci. — 2013 Feb. — 70(4). — Р. 631-59. doi: 10.1007/s00018-012-1070-x.
33. Price D.B., Ackland M.L., Burks W., Knight M.I., Suphioglu C. Peanut allergens alter intestinal barrier permeability and tight junction localisation in Caco-2 cell cultures // Cell Physiol. Biochem. — 2014. — 33(6). — Р. 1758-77. doi: 10.1159/000362956.
34. Luissint A.C., Artus C., Glacial F., Ganeshamoorthy K., Couraud P.O. Tight junctions at the blood brain barrier: physiological architecture and disease-associated dysregulation // Fluids and Barriers of the CNS. — Dec 2012. — 9(1). — 23. doi: 10.1186/2045-8118-9-23.
35. Song X., Chen H.X., Wang X.Y. et al. H. pylori-encoded CagA disrupts tight junctions and induces invasiveness of AGS gastric carcinoma cells via Cdx2-dependent targeting of Claudin-2 // Cell Immunol. — 2013 Nov-Dec. — 286(1–2). — Р. 22-30. doi: 10.1016/j.cellimm.2013.10.008.
36. Wesemann D.R., Nagler C.R. The Microbiome, Timing, and Barrier Function in the Context of Allergic Disease // Immunity. — 2016 Apr 19. — 44(4). — Р. 728-38. doi: 10.1016/j.immuni.2016.02.002.
37. Stefka A.T., Feehley T., Tripathi P. et al. Commensal bacteria protect against food allergen sensitization // Proc. Natl. Acad. Sci. USA. — 2014 Sep 9. — 111(36). — Р. 13145-50. doi: 10.1073/pnas.1412008111.
38. Brandt E.B., Strait R.T., Hershko D. et al. Mast cells are required for experimental oral allergen-induced diarrhea // J. Clin. Invest. — 2003 Dec. — 112(11). — Р. 1666-77. doi: 10.1172/JCI19785.
39. Han X., Li J.Y., Huang S., Spence J., Owyang C. Soluble Protein P40 Produced by Lactobacillus RhamnosusGG Enhances Tight Junction Protein Expression and Improves Epithelial Integrity by Preventing Alteration of DNA Methylation and Histone Acetylation in Human Colonoids // Gastroenterology. — 2017 Apr. — 5(1). — 120. doi: 10.1016/S0016-5085(17)30738-2.
40. Blackwood B.P., Yuan C.Y., Wood D.R., Nicolas J.D., Grothaus J.S., Hunter C.J. Probiotic Lactobacillus Species Strengthen Intestinal Barrier Function and Tight Junction Integrity in Experimental Necrotizing Enterocolitis // J. Probiotics Health. — 2017 Apr. — 5(1). — 159. doi: 10.4172/2329-8901.1000159.
41. Orlando A., Linsalata M., Bianco G. et al. Lactobacillus rhamnosus GG Protects the Epithelial Barrier of Wistar Rats from the Pepsin-Trypsin-Digested Gliadin (PTG)-Induced Enteropathy // Nutrients. — 2018 Nov. — 10(11). — 1698. doi: 10.3390/nu10111698.
42. Carol Stephanie C. Tan-Lim, Natasha Ann R. Esteban-Ipac. Probiotics as treatment for food allergies among pediatric patients: a meta-analysis // World Allergy Organ. J. — 2018 Nov 6. — 11(1). — 25. doi: 10.1186/s40413-018-0204-5.
43. Fang S., Zhang Y., Zhang Y., Zhu X., Yie B. Lactobacillus rhamnosus GG improves symptoms and its mechnism in mice with ovalbumin-induced food allergy. — 2017 May. — 33(5). — 597-600. — PMID: 28502295.
44. Eshrati M., Amadei F., Staffer S., Stremmel W., Tanaka M. Shear-Enhanced Dynamic Adhesion of Lactobacillus rhamnosus GG on Intestinal Epithelia: Correlative Effect of Protein Expression and Interface Mechanics // Langmuir. — 2018 Dec 19. doi: 10.1021/acs.langmuir.8b02931.
45. Chen L., Li H., Li J., Chen Y., Yang Y. Lactobacillus rhamnosus GG treatment improves intestinal permeability and modulates microbiota dysbiosis in an experimental model of sepsis // Int. J. Mol. Med. — 2019 Jan 7. — Р. 1139-1148. doi: 10.3892/ijmm.2019.4050.

/70-1.jpg)
/72-1.jpg)