Журнал «Здоровье ребенка» Том 14, №2, 2019
Вернуться к номеру
Порівняння динаміки біомаркерів нейронспецифічної єнолази та протеїну S-100 у немовлят із гіпоксично-ішемічною енцефалопатією залежно від початку проведення лікувальної гіпотермії (0–6 годин та 6–24 години після пологів)
Авторы: Сурков Д.М.
КЗ «Дніпропетровська обласна дитяча клінічна лікарня ДОР», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Актуальність. На сьогодні залишається не з’ясованою відповідність абсолютних сироваткових концентрацій нейронспецифічної єнолази (NSE) та протеїну S-100 ступеню тяжкості та можливим наслідкам гіпоксично-ішемічної енцефалопатії (ГІЕ), а також динаміка цих показників протягом гострого періоду ГІЕ залежно від початку проведення лікувальної гіпотермії. Мета: дослідити динаміку сироваткових показників нейронспецифічної єнолази та протеїну S-100 у доношених новонароджених протягом гострого періоду ГІЕ залежно від початку проведення лікувальної гіпотермії. Матеріали та методи. Проспективне одноцентрове когортне дослідження у 205 доношених немовлят, які у 2012–2017 рр. перебували на лікуванні у відділенні анестезіології та інтенсивної терапії для новонароджених із діагнозом «гіпоксично-ішемічна енцефалопатія». Діти були стратифіковані за часом від народження до надходження до відділення інтенсивної терапії (ВАІТН). Були досліджені сироваткові концентрації нейронспецифічної єнолази та протеїну S-100 у 1, 3 та 5-й день лікування як загалом в усій когорті, так і в групах: 0–6 годин (група 1, n = 56) та понад 6 годин після народження (група 2, n = 149). Результати. Динаміка S-100 була суттєвою протягом 5 днів в межах обох груп новонароджених (p < 0,001). Проте не було знайдено вірогідної відмінності у тенденції змін концентрації протеїну S-100 протягом перших 5 днів в обох групах (р = 0,082). Також не було статистично значущої різниці між пацієнтами, які надійшли в перші 6 годин і пізніше щодо значення S-100 (р = 0,320) протягом усіх п’яти днів, за винятком першого дня при надходженні (р = 0,002). Не було знайдено статистично значущої різниці рівня NSE в межах груп як у динаміці від 1-го до 5-го днів (р = 0,217), так і щодо раннього (0–6 годин) або пізнього (понад 6 годин) надходження до ВАІТН (р = 0,845). Немає також вірогідної відмінності концентрації NSE поміж групами (р = 0,719). Висновки. Відсутність вірогідної відмінності динаміки рівня протеїну S-100 та NSE у новонароджених до 6 годин від народження та пізніше свідчить про можливість застосування лікувальної гіпотермії в термін понад 6 годин після пологів, якщо з організаційних причин її не було розпочато раніше.
Актуальность. Сегодня остается невыясненным соответствие абсолютных сывороточных концентраций нейронспецифической енолазы (NSE) и протеина S-100 степени тяжести и возможным последствиям гипоксически-ишемической энцефалопатии (ГИЭ), а также динамика этих показателей на протяжении острого периода ГИЭ в зависимости от времени начала проведения лечебной гипотермии. Цель: исследовать динамику сывороточных показателей нейронспецифической енолазы и протеина S-100 у доношенных новорожденных в течение острого периода ГИЭ в зависимости от времени начала проведения лечебной гипотермии. Материалы и методы. Проспективное одноцентровое когортное исследование 205 доношенных младенцев, которые в 2012–2017 гг. находились на лечении в отделении анестезиологии и интенсивной терапии для новорожденных с диагнозом «гипоксически-ишемическая энцефалопатия». Дети были стратифицированы по времени от рождения до поступления в отделение интенсивной терапии (ОАИТН). Были исследованы сывороточные концентрации нейронспецифической енолазы и протеина S-100 в 1, 3 и 5-й день лечения как в целом во всей когорте, так и в группах: 0–6 часов (группа 1, n = 56) и более 6 часов после рождения (группа 2, n = 149). Результаты. Динамика S-100 была существенной в течение 5 дней в обеих группах новорожденных (p < 0,001). Однако не было найдено достоверного различия в тенденции изменения концентрации протеина S-100 в течение первых 5 дней в обеих группах (р = 0,082). Также не было статистически значимой разницы между пациентами, поступившими в первые 6 часов и позже, относительно значения S-100 (р = 0,320) в течение всех пяти дней, за исключением первого дня при поступлении (р = 0,002). Не было найдено статистически значимой разницы уровня NSE в группах как в динамике от 1-го до 5-го дней (р = 0,217), так и относительно раннего (0–6 часов) или позднего (более 6 часов) поступления в ОАИТН (р = 0,845). Нет также достоверного различия концентрации NSE между группами (р = 0,719). Выводы. Отсутствие достоверного различия динамики уровня протеина S-100 и NSE у новорожденных до 6 часов и после от момента рождения свидетельствует о возможности начала проведения лечебной гипотермии более чем через 6 часов после родов, если по организационным причинам ее не успели начать раньше.
Background. To date, it remains unclear whether serum levels of neuron-specific enolase (NSE) and S-100 protein definitely correspond to the severity and possible outcomes of hypoxic-ischemic encephalopathy (HIE), as well as their dynamics during the acute period of HIE, depending on the time when therapeutic hypothermia was started. The purpose was to evaluate the dynamics of such serum biomarkers as NSE and S-100 protein in full-term newborns during the acute period of HIE, depending on the time when therapeutic hypothermia was initiated. Materials and methods. A prospective, single-center cohort study was performed in 205 full-term infants treated in the neonatal intensive care unit (NICU) due to hypoxic-ischemic encephalopathy in 2012–2017. All the babies were stratified by the period from delivery to admission in the NICU. Serum concentrations of NSE and S-100 protein were determined on days 1, 3 and 5 of treatment both in the general cohort and in groups: 0–6 hours (group 1, n = 56) and over 6 hours of life (group 2, n = 149). Results. Dynamics of S-100 significantly changed during 5 days in both groups of newborns (p < 0.001). However, no significant difference was found in the trends of S-100 protein concentration during the first 5 days in both groups (p = 0.082). There was also no statistically significant difference between serum concentrations of S-100 (p = 0.320) in patients admitted in 0–6 hours and later for all five days, except for the first day of admission (p = 0.002). There was no statistically significant difference in NSE level within groups, both in the dynamics from day 1 to day 5 (p = 0.217) and compared to the early (0–6 h) or late (> 6 h) admission to the NICU (p = 0.845). There is also no significant difference in the concentration of NSE among the groups (p = 0.719). Conclusions. No significant differences in the dynamics of S-100 protein and NSE levels in newborns 0–6 hours and over 6 hours after delivery indicated the possibility of initiating therapeutic hypothermia 6 hours after birth, if it wasn’t started earlier because of organizing reasons.
новонароджені; гіпоксія; енцефалопатія; NSE; S-100; гіпотермія
новорожденные; гипоксия; энцефалопатия; NSE; S-100; гипотермия
newborns; hypoxia; encephalopathy; neuron-specific enolase; S-100; hypothermia
Дана стаття є частиною дисертаційної роботи, що планується на здобуття вченого ступеня доктора медичних наук «Нейроресусцитація та нейропротекція при тяжких перинатальних гіпоксично-ішемічних ураженнях головного мозку у доношених новонароджених». Шифр НДР (ДКР) ІН.03.11
Вступ
Тяжка гіпоксично-ішемічна енцефалопатія (ГIE) у даний час залишається основною причиною перинатальної смертності та розвитку неврологічного дефіциту різної тяжкості, таких як церебральний параліч, судоми, порушення зору, розумова відсталість, порушення здатності до навчання та епілепсія [1, 2]. Прогноз у дітей, які перенесли тяжку ГІЕ у неонатальному періоді, часто песимістичний й асоціюється із неврологічною інвалідизацією різного ступеня [3].
Діагностичні критерії ГІЕ в Україні регламентуються Наказом МОЗ від 28.03.2014 № 225 Уніфікований клінічний протокол «Початкова, реанімаційна і післяреанімаційна допомога новонародженим в Україні» та базуються на класифікації Sarnat (в модифікації A. Hill, J.J. Volpe, 1994).
Проте на сьогодні залишається відкритим питання прогнозу ступеня відновлення когнітивних функцій головного мозку, подальшого моторного та психоневрологічного розвитку та здатності до здобуття освіти в дітей, які перенесли середньотяжку або тяжку ГІЕ у неонатальному періоді. Серед діагностичних методів велика кількість дослідників приділяють увагу визначенню рівня сироваткових білків — маркерів ураження головного мозку [4, 5].
До останніх можна віднести нейронспецифічну єнолазу (NSE), білок S-100, гліальний фібрилярний кислий протеїн (Glial Fibrillary Acidic Protein), убіквітин карбокситермінальну гідролазу (Ubiquitin Carboxyl-terminal Hydrolase — UCH-L1), тау-протеїн, мікро-РНК, лактатдегідрогеназу та мозкову креатинкіназу [6, 7]. Між собою біомаркери відрізняються як специфічністю, так і чутливістю при різних варіантах пошкодження головного мозку [8]. Також для більшості з них відсутні порогові величини, які, з одного боку, прогностично корелювали би з наслідками ГІЕ, а з другого — дозволяли б визначити тяжкість ішемічного пошкодження в перші години або дні після народження.
Нашу увагу привернули можливості визначення біохімічних маркерів ураження головного мозку — нейронспецифічної єнолази та протеїну S-100 як найбільш досліджених та, за даними багатьох авторів, прогностично значущих в неонатальному періоді [9].
NSE — один із ферментів гліколізу (2-фосфо-D-гліцерато-гідроліаза), що існує у вигляді декількох димеризованих ізоферментів (aa, ab, ay, bb і yy), утворених із трьох субодиниць — a, b та y. Даний фермент був ідентифікований і вивчений у 70–80 рр. ХХ століття. За останній період накопичений великий експериментальний і клінічний матеріал, що стосується аналізу NSE в біологічних рідинах при гіпоксично-ішемічній енцефалопатії [10].
Фракція гліальних білків мозку, які продукуються головним чином астроцитами, була відкрита в 1965 році і названа S-100. Назва «S-100» пов’язана зі здатністю білка розчинятися в 100% розчині сульфату амонію при рН 7,2. Церебральний протеїн S-100 являє собою комбінацію двох тісно пов’язаних білків родини: S-100A1 (S-100a) та S-100B (S-100b). Білки S-100 синтезуються гліальними клітинами, а потім транспортуються в нейрони. Основна частина білків S-100В (до 85–90 % від загального вмісту в нервовій тканині) зосереджена в астроцитах; 10–15 % розташовані в нейронах, мінімальна кількість визначається в олігодендроцитах. Припускають, що біологічна роль S-100B є різною: у фізіологічних (наномолярних) концентраціях переважає нейротрофічний ефект у період розвитку або нервової регенерації, а у високих (мікромолярних) концентраціях можливі прояви нейротоксичних ефектів, як у гострому періоді ГІЕ [11–13].
На сьогодні доведений зв’язок нейронспецифічної єнолази та протеїну S-100 з клінічними проявами та віддаленими наслідками неонатальної ГІЕ [14], але залишається не з’ясованою динаміка цих показників протягом гострого періоду ГІЕ залежно від початку проведення лікувальної гіпотермії.
Мета: дослідити динаміку сироваткових показників нейронспецифічної єнолази та протеїну S-100 у доношених новонароджених протягом гострого періоду ГІЕ залежно від початку проведення лікувальної гіпотермії.
Матеріали та методи
Було проведене проспективне одноцентрове когортне дослідження у 205 доношених немовлят, які у 2012–2017 рр. перебували на лікуванні у відділенні анестезіології та інтенсивної терапії для новонароджених (ВАІТН) КЗ «Дніпропетровська обласна дитяча клінічна лікарня ДОР» з діагнозом «тяжка гіпоксично-ішемічна енцефалопатія» (P91.6 за МКХ-10).
Критерії включення: доношені новонароджені гестаційного віку 37–42 тижні та масою тіла ≥ 2500 г. з оцінкою за Апгар при народженні менше 7 балів та оцінкою за Sarnat II–III ст., післянатальний вік — до 72 годин після пологів.
Критерії виключення: уроджені вади розвитку серця та центральної нервової системи, нейроінфекції, підтверджені пологові травми, гестаційний вік < 37 тижнів, маса тіла при народженні < 2500 г, післянатальний вік — більше 72 годин після пологів.
Діагноз «гіпоксично-ішемічна енцефалопатія» встановлювався відповідно до Наказу МОЗ України від 08.06.2007 року № 312 «Про затвердження клінічного Протоколу з первинної реанімації та післяреанімаційної допомоги новонародженим» та Наказу МОЗ України від 28.03.2014 року № 225 «Уніфікований клінічний протокол «Початкова, реанімаційна та післяреанімаційна допомоги новонародженим в Україні» за шкалою Sarnat (H.B. Sarnat, M.S. Sarnat, 1976, у модифікації A. Hill, I.I. Volpe, 1994).
Всім дітям проводилась рутинна інтенсивна терапія відповідно до Наказу МОЗ України від 28.03.2014 року № 225 «Уніфікований клінічний протокол «Початкова, реанімаційна та післяреанімаційна допомога новонародженим в Україні», що включала раннє застосування терапевтичної гіпотермії 33–35 °С протягом 72 годин із використанням простих засобів охолодження з сервоконтролем стравохідної температури.
Етапи дослідження: при надходженні до ВАІТН, на 3-тю та 5-ту добу лікування.
Сироваткова концентрація нейронспецифічної єнолази та протеїну S-100 вимірювалась імунохімічним методом з електрохемілюмінесцентною детекцією (ECLIA, лабораторія Synevo, GCLP 2011, ISO 9001:2000, сертифікат акредитації МОЗ України № 012850). Референтними показниками відповідно до стандартів лабораторії вважались діапазони норми для NSE до 16,3 нг/мл, для протеїну S-100 — до 0,105 мкг/л. За даними J. Simon-Pimmel et al. (2017), у новонароджених та малюків до 1 місяця життя верхньою межею норми вважається рівень протеїну S-100 до 0,51 мкг/л, а за даними A. Abbasoglu et al. (2015), нормативною величиною концентрації NSE у доношених здорових немовлят є 18,06 ± 12,83 нг/мл (95% СІ 13,94–22,19 нг/мл) [15, 16].
Діагноз церебральної лейкомаляція встановлювався попередньо на підставі нейросонографічного скринінгу апаратом Sonosite Titan (США) мікроконвексним датчиком із частотою 5–8 МГц; за наявності ультразвукових ознак діагноз остаточно підтверджувався після проведення КТ-/МРТ-сканування.
Статистичну обробку матеріалів дослідження було проведено з використанням пакета програмного забезпечення JASP 0.9.0.1 (Амстердам, Нідерланди, 2018) відповідно до загальноприйнятих стандартів математичної статистики.
Перед статистичною обробкою всі дані були перевірені на нормальність розподілу із застосуванням W-тесту Шапіро — Вілка. Для непараметричних даних первинна статистична обробка включала розрахунок медіани, 25% та 75% перцентилів. Для статистичного порівняння значень досліджуваних груп використовували U-критерій Манна — Уїтні (Mann — Whitney U-test). Динаміка зміни показників оцінювалась із застосуванням знакового рангового критерію Вілкоксона. Для визначення вірогідності впливу на досліджуваний результативний показник кожного із факторів був проведений мультиваріантний дисперсійний аналіз ANOVA. Критерій р < 0,05 був прийнятий як значущий в усіх тестах.
Результати
Всього проаналізовані результати лікування 205 доношених новонароджених, середній гестаційний вік у тижнях становив 39,6 ± 1,4 [37–42], вага при народженні у грамах — 3573 ± 549 (2440–5300). За статевою ознакою 128 немовлят (62,4 %) — хлопчики та 77 (37,6 %) — дівчатка. У перші 0–6 годин від народження до відділення надійшли 56 дітей (27,4 %), в період 6–24 години — 144 (70,2 %), 24–72 години — 5 (2,4 %). 28-денна летальність становила 3 з 205 дітей (1,46 %). У 82 випадках (40 %) відбулися перші пологи, у 123 (60 %) — повторні. Частота кесарських розтинів становила 42 з 205 немовлят (20,5 %). З 42 народжених кесарським розтином 17 (40,5 %) вперше народжені та 25 (59,5 %) при повторних пологах (р = 0,994). Оцінка за Апгар становила на 1-й хвилині 4,04 ± 2,27 бала; на 5-й хвилині — 5,88 ± 1,82 бала; на 20-й хвилині (n = 56) — 6,29 ± 1,19 бала. При надходженні дітям визначався рівень лактату, що становив 7,93 ± 5,44 (0,9–25,1) ммоль/л, що дозволило підтвердити факт перенесеної анте- та інтранатальної гіпоксії.
Результати вимірювання сироваткових концентрацій біомаркерів NSE та протеїну S-100 в досліджуваній популяції подані в табл. 1.
З наведених в табл. 1 даних видно, що сироваткова концентрація біохімічних маркерів ураження головного мозку в усіх новонароджених із діагнозом ГІЕ істотно перевищувала нормативні референтні лабораторні значення.
Для порівняння динаміки сироваткових концентрацій досліджуваних біомаркерів залежно від початку проведення лікувальної гіпотермії всі немовлята були стратифіковані за часом надходження до ВАІТН на групи: 0–6 годин (група 1, n = 56) та понад 6 годин після народження (група 2, n = 149).
Результати мультиваріантного дисперсійного аналізу ANOVA динаміки показника протеїну S-100 в досліджуваних групах подані в табл. 2.
Динаміка S-100 була суттєвою протягом 5 днів в обох групах новонароджених (p < 0,001). Проте не було знайдено вірогідної відмінності у тенденції змін концентрації протеїну S-100 протягом перших 5 днів в обох групах (р = 0,082). Також не було статистично значущої різниці між пацієнтами, які надійшли в перші 6 годин і пізніше щодо значення S-100 (р = 0,320) протягом усіх п’яти днів, за винятком першого дня при надходженні
(рис. 1).
Дані, подані на рис. 1, демонструють вірогідну відмінність рівня протеїну S-100 поміж немовлятами, які надійшли до ВАІТН протягом перших 6 годин та пізніше (p = 0,002), але на 3-й та 5-й день вірогідної різниці не знайдено. Це свідчить про те, що сироваткова концентрація S-100 відображає та більше залежить від вихідного ступеня гіпоксично-ішемічного пошкодження головного мозку в новонароджених, аніж від інтенсивної терапії в гострому періоді ГІЕ.
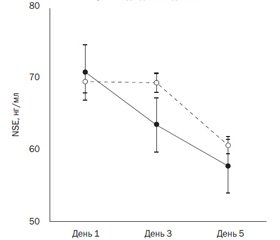
Результати мультиваріантного дисперсійного аналізу ANOVA динаміки показника NSE в досліджуваних групах наведені в табл. 3 та на рис. 2.
Не було знайдено статистично значущої різниці рівня NSE в групах як у динаміці від 1-го до 5-го днів (р = 0,217), так і щодо раннього (0–6 годин) або пізнього (понад 6 годин) надходження до ВАІТН (р = 0,845). Немає також вірогідної відмінності концентрації NSE поміж групами (р = 0,719).
Дані, наведені на рис. 2, демонструють, що пацієнти, які надійшли до ВАІТН протягом перших 6 годин, мали більш низький рівень NSE, ніж ті, які надійшли пізніше 6 годин, але ця різниця не є статистично вірогідною.
Обговорення
Таким чином, отримані результати показали, що в гострому періоді гіпоксично-ішемічної енцефалопатії в доношених новонароджених сироваткові концентрації біомаркерів ураження головного мозку — протеїну S-100 та NSE істотно перевищують референтні значення з перших годин після народження і залишаються вищими від нормативних до 5-ї доби життя. Це підтверджує їх діагностичну значущість у гострому періоді ГІЕ, з одного боку [10, 11], а з іншого — фактично є вірогідним доказом перенесеної немовлятами гострої гіпоксії — ішемії в анте- та інтранатальному періоді [14].
Але не знайдено значущої відмінності динаміки обох маркерів залежно від того, коли була розпочата спеціалізована інтенсивна терапія, в тому числі лікувальна гіпотермія. Це свідчить про можливість розпочинати терапевтичну гіпотермію навіть пізніше 6 годин після народження, що збігається з результатами робіт A.R. Laptook, S. Shankaran et al. (2017), які в мультицентровому дослідженні з квітня 2008 по червень 2016 р. в 21 центрі на території США проводили лікувальну гіпотермію 83 немовлятам у терміні 6–24 години після народження, групу контролю становили 85 дітей. За результатами цього дослідження гіпотермія, розпочата протягом 6–24 годин після пологів, знижувала у 76 % пацієнтів ймовірність смерті/тяжкого неврологічного дефіциту (RR 0,86; 95% CI 0,58–1,29) [17]. Також така думка підтверджується результатами робіт E. Smit et al. (2015) та S.L. Bourque, R.M. Dietz (2018) [18, 19].
Щодо діагностичної та прогностичної значущості, то за результатами проведеного аналізу більш важливим було вимірювання рівня протеїну S-100, про що також говорять опубліковані дані М. Zaigham et al. (2017) та G.M. El-Meshad et al. (2017) [20, 21].
До сьогодні у світі продовжуються дослідження можливості використання сироваткових біомаркерів при проведенні інтенсивної терапії помірної та тяжкої ГІЕ. I. Bersani et al (2015), проаналізувавши у своєму огляді опубліковані результати 104 досліджень різних біомаркерів, підтверджують діагностично значуще збільшення сироваткових концентрацій S-100 та NSE у немовлят із ГІЕ, які збігаються з відхиленнями патернів аЕЕГ та результатами МРТ-сканування [22]. Наукова група на чолі з A.N. Massaro (2018) опублікувала дані, які також стверджують, що істотне підвищення сироваткової концентрації S100B разом із біомаркерами Tau, UCH-L1, IL-1b, IL-6, IL-8, IL-10, IL-13, TNF-a та IFN-g корелює з відносно більшим ступенем ішемічного ураження мозку новонароджених за даними МРТ [23]. Результати мультицентрового обсерваційного дослідження, проведеного у 2012–2015 рр. S. Negro et al. (2018), продемонстрували діагностичну значущість таких маркерів, як розширені продукти білкового окислення (advanced oxidation protein products), залізо, не пов’язане з білками (non-protein-bound iron), і F2-ізопростан [24]. Зараз ще не опубліковані результати, але завершено набір пацієнтів у клінічному дослідженні референтних значень біомаркерів при неонатальній ГІЕ під керівництвом N. Copenhaver та M. Huene (2016) [25].
Висновки
1. Визначення сироваткових концентрацій біомаркерів ураження головного мозку — протеїну S-100 та нейронспецифічної єнолази в гострому періоді гіпоксично-ішемічної енцефалопатії в доношених новонароджених має вірогідне діагностичне значення.
2. Відсутність вірогідної відмінності динаміки рівня протеїну S-100 та NSE у новонароджених до 6 годин від народження та пізніше свідчить про можливість застосування лікувальної гіпотермії в термін понад 6 годин після пологів, якщо з організаційних причин її не було розпочато раніше.
Відповідність до етичних стандартів. Дослідження схвалене локальним етичним комітетом КЗ «Дніпропетровська обласна дитяча клінічна лікарня ДОР», протокол № 5 від 21 лютого 2011 року.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті. Зовнішнього джерела фінансування робота не має.
1. Allanson E. Classifying the causes of perinatal death / E. Allanson, Ö. Tunçalp, J. Gardosi et al. // Bull. World Health Organ. — 2016. — Vol. 94(2). — P. 79-79A. doi: 10.2471/BLT.15.168047.
2. Arnaez J. Incidence of hypoxic-ischaemic encephalopathy and use of therapeutic hypothermia in Spain / J. Arnaez, A. García-Alix, G. Arca, et al; Grupo de Trabajo EHI-ESP // An Pediatr. (Barc). — 2018. — Vol. 89(1). — P. 12-23. doi: 10.1016/j.anpedi.2017.06.008.
3. Lee A.C. Intrapartum-related neonatal encephalopathy incidence and impairment at regional and global levels for 2010 with trends from 1990 / A.C. Lee, N. Kozuki, H. Blencowe et al. // Pediatr Res. — 2013. — Vol. 74(1). — P. 50-72. doi: 10.1038/pr.2013.206.
4. Chalak L.F. Biomarkers for severity of neonatal hypoxic-ischemic encephalopathy and outcomes in newborns receiving hypothermia therapy / L.F. Chalak, P.J. Sánchez, B. Adams-Huet et al. // Journal of Pediatrics. — 2014. — Vol. 164. — P. 468-474. doi: 10.1016/j.jpeds.2013.10.067.
5. Douglas-Escobar M. Biomarkers of hypoxic-ischemic encephalopathy in newborns / M. Douglas-Escobar, M.D. Weiss // Frontiers in Neurology. — 2012. — Vol. 3. — P. 144. doi: 10.3389/fneur.2012.00144.
6. Lv H. Neonatal hypoxic ischemic encephalopathy-related biomarkers in serum and cerebrospinal fluid / H. Lv, Q. Wang, S. Wu et al. // Clin Chim Acta. — 2015. — Vol. 450. — P. 282-97. doi: 10.1016/j.cca.2015.08.021.
7. Qian J. Umbilical artery blood S100 beta protein: a tool for the early identification of neonatal hypoxic-ischemic encephalopathy / J. Qian, D. Zhou, Y.W. Wang // European Journal of Pediatrics. — 2009. — Vol. 168. — P. 71-77.
8. Muniraman H. Biomarkers of hepatic injury and function in neonatal hypoxic ischemic encephalopathy and with therapeutic hypothermia / H. Muniraman, D. Gardner, J. Skinner et al. // Eur. J. Pediatr. — 2017. — Vol. 176(10). — P. 1295-1303. doi: 10.1007/s00431-017-2956-2.
9. Douglas-Escobar M. A pilot study of novel biomarkers in neonates with hypoxic-ischemic encephalopathy / M. Douglas-Escobar, C. Yang, J. Bennett et al. // Pediatric Research. — 2010. — Vol. 68(6). — P. 531-536. doi: 10.3389/fneur.2012.00144.
10. Massaro A.N. Biomarkers of brain injury in neonatal encephalopathy treated with hypothermia / A.N. Massaro, T. Chang, N. Kadom et al. // Journal of Pediatrics. — 2012. — Vol. 1(3). — P. 434–440. doi: 10.1016/j.jpeds.2012.02.047.
11. Massaro A.N. Biomarkers S100b and NSE predict outcome in hypothermia-treated encephalopathic newborns / A.N. Massaro, T. Chang, S. Baumgart et al. // Pediatric Critical Care Medicine. — 2014. — Vol. 15(7). — P. 615-622. doi: 10.1097/PCC.0000000000000155.
12. Chaparro-Huerta V. Proinflammatory cytokines, enolase and S-100 as early biochemical indicators of hypoxic-ischemic encephalopathy following perinatal asphyxia in newborns / V. Chaparro-Huerta, M.E. Flores-Soto, M.E. Merin Sigala et al. // Pediatrics and Neonatology. — 2017. — Vol. 58(1). — P. 70-76. doi: 10.1016/j.pedneo.2016.05.001.
13. Белобородова Н.В. Диагностическая значимость белка S100B при критических состояниях / Н.В. Белобородова, И.Б. Дмитриева, Е.А. Черневская // Общая реаниматология. — 2011. — T. 7, № 6. — C. 72-76.
14. Merchant N. Early predictors of outcome in infants treated with hypothermia for hypoxic-ischemic encephalopathy / N. Merchant, D. Azzopardi // Dev. Med. Child Neurol. — 2015. — Vol. 57(3). — P. 8-16. doi: 10.1111/dmcn.12726.
15. Simon-Pimmel J. Reference ranges for serum S100B neuroprotein specific to infants under four months of age / J. Simon-Pimmel, F. Lorton, D. Masson et al. // Clinical Biochemistry. — 2017. — Vol. 50(18). — P. 1056-1060. doi: 10.1016/j.clinbiochem.2017.08.014.
16. Abbasoglu A. Serum neuron-specific enolase levels in preterm and term newborns and in infants 1-3 months of age / A. Abbasoglu, F. Sarialioglu, N. Yazici et al. // Pediatrics and Neonatology. — 2015. — Vol. 56(2). — P. 114-119. doi: 10.1016/j.pedneo.2014.07.005.
17. Laptook A.R. Effect of therapeutic hypothermia initiated after 6 hours of age on death or disability among newborns with hypoxic-ischemic encephalopathy: a randomized clinical trial / A.R. Laptook, S. Shankaran, J.E. Tyson et al. // JAMA. — 2017. — Vol. 318(16). — P. 1550-1560. doi: 10.1001/jama.2017.14972.
18. Smit E. Cooling neonates who do not fulfil the standard cooling criteria — short- and long-term outcomes / E. Smit, X. Liu, S. Jary et al. // Acta Paediatr. — 2015. — Vol. 104(2). — P. 138-45. doi: 10.1111/apa.12784.
19. Bourque S.L. Does late therapeutic hypothermia reduce risk of death or disability? / S.L. Bourque, R.M. Dietz // Acta Paediatr. — 2018. — Vol. 107(6). — P. 1103. doi: 10.1111/apa.14334.
20. Zaigham M. Protein S100B in umbilical cord blood as a potential biomarker of hypoxic-ischemic encephalopathy in asphyxiated newborns / M. Zaigham, F. Lundberg, P. Olofsson // Early Human Development. — 2017. — Vol. 112. — P. 48-53. doi: 10.1016/j.earlhumdev.2017.07.015.
21. El-Meshad G.M. Umbilicalcord S100B protein in neonatal hypoxic-ischemic encephalopathy / G.M. El-Meshad, D.M. El-Lahoney, N.F. Barseem et al. // Alexandria Journal of Pediatrics. — 2017. — Vol. 30(2). — P. 588-594. doi: 10.4103/mmj.mmj_655_16.
22. Bersani I., Auriti C., Ronchetti M.P., Prencipe G., Gazzolo D., Dotta A. Use of early biomarkers in neonatal brain damage and sepsis: state of the art and future perspectives // Biomed. Res. Int. — 2015. — 2015. — 253520. doi: 10.1155/2015/253520.
23. Massaro A.N. Plasma biomarkers of brain injury in neonatal hypoxic-ischemic encephalopathy / A.N. Massaro, Y.W. Wu, T.K. Bammler et al. // J. Pediatr. — 2018. — Vol. 194. — P. 67-75.e1. doi: 10.1016/j.jpeds.2017.10.060.
24. Negro S. Early prediction of hypoxic-ischemic brain injury by a new panel of biomarkers in a population of term newborns / S. Negro, M. Benders, M.L. Tataranno et al. // Oxid Med. Cell. Longev. — 2018. — e7608108. doi: 10.1155/2018/7608108.
25. Copenhaver N. Clinical utility of serum biomarkers for the management of neonatal hypoxic ischemic encephalopathy (control levels) / N. Copenhaver, M. Huene // US National Library for Medicine [Internet]. Clinicaltrials.gov. — 2016. — Available from: https://clinicaltrials.gov/ct2/show/NCT02349672. [cited 7 March 2019].

/69-1.jpg)
/70-1.jpg)
/71-1.jpg)