Журнал «Боль. Суставы. Позвоночник» Том 9, №1, 2019
Вернуться к номеру
Бронхіальна астма як патофізіологічний чинник формування саркопенії
Авторы: Масік Н.П., Поніна С.І.
Вінницький національний медичний університет імені М.І. Пирогова, м. Вінниця, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Актуальність. В умовах бронхіальної обструкції при бронхіальній астмі (БА) розвиваються зміни газового складу крові, оксидативний стрес, електролітний і метаболічний дисбаланси, що сприяють формуванню емфіземи легень і хронічної дихальної недостатності. При цьому виникають зміни дихальних м’язів, зокрема й у діафрагмі, що характеризуються прогресуючою їх атрофією з наступною втратою м’язової сили й маси. Мета: визначення функціональних можливостей скелетних м’язів і частоти розвитку саркопенії у хворих на БА. Матеріали та методи. Обстежено 70 осіб віком 47,82 ± 13,54 року. Першу групу становили 35 пацієнтів, які хворіють на БА, другу — 35 здорових осіб. Для оцінки функціональних можливостей скелетних м’язів застосовували 8-кроковий тест визначення швидкості ходьби. Силу скелетної мускулатури оцінювали за допомогою ручного пружинного динамометра. За величиною окружності гомілки оцінювали стан м’язової маси, якість життя вивчали за допомогою опитувальника О.С. Чабана. Результати. При оцінці сили скелетної мускулатури встановлено зменшення показників кистьової динамометрії на 22 % при тяжкому перебігу БА порівняно з показниками хворих на БА середньої тяжкості і на 29 % — порівняно із показниками здорових осіб. Встановлено кореляційні зворотні зв’язки між тяжкістю БА та силою кисті в жінок (r = –0,65) і чоловіків (r = –0,3); швидкістю ходьби у жінок (r = –0,72) та чоловіків (r = –0,6); окружністю гомілки у жінок (r = –0,17) і чоловіків (r = –0,28). Зниження сили м’язів і толерантності до фізичного навантаження асоціювалось із втратою м’язового компонента в 80 % пацієнтів з БА. Висновки. Саркопенія діагностована у 5,71 % осіб контрольної групи і у 25,71 % хворих на БА. Залежно від тяжкості БА і віку хворих саркопенію виявлено у 9,5 % пацієнтів із середньотяжкою БА і у 35,71 % — із тяжкою БА; у 10,53 % осіб віком молодших 45 років і у 31,25 % — старших 45 років.
Актуальность. В условиях бронхиальной обструкции при бронхиальной астме (БА) изменяется газовый состав крови, развиваются оксидативный стресс, электролитный и метаболический дисбалансы, которые способствуют формированию эмфиземы легких и хронической дыхательной недостаточности. При этом формируются изменения дыхательных мышц, в том числе и диафрагмы, которые характеризуются прогрессирующей атрофией с последующей потерей мышечной силы и массы. Цель: определение функциональных возможностей скелетной мускулатуры и частоты развития саркопении у больных БА. Материалы и методы. Обследовано 70 человек возрастом 47,82 ± 13,54 года. Первую группу составили 35 больных БА, вторую — 35 здоровых лиц. Для оценки функциональных возможностей скелетных мышц использовали 8-шаговый тест определения скорости ходьбы. Силу скелетной мускулатуры оценивали с помощью ручного пружинного динамометра. Величину окружности голени использовали для оценки мышечной массы, качество жизни изучали с помощью опросника О.С. Чабана. Результаты. При оценке силы скелетной мускулатуры установлено уменьшение кистевой динамометрии на 22 % при тяжелом течении БА по сравнению с показателями больных со среднетяжелой БА и на 29 % — по сравнению с показателями здоровых лиц. Установлены корреляционные обратные связи между тяжестью БА и силой кисти у женщин (r = –0,65) и мужчин (r = –0,3); скоростью ходьбы у женщин (r = –0,72) и мужчин (r = –0,6); окружностью голени у женщин (r = –0,17) и мужчин (r = –0,28). Снижение силы скелетной мускулатуры и толерантности к физической нагрузке ассоциировалось с потерей мышечного компонента у 80 % пациентов с БА. Выводы. Саркопения диагностирована у 5,71 % лиц контрольной группы и у 25,71 % больных БА. В зависимости от тяжести БА и возраста больных саркопения выявлена у 9,5 % пациентов со среднетяжелой БА и у 35,71 % — с тяжелой БА; у 10,53 % лиц возрастом моложе 45 лет и у 31,25 % — старше 45 лет.
Background. Under bronchial obstruction caused by the bronchial asthma (BA), one may observe a change in blood gas factor, development of oxidative stress, electrolyte and metabolic imbalance, which lead to lung emphysema and chronic respiratory failure formation. This was accompanied by changes in respiratory muscles, particularly in the diaphragm, which are characterized by an advanced atrophy and a further loss of muscle strength and mass. The question arises to which extent BA affects the state of skeletal muscles as they determine tolerance for physical activity and quality of life in these patients. The purpose was to determine functional capacity of skeletal muscles and frequency of sarcopenia in patients with BA. Materials and methods. Seventy people aged 47.82 ± 13.54 years were examined. The first group included 35 persons who had BA, while the second group consisted of 35 healthy persons. An 8-step test for walking speed was applied to assess the functional capacity of skeletal muscles. The skeletal muscle power was evaluated with the help of spring hand dynamometer. Circumference of the tibia determined the criterion of satisfactory muscle mass. Quality of life was assessed by means of O.S. Chaban’s questionnaire. Results. When evaluating skeletal muscle power, wrist dynamometry was reduced by 22 % in case of severe BA compared to moderate BA, the corresponding index made 29 % when compared to the wrist dynamometry of healthy persons. An inverse correlation was found between BA severity and wrist strength in females (r = –0.65) and males (r = –0.3); walking speed in females (r = –0.72) and males (r = –0.6); circumference of the tibia in females (r = –0.17) and males (r = –0.28). A decrease in skeletal muscle power and tolerance for physical activity were associated with the loss of muscle component among 80 % of patients with BA. Conclusions. Sarcopenia was diagnosed in 5.71 % of persons from the control group, and in 25.71 % of patients with BA. Depending on BA severity and the age of patients, sarcopenia was detected in 9.5 % of patients who had moderate BA, and in 35.71 % of patients with severe BA; in 10.53 % of persons under the age of 45, and in 31.25 % of those over 45.
бронхіальна астма; дисфункція дихальних м’язів; скелетна мускулатура; саркопенія
бронхиальная астма; дисфункция дыхательных мышц; скелетная мускулатура; саркопения
bronchial asthma; dysfunction of respiratory muscles; skeletal muscles; sarcopenia
Вступ
Бронхіальна астма (БА) — проблема глобального масштабу: у світі налічується понад 334 млн хворих, із них близько 250 тис. щорічно помирають від ускладнень даного захворювання. Фахівці Всесвітньої організації охорони здоров’я прогнозують, що до 2025 року чисельність хворих на БА зросте на 100 млн осіб. БА при неадекватному лікуванні може значно впливати на якість життя пацієнтів, призводити до госпіталізації та стійкого зниження працездатності [1]. Хронічне гетерогенне запальне захворювання дихальних шляхів, що супроводжується епізодичними свистячими хрипами, ядухою, відчуттям скованості в грудній клітці та кашлем, при БА проявляється різними фенотипами й ендотипами [2]. Фенотип захворювання та наявність супутньої патології визначають особливості перебігу, відповідь на традиційні схеми лікування та розвиток ускладнень хвороби в кожного окремого пацієнта [3].
В умовах бронхіальної обструкції апарат зовнішнього дихання, зокрема дихальна мускулатура, виконує збільшений об’єм роботи, що призводить до функціональних порушень. Низькі показники сили дихальної мускулатури можуть бути наслідком виснаження енергетичного запасу в умовах зростаючої потреби енергії [4]. Доведено, що у хворих на БА при зниженій функції зовнішнього дихання (ФЗД) фізична активність підтримується надмірною активацією анаеробних процесів метаболізму та зростанням енергетичної цінності виконаної роботи. Так, при максимальному фізичному навантаженні у хворих на БА середнього ступеня тяжкості незалежно від фази перебігу захворювання не відбувається ефективного функціонування м’язової системи через обмеження постачання до неї кисню. Внаслідок цього зростають енергозатрати в м’язах із накопиченням надлишку молочної кислоти та зсуву гомео–стазу організму [4, 5] у бік ацидозу.
Недостатня робота інспіраторної мускулатури призводить до появи гіповентиляції, а експіраторної мускулатури — до розвитку динамічної гіперінфляції, що утрудняє відходження мокротиння [6]. Порушення механіки дихання, хронічне запалення, часті загострення, електролітний і метаболічний дисбаланси пришвидшують формування хронічної стійкої гіперінфляції легень, що є однією з причин слабкості дихальних м’язів [7]. Наявність тривалої бронхіальної обструкції призводить до формування хронічної дихальної недостатності й перенапруження дихальної мускулатури, знижуючи її здатність генерувати максимальне дихальне зусилля [8]. Процес розвитку дисфункції дихальних м’язів у хворих на БА зумовлений складними патофізіологічними механізмами, зокрема хронічним прогресуючим порушенням ФЗД, змінами газового складу крові, оксидативним стресом та ін. [9, 10]. Внаслідок хронічного запалення, що перебігає з інтоксикаційним синдромом, недостатньої фізичної активності, а також через прийом системних глюкокортикоїдів (ГК) виникають зміни в дихальній мускулатурі, –зокрема й діафрагмі, що характеризуються прогресуючою їх атрофією з наступною втратою м’язової сили й маси [8]. Показано, що при БА формується також і дисфункція скелетної мускулатури, яка полягає у втраті м’язової маси, слабкості скелетних м’язів [11], розвитку саркопенії.
Згідно з консенсусом European Working Group on Sarcopenia in Older People (EWGSOP, 2010), саркопенія — синдром, що характеризується прогресивним і генералізованим зниженням скелетної м’язової маси та її сили з ризиком розвитку таких ускладнень, як порушення рухливості, зниження якості життя й підвищення показників смертності [12]. Поширеність саркопенії варіює (5–70 %) залежно від віку, статі та етнічної приналежності.
Однак на сьогодні немає даних щодо зміни стану скелетних м’язів при захворюваннях, які супроводжуються зниженням функціонального резерву легень. При цьому не можна виключати, що саркопенія може бути незалежним процесом, який сприяє системному запаленню й прогресуванню основного захворювання. Тому оцінка стану як дихальної, так і скелетної мускулатури важлива, оскільки вона визначає толерантність до фізичного навантаження хворих, які страждають від БА. У зв’язку з цим метою роботи стало визначення функціональних можливостей скелетних м’язів і частоти розвитку саркопенії у хворих на БА.
Матеріали та методи
Обстежено 70 осіб віком від 28 до 72 років (середній вік — 47,82 ± 13,54 року), із них 38 чоловіків (54,29 %) і 32 (45,71 %) жінки. У дослідження включали пацієнтів лише за умови їх добровільної згоди з метою та обсягом запланованих досліджень. Обстежені були розподілені на 2 репрезентативні за віком і статтю групи по 35 осіб, із них по 19 чоловіків і 16 жінок. Першу групу становили 35 хворих на БА у фазі ремісії: у 21 пацієнта (60,0 %) БА середнього ступеня тяжкості і у 14 (40,0 %) — тяжка БА. Усі хворі отримували стандартну базисну терапію періоду ремісії, що включала застосування інгаляційного ГК (іГК) і b2-агоніста тривалої та короткої дії для купірування симптомів БА. Другу (контрольну) групу становили 35 здорових осіб.
Під час встановлення діагнозу БА враховували анамнез, клінічні симптоми, показники ФЗД, оборотність обструкції в пробі з бронхолітиком. Відбір хворих за ступенем тяжкості БА проводили відповідно до критеріїв Наказу № 128 МОЗ України від 19.03.2007 р. «Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «пульмонологія» та наказу № 868 МОЗ України від 08 жовтня 2013 р. «Уніфікований клінічний протокол первинної, вторинної (спеціалізованої) медичної допомоги. Бронхіальна астма» [13].
Для щоденного моніторування ступеня обструкції використовували показник пікової об’ємної швидкості, визначеної за допомогою індивідуального пікфлоуметра Vitalograph® фірми Boehringer Ingelheim № 43.400BOV.
Силу скелетної мускулатури оцінювали за допомогою ручного плоскопружинного динамометра ДРП-10, який пацієнт стискає кистю витягнутої вперед верхньої кінцівки. Сила стискання (кг) вказується стрілкою на спеціальній шкалі динамометра. За величиною окружності гомілки оцінювали критерії м’язової маси. Для оцінки функціональних можливостей скелетних м’язів застосовували 8-кроковий тест визначення швидкості ходьби.
Діагноз саркопенії встановлювали на основі критеріїв EWGSOP (2010) за наявності зниження м’язової маси (окружність гомілки < 31 см), сили (< 20 кг для жінок і < 30 кг для чоловіків) і функції (< 0,8 м/с). Для встановлення діагнозу саркопенії необхідна наявність двох із трьох вищезгаданих критеріїв, наявність першого критерію обов’язкова. Перша стадія — пресаркопенія, характеризується зниженням маси скелетних м’язів без зниження їх сили та функції; друга стадія — саркопенія, характеризується зниженням маси скелетних м’язів зі зниженням їх сили або функції; третя стадія — тяжка саркопенія, характеризується зниженням усіх трьох критеріїв [12].
Для визначення адаптації пацієнта до хвороби й можливості виконання звичних функцій використовували інтегральний показник «якість життя» (ЯЖ), який вивчали методом анкетування за допомогою опитувальника оцінки рівня якості життя О.С. Чабана (Chaban Quality of Life Scale — CQLS). Опитувальник складається з 10 питань, що відображають фізичні та психічні аспекти ЯЖ [14].
Статистичний аналіз проводили з визначенням параметричних показників (середні значення (M) та їх стандартне відхилення (SD)), критерію Стьюдента для незалежних вибірок, застосовували кореляційний аналіз Пірсона та непараметричних показників. Відмінності показників вважали вірогідними при р < 0,05. При аналізі використовували пакет програми Statistiсa 6.0.
Результати та обговорення
Визначення функціональних можливостей скелетних м’язів виявило зниження швидкості ходьби у 8 (50,0 %) жінок, які страждають від БА. Встановлено сильний зворотний кореляційний зв’язок (r = –0,72) між віком та швидкістю ходьби, значне зниження показників швидкості ходьби при тяжкому перебігу БА порівняно з хворими із середнім ступенем тяжкості та контрольною групою. Натомість серед жінок контрольної групи тільки у 4 (25,0 %) виявлено уповільнення швидкості ходьби. У чоловіків, хворих на БА, у 9 (47,37 %) виявлено зниження швидкості ходьби, при цьому спостерігався помірний зворотний кореляційний зв’язок (r = –0,6) між віком і швидкістю ходьби. Серед чоловіків конт–рольної групи лише у 3 (15,79 %) виявлено уповільнення швидкості ходьби. Середні показники швидкості ходьби залежно від віку, статі та тяжкості БА наведені в табл. 1.
За результатами динамометрії, у 17 (48,57 %) хворих на БА (10 жінок та 7 чоловіків) діагностовано зниження сили скелетної мускулатури. При цьому у групі жінок встановлено сильний зворотний кореляційний зв’язок (r = –0,65) між віком і силою кисті. Нами виявлено зменшення кистьової сили на 22,0 % у хворих при тяжкому перебігу БА порівняно з жінками з середньотяжкою БА і на 29,0 % — порівняно з контрольною групою. У чоловіків встановлено слабкий зворотний кореляційний зв’язок (r = –0,3) між віком і силою кисті. Виявлено зменшення показників кистьової динамометрії на 15,0 % за тяжкого перебігу БА порівняно з хворими з середньотяжкою БА і на 17,0 % — порівняно з контрольною групою. Серед жінок контрольної групи лише у 4 (25,0 %) спостерігалось зменшення динамометричних показників, тоді як у жодного чоловіка не виявлено зниження показників кистьової динамометрії (табл. 2).
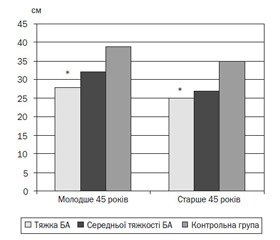
Показники окружності гомілки, що відповідають діагностичним критеріям саркопенії, виявлені у 6 жінок (18,75 %) та 3 чоловіків (7,89 %), включених у дослідження, причому встановлено слабкий негативний кореляційний зв’язок між віком та окружністю гомілки (r = –0,17 та r = –0,28 відповідно для чоловіків і жінок). Так, у жінок молодше 45 років з тяжкою БА окружність гомілки становила 28,0 ± 3,7 см, тоді як у осіб, старших 45 років, — 25,0 ± 3,5 см, що вірогідно (p < 0,05) відрізнялось від аналогічних показників контрольної групи (39,0 ± 1,4 см і 35,0 ± 2,5 см відповідно). У чоловіків молодше 45 років як з тяжкою БА (33,0 ± 2,1 см), так і з середньотяжким її перебігом (37,0 ± 1,6 см) встановлені вірогідні відмінності (p < 0,05) показників порівняно з контрольною групою (43,1 ± 0,7 см). Натомість у чоловіків, старших 45 років, вірогідні відмінності (p < 0,05) встановлені лише у разі порівняння тяжкої БА з контролем (27,2 ± 3,1 см проти 36,4 ± 1,8 см) (рис. 1, 2).
На сьогодні негативний вплив системних ГК на скелетні м’язи добре вивчено [15]. Встановлена пряма залежність між щоденним прийомом ГК та слабкістю скелетних м’язів [16]. На відміну від системних ГК, іГК мають значно менший вплив на організм людини за рахунок їх топічної дії на дихальні шляхи [17], тому іГК вважають у цілому безпечними при низьких дозах. Натомість кумулятивні ефекти при високих дозах іГК і тривалому їх використанні сприяють підвищеному ризику виникнення несприятливих подій, таких як витончення шкіри, втрата кісткової та м’язової маси, пригнічена функція надниркових залоз, цукровий діабет, пневмонія та катаракта [18, 19].
Враховуючи наведені дані, становило науковий інтерес дослідження стану скелетних м’язів у хворих на БА залежно від сумарної дози іГК. Так, пацієнти, у яких сумарна доза іГК за період хвороби була менше 5 млн мкг, мали показники швидкості ходьби на 18,4 %, сили кисті — на 29,2 %, а окружності гомілки — на 21,4 % менші порівняно з контрольною групою (табл. 3). При сумарній дозі іГК за період хвороби більше 5 млн мкг швидкість ходьби зменшувалася на 25,2 %, сила кисті — на 54,4 %, окружність гомілки — на 31,3 % порівняно з контрольною групою. Встановлено сильний зворотний кореляційний зв’язок (r = –0,8) між сумарною дозою іГК за період хвороби та силою кисті, помірний зворотний кореляційний зв’язок між сумарною дозою іГК за період хвороби й швидкістю ходьби (r = –0,5) та окружністю гомілки (r = –0,3) (p < 0,05).
Беручи до уваги діагностичні критерії EWGSOP (2010), саркопенія діагностована у 5,71 % осіб конт–рольної групи і у 25,71 % хворих на БА. Пресаркопенія виявлена у 4 пацієнтів з БА, що становило 11,43 %. Показники їх динамометрії — 23,75 ± 2,60 кг, окружності гомілки — 29,75 ± 2,80 см, швидкості ходьби — 0,95 ± 0,09 м/с.
Саркопенія виявлена у 3 осіб (8,57 %). У цих хворих показники динамометрії становили 19,25 ± 5,30 кг, окружності гомілки — 28,25 ± 1,58 см, швидкості ходьби — 0,76 ± 0,05 м/с.
Тяжка саркопенія діагностована у 2 (5,71 %) хворих, показники динамометрії яких становили 12,7 ± 2,4 кг, окружності гомілки — 26,64 ± 1,21 см, швидкості ходьби — 0,63 ± 0,01 м/с.
Визначення залежності дисфункції скелетних м’язів від тяжкості БА, віку хворих та базисної терапії дало підставу встановити саркопенію у 9,5 % пацієнтів із середньотяжкою БА й у 35,71 % — із тяжкою БА; у 10,53 % осіб віком до 45 років і у 31,25 % — старших 45 років; у 16,7 % хворих із сумарною дозою іГК за період хвороби менше 5 млн мкг і у 21,74 % — більше 5 млн мкг іГК.
Таким чином, результати отриманого нами дослідження засвідчують залежність розвитку дисфункції скелетної мускулатури та саркопенії від тяжкості БА, кумулятивного ефекту іГК та віку хворих.
Наші результати узгоджуються з даними окремих авторів, які встановили, що на початковій стадії бронхіальної обструкції респіраторна мускулатура відповідає гіпертрофією на підвищення функціонального навантаження на неї. Однак у міру прогресування хвороби зменшується сила скорочення цих м’язів, у них наростають атрофічні зміни [20, 21].
Натомість дослідження респіраторної мускулатури іншими авторами встановили, що найбільший ступінь функціональних порушень у роботі дихальних м’язів мав місце у хворих з найменшим ступенем обструктивних порушень. Автори пояснюють зниження сили м’язів вдиху результатом тривалого кашлю, дискоординацією діяльності мускулатури внаслідок компенсаторного збільшення сили м’язів у відповідь на тривале виконання роботи в умовах бронхіальної обструкції [22].
Оцінка стану дихальної та скелетної мускулатури важлива, оскільки вона дозволяє визначити толерантність до фізичного навантаження хворих із бронхіальною обструкцією. Остання залежить не тільки від ступеня вираженості легеневої патології [23], а й від позалегеневих проявів хвороби [24]. Підтвердженням цьому є результати дослідження альвеолярної вентиляції при фізичному навантаженні, можливою причиною погіршення якої автори вважають статичну гіперінфляцію легень. Вони встановили кореляційний зв’язок між ємністю вдиху та часткою вентиляції «мертвого» простору у складі дихального циклу (r = –0,74, р = 0,0048) [25].
Дегенеративно-дистрофічні зміни скелетних, зокрема й дихальних, м’язів призводять до зниження толерантності до фізичного навантаження, наростання дихальної недостатності, зниження якості життя пацієнтів із хронічним обструктивним захворюванням легень [26]. Враховуючи ці дані, ми провели дослідження якості життя хворих на БА порівняно з контролем. Так, встановлено, що 51,4 % хворих на БА вказують на низький і дуже низький рівень життя проти 25,7 % групи контролю (рис. 3).
За результатами суб’єктивної оцінки свого стану, зумовленого ступенем тяжкості захворювання, виявилося, що він був вищим у хворих при середній тяжкості БА (61,9 %), і нижчим — у хворих з тяжкою БА (42,9 %). Ймовірно, саме при вже сформованій тяжкій бронхообструкції та тривалому анамнезі хвороби пацієнти дещо звикаються з тягарем патології, тому й оцінюють свій стан оптимістичніше [27]. Обмеження у своїй повсякденній діяльності через проблеми з фізичним здоров’ям мали 47,6 % хворих із середнім ступенем тяжкості БА, при тяжкій БА цей показник зростав до 57,1 %.
Зіставлення результатів нашого дослідження з даними літератури дозволяє припустити, що ключова роль у патофізіологічних механізмах розвитку саркопенії у хворих на БА належить запальному процесу, який супроводжується змінами газового складу крові, оксидативним стресом, збільшенням рівня циркулюючих в кровотоці прозапальних цитокінів (інтерлейкін-1, -2, -6; інтерферон g; фактор некрозу пухлини a), що, в свою чергу, призводить до зниження синтезу м’язових білків, протеолізу міозину тяжких ланцюгів, зниження рівня тестостерону й збільшення синтезу катехоламінів [28].
Висновки
1. У 25,7 % хворих на БА та у 5,7 % осіб контрольної групи встановлено діагноз саркопенії; залежно від тяжкості БА і віку хворих саркопенію виявлено у 9,5 % пацієнтів з середньотяжкою БА і у 35,71 % — із тяжкою БА; у 10,53 % осіб віком молодше 45 років і у 31,25 % — старших 45 років.
2. Виявлено залежність між тяжкістю БА, з одного боку, та зменшенням сили кисті — з іншого боку. Встановлено зворотний кореляційний зв’язок у жінок (r = –0,65) і чоловіків (r = –0,3).
3. Встановлена залежність між віком та швидкістю ходьби хворих на БА: зворотний кореляційний зв’язок у жінок (r = –0,72) та середній зворотний (r = –0,6) у чоловіків.
4. Розвиток саркопенії залежить від схеми базисної терапії хворих на БА: саркопенію виявлено у 16,7 % хворих із сумарною дозою іГКС менше 5 млн мкг за період хвороби і у 21,74 % — більше 5 млн мкг іГКС.
5. У 51,4 % респондентів з-поміж тих, хто хворіє на БА, дуже низький чи низький рівень життя, що майже вдвічі більше, ніж серед контрольної групи.
Інформація про внесок кожного автора: Масік Н.П. — концепція і дизайн дослідження, аналіз отриманих даних, оформлення тексту; Поніна С.І. — збирання й обробка матеріалів, аналіз отриманих даних, написання тексту.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/72-1.jpg)
/73-1.jpg)
/74-1.jpg)