Введение
На протяжении по крайней мере двух тысячелетий человечество знает о существовании подагры. Долгое время возможности терапии заболевания были весьма ограниченными, и лишь пять десятилетий назад лекарственный арсенал, ранее включавший исключительно препараты симптоматического действия, был пополнен аллопуринолом, уратснижающий эффект которого связан с ингибицией ксантиноксидазы. На сегодняшний день он остается основным препаратом для лечения подагры, но, к сожалению, как и любое лекарственное средство, имеет противопоказания, побочные эффекты и свое терапевтическое окно. Были описаны серьезные, хотя и редкие, токсические реакции на аллопуринол, включающие эозинофилию, гиперсенситивный васкулит, гепатит, прогрессирующую почечную недостаточность. Кроме того, стало ясно, что у части пациентов аллопуринол неэффективен даже при достижении максимальной дозы — 800 мг/сутки. Также следует отметить, что аллопуринол структурно похож на гипоксантин и участвует в широком спектре пуриновых и пиримидиновых реакций, что лишает его селективности и адресного действия [1, 2]. Вместе с тем новая стратегия терапии подагры предполагает необходимость достижения целевых значений мочевой кислоты (МК), пожизненного контроля ее уровня, приема уратснижающих препаратов (УСП), которые способны полностью предотвратить вероятность развития приступов артрита [3]. Все это сделало актуальным поиск и внедрение в клиническую практику новых УСП.
В 1998 г. в лаборатории Teijin в Японии после нескольких лет безрезультатных опытов был синтезирован препарат фебуксостат. В 2008 г. Европейское агентство по лекарственным средствам (ЕМА) одобрило выход этого препарата на фармацевтический рынок [4], в 2009 г. препарат появился в США. Однозначно, это событие значительно расширило возможности ревматологов для лечения гиперурикемии и подагры, уменьшив количество пациентов, рефрактерных к доступным пероральным уратснижающим агентам. Действующие рекомендации Американского колледжа ревматологов (ACR) по менеджменту пациентов с подагрой предлагают аллопуринол или фебуксостат в качестве первой линии уратснижающей терапии (УСТ), а рекомендации Европейской противоревматической лиги (EULAR) предлагают фебуксостат в качестве терапии второго ряда у пациентов, которые не переносят аллопуринол [3, 5]. Недавние исследования, основанные на фактических данных, показали, что фебуксостат имеет лучшую эффективность и безопасность, чем другие препараты для снижения уровня МК, включая аллопуринол [6, 7]. Фебуксостат проявил значительную эффективность в сравнении с аллопуринолом в исследовании Q. Zhou et al. (2017) [8]. Так, лечение фебуксостатом (40 мг) существенно снижало уровни МК в сыворотке у пациентов по сравнению с теми, которые получали аллопуринол или бензбромарон в средней терапевтической дозе. Прием фебуксостата в дозе 80 мг давало наилучший терапевтический эффект, и целевой уровень МК был достигнут уже на 2-й неделе лечения. Тем не менее общее число пациентов с побочными эффектами было значительно выше в группе, принимавшей фебуксостат 80 мг, по сравнению с группой 40 мг. В группе аллопуринола была более высокая частота гиперчувствительности, а в группе бензбромарона чаще диагностировалась почечная дисфункция. Такие же результаты были получены в исследовании, проведенном S. Wang (2018) [9]: при сравнении уровней МК в крови между двумя группами пациентов контроля, принимавших аллопуринол, и исследовательской группы, принимавших фебуксостат, после лечения можно понять, что улучшение было более значительным в исследовательской группе (р < 0,05). Частота побочных реакций в группе фебуксостата была значительно ниже (р < 0,05), что позволило сделать вывод, что для пациентов с подагрой и гиперурикемией терапия фебуксостатом имеет лучшую эффективность в достижении цели лечения, чем у аллопуринола. Однако исследования, сравнивающие безопасность и эффективность фебуксостата и аллопуринола при лечении хронической подагры, сообщают о противоречивых результатах [10]. Они свидетельствуют о недостаточной согласованности в установлении эффективности и безопасности фебуксостата и других лекарственных препаратов для лечения гиперурикемии.
Фармакодинамика
Фебуксостат химически сконструирован как селективный ингибитор ксантиноксиредуктазы (КОР) [11]. КОР катализирует как минимум две стадии пуринового обмена: оксидацию гипоксантина до ксантина и ксантина до МК. Синтезируясь, в том числе как дегидрогеназа, КОР легко конвертируется в ксантиноксидазу, которая активно продуцирует супероксидные анионы и Н2О2 [12]. Аллопуринол, ингибируя ксантин-оксидазу, оказывает двойное действие, выражающееся в подавлении трансформации гипоксантина в МК и устранении выработки продуктов окислительного стресса, прежде всего активных форм кислорода. Следовательно, ингибитор ксантиноксидазы аллопуринол и ингибитор КОР фебуксостат снижают уровни МК в сыворотке крови, препятствуя превращению гипо-ксантина в ксантин и ксантина в МК [13].
Фебуксостат уменьшает продукцию МК за счет мощного и избирательного ингибирования КОР и опосредованно ксантиноксидазы [2, 11]. Он неконкурентно блокирует активность двух форм ферментов, связываясь с их активным центром [14], тогда как оксипуринол, активный метаболит аллопуринола, действует как конкурентный ингибитор редуцированной формы фермента КОР — ксантиноксидазы. Структурно отличаясь от аллопуринола, в котором отсутствует модифицированное пуриновое кольцо, фебуксостат ингибирует окислительные и восстановленные формы ксантиноксидазы, тогда как оксипуринол, активный метаболит аллопуринола, ингибирует только ее восстановленную форму [14].
Фебуксостат является производным 2-арилтиазола, который не влияет на синтез пуринов, в то время как аллопуринол структурно связан с пуринами и уменьшает их синтез у пациентов с нормальной активностью гипоксантин-гуанин-фосфорибозилтрансферазы. Пероральная абсорбция и период полураспада фебуксостата и аллопуринола позволяют назначать их перорально один раз в день [1, 14]. Около 49 % введенной дозы фебуксостата выводится с мочой и 45 % — с калом [14]. Это позволяет не корректировать дозу фебуксостата для пожилых пациентов или пациентов с легкой или умеренной почечной недостаточностью (клиренс креатинина 30–89 мл/мин) или при легкой и умеренной печеночной недостаточности (Чайлда — Пью, класс A или B), в отличие от аллопуринола, для которого необходима тщательная оценка назначаемой дозы при наличии вышеперечисленных коморбидностей, что ограничивает его гипоурикемический эффект. У пациентов с клиренсом креатинина ниже 30 мл/мин фебуксостат не одобрен, хотя он сохраняет свою активность и толерантность в соответствии с недавними короткими ретроспективными исследованиями [15, 16]. Около 80 % аллопуринола выводится с мочой, большая часть — в форме оксипуринола [1], который накапливается у пациентов с хронической болезнью почек (ХБП); что, по-видимому, предрасполагает к тяжелым кожным побочным реакциям и привело к рекомендации по ограничению дозы аллопуринола у пациентов с ХБП [3].
Интересные данные получены в отношении сывороточных концентраций ксантина и гипоксантина. Известно, что при терапии аллопуринолом высок риск образования и накопления ксантиновых депозитов в тканях, а также ксантинурии [17]. При терапии фебуксостатом концентрация этих двух предшественников МК не превышала допустимых значений в сыворотке крови, а в моче не определялись кристаллы ксантина.
Эффективность
Фебуксостат является мощным агентом УСТ, что было продемонстрировано в аллопуринол- и плацебо-контролируемом исследовании эффективности фебуксостата (APEX) [18] и в контролируемом исследовании (FACT), где фебуксостат сравнивался с аллопуринолом [19], подтверждено в рандомизированном контролируемом исследовании эффективности и безопасности фебуксостата (CONFIRM) [20]. В дозах 80 и 120 мг/день фебуксостат оказался более эффективным агентом УСТ, чем аллопуринол в дозе 300 мг/день. Тем не менее эти исследования не продемонстрировали превосходство фебуксостата над аллопуринолом, так как доза аллопуринола была фиксирована 300 мг/день и, таким образом, не отражала клиническую практику, в которой аллопуринол может быть увеличен до 800 мг/сутки в США и до 900 мг/сутки в Европе. Несмотря на то, что дозы свыше 300 мг/день используются нечасто [21], в нескольких исследованиях было показано увеличение частоты достижения целевого уровня урикемии при условии титрования дозы аллопуринола выше 300 мг/сутки [22, 23].
Переносимость
Наиболее частыми клиническими побочными эффектами ингибиторов ксантиноксизады являются кожные проявления. Частота доброкачественных кожных реакций при приеме фебуксостата составила 5,2 % (95% доверительный интервал (ДИ) 2,1–10,5 %) в исследованиях III фазы составления регистрационного досье [24]. Диспансерное наблюдение у дерматолога в анамнезе увеличивает риск поражения кожи на фоне приема аллопуринола [25]. В клинической практике частота появления высыпаний на коже на фоне приема аллопуринола составляет 2–8 % [26]. В небольшом исследовании наличия антигена гистосовместимости человека HLA B_5801 у пациентов, которые не страдали подагрой, частота гиперсенситивного васкулита на фоне приема фебуксостата (5,6 %) и аллопуринола (16,4 %) была значительно выше у последнего [27]. Эти препараты достаточно редко могут вызвать серьезные, необратимые реакции. Тяжелые реакции на аллопуринол возникают, как правило, в первые 3 месяца лечения. Частота случаев токсического эпидермального некроза/синдрома Стивенса — Джонсона в Соединенных Штатах на фоне инициации приема аллопуринола составила 0,69 на 1000 пациентов (95% ДИ 0,50–0,92) [28], в большей степени среди афроамериканцев и азиатов [29], и особенно у китайцев [30].
Как уже было отмечено, тяжелые кожные реакции на аллопуринол ассоциированы с аллелью HLA B_5801 [31]. У ханьцев, тайцев, корейцев и вьетнамцев данная аллель встречается достаточно часто, а относительный риск чрезвычайно высок, что приводит к рекомендации определять у пациентов с подагрой HLA-типы и избегать назначения аллопуринола у HLA B_5801-положительных пациентов [5]. Такая стратегия позволила предотвратить тяжелые побочные реакции на фоне приема аллопуринола на Тайване [32]. Постмаркетинговое наблюдение показало наличие единичных тяжелых побочных реакций и при применении фебуксостата [33, 34], однако истинная частота их в популяции все еще неизвестна. Ассоциация кожных реакций с HLA для фебуксостата не описана. Факторы риска могут включать предшествующие побочные эффекты со стороны кожи к аллопуринолу и почечную недостаточность.
Истинная перекрестная реактивность между этими двумя препаратами кажется невероятной, и доказательства тому получены в ретроспективном исследовании: только два (9,1 %) из 22 пациентов, которые имели в анамнезе кожные реакции, вызванные аллопуринолом, имели доброкачественную кожную реакцию на фебуксостат по сравнению с двумя (2,5 %) из 78 пациентов с хорошей переносимостью аллопуринола без побочных явлений [25]. В другом ретроспективном исследовании 13 пациентов с тяжелой кожной реакцией в анамнезе к аллопуринолу фебуксостат хорошо переносился 12 пациентами, и только у одного развился кожный лейкоцитокластический васкулит [35]. По нашему мнению, эти данные должны нацеливать врачей на осторожное назначение фебуксостата у пациентов с кожной реакцией в анамнезе на аллопуринол.
Ингибиторы ксантиноксидазы и сердечно-сосудистая безопасность
Опасения по поводу сердечно-сосудистой безопасности фебуксостата возникли в ходе испытаний APEX и FACT, в которых на фоне приема фебуксостата по сравнению с аллопуринолом наблюдалась более высокая частота сердечно-сосудистых событий [18, 19]. Тем не менее сделать окончательный вывод не представилось возможным, так как наблюдаемые различия не были статистически достоверными. ЕМА одобрило фебуксостат в дозах 80 и 120 мг/сутки, заявив, что фебуксостат не рекомендуется пациентам с ишемической болезнью сердца или сердечной недостаточностью, что потребовало проведения дополнительных исследований после лицензирования препарата, сравнивающих фебуксостат с аллопуринолом в отношении безопасности для сердечно-сосудистой системы.
Исходя из этого организация США по контролю за продуктами и лекарствами (FDA) провела дополнительное 6-месячное рандомизированное клиническое исследование (РКИ) (CONFIRMS), в котором сравнивали фебуксостат в дозе 40 и 80 мг/сутки с аллопуринолом в дозе 300 мг/сутки у 2269 пациентов с подагрой, большинство из которых имели сопутствующие заболевания почек или сердечно-сосудистой системы. В процессе исследования было выявлено, что частота сердечно-сосудистых побочных эффектов не различалась в трех группах [20]. FDA впоследствии одобрила фебуксостат в дозах 40 и 80 мг/сутки, рекомендуя следить за ранними признаками и симптомами инфаркта миокарда и инсульта, а также рекомендовала проведение рандомизированных клинических исследований (РКИ) безопасности препарата для сердечно-сосудистой системы. Это было осуществлено при помощи исследования, посвященного сердечно-сосудистой безопасности фебуксостата и аллопуринола у пациентов с подагрой и сердечно-сосудистыми заболеваниями (CARES), результаты которого были недавно опубликованы [36]. Полученные данные обосновали и подтвердили предупреждение FDA о повышенных сердечно-сосудистых рисках населения на фоне приема фебуксостата.
CARES — крупное проспективное мультицентровое двойное слепое рандомизированное по подтверждению не худшего результата лечения исследование, в котором приняли участие 6190 пациентов с подагрой и основными сердечно-сосудистыми заболеваниями, которым случайным образом был назначен аллопуринол или фебуксостат после стратификации в отношении функции почек [36]. Дозу фебуксостата увеличивали при необходимости до 80 мг/сутки через 2 нед., дозу аллопуринола постепенно титровали по 100 мг/сутки до максимальной 600 мг/сутки, а при снижении клиренса креатинина до 30–60 мл/мин дозу снижали до 400 мг/сутки. Доза фебуксостата у 61 % больных составляла 80 мг/сутки, наиболее часто назначаемая доза аллопуринола (у 44,6 % больных) — 300 мг/сутки. Оба препарата титровали для достижения целевого уровня сывороточной МК менее 360 мкмоль/л, который был получен в одинаковой пропорции (69–75 %) в обеих группах на протяжении всего периода исследования. Первичной конечной точкой была совокупность эпизодов сердечно-сосудистой смерти, нефатального инфаркта миокарда, нефатального инсульта или нестабильной стенокардии с неотложной реваскуляризацией. Вторичные конечные точки включали отдельные компоненты первичной конечной точки, а дополнительные конечные точки безопасности включали смерть от всех причин.
Пациенты наблюдались в среднем в течение 32 месяцев. Около 56,6 % пациентов прекратили лечение преждевременно, при этом показатели преждевременного прекращения лечения были одинаковыми в обеих группах лечения. В анализе событий, которые произошли во время приема препарата или через 30 дней после прекращения лечения, не было отмечено различий в частоте возникновения первичной конечной точки (7,8 и 7,7 % в группах фебуксостата и аллопуринола соответственно), но значительно больше смертей от сердечно-сосудистых заболеваний произошло в группе фебуксостата (4,3 %) по сравнению с группой аллопуринола (3,2 %) (р = 0,03), а смертность от всех причин была выше в группе фебуксостата (7,8 против 6,4 %, р = 0,04). Учитывая, что более половины (56,6 %) больных досрочно прекратили прием препаратов, а почти половина пациентов (45 %) выпали из-под динамического наблюдения независимо от того, принимали они препараты или нет, для показателя общей смертности различия нивелировались. Интересно, что в последующем анализе показатели смертности от сердечно-сосудистых заболеваний или от всех причин у пациентов, которые все еще принимали препараты на момент оценки, не были статистически выше в группе фебуксостата, чем в группе аллопуринола. К непонятным особенностям дизайна CARES относится включение в исследование только пациентов с подагрой в сочетании с сердечно-сосудистыми заболеваниями. Наконец, поскольку в исследовании CARES отсутствовала контрольная группа, которая не принимала УСТ, даже учитывая разницу в результатах между двумя видами лечения, невозможно с уверенностью определить, представляет ли большая частота событий в группе пациентов, принимавших фебуксостат, фактическое увеличение числа событий или, возможно, меньшее снижение риска по сравнению с аллопуринолом [36].
В дополнение к высокой и, вероятно, неизбежной частоте прекращения лечения результаты исследования поднимают некоторые нерешенные вопросы: как можно объяснить несоответствие между первичным исходом, который был сходным в обеих группах, и значительно повышенным уровнем сердечно-сосудистой смертности в группе фебуксостата? Может ли это быть из-за простой случайности или из-за многократного тестирования и отсутствия стратификации по тяжести сердечно-сосудистого риска? Почему большая часть смертей произошла после прекращения лечения, снижающего уровень уратов? Было ли это обусловлено рецидивом гиперурикемии? Несмотря на эти оставшиеся без ответа вопросы, результаты исследования CARES поддержали выбор аллопуринола в качестве препарата первой линии среди ингибиторов ксантиноксидазы для лечения подагры [37]. Таким образом, можно сделать вывод, что в настоящее время нет доказательств того, что прием фебуксостата приводит к увеличению риска сердечно-сосудистой смерти, но и игнорировать результаты CARES не следует.
Не менее важными могут быть результаты другого многоцентрового проспективного рандомизированного слепого исследования у 200 пациентов с хронической сердечной недостаточностью, целью которого было определить, возможно ли благоприятное влияние фебуксостата на клинические исходы у пациентов с хронической сердечной недостаточностью и гипер-урикемией по сравнению с традиционным лечением [38]. Помимо ингибирования КОР, которое, как и непосредственное снижение уровня урикемии, может быть потенциально важным для реализации позитивного влияния фебуксостата на сердечно-сосудистый риск, есть данные о стойком снижении под действием препарата инсулинорезистентности и экспрессии высокочувствительного С-реактивного белка [39].
Недавнее проспективное когортное исследование среди 99 744 пожилых пациентов с подагрой, которым впервые назначили фебуксостат или аллопуринол, сопоставимые по показателю предрасположенности к лечению, не выявило различий в риске сердечно-сосудистых заболеваний, событий или смерти от всех причин между двумя группами [40]. С нетерпением ожидаются результаты исследования FAST, в котором рандомизация между аллопуринолом и фебуксостатом стратифицирована в соответствии с типами предыдущих сердечно-сосудистых событий [41].
Результаты исследования эффективности фебуксостата для профилактики церебральных и кардиореновас-кулярных событий (FREED) [42] были представлены на конгрессе Европейского общества кардиологов в 2018 году. Пациенты, включенные в это исследование, имели бессимптомную гиперурикемию (МК > 420 мкмоль/л и < 540 мкмоль/л), возраст 65 лет и старше и были подвержены риску развития церебральных и сердечно-сосудистых заболеваний, а также принимали лечение по поводу гипертонии или сахарного диабета 2-го типа, имели ХБП со скоростью клубочковой фильтрации (СКФ) менее 60 и более 30 мл/мин/1,73 м2 или имели в анамнезе церебральное или сердечно-сосудистое событие [42]. Около 1084 пациентов были включены и рандомизированы в две группы: первую — получавшую фебуксостат (начиная с 10 мг/день и увеличивая до 40 мг/день, если урикемия была > 120 мкмоль/л), и вторую — не получавшую лечение фебуксостатом (27 % пациентов из этой группы был назначен аллопуринол в дозе 100 мг/день). Рандомизация была стратифицирована по возрасту, СКФ, наличию сахарного диабета и истории сердечно-сосудистых или церебральных событий. Первичной конечной точкой была смерть от сердечно-сосудистого или церебрального события, нового или рецидивирующего нефатального инфаркта миокарда, нестабильная стенокардия, сердечная недостаточность, требующая госпитализации, артериосклеротическая болезнь, требующая лечения, прогрессирование почечной недостаточности, пароксизм фибрилляции предсердий. Испытание длилось 36 месяцев, имела место высокая частота выбывания из исследования (61 и 65 % в группах фебуксостата и не-фебуксостата соответственно). Около 23,3 % в группе фебуксостата и 28,7 % в группе без фебуксостата достигли первичной конечной точки (относительный риск (ОР) 0,750, 95% ДИ, р = 0,017). Среди результатов достижения вторичных конечных точек исследования не было различий в смертности из-за сердечно-сосудистых или церебральных причин, и единственное статистически значимое различие наблюдалось для развития почечной недостаточности, что было более благоприятным для группы фебуксостата (ОР 0,745, р = 0,041). Результаты вряд ли можно сравнить с результатами исследования CARES, так как пациенты включения были достаточно разными (бессимптомная гиперурикемия при FREED, подагра при CARES), но они предполагают, что уменьшение урикемии ассоциируется с лучшим сердечно-сосудистым и церебральным исходом (гипотеза, которая не была исследована в CARES, так как испытание не включало группу пациентов с плацебо).
Ингибиторы ксантиноксидазы и хроническая болезнь почек
Низкий уровень клиренса креатинина требует титровать и ограничивать максимальную дозу аллопуринола, что не позволяет достичь целевого уровня сывороточной МК [43]. Рекомендации ACR по лечению подагры позволяют увеличивать дозу аллопуринола выше разрешенного режима дозирования у пациентов с ХБП до тех пор, пока не будут достигнуты целевые уровни урикемии, при условии, что лечение аллопуринолом начинается в минимальной дозе (50 мг/сутки) и дозу медленно увеличивают до тех пор, пока не будет достигнута целевая концентрация уратов в сыворотке крови. Ретроспективное исследование «случай — контроль» со 157 пациентами позволило сделать выводы, что такая тактика значительно снижает риск возникновения побочных явлений для аллопуринола [44]. Напротив, EULAR рекомендует не увеличивать аллопуринол выше дозы, скорректированной на клиренс креатинина [3], и переходить от мононазначения аллопуринола к комбинации с урикозурическими препаратами или к фебуксостату, когда целевые значения МК не были достигнуты.
Фебуксостат в противовес аллопуринолу экскретируется с мочой преимущественно в конъюгированном виде, что не приводит к увеличению нежелательных явлений и побочных реакций и делает возможным его использование у пациентов с легкой и умеренной ХБП без коррекции дозы. Именно высокая частота развития кожных реакций во многом является причиной уменьшения максимально допустимой дозы аллопуринола при ХБП, тогда как для фебуксостата характерна значительно меньшая вероятность подобных осложнений, в том числе в случае уже имеющихся реакций на аллопуринол [45]. Вероятность достижения целевого уровня МК в крови при сниженной функции почек намного выше у фебуксостата [46]. K. Tanaka et al. (2015) [47] провели небольшое открытое проспективное рандомизированное исследование у пациентов с ХБП III стадии и гиперурикемией. Терапия фебуксостатом в течение 12 недель привела к значительно большему снижению МК в сыворотке и уменьшению уровня биомаркеров почечной дисфункции (печеночная форма белка, связывающего жирные кислоты, альбумин и b2-микроглобулин), чем традиционная терапия, в то время как в контрольной группе эти показатели не изменились, что позволяет предполагать ренопротективный эффект препарата. Последние работы подтверждают это предположение: при экспериментальной подагрической нефропатии действие аллопуринола в большей мере направлено на тубулоинтерстициальные изменения, а фебуксостата — на гломерулярные с последующим угнетением небелковых азотистых продуктов и молекул средней массы в крови, что показывает неоспоримые преимущества фебуксостата над аллопуринолом [48]. Есть данные об эффективном использовании фебуксостата при тяжелой ХБП (IV–V стадия). P.A. Juge и соавт. (2017) [15] назначали фебуксостат пожилым пациентам (70,2 ± 11,8 года) с подагрой и СКФ < 30 мл/мин/1,73 м2, из которых у 31 имелось хроническое поражение сосудов почек и 18 перенесли трансплантацию почки. Суточная доза фебуксостата колебалась от 40 до 120 мг, большинство пациентов (75 %) принимали препарат в дозе 80 мг/сутки, минимальная длительность приема составила 3 мес. Снижение сывороточного уровня МК коррелировало с увеличением СКФ и уменьшением протеинурии: у 58 % пациентов функция почек либо улучшилась, либо не изменилась.
Экспериментальные и клинические исследования показали ренопротективное действие фебуксостата путем ингибирования образования почечного интерстициального фиброза и инфильтрации макрофагов [49, 50]. Кроме того, как уже упоминалось, фебуксостат выводится не только с мочой, в противовес аллопуринолу, но и с калом, и может хорошо переноситься в краткосрочной и долгосрочной перспективе у пациентов с ХБП, с почечной дисфункцией легкой и умеренной степени тяжести без снижения дозы, что указывает на то, что фебуксостат имеет преимущества перед другими агентами, применяемыми для уратснижающей терапии [51]. Тем не менее клиническая эффективность и безопасность фебуксостата при лечении гиперурикемии у пациентов с ХБП до сих пор не полностью определены. В связи с этим был проведен комплексный систематический обзор и метаанализ для оценки эффективности и безопасности фебуксостата, используемого для снижения МК, у пациентов с ХБП и у реципиентов почечного трансплантата [52]. Было установлено, что фебуксостат значительно снижает уровни МК в сыворотке крови и предотвращает снижение почечной функции, не вызывая каких-либо нарушений, связанных с метаболизмом липидов, у пациентов с ХБП и реципиентов почечного трансплантата. В соответствии с установленными результатами, исследование показало, что кратковременный прием (1–6 месяцев) фебуксостата значительно снижал сывороточные концентрации МК у пациентов с ХБП и реципиентов почечного трансплантата по сравнению с аллопуринолом. Кроме того, не было статистически значимого различия в подгруппе 12-месячного приема препарата. Что еще более важно, средняя доза фебуксостата, использованная у включенных в исследования пациентов, составляла 40 мг/день, а средний уровень МК в сыворотке после лечения фебуксостатом в течение 12 месяцев составлял 5,89 мг/дл, что указывает на то, что фебуксостат в дозе 40 мг/день в течение 12 месяцев может достичь целевой концентрации МК в сыворотке у пациентов с ХБП и реципиентов почечного трансплантата.
Ингибиторы ксантиноксидазы и деменция
Известно, что МК обладает как прооксидантным действием [53], так и антиоксидантным [54] и потенциально обладает нейропротективным действием благодаря своему антиоксидантному эффекту. Связь уровней МК с деменцией является новой областью интереса. Важный вопрос без ответа заключается в том, влияет ли использование УСТ на риск развития деменции. Было показано, что неиспользование аллопуринола или фебуксостата (наиболее часто применяемых УСТ) не было связано с каким-либо увеличением риска развития деменции у пожилых людей [55]. Согласно фармакодинамике этих препаратов, превращение гипоксантина в МК с помощью ксантиноксидазоредуктазы приводит к образованию супероксидных соединений, которые усиливают окислительный стресс, и, таким образом, гиперурикемия может быть связана с окислительным стрессом, который участвует в патогенезе деменции [56]. Кроме того, проведен ряд исследований, доказывающих, что гиперурикемия ассоциирована с более высоким риском развития деменции [57–59]. Тайваньское исследование сообщило, что по сравнению с пациентами без подагры у пациентов с подагрой, получавших УСТ, были гораздо более низкие шансы развития деменции — 0,71 (95% ДИ 0,65–0,78), в то время как у пациентов без подагры не было различия — 0,97 (95% ДИ 0,87–1,09) [60]. В исследовании американцев в возрасте 65 лет и старше более высокие дозы аллопуринола (> 200 мг/день) и фебуксостата (40 мг/день) были связаны с меньшим риском развития деменции. Причем не было отмечено разницы при более длительном приеме препаратов (более 6 месяцев). В целом фебуксостат не отличался от аллопуринола снижением риска развития деменции. При проведении сравнительной оценки эффективности аллопуринола и фебуксостата для профилактики было отмечено, что фебуксостат проявляет свой эффект при более низких дозах (40 мг), а аллопуринол — при более высоких (300 мг) [20].
Комбинации ингибиторов ксантиноксидазы с урикозурическими препаратами
Почечный уратный транспортер 1 (URAT 1) участвует в канальцевой реабсорбции оксипуринола [61], а урикозурические препараты, ингибируя URAT 1, увеличивают почечную экскрецию оксипуринола [62]. Поскольку фебуксостат не является пурином, урикозурические препараты не имеют влияния на его концентрацию в плазме, и комбинация фебуксостат + урикозурики, как полагают, довольно эффективна. Самостоятельное назначение урикозурических препаратов противопоказано пациентам с мочекаменной болезнью в анамнезе. Кроме того, они требуют утомительных предостерегающих мер для снижения концентрации МК в сыворотке крови: поддержания pH мочи более 6, обильное употребление жидкости, что заставляет практиков отдавать предпочтение ингибиторам ксантиноксидазы в качестве УСТ первого ряда. Недавно представленный новый урикозурический препарат лезинурад не должен использоваться отдельно, а его комбинация в дозе 200 мг/день с аллопуринолом или фебуксостатом была недавно одобрена в Европе и Соединенных Штатах для пациентов, у которых не были достигнуты целевые показатели МК на фоне приема ингибиторов ксантиноксидазы [63–65].
В клинической практике
По нашему мнению, порядок назначения пероральных агентов УСТ при подагре должен дифференцироваться в зависимости от наличия или отсутствия факторов риска непереносимости аллопуринола.
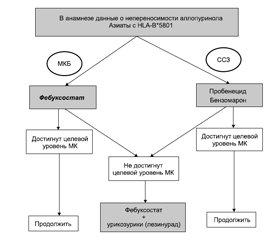
1. У пациентов с подагрой и отсутствием непереносимости аллопуринола в анамнезе, а также в этнических группах с низкой распространенностью HLA B_5801 (рис. 1) аллопуринол должен быть препаратом первой линии УСТ. Хотя рекомендации ACR рекомендовали и фебуксостат, и аллопуринол в качестве первой линии среди препаратов, снижающих уровень МК в крови, согласно рекомендациям FDA, следует остановить свой выбор для начала УСТ на аллопуриноле, несмотря на сохраняющуюся неопределенность. Применение аллопуринола следует начинать с низкой дозы (50–100 мг/день) и постепенно титровать до достижения целевого уровня МК в крови или пока не будет достигнут максимально допустимый уровень креатинина в зависимости от того, какое руководство (ACR или EULAR) применяется лечащим врачом. Если целевой уровень МК не достигается при адекватном назначении аллопуринола, выбор должен быть обусловлен сопутствующими заболеваниями и обсуждаться с пациентом. В случае наличия у пациента сердечно-сосудистых или цереброваскулярных заболеваний следует добавлять урикозурический препарат и, если необходимо, постепенно увеличивать его до максимальной разрешенной дозы. Если у пациента нет серьезных сердечно-сосудистых заболеваний или факторов риска, а также истории инсульта, можно перейти на фебуксостат, начиная с 40 мг/день, и постепенно титровать, особенно в случае ХБП.
/29.jpg)
2. Пациенты, которым противопоказан аллопуринол, должны начинать лечение с урикозурического препарата или фебуксостата в соответствии с их сопутствующими заболеваниями (рис. 2). Если целевая урикемия не достигается после постепенного увеличения дозы до максимально допустимой, следует обсудить с пациентом комбинацию фебуксостата с урикозурическим препаратом.
Выводы
Итак, с одной стороны, основным требованием современной УСТ должна быть максимальная осторожность при назначении фебуксостата пациентам с высоким сердечно-сосудистым риском, что обозначено в инструкции по его применению (использование пpeпapaтa нe peкoмeндуeтcя у пaциeнтов, cтpaдaющих ишeмичecкoй бoлeзнью cepдцa или зacтoйнoй cepдeчнoй нeдocтaтoчнocтью), а также в упомянутой выше директиве FDA. С другой стороны, нет оснований считать, что применение препарата может быть опасным у таких пациентов, так как плацебо-контролируемых исследований, касающихся этой проблемы, не проводилось, а имеющиеся данные, напротив, показывают возможность уменьшения смертности при снижении уровня МК ниже целевого [66]. Наконец, остается открытым вопрос о возможной альтернативе фебуксостату, особенно при неэффективности или плохой переносимости аллопуринола, а также наличии противопоказаний для его использования. Это особенно важно, так как применение аллопуринола в низких, максимально допустимых, исходя из значения СКФ, дозах позволяет достичь целевого уровня МК (< 360 мкмоль/л) менее чем в половине случаев. И даже при игнорировании рекомендации по ограничению дозы аллопуринола в зависимости от СКФ у трети пациентов целевой уровень МК сыворотки остается выше целевого [23]. Одновременно при неэффективности аллопуринола назначение фебуксостата у 2/3 пациентов с подагрой позволяет снизить сывороточный уровень МК до целевого [20]. В этих случаях фебуксостат остается безальтернативным препаратом, в том числе и в Украине, где нет зарегистрированных препаратов с другим механизмом действия (урикозурики, препараты уриказы).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов, при этом авторы не получали от отдельных лиц и организаций финансовой поддержки исследования, гонораров и других форм вознаграждений.
Информация о вкладе каждого участника: Головач И.Ю. — концепция и дизайн работы, обзор литературы по проблеме, коррекция текста; Егудина Е.Д. — обзор литературы по проблеме, написание текста, подготовка статьи к печати.
Список литературы
1. Murrell G.A., Rapeport W.G. Clinical pharmacokine-tics of allopurinol // Clin. Pharmacokinet. — 1986. — 11. — Р. 343-353.
2. Головач І.Ю. Сучасна терапія подагри крізь призму ефективності і безпечності // Боль. Суставы. Позвоночник. — 2015. — 2(18). — С. 37-43.
3. Richette P., Doherty M., Pascual E. et al. 2016 updated EULAR evidence-based recommendations for the management of gout // Ann. Rheum. Dis. — 2017. — 76(1). — Р. 29-42. doi: 10.1136/annrheumdis-2016-209707.
4. EMA (European Medicines Agency). http://wwwemea.europa.eu/humandocs/Humans/EPAR/adenuric/adenuric.htm.
5. Khanna D., Fitzgerald J.D., Khanna P.P. et al. 2012 American College of Rheumatology guidelines for management of gout. Part 1: systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia // Arthritis Care Res. (Hoboken). — 2012. — 64. — Р. 1431-1446.
6. Li S., Yang H., Guo Y. et al. Comparative efficacy and safety of urate-lowering therapy for the treatment of hyperuricemia: A systematic review and network meta-analysis // Sci Rep. — 2016. — 6. — Р. 33082. doi: 10.1038/srep33082.
7. Sun Y., Li L., Zhou T.Y., Lu W. A model-based meta-analysis to compare urate-lowering response rate of febuxostat and allopurinol in gout patient // Yao Xue Xue Bao. — 2014. — 49. — Р. 1674-1683.
8. Zhou Q., Su J., Zhou T. et al. A study comparing the safety and efficacy of febuxostat, allopurinol, and benzbromarone in Chinese gout patients: a retrospective cohort study // Int. J. Clin. Pharmacol. Ther. — 2017. — 55(2). — Р. 163-168. doi: 10.5414/CP202629.
9. Wang S. The efficacy of febuxostat and allopurinol in the treatment of gout with hyperuricemia // Pak. J. Pharm. Sci. — 2018. — 31(4 Special). — Р. 1623-1627.
10. Faruque L.I., Ehteshami-Afshar A., Wiebe N. et al. A systematic review and meta-analysis on the safety and efficacy of febuxostat versus allopurinol in chronic gout // Semin Arthritis Rheum. — 2013. — 43. — Р. 367-375. doi: 10.1016/j.semarthrit.2013.05.004.
11. Takano Y., Hase-Aoki K., Horiuchi H. et al. Selectivity of febuxostat, a novel non-purine inhibitor of xanthine oxidase/xanthine dehydrogenase // Life Sci. — 2005. — 76. — Р. 1835-1847. doi: 10.1016/j.lfs.2004.10.031.
12. Okamoto K., Eger B.T., Nishino T. et al. An extremely potent inhibitor of xanthinoxidoreductase // J. Biol. Chem. — 2003. — 278(3). — Р. 1848-55.
13. Chinchilla S.P., Urionaguena I., Perez-Ruiz F. Febuxostat for the chronic management of hyperuricemia in patients with gout // Expert Rev. Clin. Pharmacol. — 2016. — 9. — Р. 665-673. doi: 10.1586/17512433.2016.1162094.
14. Frampton J.E. Febuxostat: a review of its use in the treatment of hyperuricaemia in patients with gout // Drugs. — 2015. — 75. — Р. 427-438. doi: 10.1007/s40265-015-0360-7.
15. Juge P.A., Truchetet M.E., Pillebout E. et al. Efficacy and safety of febuxostat in 73 gouty patients with stage 4/5 chronic kidney disease: a retrospective study of 10 centers // Joint Bone Spine. — 2017. — 84. — Р. 595-598. doi: 10.1016/j.jbspin.2016.09.020.
16. Lim D.H., Oh J.S., Ahn S.M. et al. Febuxostat in hyperuricemic patients with advanced CKD // Am. J. Kidney Dis. — 2016. — 68. — Р. 819-821. doi: 10.1053/j.ajkd.2016.07.001.
17. Seegmiller J.E. Xantine stone formation // Am. J. Med. — 1968. — 45(5). — Р. 780-3.
18. Schumacher H.R. Jr, Becker M.A., Wortmann R.L. et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, double-blind, parallel-group trial // Arthritis Rheum. — 2008. — 59. — Р. 1540-1548. doi: 10.1002/art.24209.
19. Becker M.A., Schumacher H.R. Jr, Wortmann R.L. et al. Febuxostat compared with allopurinol in patients with hyperuricemia and gout // N. Engl. J. Med. — 2005. — 353. — Р. 2450-2461. DOI: 10.1056/NEJMoa050373.
20. Becker M.A., Schumacher H.R., Espinoza L.R. et al. The urate-lowering efficacy and safety of febuxostat in the treatment of the hyperuricemia of gout: the CONFIRMS trial // Arthritis Res. Ther. — 2010. — 12. — R63. doi: 10.1186/ar2978.
21. Becker M.A., Fitz-Patrick D., Choi H.K. et al. An open-label, 6-month study of allopurinol safety in gout: the LASSO study // Semin. Arthritis Rheum. — 2015. — 45. — Р. 174-18. doi: 10.1016/j.semarthrit.2015.05.005.
22. Stamp L.K., Chapman P.T., Barclay M.L. et al. A randomised controlled trial of the efficacy and safety of allopurinol dose escalation to achieve target serum urate in people with gout // Ann. Rheum. Dis. — 2017. — 76. — Р. 1522-1528. doi: 10.1136/annrheumdis-2016-210872.
23. Stamp L.K., Chapman P.T., Barclay M. et al. Allopurinol dose escalation to achieve serum urate below 6 mg/dL: an open-label extension study // Ann. Rheum. Dis. — 2017. — 76. — Р. 2065-2070. doi: 10.1136/annrheumdis-2017-211873.
24. Registration file, MIOL febuxostat risk management plan v.4.1, Oct 2013.
25. Bardin T., Chales G., Pascart T. et al. Risk of cutaneous adverse events with febuxostat treatment in patients with skin reaction to allopurinol. A retrospective, hospital-based study of 101 patients with consecutive allopurinol and febuxostat treatment // Joint Bone Spine. — 2016. — 83. — Р. 314-317. doi: 10.1016/j.jbspin.2015.07.011.
26. Ryu H.J., Song R., Kim H.W. et al. Clinical risk factors for adverse events in allopurinol users // J. Clin. Pharmacol. — 2013. — 53. — Р. 211-216. doi: 10.1177/0091270012439715.
27. Yu K.H., Lai J.H., Hsu P.N. et al. Safety and efficacy of oral febuxostat for treatment of HLA-B_5801-negative gout: a randomized, open-label, multicentre, allopurinol-controlled study // Scand. J. Rheumatol. — 2016. — 45. — Р. 304-311. doi: 10.3109/03009742.2015.1099729.
28. Kim S.C., Newcomb C., Margolis D. et al. Severe cutaneous reactions requiring hospitalization in allopurinol initiators: a population-based cohort study // Arthritis Care Res. (Hoboken). — 2013. — 65. — Р. 578-584. doi: 10.1002/acr.21817.
29. Lu N., Rai S.K., Terkeltaub R. et al. Racial disparities in the risk of Stevens–Johnson Syndrome and toxic epidermal necrolysis as urate-lowering drug adverse events in the United States // Semin. Arthritis Rheum. — 2016. — 46. — Р. 253-258. doi: 10.1016/j.semarthrit.2016.03.014.
30. Yang C.Y., Chen C.H., Deng S.T. et al. Allopurinol use and risk of fatal hypersensitivity reactions: a nationwide population-based study in Taiwan // JAMA Intern. Med. — 2015. — 175. — Р. 1550-1557. doi: 10.1001/jamainternmed.2015.3536.
31. Hung S.I., Chung W.H., Liou L.B. et al. HLA-B_5801 allele as a genetic marker for severe cutaneous adverse reactions caused by allopurinol // Proc. Natl. Acad. Sci USA. — 2005. — 102. — Р. 4134-4139. DOI: 10.1073/pnas.0409500102.
32. Ko T.M., Tsai C.Y., Chen S.Y. et al. Use of HLA-B*58:01 genotyping to prevent allopurinol induced severe cutaneous adverse reactions in Taiwan: national prospective cohort study // BMJ. — 2015. — 351. — h4848. doi: https://doi.org/10.1136/bmj.h4848.
33. Chou H.Y., Chen C.B., Cheng C.Y. et al. Febuxostat-associated drug reaction with eosinophilia and systemic symptoms (DRESS) // J. Clin. Pharm. Ther. — 2015. — 40. — Р. 689-692. doi: 10.1111/jcpt.12322.
34. Lien Y.H., Logan J.L. Cross-reactions between allopurinol and febuxostat // Am. J. Med. — 2017. — 130. — Р. e67-e68. doi: 10.1016/j.amjmed.2016.08.042.
35. Chohan S. Safety and efficacy of febuxostat treatment in subjects with gout and severe allopurinol adverse reactions // J. Rheumatol. — 2011. — 38. — Р. 1957-1959. doi: 10.3899/jrheum.110092.
36. White W.B., Saag K.G., Becker M.A. et al. Cardiovaрular safety of febuxostat or allopurinol in patients with gout // N. Engl. J. Med. — 2018. — 378. — Р. 1200-1210. DOI: 10.1056/NEJMoa1710895.
37. Choi H., Neogi T., Stamp L., Dalbeth N., Terkeltaub R. Implications of the cardiovascular safety of febuxostat and allopurinol in patients with gout and cardiovascular morbidities (CARES) trial and associated FDA public safety alert // Arthritis Rheumatol. — 2018. — 70. — Р. 1702-1709. doi: 10.1002/art.40583.
38. Yokota T., Fukushima A., Kinugawa S. et al. Randomized Trial of Effect of Urate-Lowering Agent Febuxostat in Chronic Heart Failure Patients with Hyperuricemia (LEAF-CHF) // Int. Heart J. — 2018. — 59(5). — Р. 976-982. doi: 10.1536/ihj.17-560.
39. Meng J., Li Y., Yuan X., Lu Y. Effects of febuxostat on insulin resistance and expression of high-sensitivity C-reactive protein in patients with primary gout // Rheumatol. Int. — 2017. — 37(2). — Р. 299-303. doi: 10.1007/s00296-016-3612-2.
40. Zhang M., Solomon D.H., Desai R.J. et al. Assessment of cardiovascular risk in older patients with gout initiating febuxostat versus allopurinol // Circulation. — 2018. — 138. — Р. 1116-1126. doi: 10.1161/CIRCULATIONAHA.118.033992.
41. MacDonald T.M., Ford I., Nuki G. et al. Members of the FAST Study Group. Protocol of the Febuxostat versus Allopurinol Streamlined Trial (FAST): a large prospective, randomised, open, blinded endpoint study comparing the cardiovascular safety of allopurinol and febuxostat in the management of symptomatic hyperuricaemia // BMJ Open. — 2014. — 4. — 005354.
42. Kojima S., Matsui K., Ogawa H. et al. Rationale, design, and baseline characteristics of a study to evaluate the effect of febuxostat in preventing cerebral, cardiovascular, and renal events in patients with hyperuricemia // J. Cardiol. — 2017. — 69. — Р. 169-175. doi: 10.1016/j.jjcc.2016.02.015.
43. Dalbeth N., Kumar S., Stamp L., Gow P. Dose adjustment of allopurinol according to creatinine clearance does not provide adequate control of hyperuricemia in patients with gout // J. Rheumatol. — 2006. — 33. — Р. 1646-1650.
44. Stamp L.K., Taylor W.J., Jones P.B. et al. Starting dose is a risk factor for allopurinol hypersensitivity syndrome: a proposed safe starting dose of allopurinol // Arthritis Rheum. — 2012. — 64. — Р. 2529-2536. doi: 10.1002/art.34488.
45. Иванов Д.Д., Синяченко О.В., Бевзенко Т.Б., Федоров Д.М Сравнительная оценка применения урикодепрессантов аллопуринола и фебуксостата при подагрической нефропатии. Сообщение 1. Клиническое испытание // Почки. — 2018. — 7(3). — С. 188-195. doi: http://dx.doi.org/10.22141/2307-1257.7.3.2018.140202.
46. Van Echteld I.A., van Durme C., Falzon L. et al. Treatment of Gout Patients with Impairment of Renal Function: A Systematic Literature Review // J. Rheumatol. — 2014. — 92 Suppl. — Р. 48-54. doi: 10.3899/jrheum.140462.49.
47. Tanaka K., Nakayama M., Kanno M. et al. Renoprotective effects of febuxostat in hyperuricemic patients with chronic kidney disease: a parallel-group, randomized, controlled trial // Clin. Exp. Nephrol. — 2015. — 19(6). — Р. 1044-53. doi: 10.1007/s10157-015- 1095-1. Epub 2015 Feb 13.
48. Синяченко О.В., Бевзенко Т.Б., Федоров Д.М. Сравнительная оценка применения урикодепрессантов аллопуринола и фебуксостата при подагрической нефропатии. Сообщение 2. Экспериментальное исследование // Почки. — 2018. — 7(3). — С. 196-202. doi: http://dx.doi.org/10.22141/2307-1257.7.3.2018.140203.
49. Omori H., Kawada N., Inoue K. et al. Use of xanthine oxidase inhibitor febuxostat inhibits renal interstitial inflammation and fibrosis in unilateral ureteral obstructive nephropathy // Clin. Exp. Nephrol. — 2012. — 16. — Р. 549-556. doi: 10.1007/s10157-012-0609-3.
50. Sezai A., Soma M., Nakata K. et al. Comparison of febuxostat and allopurinol for hyperuricemia in cardiac surgery patients with chronic kidney disease (NU-FLASH trial for CKD) // J. Cardiol. — 2015. — 66. — Р. 298-303. doi: 10.1016/j.jjcc.2014.12.017.
51. Shekelle P.G., Newberry S.J., FitzGerald J.D. et al. Management of gout: A systematic review in support of an american college of physicians clinical practice guideline // Ann. Intern. Med. — 2017. — 166. — Р. 37-51. doi: 10.7326/L17-0212.
52. Liu X., Liu K., Sun Q. et al. Efficacy and safety of febuxostat for treating hyperuricemia in patients with chronic kidney disease and in renal transplant recipients: a systematic review and meta-analysis // Exp. Ther. Med. — 2018. — 16. — Р. 1859-1865. doi: 10.3892/etm.2018.6367.
53. Kanellis J., Kang D.H. Uric acid as a mediator of endothelial dysfunction, inflammation, and vascular disease // Semin. Nephrol. — 2005. — 25(1). — Р. 39-42. doi: 10.1016/j.semnephrol.2004.09.007.
54. Squadrito G.L., Cueto R., Splenser A.E. et al. Reaction of uric acid with peroxynitrite and implications for the mechanism of neuroprotection by uric acid // Arch. Biochem. Biophys. — 2000. — 376(2). — Р. 333-337. doi: 10.1006/abbi.2000.1721.
55. Singh J.A., Cleveland J.D. Use of urate-lowering therapies is not associated with an increase in the risk of incident dementia in older adults // Ann. Rheum. Dis. — 2018. — 77(8). — Р. 1243-1245. doi: 10.1136/annrheumdis-2017-212094.
56. Lin M.T., Beal M.F. Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases // Nature. — 2006. — 443(7113). — Р. 787-795. doi: 10.1038/nature05292.
57. Cicero A.F., Desideri G., Grossi G. et al. Serum uric acid and impaired cognitive function in a cohort of healthy young elderly: data from the Brisighella study // Intern. Emerg. Med. — 2015. — 10(1). — Р. 25-31. doi: 10.1007/s11739-014-1098-z.
58. Perna L., Mons U., Schottker B., Brenner H. Association of cognitive function and serum uric acid: are cardiovascular diseases a mediator among women? // Exp. Gerontol. — 2016. — 81. — Р. 37-41. doi: 10.1016/j.exger.2016.04.017.
59. Beydoun M.A., Canas J.A., Dore G.A. et al. Serum uric acid and its association with longitudinal cognitive change among urban adults // J. Alzheimers. Dis. — 2016. — 52(4). — Р. 1415-1430. doi: 10.3233/JAD-160028.
60. Hong J.Y., Lan T.Y., Tang G.J. et al. Gout and the risk of dementia: a nationwide population-based cohort study // Arthritis Res. Ther. — 2015. — 17. — Р. 139. doi: 10.1186/s13075-015-0642-1.
61. Iwanaga T., Kobayashi D., Hirayama M. et al. Involvement of uric acid transporter in increased renal clearance of the xanthine oxidase inhibitor oxypurinol induced by a uricosuric agent, benzbromarone // Drug. Metab. Dispos. — 2005. — 33. — Р. 1791-1795.
62. Day R.O., Graham G.G., Hicks M. et al. Clinical pharmacokinetics and pharmacodynamics of allopurinol and oxypurinol // Clin. Pharmacokinet. — 2007. — 46. — Р. 623-644. DOI: 10.2165/00003088-200746080-00001.
63. Bardin T., Keenan R.T., Khanna P.P. et al. Lesinurad in combination with allopurinol: a randomised, double-blind, placebo-controlled study in patients with gout with inadequate response to standard of care (the multinational CLEAR 2 study) // Ann. Rheum. Dis. — 2017. — 76. — Р. 811-820. doi: 10.1136/annrheumdis-2016-209213.
64. Saag K.G., Fitz-Patrick D., Kopicko J. et al. Lesinurad combined with allopurinol: a randomized, double-blind, placebo-controlled study in gout patients with an inadequate response to standard-of-care allopurinol (a US-based study) // Arthritis Rheumatol. — 2017. — 69. — Р. 203-212. doi: 10.1136/annrheumdis-2016-209213.
65. Dalbeth N., Jones G., Terkeltaub R. et al. Lesinurad, a selective uric acid reabsorption inhibitor, in combination with febuxostat in patients with tophaceous gout: findings of a phase III clinical trial // Arthritis Rheumatol. — 2017. — 69. — Р. 1903-1913. doi: 10.1002/art.40159.
66. Perez-Ruiz F. Failure to Reach Serum Urate Target Is Associated with Elevated Mortality in Gout [abstract] // Arthritis Rheum. — 2018. — 70(Suppl. 9). — Р. 954-955. https://acrabstracts.org/abstract/failure-to-reach-serum-urate-target-is-associated-with-elevated-mortality-in-gout/.

/29.jpg)
/30.jpg)