Журнал "Гастроэнтерология" Том 53, №2, 2019
Вернуться к номеру
Кишковий мікробіом й остеоартрит
Авторы: Губська О.Ю., Кузьмінець А.А., Гуцул В.М., Лавренчук І.О.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Вивчення кишкового мікробіому є дуже актуальною темою, популярною серед дослідників. За нею проводиться велика кількість досліджень. На сьогодні високими темпами зростає кількість даних щодо кишкового мікробіому людини як у здоровому стані, так і за різних патологічних станів. Зі зростанням накопичених даних розширюється розуміння того, що мікробіом є дуже складною системою, частини якої знаходяться у тісних відношеннях з організмом хазяїна, а також реагують на фактори навколишнього середовища, у тому числі на раціон харчування та ліки. Дослідники знаходять все більше даних щодо взаємного впливу прийому медикаментів, кишкової мікрофлори та позакишкових захворювань. Дана стаття присвячена огляду даних, що наявні у сучасній літературі, щодо особливостей стану кишкової мікрофлори у хворих на остеоартрит, її можливого впливу на патогенез даного захворювання, а також змінам, які виникають у мікробіомі на фоні лікування остеоартриту, зокрема за допомогою нестероїдних протизапальних препаратів.
Изучение кишечного микробиома является очень актуальной темой, популярной среди исследователей. По ней проводится большое количество исследований. В настоящее время высокими темпами растет количество данных относительно кишечного микробиома человека как в здоровом состоянии, так и при различных патологических состояниях. С ростом накопленных данных расширяется понимание того, что микробиом является весьма сложной системой, части которой находятся в тесных взаимоотношениях с организмом хозяина, а также реагируют на факторы окружающей среды, в том числе на рацион питания и лекарства. Исследователи находят все больше данных относительно взаимного влияния приема медикаментов, кишечной микрофлоры и внекишечных заболеваний. Cтатья посвящена обзору данных, имеющихся в современной литературе, об особенностях состояния кишечной микрофлоры у больных остеоартритом, ее возможному влиянию на патогенез данного заболевания, а также изменениям, которые возникают в микробиоме на фоне лечения остеоартрита, в частности с помощью нестероидных противовоспалительных препаратов.
The study of intestinal microbiome is a very relevant topic popular among researchers, and a large number of studies are conducted. Currently, the amount of data on the human intestinal microbiome is growing at a high rate, both in health and in various pathological conditions. With an increase in the amount of the accumulated data, there is an expanded understanding that the microbiome is a very complex system, parts of which are in close relationship with the host organism, and react to environmental factors, including diet and medication intake. Researchers find more and more data on the correlation between medications, intestinal microflora and extraintestinal diseases. This article provides an overview of the data available in modern literature on the peculiarities of the state of intestinal microflora in patients with osteoarthritis, its possible impact on the disease pathogenesis, as well as changes that occur in the microbiome during treatment of osteoarthritis, particularly when using nonsteroidal anti-inflammatory drugs.
кишковий мікробіом; остеоартрит; нестероїдні протизапальні препарати; запалення слизової оболонки кишечника
кишечный микробиом; остеоартрит; нестероидные противовоспалительные препараты; воспаление слизистой оболочки кишечника
intestinal microbiome; osteoarthritis; nonsteroidal anti-inflammatory drugs; inflammation of the intestinal mucosa
На сьогодні накопичується все більше даних щодо взаємного зв’язку між кишковою мікрофлорою та розвитком патології опорно-рухового апарату. Вже не викликає сумнівів вплив кишкової мікробіоти на виникнення ожиріння та метаболічного синдрому [1, 2]. У той же час є добре відомими відношення цих двох патологій з остеоартритом (ОА). Серед особливостей цієї патології — чітка асоціація ОА колінних суглобів з ожирінням та ОА кистей з проявами метаболічного синдрому — гіперглікемією, гіперліпідемією, а також зі змінами складу кишкової мікрофлори [3, 4]. Досліджено, що у хворих на ОА при ожирінні збільшується кількість умовно-патогенних бактерій на фоні зменшення вмісту бактероїдів; також у таких хворих зі збільшенням ступеня ожиріння підвищується частота виділення ентерококів при зниженні їх абсолютної кількості у складі мікробіому [5]. Досить детально вивчено роль кишкової мікрофлори в патогенезі автоімунних захворювань, у тому числі запальних захворювань суглобів — ревматоїдного артриту, анкілозуючого спондилоартриту і псоріатичного артриту [6, 7]. Важливе значення в активації запального процесу у хворих на ревматоїдний артрит має такий кишковий мікроорганізм, як Prevotella copri [8].
Значно менша кількість даних стосується ролі кишкової мікробіоти у патогенезі ОА. Так, в експериментальних роботах показано значення кишкової мікрофлори в генезі запального ушкодження хряща у тварин з ожирінням [9]. Одним із факторів, що провокують таке пошкодження, вважають бактеріальні ліпополісахариди, що виробляються кишковими мікроорганізмами — грамнегативними бактеріями. В умовах підвищеної кишкової проникності рівень ліпополісахаридів підвищується у пацієнтів з ОА не тільки в крові, але і в синовіальній рідині. Їх концентрація корелює з тяжкістю ураження суглобів, вираженістю больового синдрому і ступенем звуження суглобової щілини [10]. В експерименті показано, що застосування пребіотика — олігофруктози у тварин з ожирінням й остеоартритом призводить до нормалізації кишкової мікрофлори, зменшення мікрозапалення (у тому числі синовіальної оболонки) і вираженості ураження суглобів [11]. Обговорюється місце кишкової мікрофлори у розвитку остеопорозу [12]. Добре відомими є стосунки остеопорозу й ОА [13].
Зосередимося докладніше на можливих механізмах впливу кишкових мікроорганізмів на суглоби. Грамнегативна кишкова мікрофлора здатна продукувати, а потім виділяти везикули, що містять ліпополісахариди та протеїни. Везикули, особливо за підвищеної кишкової проникності, здатні всмоктуватися в кров і поширюватися по всьому організму, в тому числі проникати в порожнину суглобів. Залежно від свого складу такі везикули можуть обумовлювати як про-, так і протизапальну дію. Прозапальний ефект ліпополісахаридів значною мірою обумовлений ліпідом А, сполученим із ліпідзв’язуючим протеїном. Подібний прозапальний комплекс активує нейтрофіли і макрофаги. Активовані клітини запускають запальний каскад, що включає інтерлейкін (IL)-1β, фактор некрозу пухлин (TNF), матриксні металопротеїнази, вільні радикали, які несприятливо впливають на суглобові структури [14]. Підвищений рівень мікробних ліпополісахаридів викликає мікрозапалення, характерне для хворих з ожирінням і метаболічним синдромом. Він, у свою чергу, активує синтез прозапальних цитокінів, таких як IL-1, IL-6, TNF-α, інгібітор активатора плазміногена 1, що в подальшому призводить до запалення [5]. Добре відоме значення Toll-like рецепторів (TLR) четвертого типу і їх корецептора MD-2 в активації як макрофагів, так і синовіоцитів. Особливо значущою є роль цього механізму при вживанні в їжу великої кількості тваринних жирів. У фізіологічних умовах мікробні ліпополісахариди інактивуються печінкою, однак при їх надлишку відбувається накопичення таких продуктів в гепатоцитах із формуванням неалкогольної жирової хвороби печінки зі зниженням її знешкоджуючої здатності. У товстому кишечнику за цих умов спостерігається дисбіоз, що супроводжується зменшенням кількості грампозитивних біфідобактерій і наростанням грамнегативної флори. Ще одним фактором ризику ОА є низька фізична активність, яка супроводжується зниженням рівня ліпопротеїдів високої щільності, які здатні знижувати рівень ліпополісахаридів і запобігати пошкодженню не тільки печінки, але і суглобів [10].
Одним із механізмів впливу кишкових мікроорганізмів на перебіг ОА може бути зміна метаболізму різних лікарських засобів під впливом останніх. Цікаві дані наведені в дослідженні Q. Wang та співавт. (2017), які показали, що деградація хондроїтину у кишечнику залежить, з одного боку, від співвідношення мікроорганізмів, які секретують сульфатазу, та сульфатредукуючих бактерій, з іншого — їх антагоніста — Akkermansia muciniphila. Обидві ці групи мікроорганізмів конкурують за субстрат, що містить сульфгідрильні групи, в даному випадку — хондроїтин. Тому в присутності A.muciniphila, що захищає хондроїтину сульфат від розпаду, препарат ефективний, а за її відсутності — ні [15]. У невеликому китайському дослідженні визначено роль Bacteroides thetaiotaomicron J1, Bacteroides thetaiotaomicron 82, Bacteroides ovatus E3 та Clostridium hathewayi R4 в деградації хондроїтину сульфату у здорових людей [16].
Важливим є те, що під впливом лікування ОА нестероїдними протизапальними препаратами (НПЗП), незалежно від того, чи це селективні чи неселективні препарати, є великий ризик виникнення НПЗП-асоційованих уражень кишечника. У зв’язку з тим, що НПЗП-асоційовані ентеропатії здебільшого мають асимптоматичний характер, протягом тривалого часу цій проблемі не приділялось належної уваги лікарів. За відсутності будь-яких специфічних маркерів діагностики ентеропатій було впроваджено метод відеокапсульної ентероскопії, який використовується на даний час та має високу інформативність. З метою спрощення діагностики були запропоновані неінвазивні методи виявлення кишкового запалення, одним з яких стало визначення в калі пацієнта кальпротектину (КП). КП є цитозольним нейтрофільним білком, який не має властивості руйнуватися в процесі травлення та відображає наявність запальних процесів в кишечнику [17].
Не менш значущою є роль кишкових мікроорганізмів у виникненні побічних ефектів НПЗП. Приклад — добре відомий потенціюючий вплив Helicobacter pylori на розвиток НПЗП/аспірин-асоційованої гастропатії [18, 19]. Останнім часом накопичено нові дані щодо внутрішньопросвітної флори в пошкодженні нижніх відділів шлунково-кишкового тракту. При цьому вирішальне значення має згаданий вище механізм активації TLR4 бактеріальними ліпополісахаридами з подальшим залученням нейтрофілів. Наявні результати досліджень, які свідчать, що у щурів з нейтропенією прийом НПЗП не супроводжувався кишковим пошкодженням. В інших експериментальних роботах показано відсутність ерозивно-виразкових змін у тонкій кишці у безмікробних (germ-free) щурів та гризунів, які отримували антибіотики, що забезпечують стерилізацію кишечника [20]. Варто зазначити, що при стресі стимуляція глюкокортикоїдних рецепторів призводить до зміни кишкової проникності, збільшення вмісту грамнегативної мікрофлори та наростання пошкоджуючого впливу НПЗП на слизову оболонку тонкої кишки [21]. Однак через різний склад кишкового мікробіому у щурів і людини не можна механічно переносити дані, отримані на гризунах, на людей, у клінічну практику. Тому необхідні подальші дослідження значення кишкового дисбіозу у генезі НПЗП-індукованої ентеропатії у людини.
Цікаві дані отримані дослідниками з США щодо гендерної відмінності у кишковій проникності та складі кишкової мікрофлори. Так, у здорових жінок порівняно з чоловіками встановлено більш виражене розмаїття мікробіоти у верхніх і нижніх відділах шлунково-кишкового тракту. При цьому у жінок спостерігається менша кишкова проникність. Застосування такого НПЗП, як індометацин, у представників жіночої чи чоловічої статі призводить до збільшення кишкової проникності. Але у жінок додатково спостерігалося зменшення різноманітності мікрофлори та збільшення вмісту у кишечнику мікроорганізму роду Prevotella. Після припинення прийому індометацину досить швидко спостерігаються оборотні зміни у вигляді відновлення кишкової проникності та складу мікрофлори [22]. За даними, наведеними у статті Y. Li та ін. (2016), з посиланням на дослідження C. Haro та ін. (2016), у жінок більш поширеним є рід Bacteroides, менш поширеним — рід Bilophila, при частішому виявленні родів Veillonella та Methanobrevibacter [23, 24]. Також, розглядаючи гендерно-залежні особливості зв’язків зі складом кишкової мікробіоти, було доведено, що у тварин, а саме у мишей, також спостерігається гендерна відмінність. Це проявляється у зміні добових коливань у мікробіоті кишечника, які мають більш високий рівень у самок, ніж у самців. Проте у самок мишей спостерігається менша кількість бактерій у фекаліях порівняно із самцями. Це все ще раз доводить те, що гени, які детермінують стать, мають значний вплив на кишкову мікрофлору [23]. Як згадувалося вище, мікроорганізми роду Prevotella мають високий прозапальний потенціал та активують Т-хелпер-17 (Th17)-опосередкований механізм запалення. Пусковим моментом у цьому механізмі є стимуляція TLR2 з подальшим збільшенням синтезу IL-23, -1, -6 та -8. Саме цю активацію у даний час пов’язують з розвитком ревматоїдного артриту, індукованого кишкової мікробіотою [25, 26].
Одним із клінічних доказів взаємного зв’язку складу кишкової мікробіоти та формування НПЗП-ентеропатії є дані про те, що при 3-місячному прийомі НПЗП наявність синдрому надлишкового бактеріального росту у 6,5 раза підвищує ризик розвитку виражених ерозивно-виразкових уражень тонкої кишки [27]. У той же час використання протягом 2 тижнів у хворих, які отримують НПЗП, рифаксиміну повністю запобігає серйозним ушкодженням та значно зменшує частоту незначних ушкоджень тонкої кишки (ТК) [28]. Ще одним доказом взаємозв’язку складу кишкової мікробіоти та шкідливої дії НПЗП є позитивний вплив деяких пробіотиків на виникнення таких ушкоджень. Показано, що комбінований пробіотик VSL-3 (4 штами Lactobacilli, 3 — Bifidobacteria та Streptococcus salivaris) попереджує індометацин-індуковане пошкодження ТК, що оцінювалося по зниженню виділення фекального кальпротектину [29]. В іншому дослідженні використання пробіотика на основі Lactobacillus casei дозволило усунути пошкодження слизової оболонки тонкої кишки, викликане одночасним прийомом аспірину та омепразолу [30]. У ще одному рандомізованому дослідженні був показаний протективний вплив Lactobacillus gasseri на слизову оболонку (СО) ТК у хворих, які тривалий час отримують низькі дози аспірину [31]. В оглядовій статті К. Otani та співавт. (2017) докладно розглядаються вплив кишкової мікрофлори на виникнення НПЗП-індукованої ентеропатії, потенціювання негативного впливу останніх поєднанням з інгібіторами протонної помпи (ІПП), а також перспективи лікувально-профілактичного впливу на кишкову мікробіоту за допомогою пробіотиків та ребаміпіду [18, 32].
Що стосується впливу рівня селективності НПЗП на стан кишечника, науковцями були проведені дослідження впливу неселективних НПЗП (н-НПЗП) (диклофенак) та селективних НПЗП (с-НПЗП) (німесулід) на функціональний стан тонкої кишки: на підставі вивчення пристінкового травлення, а саме стану всмоктування D-ксилози методом Roe та Rice у п’ятигодинній порції сечі, було знайдено, що максимальне зниження резорбції речовини спостерігається у перші дві години. Саме цей час є відображенням стану травлення в проксимальному відділі тонкої кишки. Однак було зафіксовано, що цей показник не є однаковим для пацієнтів з різною тривалістю прийому препаратів. Отже, виходячи з цього було доведено, що під час прийому НПЗП порушення процесів всмоктування першочергово спостерігається у проксимальних відділах тонкої кишки, але згодом, при прийомі НПЗП більше 3 років, процес захоплює мембранний і порожнинний етапи гідролізу. Також важливим є те, що функціональні зміни тонкої кишки на тлі прийому с-НПЗП мають менш виражений характер на відміну від н-НПЗП [33]. Як бачимо, результати досліджень змін проникності корелюють із результатами змін мікрофлори, що може вказувати на їх зв’язок.
Не менш важливим є безпосередній вплив НПЗП на склад кишкової мікрофлори. Давно та добре вивчено антибактеріальну дію саліцилатів, у тому числі ацетилсаліцилової кислоти [19]. Наведемо дані дослідження 2015 року, проведеного M. Rogers та D. Aronoff. У ньому автори порівнювали вплив прийому багатьох препаратів, включаючи НПЗП (найпоширенішими з яких виявилися напроксен та ібупрофен) та інгібітори протонної помпи, на вміст штамів фекальних бактерій у групі з 155 дорослих пацієнтів. Вони дійшли висновку, що різні препарати чинили не однакову дію. В осіб, які приймають аспірин, знайдено зміну вмісту Prevotella spp., Bacteroides spp., Barnesiella spp. та родини Ruminococcaceae. У пацієнтів, які застосовують НПЗП, виявлені зміни кількості Bacteroides spp., а також родин Enterobacteriaceae та Acidaminococcaceae. Обстежуючи хворих, які отримували ібупрофен, знаходили підвищення вмісту родин Propionibacteriaceae, Pseudomonadaceae, Puniceicoccaceae та Rikenellaceae, причому відмінності були зафіксовані не тільки порівняно з групою людей, які не отримували нестероїдні протизапальні засоби, а й з хворими, які приймали напроксен. Цікаво, що при прийомі пацієнтами целекоксибу мікробний профіль був подібний до профілю пацієнтів, які отримували ібупрофен, і збагачувався бактеріями родини Acidaminococcaceae та ентеробактеріями. Для хворих, які приймали кеторолак, характерним виявилося значне збільшення кількості Alistipes spp. Загальним для всіх хворих, які приймали різноманітні НПЗП, було збільшення бактерій родин Acidaminococcaceae, Desulfovibrionaceae, Enterococcaceae та Erysipelotrichaceae. При додаванні до НПЗП ІПП спостерігалася додаткова зміна вмісту Bacteroides spp., Erysipelotrichaceae spp. [34]. Проте у ще одному, невеликому, дослідженні не було знайдено впливу прийому селективного інгібітора циклооксигенази-2 целекоксибу на склад кишкової мікрофлори [35].
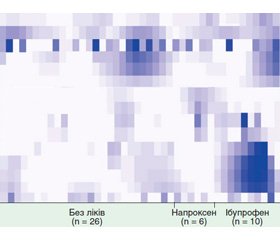
Наведемо деякі матеріали з дослідження M. Rogers та D. Aronoff (рис. 1).
На рис. 1 показані зміни мікробіому на фоні прийому НПЗП. Як бачимо, зміни помітні практично в усіх родинах мікроорганізмів. Особливо у групі тих, хто вживає НПЗП, проявилося збільшення поширеності бактерій роду Acidaminococcaceae. За аналізом, проведеним авторами, було виявлено 4 таксономічні одиниці, асоційовані із прийомом НПЗП: 2 окремі види роду Bacteroides (із них один вид частіше знаходили у тих, хто вживає НПЗП, інший — у групи контролю), одна бактерія роду Enterobacteriaceae та одна роду Acidaminococcaceae.
На рис. 2 видно різницю у мікробній композиції хворих на фоні прийому напроксену чи ібупрофену порівняно із тими, хто не приймав препарати. Як бачимо, у тих, хто приймав ібупрофен, підвищувався вміст бактерій родин Propionibacteriaceae, Pseudomonadaceae, Puniceicoccaceae та Rikenellaceae порівняно навіть із тими, хто приймав напроксен. Загальним для НПЗП виявилося підвищення вмісту родин Acidaminococcaceae, Desulfovibrionaceae, Enterococcaceae та Erysipelotrichaceae. Хотілося б зазначити, що мікробіологічний профіль деяких хворих, які не приймали ліків, візуально подібний такому у деяких пацієнтів, які приймали ібупрофен. Це можна було б пояснити епізодичними прийомами ібупрофену, наприклад, для купірування головного болю, про який пацієнти не доповіли дослідникам.
Цілком закономірно, що отримані дані про відношення кишкового дисбіозу та виникнення ОА стали підставою для застосування різних методів корекції мікрофлори з метою лікування остеоартриту. Окрім вже згаданих досліджень з застосування рифаксиміну, пробіотиків VSL-3, штамів Lactobacillus casei та Lactobacillus gasseri, наведемо ще декілька прикладів. Одним із перших досліджень було застосування у 2013 році для лікування ОА екстракту новозеландської зеленої мідії, який має пребіотичну активність. Було показано, що через 12 тижнів лікування спостерігалося збільшення вмісту Bifidobacterium, а Enterococcus, Clostridium, Staphylococcus та дріжджових грибків стало менше. При цьому відзначалося вірогідне полегшення симптоматики ОА, підтверджене зниженням показника WOMAC [36]. Отримані дані можуть бути роз’яснені тісним відношенням між типом харчування, мікронутрієнтами, які надходять з ним, та зміною кишкової мікробіоти, з подальшим модифікуючим впливом на чинники патогенезу ОА [23]. На даний час опубліковані результати одного рандомізованого дослідження, присвяченого лікуванню ОА колінних суглобів за допомогою пробіотика. При шестимісячному застосуванні Lactobacillus casei Shirota відзначалося вірогідне зменшення вираженості симптоматики ОА за шкалою WOMAC та візуальною аналоговою шкалою, що супроводжувалося вірогідним зниженням рівня С-реактивного протеїну як маркера мікрозапалення [37].
Таким чином, на даний час існує чимало спостережень щодо наявних змін складу кишкової мікробіоти у хворих на ОА. Однак нами не було знайдено досліджень щодо особливостей кишкового мікробіому у хворих, які належать до різних географічних груп, у тому числі української популяції. Також недостатньо вивчено вплив прийому різних лікарських препаратів (у першу чергу НПЗП) на склад кишкової мікрофлори у хворих на ОА. Перераховане вище спонукає до подальшого вивчення та аналізу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Внесок авторів у підготовку статті: концепція і дизайн дослідження, редагування тексту — О.Ю. Губська; збір матеріалу, написання тексту — А.А. Кузьмінець, В.М. Гуцул; опрацювання матеріалу — А.А. Кузьмінець, В.М. Гуцул, І.О. Лавренчук.
1. Maruvada P., Leone V., Kaplan L.M., Chang E.B. The human microbiome and obesity: moving beyond associations // Cell host & microbe. — 2017. — Vol. 22, № 5. — Р. 589-599. doi: 10.1016/J.CHOM.2017.10.005.
2. Fändriks L. Roles of the gut in the metabolic syndrome: an overview // Journal of internal medicine. — 2017. — Vol. 281, № 4. — Р. 319-336. doi: 10.1111/joim.12584.
3. Sanchez-Santos M., Judge A., Gulati M. et al. Association of metabolic syndrome with knee and hand osteoarthritis: A community-based study of women // Seminars in arthritis and rheumatism. — WB Saunders, 2018. doi: 10.1016/J.SEMARTHRIT.2018.07.007.
4. Courties A., Sellam J., Berenbaum F. Metabolic syndrome-associated osteoarthritis // Current opinion in rheumatology. — 2017. — Vol. 29, № 2. — P. 214-222. doi: 10.1097/BOR.0000000000000373.
5. Гульнева М.Ю., Носков С.М., Малафеева Э.В. Микробиоценоз кишечника при сочетании ожирения и остеоартрита // Проблемы эндокринологии. — 2012. — № 3.
6. Picchianti-Diamanti A., Rosado M.M., D’Amelio R. Infectious Agents and Inflammation: The Role of Microbiota in Autoimmune Arthritis // Frontiers in microbiology. — 2018. — Vol. 8. — P. 2696. doi: 10.3389/fmicb.2017.02696.
7. Zhong D., Wu C., Zeng X., Wang Q. The role of gut microbiota in the pathogenesis of rheumatic diseases // Clinical rheumatology. — 2018. — Vol. 37, № 1. — P. 25-34. doi: 10.1007/s10067-017-3821-4.
8. Maeda Y., Takeda K. Role of Gut Microbiota in Rheumatoid Arthritis // Journal of clinical medicine. — 2017. — Vol. 6, № 6. — P. 60. doi: 10.3390/jcm6060060.
9. Hernandez C.J. The Microbiome and Bone and Joint Disease // Current rheumatology reports. — 2017. — Vol. 19, № 12. — P. 77. doi: 10.1007/s11926-017-0705-1.
10. Huang Z.Y., Stabler T., Pei F.X., Kraus V.B. Both systemic and local lipopolysaccharide (LPS) burden are associated with knee OA severity and inflammation // Osteoarthritis and cartilage. — 2016. — Vol. 24, № 10. — P. 1769-1775. doi: 10.1016/J.JOCA.2016.05.008.
11. Schott E.M., Farnsworth C.W., Grier A. et al. Targeting the gut microbiome to treat the osteoarthritis of obesity // JCI insight. — 2018. — Vol. 3, № 8. doi: 10.1172/jci.insight.95997.
12. Ibáñez L., Rouleau M., Wakkach A., Blin-Wakkach C. Gut microbiome and bone // Joint Bone Spine. — 2019. — Vol. 86, № 1. — P. 43-47. doi: 10.1016/J.JBSPIN.2018.02.008.
13. Bultink I.E.M., Lems W.F. Osteoarthritis and Osteoporosis: What Is the Overlap? // Current rheumatology reports. — 2013. — Vol. 15, № 5. — P. 328. doi: 10.1007/s11926-013-0328-0.
14. Lorenz W., Buhrmann C., Mobasheri A. et al. Bacterial lipopolysaccharides form procollagen-endotoxin complexes that trigger cartilage inflammation and degeneration: implications for the development of rheumatoid arthritis // Arthritis research & therapy. — 2013. — Vol. 15, № 5. — P. R111. doi: 10.1186/ar4291.
15. Wang Q., Huang S.-Q., Li C.-Q. et al. Akkermansia muciniphila May Determine Chondroitin Sulfate Ameliorating or Aggravating Osteoarthritis // Frontiers in microbiology. — 2017. — Vol. 8. — P. 1955. doi: 10.3389/fmicb.2017.01955.
16. Shang Q., Yin Y., Zhu L. et al. Degradation of chondroitin sulfate by the gut microbiota of Chinese individuals // International journal of biological macromolecules. — 2016. — Vol. 86. — С. 112-118. doi: 10.1016/J.IJBIOMAC.2016.01.055.
17. Ахмедов В.А., Остапенко В.А., Винжегина В.А. та ін. Влияние селективных и неселективных нестероидных противовоспалительных средств на кишечник и гепатобилиарную систему // Экспериментальная и клиническая гастроэнтерология. — 2008. — № 3 (in Russian).
18. Губська О.Ю., Кузьмінець А.А. НПЗП-ентеротоксичність: фокус на проблему // Сучасна гастроентерологія. — 2018. — Т. 103, № 5. — C. 50-59.
19. Губська О.Ю., Таран А.І., Лавренчук І.О., Альянова Т.С. Ацетилсаліцилова кислота в кардіологічній практиці: фокус на ентеротоксичність // Український терапевтичний журнал. — 2018. — № 3–4. — C. 79-85.
20. Bjarnason I., Scarpignato C., Holmgren E. et al. Mechanisms of Damage to the Gastrointestinal Tract From Nonsteroidal Anti-Inflammatory Drugs // Gastroenterology. — 2018. — Vol. 154, № 3. — P. 500-514. doi: 10.1053/j.gastro.2017.10.049.
21. Yoshikawa K., Kurihara C., Furuhashi H. et al. Psychological stress exacerbates NSAID-induced small bowel injury by inducing changes in intestinal microbiota and permeability via glucocorticoid receptor signaling // Journal of gastroenterology. — 2017. — Vol. 52, № 1. — P. 61-71. doi: 10.1007/s00535-016-1205-1.
22. Edogawa S., Peters S.A., Jenkins G.D. et al. Sex differences in NSAID-induced perturbation of human intestinal barrier function and microbiota // The FASEB Journal. — 2018. — Vol. 32, № 12. — P. 6615-6625. doi: 10.1096/fj.201800560R.
23. Li Y., Luo W., Deng Z., Lei G. Diet-Intestinal Microbiota Axis in Osteoarthritis: A Possible Role // Mediators of Inflammation. — 2016. — Vol. 2016. doi: 10.1155/2016/3495173.
24. Haro C., Rangel-Zúñiga O.A., Alcalá-Díaz J.F. et al. Intestinal Microbiota Is Influenced by Gender and Body Mass Index // PloS one. — 2016. — Vol. 11, № 5. — P. e0154090. doi: 10.1371/journal.pone.0154090.
25. Larsen J.M. The immune response to Prevotella bacteria in chronic inflammatory disease // Immunology. — 2017. — Vol. 151, № 4. — P. 363-374. doi: 10.1111/imm.12760.
26. Sakkas L.I., Bogdanos D.P. Multiple hit infection and autoimmunity: the dysbiotic microbiota — ACPA connection in rheumatoid arthritis // Current opinion in rheumatology. — 2018. — Vol. 30, № 4. — P. 403-409. doi: 10.1097/BOR.0000000000000503.
27. Muraki M., Fujiwara Y., Machida H. et al. Role of small intestinal bacterial overgrowth in severe small intestinal damage in chronic non-steroidal anti-inflammatory drug users // Scandinavian journal of gastroenterology. — 2014. — Vol. 49, № 3. — P. 267-273. doi: 10.3109/00365521.2014.880182.
28. Scarpignato C., Dolak W., Lanas A. et al. Rifaximin Reduces the Number and Severity of Intestinal Lesions Associated With Use of Nonsteroidal Anti-Inflammatory Drugs in Humans // Gastroenterology. — 2017. — Vol. 152, № 5. — P. 980-982. e3. doi: 10.1053/j.gastro.2016.12.007.
29. Montalto M., Gallo A., Curigliano V. et al. Clinical trial: The effects of a probiotic mixture on non-steroidal anti-inflammatory drug enteropathy — A randomized, double-blind, cross-over, placebo-controlled study // Alimentary pharmacology & therapeutics. — 2010. — Vol. 32, № 2. — P. 209-214. doi: 10.1111/j.1365-2036.2010.04324.x.
30. Endo H., Higurashi T., Hosono K. та ін. Efficacy of Lactobacillus casei treatment on small bowel injury in chronic low-dose aspirin users: a pilot randomized controlled study // Journal of gastroenterology. — 2011. — Vol. 46, № 7. — P. 894-905. doi: 10.1007/s00535-011-0410-1.
31. Suzuki T., Masui A., Nakamura J. et al. Yogurt Containing Lactobacillus gasseri Mitigates Aspirin-Induced Small Bowel Injuries: A Prospective, Randomized, Double-Blind, Placebo-Controlled Trial // Digestion. — 2017. — Vol. 95, № 1. — P. 49-54. doi: 10.1159/000452361.
32. Otani K., Tanigawa T., Watanabe T. et al. Microbiota Plays a Key Role in Non-Steroidal Anti-Inflammatory Drug-Induced Small Intestinal Damage // Digestion. — 2017. — Vol. 95, № 1. — P. 22-28. doi: 10.1159/000452356.
33. Вахрушев Я.М., Загребина Е.А. Клинико-функциональные изменения тонкой кишки при лечении остеоартроза нестероидными противовоспалительными препаратами // Экспериментальная и клиническая гастроэнтерология. — 2010. — № 3 (in Russian).
34. Rogers M.A.M., Aronoff D.M. The influence of non-steroidal anti-inflammatory drugs on the gut microbiome // Clinical Microbiology and Infection. — 2016. — Vol. 22, № 2. — P. 178. e1-178. e9. doi: 10.1016/J.CMI.2015.10.003.
35. Bokulich N.A., Battaglia T., Aleman J.O. et al. Celecoxib does not alter intestinal microbiome in a longitudinal diet-controlled study // Clinical Microbiology and Infection. — 2016. — Vol. 22, № 5. — P. 464-465. doi: 10.1016/j.cmi.2016.01.013.
36. Coulson S., Butt H., Vecchio P. et al. Green-lipped mussel extract (Perna canaliculus) and glucosamine sulphate in patients with knee osteoarthritis: therapeutic efficacy and effects on gastrointestinal microbiota profiles // Inflammopharmacology. — 2013. — Vol. 21, № 1. — P. 79-90. doi: 10.1007/s10787-012-0146-4.
37. Lei M., Guo C., Wang D. et al. The effect of probiotic Lactobacillus casei Shirota on knee osteoarthritis: a randomised double-blind, placebo-controlled clinical trial // Beneficial microbes. — 2017. — Vol. 8, № 5. — P. 697-703. doi: 10.3920/BM2016.0207.

/81-1.jpg)
/81-2.jpg)