Журнал «Здоровье ребенка» Том 14, №4, 2019
Вернуться к номеру
Медикаментозное подавление активности кворум сенсинга бактерий Pseudomonas aeruginosa
Авторы: Абатуров А.Е.(1), Крючко Т.А.(2)
(1) — ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
(2) — ВГУЗУ «Украинская медицинская стоматологическая академия», г. Полтава, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Науковий огляд присвячений сучасним уявленням про системи кворум сенсингу LasI/R, RhlI/R, PqsABCDH/R і IQS бактерій Pseudomonas aeruginosa, функціонування яких зумовлює їх виживання у найнесприятливіших і бактерицидних умовах. Для написання статті здійснювався пошук інформації з використанням баз даних Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library, CyberLeninka, РІНЦ. Висока антибіотикорезистентність бактерій Pseudomonas aeruginosa як збудників нозокоміальних інфекційних захворювань обумовлена здатністю до створення біоплівки. Описано механізми формування бактеріями Pseudomonas aeruginosa біоплівки, яка представлена системами кворум сенсингу LasI/R, RhlI/R, PqsABCDH/R і IQS. Наведено дані наукових досліджень, що розкривають роль кворум сенсинг-залежних факторів вірулентності бактерій Pseudomonas aeruginosa у патогенезі інфекційного процесу. Продемонстровано ієрархічну єдину організацію систем кворум сенсингу бактерій Pseudomonas aeruginosa при формуванні біоплівки. Формування біоплівки бактеріями Pseudomonas aeruginosa зумовлює недостатню ефективність антибактеріальної терапії і ризик розвитку хронічного процесу. Акцентовано увагу на можливості медикаментозного пригнічення кворум сенсинг-асоційованих факторів бактеріальної вірулентності та формування біоплівки при використанні будь-якого молекулярного компонента системи кворум сенсингу бактерій Pseudomonas aeruginosa як мішені. Наведена характеристика деяких сполук, що пригнічують системи кворум сенсингу бактерій Pseudomonas aeruginosa і дадуть можливість розробити лікарські засоби для використання в медичній практиці при лікуванні інфекцій, викликаних бактеріями Pseudomonas aeruginosa.
Научный обзор посвящен современным представлениям о системах кворум сенсинг LasI/R, RhlI/R, PqsABCDH/R и IQS бактерий Pseudomonas aeruginosa, функционирование которых обусловливает их выживание в самых неблагоприятных и бактерицидных условиях. Для написания статьи осуществлялся поиск информации с использованием баз данных Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library, CyberLeninka, РИНЦ. Высокая антибиотикорезистентность бактерий Pseudomonas aeruginosa как возбудителей нозокомиальных инфекционных заболеваний обусловлена способностью к созданию биопленки. Описаны механизмы формирования бактериями Pseudomonas aeruginosa биопленки, которая представлена системами кворум сенсинга LasI/R, RhlI/R, PqsABCDH/R и IQS. Приведены данные научных исследований, раскрывающие роль кворум сенсинг-зависимых факторов вирулентности бактерий Pseudomonas aeruginosa в патогенезе инфекционного процесса. Продемонстрирована иерархическая единая организация систем кворум сенсинга бактерий Pseudomonas aeruginosa при формировании биопленки. Формирование биопленки бактериями Pseudomonas aeruginosa предопределяет недостаточность эффективности антибактериальной терапии и риск развития хронического процесса. Акцентировано внимание на возможности медикаментозного подавления кворум сенсинг-ассоциированных факторов бактериальной вирулентности и формирования биопленки при использовании любого молекулярного компонента системы кворум сенсинга бактерий Pseudomonas aeruginosa в качестве мишени. Представлена характеристика соединений, которые ингибируют системы кворум сенсинга бактерий Pseudomonas aeruginosa и дадут возможность разработать лекарственные средства для использования в медицинской практике при лечении инфекций, вызванных бактериями Pseudomonas aeruginosa.
The scientific review deals with the modern concepts of the quorum sensing systems LasI/R, RhlI/R, PqsABCDH/R and IQS of Pseudomonas aeruginosa bacteria, the functioning of which causes their survival under the most unfavorable and bactericidal conditions. For writing the article, information was searched using Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library, CyberLeninka, RISC. High antibiotic resistance of Pseudomonas aeruginosa bacteria as causative agents for nosocomial infectious diseases is due to the ability to create a biofilm. The mechanisms of biofilm formation by Pseudomonas aeruginosa bacteria, which are represented by the quorum sensing system LasI/R, RhlI/R, PqsABCDH/R and IQS, are described. The data of scientific studies that reveal the role of quorum sensing-dependent virulence factors of the bacteria Pseudomonas aeruginosa in the pathogenesis of the infectious process are presented. The hierarchical unified organization of the quorum sensing of Pseudomonas aeruginosa bacteria in the formation of a biofilm was demonstrated. The formation of biofilm by Pseudomonas aeruginosa bacteria predetermines the lack of effectiveness of antibiotic therapy and the risk of developing a chronic process. Attention is focused on the possibilities of drug suppression of quorum sensing-associated factors of bacterial virulence and biofilm formation when using any molecular component of the quorum system of sensing bacteria Pseudomonas aeruginosa as a target. The characteristics of some compounds that inhibit the sensory system of Pseudomonas aeruginosa bacteria are given, and it is likely that they will be able to develop medicines for use in medical practice for the treatment of infections caused by Pseudomonas aeruginosa bacteria.
кворум сенсинг; Pseudomonas aeruginosa; інгібітори кворум сенсингу; огляд
кворум сенсинг; Pseudomonas aeruginosa; ингибиторы кворум сенсинга; обзор
quorum sensing; Pseudomonas aeruginosa; inhibitors of quorum sensing; review
Введение
В этиологической структуре инфекционных заболеваний, вызванных грамотрицательными палочками, бактерии Pseudomonas aeruginosa занимают лидирующие позиции [1, 16, 27]. Бактерии Pseudomonas aeruginosa являются основной причиной нозокомиальных инфекций. В США госпитальными инфекциями ежегодно заболевают более чем 648 000 человек, и примерно в 10 % случаев заболевание у них заканчивается летально [47]. Для возбудителей нозокомиальных инфекций, в том числе бактерий Pseudomonas aeruginosa, характерна высокая антибиотикорезистентность [6, 11, 25].
Известно, что бактерии Pseudomonas aeruginosa используют свои системы кворум сенсинга (quorum sensing — QS) — LasI/R, RhlI/R, PqsABCDH/R и IQS — как для координации продукции различных факторов вирулентности, так и для уклонения от механизмов иммунной системы макроорганизма [2, 33, 69]. Биопленки, сформированные бактериями Pseudomonas aeruginosa, создают серьезные проблемы при лечении инфекционного процесса, особенно у больных муковисцидозом и иммунокомпрометированных людей. Уникальные свойства биопленки бактерий Pseudomonas aeruginosa способствуют развитию хронического течения заболевания [38].
Механизмы формирования биопленки бактериями Pseudomonas aeruginosa
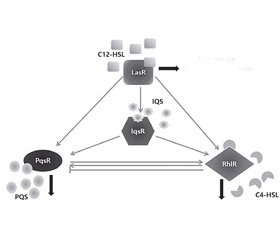
Бактерии Pseudomonas aeruginosa обладают четырьмя QS системами: N-ацильных гомосериновых лактонов (N-acyl homoserine lactones — HSL), Pseudomonas хинолонового сигнала (Pseudomonas quinolone signal — PQS), N-бутирилгомосериновых лактонов (N-butyrylhomoserine lactone — BHL) и IQS. Две системы QS бактерий Pseudomonas aeruginosa опосредованы сигналами N-ацильных гомосериновых лактонов (HSL), а другие — влиянием хинолонов и молекулы IQS. Так, основные сигнальные молекулы кворум сенсинга бактерий Pseudomonas aeruginosa представлены N-(3-оксододеканоил)-L-гомосерин-лактоном (N-(3-oxododecanoyl)-L-homoserine lactone — 3-oxo-C12-HSL); N-бутаноил-L-гомосерин-лактоном (N-butanoyl-L-homoserine lactone — C4-HSL); 2-гептил-3-гидрокси-4-хинолоном (2-heptyl-3-hydroxy-4-quinolone — HHQ) и 2-(2-гидроксифенил) тиазол-4-карбальдегидом (2-(2-hydroxyphenyl)-thiazole-4-carbaldehyde — aeruginaldehyde). Аутоиндукторная молекула 3-oxo-C12-HSL участвует в регуляции системы HSL (LasI/R), C4-HSL — системы BHL (RhlI/R), HHQ — системы PQS (PqsABCDH/R), IQS молекула (aeruginaldehyde) — системы IQS (рис. 1) [3, 34, 42, 48, 56].
Система HSL при помощи LasI (HSL-ацилсинтазы) продуцирует лактон 3-оксо-С12-HSL, связывающийся с рецептором LasR, который впоследствии димеризуется и взаимодействует с промоторами определенных генов факторов вирулентности, в том числе и гена LasI, усиливая их экспрессию. Вторая система BHL, функционирование которой опосредуется HSL, ассоциирована с ферментом RhlI, продуцирующим N-бутирил-L-гомосериновый лактон, который распознается рецептором RhlR. Функционирование системы PQS опосредовано различными видами алкилхинолонов, в частности HHQ. Данный алкилхинолон синтезируется из антранилата продуктами генов pqsABCDEH и распознается рецептором PqsR. Работа системы IQS обусловлена продукцией фермента AmbDCDE молекулы IQS, которая взаимодействует с неизвестным рецептором [14, 36, 53].
Системы кворум сенсинга бактерий Pseudomonas aeruginosa контролируют продукцию многочисленных факторов вирулентности (табл. 1).
Все системы кворум сенсинга бактерий Pseudomonas aeruginosa взаимосвязаны, и функционирует иерархическая единая организация. Первой активируется система HSL, которая стимулирует системы BHL и PQS; система PQS активирует BHL, а система BHL ингибирует PQS (рис. 2) [60].
Лекарственные средства, подавляющие развитие биопленки у бактерий Pseudomonas aeruginosa
В настоящее время идентифицированы и синтезированы многочисленные ингибиторы функционирования QS-систем бактерий Pseudomonas aeruginosa. Практически все молекулярные компоненты QS-систем бактерий Pseudomonas aeruginosa являются потенциальными мишенями для медикаментозного подавления QS-ассоциированных факторов бактериальной вирулентности и формирования биопленки. Полагают, что одновременное ингибирование QS-систем и основного регулятора или регулятора бактериального метаболизма может быть более эффективным методом лечения, чем блокирование только одного компонента, например, QS-рецептора [64]. Некоторые ингибиторы бактериальных QS-систем и QS-ассоциированных факторов вирулентности бактерий Pseudomonas aeruginosa представлены в табл. 2–7.
Необходимо отметить, что для разработки медицинских препаратов, оказывающих выраженное ингибирующее действие на формирование биопленки бактериями Pseudomonas aeruginosa in vivo, потребуется проведение дополнительных научных исследований.
Выводы
Нозокомиальные инфекции, ставшие в последнее время мировой проблемой, чаще всего вызваны бактериями Pseudomonas aeruginosa, как правило, обладающими антибиотикорезистентностью и способностью к формированию биопленки. Бактерии Pseudomonas aeruginosa имеют несколько систем кворум сенсинга (LasI/R, RhlI/R, PqsABCDH/R и IQS), которые обусловливают их выживание в самых неблагоприятных и бактерицидных условиях и уклонение от эффекторных механизмов защиты макроорганизма. Уникальная способность бактерий Pseudomonas aeruginosa быстро формировать биопленки лежит в основе низкой эффективности антибактериальной терапии и высокой вероятности развития хронического инфекционно-воспалительного процесса. В настоящее время разрабатываются лекарственные препараты, действие которых направлено на молекулярные компоненты QS-систем и на QS-ассоциированные факторы вирулентности бактерий Pseudomonas aeruginosa. Клиническое применение данных препаратов, несом–ненно, позволит предупредить как развитие осложнений, так и неблагоприятный исход инфекций, вызванных бактериями Pseudomonas aeruginosa.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
1. Абатуров А.Е., Крючко Т.А. Синегнойная инфекция у детей / А.Е. Абатуров, Т.А. Крючко, О.А. Пода, А.А. Никулина. Хмельницкий: ФЛП Сторожук, 2017. 224 с.
2. Абатуров А.Е., Никулина А.А. Развитие иммунного ответа при пневмонии, вызванной Pseudomonas aeruginosa (Ч. 1). Семейная медицина. 2016. 5(67). 20-27.
3. Маянский А.Н. Pseudomonas aeruginosa: характеристика биопленочного процесса / А.Н. Маянский, И.В. Чеботарь, Е.И. Руднева, В.П. Чистякова. Молекулярная генетика, микробиология и вирусология. 2012. 1. 3-8.
4. Abbas H.A., Elsherbini A.M., Shaldam M.A. Repurposing metformin as a quorum sensing inhibitor in Pseudomonas aeruginosa. Afr. Health Sci. 2017 Sep. 17(3). 808-819. doi: 10.4314/ahs.v17i3.24.
5. Abbas H.A., Shaldam M.A. Glyceryl trinitrate is a novel inhibitor of quorum sensing in Pseudomonas aeruginosa. Afr. Health Sci. 2016 Dec. 16(4). 1109-1117. doi: 10.4314/ahs.v16i4.29.
6. Agarwal M. Repeat gram-negative hospital-acquired infections and antibiotic susceptibility: A systematic review / M. Agarwal, S. Shiau, E.L. Larson et al. J. Infect. Public. Health. 2018 Jul — Aug. 11(4). 455-462. doi: 10.1016/j.jiph.2017.09.024.
7. Algburi A. Control of Biofilm Formation: Antibiotics and Beyond / A. Algburi, N. Comito, D. Kashtanov et al. Appl. Environ. Microbiol. 2017 Jan 17. 83(3). pii: e02508-16. doi: 10.1128/AEM.02508-16.
8. Allegretta G. In-depth Profiling of MvfR-Regulated Small Mo–lecules in Pseudomonas aeruginosa after Quorum Sensing Inhibitor Treatment / G. Allegretta, C.K. Maurer, J. Eberhard et al. Front. Microbiol. 2017 May 24. 8. 924. doi: 10.3389/fmicb.2017.00924.
9. Almohaywi B. Design and Synthesis of Lactams Derived from Mucochloric and Mucobromic Acids as Pseudomonas aeruginosa Quorum Sensing Inhibitors/ B. Almohaywi, A. Taunk, D.S. Wenholz et al. Mo–lecules. 2018 May 7. 23(5). pii: E1106. doi: 10.3390/molecules23051106.
10. Appelbaum P.C. 2012 and beyond: potential for the start of a se–cond pre-antibiotic era? J. Antimicrob. Chemother. 2012 Sep. 67(9). 2062-8. doi: 10.1093/jac/dks213.
11. Athanasiou C.I., Kopsini A. A systematic review on the use of time series data in the study of antimicrobial consumption and Pseudomonas aeruginosa resistance. J. Glob. Antimicrob. Resist. 2018 Jun 12. pii: S2213-7165(18)30110-3. doi: 10.1016/j.jgar.2018.06.001.
12. Chatterjee M. Mechanistic understanding of Phenyllactic acid mediated inhibition of quorum sensing and biofilm development in Pseudomonas aeruginosa / M. Chatterjee, S. D'Morris, V. Paul et al. Appl. Microbiol. Biotechnol. 2017 Nov. 101(22). 8223-8236. doi: 10.1007/s00253-017-8546-4.
13. Chong Y.M. Malabaricone C from Myristica cinnamomea exhibits anti-quorum sensing activity / Y.M. Chong, W.F. Yin, C.Y. Ho et al. J. Nat. Prod. 2011 Oct 28. 74(10). 2261-4. doi: 10.1021/np100872k.
14. Chugani S., Greenberg E.P. An evolving perspective on the Pseudomonas aeruginosa orphan quorum sensing regulator QscR. Front. Cell. Infect. Microbiol. 2014 Oct 28. 4. 152. doi: 10.3389/fcimb.2014.00152.
15. Easwaran N. Identification and analysis of the salt tolerant pro–perty of AHL lactonase (AiiATSAWB ) of Bacillus species / N. Easwaran, S. Karthikeyan, B. Sridharan, K.M. Gothandam. J. Basic. Microbiol. 2015 May. 55(5). 579-90. doi: 10.1002/jobm.201400013.
16. El Zowalaty M.E. Pseudomonas aeruginosa: arsenal of resistance mechanisms, decades of changing resistance profiles, and future antimicrobial therapies / M.E. El Zowalaty, A.A. Al Thani, T.J. Webster et al. Future Microbiol. 2015. 10(10). 1683-706. doi: 10.2217/fmb.15.48.
17. El-Mowafy S.A. Aspirin is an efficient inhibitor of quorum sen–sing, virulence and toxins in Pseudomonas aeruginosa / S.A. El-Mowafy, K.H. Abd El Galil, S.M. El-Messery, M.I. Shaaban. Microb. Pathog. 2014 Sep. 74. 25-32. doi: 10.1016/j.micpath.2014.07.008.
18. El-Shaer S. Control of quorum sensing and virulence factors of Pseudomonas aeruginosa using phenylalanine arginyl b-naphthylamide / S. El-Shaer, M. Shaaban, R. Barwa, R. Hassan. J. Med. Microbiol. 2016 Oct. 65(10). 1194-1204. doi: 10.1099/jmm.0.000327.
19. Ganin H. Sulforaphane and erucin, natural isothiocyanates from broccoli, inhibit bacterial quorum sensing / H. Ganin, J. Rayo, N. Amara. Med. Chem. Commun. 2013. 4. 175-179. doi: 10.1039/C2MD20196H.
20. García-Contreras R. High variability in quorum quenching and growth inhibition by furanone C-30 in Pseudomonas aeruginosa clinical isolates from cystic fibrosis patients / García-Contreras R., Peréz-Eretza B., Jasso-Chávez R. et al. Pathog. Dis. 2015 Aug. 73(6). ftv040. doi: 10.1093/femspd/ftv040.
21. García-Contreras R. Resistance to the quorum-quenching compounds brominated furanone C-30 and 5-fluorouracil in Pseudomonas aeruginosa clinical isolates / R. García-Contreras, M. Martínez-Vázquez, N. Velázquez Guadarrama et al. Pathog. Dis. 2013 Jun. 68(1). 8-11. doi: 10.1111/2049-632X.12039.
22. Geske G.D. Comparative analyses of N-acylated homose–rine lactones reveal unique structural features that dictate their ability to activate or inhibit quorum sensing / G.D. Geske, J.C. O'Neill, D.M. Mil–ler et al. Chembiochem. 2008 Feb 15. 9(3). 389-400. doi: 10.1002/cbic.200700551.
23. Girennavar B. Grapefruit juice and its furocoumarins inhibits autoinducer signaling and biofilm formation in bacteria / B. Girennavar, M.L. Cepeda, K.A. Soni et al. Int. J. Food Microbiol. 2008 Jul 15. 125(2). 204-8. doi: 10.1016/j.ijfoodmicro.2008.03.028.
24. Guendouze A. Effect of Quorum Quenching Lactonase in Clinical Isolates of Pseudomonas aeruginosa and Comparison with Quorum Sensing Inhibitors / A. Guendouze, L. Plener, J. Bzdrenga et al. Front. Microbiol. 2017 Feb 14. 8. 227. doi: 10.3389/fmicb.2017.00227.
25. Guitor A.K., Wright G.D. Antimicrobial Resistance and Respiratory Infections. Chest. 2018 Jun 27. pii: S0012-3692(18)30966-8. doi: 10.1016/j.chest.2018.06.019.
26. Hançer Aydemir D. Quorum-sensing inhibitor potential of trans-anethole aganist Pseudomonas aeruginosa / D. Hançer Aydemir, G. Çifci, V. Aviyente et al. J. Appl. Microbiol. 2018 Apr 25. doi: 10.1111/jam.13892.
27. Hawken S.E., Snitkin E.S. Genomic epidemiology of multidrug-resistant Gram-negative organisms. Ann. N. Y. Acad Sci. 2018 Mar 31. doi: 10.1111/nyas.13672.
28. Hinsberger S. Benzamidobenzoic acids as potent PqsD inhibitors for the treatment of Pseudomonas aeruginosa infections / S. Hinsberger, J.C. de Jong, M. Groh et al. Eur. J. Med. Chem. 2014 Apr 9. 76. 343-51. doi: 10.1016/j.ejmech.2014.02.014.
29. Ilangovan A. Structural basis for native agonist and synthetic inhibitor recognition by the Pseudomonas aeruginosa quorum sensing regulator PqsR (MvfR) / A. Ilangovan, M. Fletcher, G. Rampioni et al. PLoS Pathog. 2013. 9(7). e1003508. doi: 10.1371/journal.ppat.1003508.
30. Ji C. Designed Small-Molecule Inhibitors of the Anthranilyl-CoA Synthetase PqsA Block Quinolone Biosynthesis in Pseudomonas aeruginosa / C. Ji, I. Sharma, D. Pratihar et al. ACS Chem. Biol. 2016 Nov 18. 11(11). 3061-3067.
31. Joshi S. Lactonase-expressing Lactobacillus plantarum NC8 attenuates the virulence factors of multiple drug resistant Pseudomonas aeruginosa in co-culturing environment / S. Joshi, A. Kaur, P. Sharma et al. World J. Microbiol. Biotechnol. 2014 Aug. 30(8). 2241-9. doi: 10.1007/s11274-014-1645-9.
32. Kalia M. Exploring the impact of parthenolide as anti-quorum sensing and anti-biofilm agent against Pseudomonas aeruginosa / M. Kalia, V.K. Yadav, P.K. Singh et al. Life Sci. 2018 Apr 15. 199. 96-103. doi: 10.1016/j.lfs.2018.03.013.
33. Kariminik A. Baseri-Salehi M., Kheirkhah B. Pseudomonas aeruginosa quorum sensing modulates immune responses: An updated review article. Immunol. Lett. 2017 Oct. 190. 1-6. doi: 10.1016/j.imlet.2017.07.002.
34. Kim S.K., Lee J.H. Biofilm dispersion in Pseudomonas aeruginosa. J. Microbiol. 2016 Feb. 54(2). 71-85. doi: 10.1007/s12275-016-5528-7.
35. Klein T. Identification of small-molecule antagonists of the Pseudomonas aeruginosa transcriptional regulator PqsR: biophysically guided hit discovery and optimization / T. Klein, C. Henn, J.C. de Jong et al. ACS Chem. Biol. 2012 Sep 21. 7(9). 1496-501. doi: 10.1021/cb300208g.
36. Lee J., Zhang L. The hierarchy quorum sensing network in Pseudomonas aeruginosa. Protein Cell. 2015 Jan. 6(1). 26-41. doi: 10.1007/s13238-014-0100-x.
37. Lee J.H. 7-fluoroindole as an antivirulence compound against Pseudomonas aeruginosa / J.H. Lee, Y.G. Kim, M.H. Cho et al. FEMS Microbiol. Lett. 2012 Apr. 329(1). 36-44. doi: 10.1111/j.1574-6968.2012.02500.x.
38. Lee K., Yoon S.S. Pseudomonas aeruginosa Biofilm, a Programmed Bacterial Life for Fitness. J. Microbiol. Biotechnol. 2017 Jun 28. 27(6). 1053-1064. doi: 10.4014/jmb.1611.11056.
39. Lesic B. Inhibitors of pathogen intercellular signals as selective anti-infective compounds / B. Lesic, F. Lépine, E. Déziel et al. PLoS Pathog. 2007 Sep 14. 3(9). 1229-39. doi: 10.1371/journal.ppat.0030126.
40. Li S. Anti-biofilm effect of novel thiazole acid analogs against Pseudomonas aeruginosa through IQS pathways / S. Li, S. Chen, J. Fan et al. Eur. J. Med. Chem. 2018 Feb 10. 145. 64-73. doi: 10.1016/j.ejmech.2017.12.076.
41. Li Y. Synergistic Activity of Berberine with Azithromycin against Pseudomonas Aeruginosa Isolated from Patients with Cystic Fibrosis of Lung In Vitro and In Vivo / Y. Li, J. Huang, L. Li, L. Liu. Cell. Physiol. Biochem. 2017. 42(4). 1657-1669. doi: 10.1159/000479411. Epub 2017 Jul 24.
42. Lin J. The Pseudomonas Quinolone Signal (PQS): Not Just for Quorum Sensing Anymore / J. Lin, J. Cheng, Y. Wang, X. Shen. Front. Cell. Infect. Microbiol. 2018 Jul 4. 8. 230. doi: 10.3389/fcimb.2018.00230.
43. Liu H.B. Inhibitors of the Pseudomonas aeruginosa quorum-sensing regulator, QscR / H.B. Liu, J.S. Kim, S. Park. Biotechnol. Bioeng. 2010 May 1. 106(1). 119-26. doi: 10.1002/bit.22672.
44. Luo J. Baicalein attenuates the quorum sensing-controlled virulence factors of Pseudomonas aeruginosa and relieves the inflammatory response in P. aeruginosa-infected macrophages by downregulating the MAPK and NFkB signal-transduction pathways / J. Luo, J.L. Kong, B.Y. Dong et al. Drug Des. Devel Ther. 2016 Jan 7. 10. 183-203. doi: 10.2147/DDDT.S97221.
45. Ma Z.P. Anti-quorum Sensing Activities of Selected Coral Symbiotic Bacterial Extracts From the South China Sea / Z.P. Ma, Y. Song, Z.H. Cai et al. Front Cell. Infect. Microbiol. 2018 May 8. 8. 144. doi: 10.3389/fcimb.2018.00144.
46. Magill S.S. Multistate point-prevalence survey of health care-associated infections / S.S. Magill, J.R. Edwards, W. Bamberg et al. N. Engl. J. Med. 2014 Mar 27. 370(13). 1198-208. doi: 10.1056/NEJMoa1306801.
47. Maura D., Rahme L.G. Pharmacological Inhibition of the Pseudomonas aeruginosa MvfR Quorum-Sensing System Interferes with Biofilm Formation and Potentiates Antibiotic-Mediated Biofilm Disruption. Antimicrob. Agents Chemother. 2017 Nov 22. 61(12). pii: e01362-17. doi: 10.1128/AAC.01362-17.
48. Moradali M.F., Ghods S., Rehm B.H. Pseudomonas aeruginosa Lifestyle: A Paradigm for Adaptation, Survival, and Persistence. Front Cell. Infect. Microbiol. 2017 Feb 15. 7. 39. doi: 10.3389/fcimb.2017.00039.
49. Müh U. Novel Pseudomonas aeruginosa quorum-sensing inhibitors identified in an ultra-high-throughput screen / U. Müh, M. Schuster, R. Heim et al. Antimicrob. Agents Chemother. 2006 Nov. 50(11). 3674-9. doi: 10.1128/AAC.00665-06.
50. Musthafa K.S. Evaluation of anti-quorum-sensing activity of edible plants and fruits through inhibition of the N-acyl-homoserine lactone system in Chromobacterium violaceum and Pseudomonas aeruginosa / K.S. Musthafa, A.V. Ravi, A. Annapoorani et al. Chemotherapy. 2010. 56(4). 333-9. doi: 10.1159/000320185.
51. O'Loughlin C.T. A quorum-sensing inhibitor blocks Pseudomonas aeruginosa virulence and biofilm formation / C.T. O'Loughlin, L.C. Miller, A. Siryaporn et al. Proc. Natl. Acad. Sci USA. 2013 Oct 29. 110(44). 17981-6. doi: 10.1073/pnas.1316981110.
52. Paczkowski J.E. Flavonoids Suppress Pseudomonas aeruginosa Virulence through Allosteric Inhibition of Quorum-sensing Receptors / J.E. Paczkowski, S. Mukherjee, A.R. McCready et al. J. Biol. Chem. 2017 Mar 10. 292(10). 4064-4076. doi: 10.1074/jbc.M116.770552.
53. Papenfort K., Bassler B.L. Quorum sensing signal-response systems in Gram-negative bacteria. Nat. Rev. Microbiol. 2016 Aug 11. 14(9). 576-88. doi: 10.1038/nrmicro.2016.89.
54. Passador L. Functional analysis of the Pseudomonas aeruginosa autoinducer PAI / L. Passador, K.D. Tucker, K.R. Guertin et al. J. Bacteriol. 1996 Oct. 178(20). 5995-6000.
55. Persson T. Rational design and synthesis of new quorum-sensing inhibitors derived from acylated homoserine lactones and natural products from garlic / T. Persson, T.H. Hansen, T.B. Rasmussen et al. Org. Biomol Chem. 2005 Jan 21. 3(2). 253-62. doi: 10.1039/b415761c.
56. Rasamiravaka T., El Jaziri M. Quorum-Sensing Mechanisms and Bacterial Response to Antibiotics in P. aeruginosa. Curr. Microbiol. 2016 Nov. 73(5). 747-53. doi: 10.1007/s00284-016-1101-1.
57. Rasmussen T.B. Screening for quorum-sensing inhibitors (QSI) by use of a novel genetic system, the QSI selector / T.B. Rasmussen, T. Bjarnsholt, M.E. Skindersoe et al. J. Bacteriol. 2005 Mar. 187(5). 1799-814. doi: 10.1128/JB.187.5.1799-1814.2005.
58. Ravindra Pal Singh Attenuation of quorum sensing-mediated virulence in Gram-negative pathogenic bacteria: implications for the post-antibiotic era. Med. Chem. Commun. 2015. 6. 259-272. doi: 10.1039/C4MD00363B.
59. Sakr M.M. Characterization and complete sequence of lactonase enzyme from Bacillus weihenstephanensis isolate P65 with potential activity against acyl homoserine lactone signal molecules / M.M. Sakr, K.M. Aboshanab, M.M. Aboulwafa, N.A. Hassouna. Biomed. Res. Int. 2013. 2013. 192589. doi: 10.1155/2013/192589.
60. Shang F. One step preparation and electrochemical analysis of IQS, a cell-cell communication signal in the nosocomial pathogen Pseudomonas aeruginosa / F. Shang, E.Ó. Muimhneacháin, F.J. Reen et al. Bioorg. Med. Chem. Lett. 2014 Oct 1. 24(19). 4703-7. doi: 10.1016/j.bmcl.2014.08.023.
61. Skindersoe M.E. Quorum sensing antagonism from marine organisms / M.E. Skindersoe, P. Ettinger-Epstein, T.B. Rasmussen et al. Mar. Biotechnol (NY). 2008 Jan-Feb. 10(1). 56-63. doi: 10.1007/s10126-007-9036-y.
62. Smith K.M., Bu Y., Suga H. Library screening for synthetic agonists and antagonists of a Pseudomonas aeruginosa autoinducer. Chem. Biol. 2003 Jun. 10(6). 563-71. doi: 10.1016/S1074-5521(03)00107-8.
63. Thomann A. Structure-Activity Relationships of 2-Sufonylpyrimidines as Quorum-Sensing Inhibitors to Tackle Biofilm Formation and eDNA Release of Pseudomonas aeruginosa / A. Thomann, C. Brengel, C. Börger et al. Chem. Med. Chem. 2016 Nov 21. 11(22). 2522-2533. doi: 10.1002/cmdc.201600419.
64. Welsh M.A., Blackwell H.E. Chemical probes of quorum sensing: from compound development to biological discovery. FEMS Microbiol. Rev. 2016 Sep. 40(5). 774-94. doi: 10.1093/femsre/fuw009.
65. Weng L. Isolation of the autoinducer-quenching strain that inhibits LasR in Pseudomonas aeruginosa / L. Weng, Y. Zhang, Y. Yang, L. Wang. Int. J. Mol. Sci. 2014 Apr 14. 15(4). 6328-42. doi: 10.3390/ijms15046328.
66. Xu Y. Virtual screening and biological evaluation of biofilm inhibitors on dual targets in quorum sensing system / Y. Xu, X. Tong, P. Sun et al. Future Med. Chem. 2017 Nov. 9(17). 1983-1994. doi: 10.4155/fmc-2017-0127.
67. Yang L. Computer-aided identification of recognized drugs as Pseudomonas aeruginosa quorum-sensing inhibitors / L. Yang, M.T. Rybtke, T.H. Jakobsen et al. Antimicrob. Agents Chemother. 2009 Jun. 53(6). 2432-43. doi: 10.1128/AAC.01283-08.
68. Zender M. Discovery and biophysical characterization of 2-amino-oxadiazoles as novel antagonists of PqsR, an important regulator of Pseudomonas aeruginosa virulence / M. Zender, T. Klein, C. Henn et al. J. Med. Chem. 2013 Sep 12. 56(17). 6761-74. doi: 10.1021/jm400830r.
69. Zhao K. Pseudomonas aeruginosa outer membrane vesicles modulate host immune responses by targeting the Toll-like receptor 4 signaling pathway / K. Zhao, X. Deng, C. He et al. Infect. Immun. 2013 Dec. 81(12). 4509-18. doi: 10.1128/IAI.01008-13.
70. Zhou J.W. Hordenine: A Novel Quorum Sensing Inhibitor and Antibiofilm Agent against Pseudomonas aeruginosa / J.W. Zhou, H.Z. Luo, H. Jiang et al. J. Agric. Food Chem. 2018 Feb 21. 66(7). 1620-1628. doi: 10.1021/acs.jafc.7b05035.

/122-1.jpg)
/123-1.jpg)
/124-1.jpg)
/125-1.jpg)
/126-1.jpg)
/127-1.jpg)