Журнал «Здоровье ребенка» Том 14, №5, 2019
Вернуться к номеру
Диспергирование бактериальной биопленки и хронизация инфекционного процесса респираторного тракта
Авторы: Абатуров А.Е.(1), Крючко Т.А.(2)
(1) — ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
(2) — ВГУЗУ «Украинская медицинская стоматологическая академия», г. Полтава, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Науковий огляд присвячено сучасним уявленням про процес диспергування біоплівки патогенних бактерій. Для написання статті здійснювався пошук інформації з використанням баз даних Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library, CyberLeninka. Диспергування біоплівки є скоординованим вивільненням з матриксу диференційованих рухливих хемотаксичних бактерій і їх поширенням на нові локуси колонізації. Продемонстровано залежність диспергування біоплівки від впливу щільності у ній бактерій, сигналів кворум-сенсингу і забезпечення поживними речовинами. Надано характеристику механізмам, фазам і типам диспергування біоплівки. Виділено три фази диспергування бактеріальної біоплівки: 1) відділення клітин від бактеріальної колонії біоплівок; 2) транслокація бактерій на нове місце локалізації; 3) адгезія бактерій до субстрату нового регіону. Описано активний і пасивний механізми диспергування біоплівки. Охарактеризовано три типи диспергування: ерозія, лущення та відсів. Розглянуто послідовність подій, що ведуть до деструкції біоплівки. Описано тригери диспергування бактеріальної біоплівки, якими є різні екзо- й ендогенні чинники. Акцентовано увагу на лізисі бактерій, що сприяє утворенню порожнин у її матриксі, як найважливішому компоненті диспергування біоплівки. Охарактеризовано роль диспергування біоплівки у розвитку рецидивуючих і хронічних інфекційно-запальних захворювань респіраторного тракту. Акцентовано увагу на особливості популяції диспергованих патогенів, яка складається як з окремих бактерій, так і з бактеріальних агрегатів, що дозволяє бактеріям краще адаптуватися до змін навколишнього середовища.
Научный обзор посвящен современным представлениям о процессе диспергирования биопленки патогенных бактерий. Для написания статьи осуществлялся поиск информации с использованием баз данных Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library, CyberLeninka. Диспергирование биопленки представляет собой скоординированное высвобождение из матрикса дифференцированных подвижных хемотаксических бактерий и их распространение на новые локусы колонизации. Продемонстрирована зависимость диспергирования биопленки от влияния плотности в ней бактерий, сигналов кворум-сенсинга и обеспечения питательными веществами. Дана характеристика механизмам, фазам и типам диспергирования биопленки. Выделены три фазы диспергирования бактериальной биопленки: 1) отделение клеток от бактериальной колонии биопленок; 2) транслокация бактерий на новое место локализации; 3) адгезия бактерий к субстрату нового региона. Описаны активный и пассивный механизмы диспергирования биопленки. Охарактеризованы три типа диспергирования: эрозия, шелушение и отсев. Рассмотрена последовательность событий, ведущих к деструкции биопленки. Описаны триггеры диспергирования бактериальной биопленки, которыми являются различные экзо- и эндогенные факторы. Акцентировано внимание на лизисе бактерий, который способствует образованию полостей в матриксе биопленки, как важнейшем компоненте ее диспергирования. Охарактеризована роль диспергирования биопленки в развитии рецидивирующих и хронических инфекционно-воспалительных заболеваний респираторного тракта. Акцентировано внимание на особенности популяции диспергированных патогенов, состоящей как из отдельных бактерий, так и из бактериальных агрегатов, что позволяет бактериям лучше адаптироваться к изменениям окружающей среды.
The scientific review deals with modern ideas about the process of dispersing the biofilms of pathogenic bacteria. For writing the article, information was searched using Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library, CyberLeninka databases. Biofilm dispersion is the coordinated release of differentiated, motile, chemotactic bacteria from the matrix and their spread to new colonization loci. The dependence of biofilm dispersion on the influence of bacterial density in the biofilm, quorum-sensing signals, and nutrient supply has been demonstrated. The characteristics of mechanisms, phases and types of biofilm dispersion are given. Three phases of dispersion of the bacterial biofilm were distinguished: 1) separation of cells from the bacterial colony of biofilms; 2) translocation of bacteria to a new location; 3) the adhesion of bacteria to the substrate of a new region. The active and passive mechanisms of biofilm dispersion are described. Three types of dispersion are characterized: erosion, peeling and seeding. The sequence of events leading to the destruction of biofilm is considered. The triggers of dispersion of the bacterial biofilm, which are various exo- and endogenous factors, are described. Attention is focused on the lysis of bacteria, which contributes to the formation of cavities in the biofilm matrix, as an essential component of biofilm dispersion. The role of biofilm dispersion in the development of recurrent and chronic infectious inflammatory diseases of the respiratory tract is characterized. Attention is focused on the features of the dispersed pathogen population consisting of both individual bacteria and bacterial aggregates, which allows for better adaptation of bacteria to environmental changes.
диспергування біоплівки; респіраторний тракт; рецидивуючі та хронічні інфекційно-запальні захворювання; огляд
диспергирование биопленки; респираторный тракт; рецидивирующие и хронические инфекционно-воспалительные заболевания
biofilm dispersion; respiratory tract; recurrent and chronic infectious inflammatory diseases; review
Введение
Бактериальная биопленка в течение своего существования проходит несколько стадий: от инициации, формирования до заключительного этапа развития — деградации сложной архитектуры матрикса с диспергированием бактерий. Диспергирование биопленки представляет собой скоординированное высвобождение из матрикса дифференцированных подвижных хемотаксических бактерий и их распространение на новые локусы колонизации [1]. Диспергирование биопленки зависит от влияния множества факторов, включая плотность бактерий в биопленке, сигналы кворум-сенсинга и обеспечение питательными веществами. Основными эффекторными молекулами, которые используются разнообразными бактериями для деструкции матрикса биопленки, являются бактериальные ферменты. Деградация матрикса приводит к отрыву отдельных бактерий или бактериальных агрегатов и их высвобождению из биопленки [13].
Фазы диспергирования биопленки
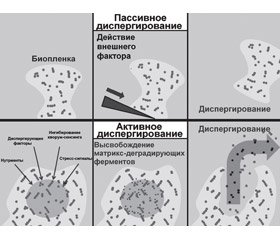
Диспергирование бактериальной биопленки можно разделить на три отдельные фазы: 1) отделение клеток от бактериальной колонии биопленок; 2) транслокация бактерий на новое место локализации; 3) адгезия бактерий к субстрату нового региона. Различают активный и пассивный механизмы диспергирования биопленки: к активным механизмам относят те, которые инициируются самими бактериями, к пассивным — те, которые вызваны внешними факторами (рис. 1) [13].
Типы диспергирования биопленки
Также выделяют три типа диспергирования: эрозию, шелушение и отсев. Непрерывное высвобождение отдельных бактерий или небольших бактериальных кластеров из биопленки во время ее формирования считается эрозией. Внезапное отсоединение больших частей биопленки, как правило, наблюдаемое на поздних стадиях ее жизненного цикла, относится к шелушению. Быстрое высвобождение большого количества отдельных бактерий или небольших бактериальных кластеров из полостей, образованных внутри биопленок, определено как отсев [13].
Индукция активного диспергирования
У многочисленных видов бактерий диспергирование обычно происходит от микроколоний зрелых биопленок и предшествует локализованной гибели и лизису бактериальных клеток в центре биопленочных архитектурных структур [2].
Триггерами диспергирования бактериальной биопленки выступают различные экзо- и эндогенные факторы: изменение доступности питательных веществ, бактериальные аутоиндукторы, жирные кислоты, пептидные сигналы, оксид азота, стресс-сигналы (голод, избыток железа, фосфатов и др.). Триггеры приводят к изменению концентрации вторичных нуклеозидных мессенджеров — циклического дигуанозинмонофосфата (cyclic diguanyl monophosphate — c-di-GMP/ц-ди-ГМФ), гуанозинтетрафосфата (guanosine tetraphosphate — ppGpp), пентафосфата (guanosine tetraphosphate — pppGpp) и малых регуляторных РНК, которые изменяют активность экспрессии бактериальных генов [20].
Эффекторы активного диспергирования
Изменение транскрипционного профиля бактерии под влиянием вторичных месенджеров обусловливает продукцию ряда эффекторных молекул, которые нарушают структуру полисахаридного матрикса биопленки и разрушают связь бактерий с ее архитектурными компонентами, что приводит к диспергированию [1, 24]. Во-первых, бактерии продуцируют ферменты, которые деградируют компоненты матрикса биопленки: протеазы, гидролазы, дезоксирибонуклеазы, которые лизируют протеины, полисахариды, нуклеиновые кислоты соответственно. Во-вторых, бактерии для снижения поверхностного натяжения и облегчения процесса своего высвобождения из биопленок продуцируют такие амфипатические молекулы, как рамнолипиды [14], эндогенные биосурфактанты: вискозин (липопептид), сурфактин, путисольвины, стафилококковые фенолсолютабные модулины, обладающие способностью индуцировать отделение биопленки [16, 22]. И, в-третьих, у бактерий, высвобождаемых из биопленок, нарушается обычная структура пили IV типа, они удлиняются и утолщаются, что приводит к резкому снижению степени их адгезии с клетками макроорганизма. Переход от оседлого к планктонному образу жизни также сопровождается активацией подвижности бактерий [1, 9].
Лизис бактерий биопленки
Важнейшим компонентом диспергирования биопленки является лизис бактерий, который способствует образованию полостей в матриксе биопленки. У многочисленных видов бактерий локализованная гибель и лизис микроорганизмов в центре биопленочных архитектурных структур обычно предшествуют диспергированию зрелых биопленок. Лизис бактерий биопленки обусловлен активацией генов, индуцирующих аутолизис бактерий. В частности, продемонстрировано, что универсальная молекула кворум-сенсинга AI-2 обладает способностью индуцировать экспрессию гена профага 5 (prophage 5 — Pp5) бактерий Enterococcus faecalis V583DABC. Продукты гена Pp5 вызывают аутолизис бактерий биопленки [21]. Luyan Ma и соавт. [17] предполагают, что запрограммированная гибель бактерий биопленки формирует образование полостей в центре матрикса для высвобождения части бактерий. Бактериальная микроколония ради распространения жертвует частью клеток. Лизис клеток также высвобождает экстрацеллюлярную ДНК (эДНК), питательные вещества и ферменты, которые участвуют в деградации компонентов матрикса. Диспергированные бактерии, представляющие «второе поколение», адгезируют на новых участках поверхности и инициируют повторную колонизацию, вызывая воспалительную реакцию и формируя новую биопленку.
Бактериальные клетки, высвобожденные из биопленок
Бактерии, высвобожденные из биопленок, отличаются по морфофункциональным особенностям от своих предшественников, сформировавших биопленку [5]. Диспергированные бактерии в отличие от планктонных форм содержатся в виде как отдельных одиночных бактерий, так и бактериальных агрегатов [15].
Популяция диспергированных бактерий характеризуется высокой фенотипической гетерогенностью своих представителей. В основе проявления феномена фенотипической гетерогенности диспергированных бактерий лежат три основных механизма: 1) физиологическая адаптация бактерий к локальным условиям окружающей среды за счет изменения спектра экспрессируемых генов; 2) генотипическая вариабельность за счет мутаций или хромосомных перегруппировок; 3) стохастическое переключение генов [23]. Согласно данным транскрипционных исследований, проведенных с бактериями Streptococcus pneumoniae, Pseudomonas aeruginosa, Klebsiella pneumoniae, диспергированные бактерии имеют признаки глобального транскрипционного перепрограммирования и в целом характеризуются проявлениями уникального фенотипа, который не похож на фенотип планктонных бактерий, инициировавших формирование биопленки, и фенотипа бактерий зрелых биопленок [7, 10, 19]. Диспергированные бактерии отличаются одновременным наличием признаков как планктонных микроорганизмов, так и микроорганизмов биопленки и сохраняют этот особый фенотип в течение длительного времени. Сочетание признаков различных форм жизни, по всей вероятности, обусловлено флуктуациями уровня вторичных мессенджеров. Так, диспергирование бактерий приводит к усилению продукции ц-ди-ГМФ, что возвращает бактериям биопленки их планктонный фенотип. Однако рост колонии диспергированных бактерий в присутствии диспергирующих агентов конститутивно активирует PDE и приводит к снижению ц-ди-ГМФ, в результате чего диспергированные бактерии не могут приобрести полностью планктонный фенотип [7].
Важнейшей особенностью диспергированных бактерий является сверхэкспрессия общих факторов вирулентности по сравнению с планктонными или «оседлыми» формами микроорганизмов [19]. Так, продемонстрировано, что у диспергированных бактерий Streptococcus pneumoniae наблюдается более высокая экспрессия генов вирулентности, чем у представителей планктона и биопленок. Они индуцируют более высокий уровень активности ответной воспалительной реакции и вызывают более интенсивную гибель человеческих эпителиальных клеток респираторного тракта [18]. Диспергированные бактерии Pseudomonas aeruginosa, в отличие от их планктонных форм, характеризуются низким уровнем экспрессии Gac-зависимых малых РНК RsmY и RsmZ, высоким уровнем экспрессии факторов вирулентности, в частности компонентов механизмов секреции T2SS, адгезинов, и более низкой продукцией сидерофоров, например пиовердина [7].
В отличие от планктонных бактерий диспергированные бактерии характеризуются высокой активностью адгезии, что позволяет им быстро колонизировать новые локусы слизистой оболочки и формировать новые очаги патологической биопленки [1].
Важнейшим отличием популяции диспергированных патогенов является то, что она состоит как из отдельных бактерий, так и из бактериальных агрегатов [15]. Cyril Guilhen и соавт. [11] подчеркивают, что отдельные бактерии высокомобильны — могут активно перемещаться, избегая неблагоприятных для жизнедеятельности локальных условий, и восприимчивы к действию антибиотиков, в то время как агрегированные бактерии малоподвижны, защищены экстрацеллюлярным матриксом и резистентны к действию антибиотиков. Прогностическое компьютерное моделирование поведения микроколонии диспергированных бактерий показало, что одновременное присутствие отдельных бактерий и бактериальных агрегатов позволяет бактериям лучше адаптироваться к изменениям окружающей среды.
Диспергированные бактерии характеризуются подавленной экспрессией генов, которые активны у бактерий с фенотипом оседлого образа жизни и кодируют экзополисахариды, компоненты фимбрий, и повышенной экспрессией генов, кодирующих факторы, которые определяют подвижность микроорганизмов [1, 3].
Острые инфекционные заболевания вызваны планктонными бактериями, которые, как правило, высокочувствительны к антибактериальным препаратам. Полагают, что в отличие от острых инфекций развитие хронического процесса ассоциировано с диспергированными бактериями из биопленки, обладающими резистентностью к действию как антибактериальных средств, так и антимикробных пептидов. Считают, что 65–80 % хронических инфекций человека связаны с развитием биопленки [7].
Выводы
Таким образом, разрушение матрикса биопленки способствует высвобождению патогенных бактерий и последующей их транслокации на непораженные места слизистой оболочки респираторного тракта. Считается, что диспергирование происходит в виде либо высвобождения отдельных бактерий, либо отрыва от биопленок небольших микроколоний. Распространение бактерий из биопленки предоставляет им возможность колонизировать новые зоны или ниши и, таким образом, хронизировать инфекционный процесс. Фактически диспергирование является причиной обострений инфекционно-воспалительных рецидивирующих и хронических заболеваний [4, 6, 8, 12]. Некоторые исследователи считают, что распространение биопленки является начальной точкой системного инфекционного процесса [11, 18].
Медикаментозное управление диспергированием биопленок, сформированных патогенными бактериями, вероятно, позволит оптимизировать процесс лечения рецидивирующих и хронических инфекционно-воспалительных заболеваний респираторного тракта, резистентных к традиционной терапии.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
1. Barraud N., Kjelleberg S., Rice S.A. Dispersal from Microbial Biofilms. Microbiol Spectr. 2015 Dec. 3 (6). doi: 10.1128/microbiolspec.MB-0015-2014.
2. Bayles K.W. The biological role of death and lysis in biofilm development. Nat. Rev. Microbiol. 2007 Sep. 5 (9). 721-6. doi: 10.1038/nrmicro1743.
3. Beitelshees M., Hill A., Jones C.H., Pfeifer B.A. Phenotypic Variation during Biofilm Formation: Implications for Anti-Biofilm Therapeutic Design. Materials (Basel). 2018 Jun 26. 11 (7). pii: E1086. doi: 10.3390/ma11071086.
4. Beloin C., Renard S., Ghigo J.M., Lebeaux D. Novel approaches to combat bacterial biofilms. Curr. Opin. Pharmacol. 2014 Oct. 18. 61-8. doi: 10.1016/j.coph.2014.09.005.
5. Berlanga M., Guerrero R. Living together in biofilms: the microbial cell factory and its biotechnological implications. Microb. Cell. Fact. 2016 Oct 1. 15 (1). 165. doi: 10.1186/s12934-016-0569-5.
6. Bjarnsholt T. The role of bacterial biofilms in chronic infections. APMIS Suppl. 2013 May. 136. 1-51. doi: 10.1111/apm.12099.
7. Chua S.L., Liu Y., Yam J.K. et al. Dispersed cells represent a distinct stage in the transition from bacterial biofilm to planktonic lifestyles. Nat. Commun. 2014 Jul 21. 5. 4462. doi: 10.1038/ncomms5462.
8. de la Fuente-Núñez C., Reffuveille F., Fernández L., Hancock R.E. Bacterial biofilm development as a multicellular adaptation: antibiotic resistance and new therapeutic strategies. Curr. Opin. Microbiol. 2013 Oct. 16 (5). 580-9. doi: 10.1016/j.mib.2013.06.013.
9. Fleming D., Rumbaugh K.P. Approaches to Dispersing Medical Biofilms. Microorganisms. 2017 Apr 1. 5 (2). pii: E15. doi: 10.3390/microorganisms5020015.
10. Guilhen C., Charbonnel N., Parisot N.et al Transcriptional profiling of Klebsiella pneumoniae defines signatures for planktonic, sessile and biofilm-dispersed cells. BMC Genomics. 2016 Mar 15. 17. 237. doi: 10.1186/s12864-016-2557-x.
11. Guilhen C., Forestier C., Balestrino D. Biofilm dispersal: multiple elaborate strategies for dissemination of bacteria with unique properties. Mol. Microbiol. 2017 Jul. 105 (2). 188-210. doi: 10.1111/mmi.13698.
12. Jamal M., Ahmad W., Andleeb S. et al. Bacterial biofilm and associated infections. J. Chin. Med. Assoc. 2018 Jan. 81 (1). 7-11. doi: 10.1016/j.jcma.2017.07.012.
13. Kaplan J.B. Biofilm dispersal: mechanisms, clinical implications, and potential therapeutic uses. J. Dent. Res. 2010 Mar. 89 (3). 205-18. doi: 10.1177/0022034509359403.
14. Kiran G.S., Ninawe A.S., Lipton A.N. et al Rhamnolipid biosurfactants: evolutionary implications, applications and future prospects from untapped marine resource. Crit. Rev. Biotechnol. 2016. 36 (3). 399-415. doi: 10.3109/07388551.2014.979758.
15. Kragh K.N., Hutchison J.B., Melaugh G. et al. Role of Multicellular Aggregates in Biofilm Formation. MBio. 2016 Mar 22. 7 (2). e00237. doi: 10.1128/mBio.00237-16.
16. Kruijt M., Tran H., Raaijmakers J.M. Functional, genetic and chemical characterization of biosurfactants produced by plant growth-promoting Pseudomonas putida 267. J. Appl. Microbiol. 2009 Aug. 107 (2). 546-56. doi: 10.1111/j.1365-2672.2009.04244.x.
17. Ma L., Conover M., Lu H. et al. Assembly and development of the Pseudomonas aeruginosa biofilm matrix. PLoS Pathog. 2009 Mar. 5 (3): e1000354. doi: 10.1371/journal.ppat.1000354.
18. Marks L.R., Davidson B.A., Knight P.R., Hakansson A.P. Interkingdom signaling induces Streptococcus pneumoniae biofilm dispersion and transition from asymptomatic colonization to disease. MBio. 2013 Jul 23. 4 (4). pii: e00438-13. doi: 10.1128/mBio.00438-13.
19. Pettigrew M.M., Marks L.R., Kong Y. et al. Dynamic changes in the Streptococcus pneumoniae transcriptome during transition from biofilm formation to invasive disease upon influenza. A virus infection. Infect Immun. 2014 Nov. 82 (11). 4607-19. doi: 10.1128/IAI.02225-14.
20. Römling U., Galperin M.Y. Discovery of the Second Messenger Cyclic di-GMP. Methods Mol. Biol. 2017. 1657. 1-8. doi: 10.1007/978-1-4939-7240-1_1.
21. Rossmann F.S., Racek T., Wobser D. et al Phage-mediated dispersal of biofilm and distribution of bacterial virulence genes is induced by quorum sensing. PLoS Pathog. 2015 Feb 23. 11 (2). e1004653. doi: 10.1371/journal.ppat.1004653.
22. Satputea S.K., Banpurkar A.G., Banat I.M. et al. Multiple Roles of Biosurfactants in Biofilms. Curr. Pharm. Des. 2016. 22 (11). 1429-48. PMID: 26786675.
23. Stewart P.S., Franklin M.J. Physiological heterogeneity in biofilms. Nat. Rev. Microbiol. 2008 Mar. 6 (3). 199-210. doi: 10.1038/nrmicro1838.
24. Wood T.K. Biofilm dispersal: deciding when it is better to travel. Mol. Microbiol. 2014 Nov. 94 (4). 747-50. doi: 10.1111/mmi.12797.

/95-1.jpg)