Журнал «» №3-4 (65-66), 2019
Вернуться к номеру
Бета-блокаторы у беременных с хронической артериальной гипертензией: какой препарат выбрать?
Авторы: А.В. Савустьяненко
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Нелікована хронічна артеріальна гіпертензія у вагітних часто посилюється під час вагітності та в післяпологовому періоді, що призводить до підвищення ризику захворюваності і смерті матері, плода або новонародженого. Тому пошук ефективної і безпечної антигіпертензивної терапії є важливим завданням. У цій статті виконано короткий огляд одного з вітчизняних досліджень, у рамках якого були вивчені 4 групи вагітних із хронічною гіпертензією: без лікування; які отримували комбінацію метилдопи і звичайних бета-блокаторів (атенолол, метопролол, бісопролол); які отримували комбінацію метилдопи і бета-блокатора з судинорозширювальними властивостями (небіволол); здорових вагітних. Небіволол відноситься до групи кардіоселективних вазодилататорних бета-блокаторів і на додаток до β1-адреноблокади розширює судини за рахунок посилення утворення оксиду азоту (NO). Оцінку показників, описаних нижче, виконували під час пологів і в найближчому післяпологовому періоді. У всіх випадках було виявлено перевагу небівололу перед звичайними бета-блокаторами. Було з’ясовано, що включення небівололу в схему лікування хронічної артеріальної гіпертензії забезпечувало чіткий контроль артеріального тиску і запобігало різкому (стрибкоподібному) підвищенню систолічного і діастолічного тиску і частоти серцевих скорочень, що могло б становити небезпеку для здоров’я матері й дитини. На тлі лікування даним препаратом не виникало задишки. Також включення небівололу в схему лікування хронічної артеріальної гіпертензії сприяло максимальному наближенню тривалості й характеру перебігу пологів, обсягу крововтрати, значення за шкалою Апгар і ваги новонароджених до значень даних показників у групі здорових породіль. Існують загальновідомі уявлення про те, що бета-блокатори чинять негативний вплив на перебіг вагітності (збільшують ризик народження плода з низькою масою тіла для даного терміну вагітності (англ. Small for gestational age), передчасних пологів, перинатальної смертності і т.д.). Дані розглянутого нами і низки інших вітчизняних досліджень дозволяють припустити, що негативний вплив бета-блокаторів на перебіг вагітності не варто розглядати як загальнокласовий ефект, а потрібно співвідносити з тим або іншим препаратом окремо. Зокрема, небіволол негативної дії не виявляв. За даними вітчизняних досліджень, небіволол може бути призначений як ефективне і безпечне лікування вагітним із хронічною артеріальною гіпертензією.
Нелеченая хроническая артериальная гипертензия у беременных часто усугубляется во время беременности и в послеродовом периоде, что приводит к повышению риска заболеваемости и смерти матери, плода или новорожденного. Поэтому поиск эффективной и безопасной антигипертензивной терапии является важной задачей. В настоящей статье выполнен краткий обзор одного из отечественных исследований, в рамках которого были изучены 4 группы беременных с хронической гипертензией: без лечения; получавших комбинацию метилдопы и обычных бета-блокаторов (атенолол, метопролол, бисопролол); получавших комбинацию метилдопы и бета-блокатора с сосудорасширяющими свойствами (небиволол); здоровых беременных. Небиволол относится к группе кардиоселективных вазодилататорных бета-блокаторов и в дополнение к β1-адреноблокаде расширяет сосуды за счет усиления образования оксида азота (NO). Оценку показателей, описанных ниже, производили во время родов и в ближайшем послеродовом периоде. Во всех случаях было обнаружено преимущество небиволола перед обычными бета-блокаторами. Было выяснено, что включение небиволола в схему лечения хронической артериальной гипертензии обеспечивало четкий контроль артериального давления и предотвращало резкое (скачкообразное) повышение систолического и диастолического давления и частоты сердечных сокращений, что могло бы представлять опасность для здоровья матери и ребенка. На фоне лечения данным препаратом не возникала одышка. Также включение небиволола в схему лечения хронической артериальной гипертензии способствовало максимальному приближению длительности и характера течения родов, объема кровопотери, значения по шкале Апгар и веса новорожденных к значениям данных показателей в группе здоровых рожениц. Существуют общеизвестные представления о том, что бета-блокаторы оказывают негативное влияние на течение беременности (увеличивают риск рождения плода с низкой массой тела для данного срока беременности (англ. small for gestational age), преждевременных родов, перинатальной смертности и т.д.). Данные рассматриваемого нами и ряда других отечественных исследований позволяют предположить, что негативное влияние бета-блокаторов на течение беременности не следует рассматривать как общеклассовый эффект, а нужно соотносить с тем или иным препаратом в отдельности. В частности, небиволол негативного действия не проявлял. По данным отечественных исследований, небиволол может быть назначен в качестве эффективного и безопасного лечения беременным с хронической артериальной гипертензией.
Untreated chronic arterial hypertension in pregnant women often leads to a worsening of hypertension during pregnancy and the postpartum period, as well as an increased risk of morbidity and mortality in the mother, fetus or newborn. Therefore, the search for effective and safe antihypertensive therapy is an important task. This article provides a brief overview of one of the Ukrainian studies, in which four groups of pregnant women with chronic hypertension were studied: without treatment; treated with a combination of methyldopa and conventional beta-blockers (atenolol, metoprolol, bisoprolol); treated with a combination of methyldopa and beta-blocker with vasodilating properties (nebivolol); healthy pregnant. Nebivolol belongs to the group of cardioselective, vasodilatory beta-blockers, and in addition to β1-adrenoblockade, it dilates blood vessels by enhancing the formation of nitric oxide (NO). Evaluation of the indicators described below was performed during delivery and in the immediate postpartum period. In all cases, nebivolol was found to be superior to conventional beta-blockers. It was found that the inclusion of nebivolol in the treatment regimen of chronic arterial hypertension provided a clear control of blood pressure and prevented a sudden increase in systolic blood pressure, diastolic blood pressure and heart rate, which could pose a risk to the health of the mother and child. During treatment with this drug, shortness of breath did not occur. The inclusion of nebivolol in the treatment regimen of chronic arterial hypertension contributed to the maximum similarity of the duration and course of labor, the volume of blood loss, Apgar score and newborn weight to the values of these indicators in the group of healthy women in childbirth. There is a well-known statement that beta-blockers have a negative effect on the course of pregnancy (increase the risk of being born small for gestational age, premature birth, perinatal mortality, etc.). The data of study under discussion and several other domestic studies suggest that the negative effect of beta-blockers on pregnancy should not be considered as a class-wide effect, but should be correlated with a particular drug separately. In particular, nebivolol did not show a negative effect. According to Ukrainian, Russian and Belarusian studies, nebivolol can be prescribed as an effective and safe agent for pregnant women with chronic arterial hypertension.
бета-блокатори; небіволол; хронічна артеріальна гіпертензія; вагітні
бета-блокаторы; небиволол; хроническая артериальная гипертензия; беременные
beta-blockers; nebivolol; chronic arterial hypertension; pregnant women
Введение
В соответствии с определением Американского колледжа акушерства и гинекологии, диагноз хронической гипертензии у беременных выставляют в том случае, если систолическое артериальное давление (САД) ≥ 140 мм рт.ст. и диастолическое артериальное давление (ДАД) ≥ 90 мм рт.ст. выявляют до беременности или до 20–й недели гестации. Внесение последнего пункта было связано с тем, что многие женщины обращаются за медицинской помощью только тогда, когда становятся беременными [1, 2].
По данным разных авторов, частота хронической гипертензии у беременных составляет 1–5 % [3, 4] и неуклонно продолжает расти, что связано преимущественно с эпидемией ожирения и увеличением материнского возраста [3].
Существует много негативных следствий хронической гипертензии у беременных. Прежде всего это утяжеление самого состояния: при плохом контроле давления значительно чаще развивается тяжелая гипертензия (≥ 160/110 мм рт.ст.), чем при хорошем контроле. (В процитированной работе под «плохим контролем давления» подразумевается целевое ДАД на уровне 100 мм рт.ст.; под «хорошим контролем давления» — целевое ДАД 85 мм рт.ст.) [5]. В одном из метаанализов также было продемонстрировано, что антигипертензивная терапия уменьшает риск тяжелого повышения давления у беременных с хронической гипертензией [6].
Следующим следствием хронической гипертензии у беременных является повышение риска заболеваемости и смерти матери, плода или новорож–денного.
Например, в метаанализе [7] было выявлено, что хроническая гипертензия увеличивает частоту сочетанной преэклампсии, кесарева сечения, прежде–временных родов раньше 37 недель гестации, веса новорожденных < 2500 граммов, госпитализации в неонатологическое отделение и перинатальной смертности.
В популяционном исследовании [8] было обнаружено, что хроническая гипертензия приводит к росту внутригоспитальной материнской, фетальной и неонатальной смертности. Кроме того, росла частота инсультов, почечной недостаточности, отека легких, тяжелой преэклампсии, отслойки плаценты у матерей; синдрома задержки развития плода, недоношенности, низкого и очень низкого веса, респираторного дистресс–синдрома у новорожденных.
Когда беременных делили на группы в соответствии с их артериальным давлением, то риск развития вышеперечисленных осложнений закономерно рос в ряду увеличения давления от менее 140/90 мм рт.ст. до 140–150/90–99 мм рт.ст. и до 151–159/100–109 мм рт.ст. [9].
При использовании вспомогательных репродуктивных технологий (ВРТ) степень гипертензии и выраженность осложнений могут быть даже хуже, чем при естественной беременности [10].
Наконец, еще одним негативным следствием хронической гипертензии у беременных является тот факт, что она может утяжелять гипертензию, увеличивать риск сердечно–сосудистых, цереброваскулярных и прочих осложнений в последующие годы жизни женщин, в том числе и во время следующей беременности [3, 11, 12].
С учетом актуальности проблемы очевидна необходимость поиска эффективных фармакологических средств для борьбы с хронической гипертензией у беременных. В этом направлении украинские исследователи С.Н. Геряк, И.Е. Гуменная, И.В. Корда и В.Ю. Добрянская выполнили открытое контролируемое исследование, результаты которого были опубликованы на украинском и английском языках [13, 14]. Далее на эту работу мы будем ссылаться по первому автору английской версии в виде «Гуменная И.Е. и соавт.». В исследовании сравнивали антигипертензивную эффективность и безопасность обычных бета–блокаторов (атенолол, метопролол, бисопролол) и бета–блокатора с сосудорасширяющими свойствами (небиволол), в обоих случаях назначаемых в комбинации с центральным альфа–адреномиметиком (метилдопа). Цель нашей статьи сводилась к краткому обзору основных результатов этой работы.
Для ясности отметим, что в соответствии с со–временной классификацией атенолол, метопролол и бисопролол относят к кардиоселективным невазодилататорным бета–блокаторам. Их эффект проявляется в основном благодаря блокаде β1–адренорецепторов сердца. Небиволол относится к группе кардиоселективных вазодилататорных бета–блокаторов и в дополнение к β1–адреноблокаде расширяет сосуды за счет усиления образования оксида азота (NO) [15].
Небиволол уменьшает эндотелиальную дисфункцию, сопровождающую артериальную гипертензию, и, стимулируя β3–адренорецепторы, повышает активность эндотелиальной NO–синтазы, приводя к образованию NO. Препарат проявляет антиоксидантные свойства, обладает благоприятным профилем в отношении липидного и углеводного метаболизма. В частности, он достоверно снижает уровень триглицеридов, общего холестерина и холестерина липопротеидов низкой плотности (ЛПНП); он не уменьшает чувствительность к инсулину подобно атенололу и не влияет на частоту новых случаев сахарного диабета. Такие побочные эффекты, как утомляемость, депрессия, брадикардия, ухудшение сердечной сократимости и бронхоспазм, очень редко возникают при использовании небиволола [16–18].
Краткий обзор результатов работы И.Е. Гуменной и соавт. [13, 14]
Пациенты и проводимое лечение
В период 2013–2018 гг. в исследование было включено 228 женщин, за которыми наблюдали примерно по 90 дней до и после родов. Во всех случаях имелась доношенная (40 ± 2 недели) одноплодная беременность, спонтанное начало родов в перед– нем виде затылочного предлежания.
Среди женщин 56 были условно здоровы и составили контрольную группу. У остальных 172 женщин еще до наступления беременности был диагностирован один из вариантов хронической артериальной гипертензии (гипертоническая болезнь I–II стадии, II степени тяжести; артериальная гипертензия на фоне патологических состояний, сопровождающихся вегетососудистой дисфункцией, и/или эпизоды артериальной гипертензии в анамнезе). У участниц не было симптоматической артериальной гипертензии и преэклампсии.
Всех женщин с хронической артериальной гипертензией разделили на три группы:
— не лечивших гипертензию до беременности и имевших плохой комплайенс к лечению во время беременности (n = 58);
— принимавших во время беременности метилдопу + обычные бета–блокаторы (атенолол, метопролол, бисопролол; n = 57);
— принимавших во время беременности метилдопу + бета–блокатор с сосудорасширяющими свойствами (небиволол 5–10 мг/день перорально; n = 57).
В ходе исследования было проанализировано влияние указанных программ антигипертензивной терапии на САД и ДАД, частоту сердечных сокращений (ЧСС) и частоту дыхания (ЧД) во время родов и в ближайшем послеродовом периоде. Кроме того, было изучено влияние антигипертензивной терапии на ряд других параметров здоровья матери и ребенка (величина кровопотери, значение по шкале Апгар, вес ребенка и т.д.).
У части женщин роды проводили в условиях спинальной/эпидуральной анальгезии, у части — без нее. Поскольку данный вид анальгезии влияет на гемодинамические параметры, то при проведении статистического анализа поступали следующим образом. Влияние антигипертензивной терапии на САД, ДАД, ЧСС и ЧД оценивали только среди женщин, не получавших спинальную/эпидуральную анальгезию:
— контрольная группа (n = 20);
— не лечившие гипертензию (n = 24);
— метилдопа + обычные бета–блокаторы (n = 22);
— метилдопа + небиволол (n = 22).
Влияние антигипертензивной терапии на дополнительные параметры (величина кровопотери, значение по шкале Апгар, вес ребенка и т.д.) оценивали среди всех женщин, без разделения на получавших и не получавших спинальную/эпидуральную анальгезию.
Результаты
Влияние на артериальное давление, частоту сердечных сокращений и частоту дыхания
Влияние антигипертензивной терапии на САД, ДАД, ЧСС и ЧД оценивали в начале I периода родов, непосредственно во время I периода родов (переход латентной фазы родов в активную — раскрытие шейки матки более 3 см), во время II и III периодов родов и спустя 2 ч после родов.
Из рис. 1 видно, что у рожениц без лечения САД во всех точках превышало таковое в контрольной группе. При назначении метилдопы и обычных бета–блокаторов САД снижалось во II периоде родов, однако, несмотря на это, во всех точках продолжало превышать таковое в контрольной группе.
Лишь при назначении метилдопы и небиволола САД снижалось настолько, что во всех точках переставало достоверно отличаться от САД в контрольной группе (т.е. становилось практически таким, как давление здоровых рожениц).
Динамика ДАД в целом соответствовала динамике САД, поэтому подробно мы ее описывать не будем. Авторы цитируемой работы обратили внимание на тот факт, что ДАД в группе с обычными бета–блокаторами становилось ригидным (практически не менялось: I период — 102,1 мм рт.ст., II период — 103,4 мм рт.ст., III период — 102,8 мм рт.ст.). Этот негативный феномен не наблюдался в группе с небивололом.
Интересный феномен наблюдался и в отношении ЧСС. У рожениц контрольной группы данный показатель увеличивался (начало родов — 87 уд/мин, I период — 91 уд/мин, II период — 99 уд/мин), что отражает физиологическую перестройку в связи с протеканием родов. У рожениц без лечения тахикардия была слишком высокой (II период — 111 уд/мин). У рожениц с метилдопой и обычными бета–блокаторами, напротив, наблюдалось недостаточное компенсаторное увеличение ЧСС (начало родов — 77 уд/мин, I период — 79 уд/мин, II период — 81 уд/мин), что влекло за собой нарастание одышки, чтобы удовлетворить потребности организма в кислороде. И лишь у рожениц с метилдопой и небивололом перестройка ЧСС и ЧД была максимально приближена к таковой в контрольной группе (без достоверных различий).
Использование спинальной/эпидуральной анальгезии в целом не влияло на вышеописанные закономерности, лишь незначительно изменяя оцениваемые показатели (например, САД могло быть снижено на 6–7 мм рт.ст., ЧСС — на 5 уд/мин и т.д.).
Авторы сделали вывод о том, что включение небиволола в схему лечения хронической артериальной гипертензии обеспечивало четкий контроль артериального давления и предотвращало резкое (скачко–образное) повышение САД, ДАД и ЧСС, что могло бы представлять опасность для здоровья матери и ребенка. На фоне лечения данным препаратом не возникала одышка.
Влияние на длительность и характер течения родов, величину кровопотери, оценку по шкале Апгар, вес новорожденных
Наличие хронической артериальной гипертензии влияет не только на работу сердечно–сосудистой системы, но и на ряд других параметров здоровья роженицы и ребенка.
В частности, было отмечено увеличение длительности родов. У первородящих в группе без лечения такой показатель, как длительность I периода родов более 8 часов, наблюдался у 10 (17,9 %) женщин, в группе с обычными бета–блокаторами — у 10 (17,5 %), в группе с небивололом — у 5 (8,6 %), в группе контроля — у 2 (3,6 %) женщин. Всем перечисленным роженицам в связи со слабой родовой деятельностью требовался тот или иной вид родостимуляции (простагландины, окситоцин, амнио– томия и т.д.). Из приведенных цифр видно, что рассматриваемый показатель в 5 раз выше в группах без лечения и с обычными бета–блокаторами и в 2,5 раза выше в группе с небивололом по сравнению с контрольной группой.
Объем кровопотери во время родов был достоверно выше в группах без лечения и с обычными бета–блокаторами. Только в группе с небивололом данный показатель достоверно не отличался от контрольной группы (рис. 2).
В ходе исследования был оценен один из производных показателей: количество женщин, у которых кровопотеря превышала 400 мл. В группе без лечения таких рожениц было 17 (30,4 %), в группе с обычными бета–блокаторами — 15 (26,3 %), в группе с небивололом — 5 (8,8 %), в контрольной группе — 2 (3,6 %). Налицо преимущества в той группе, которая вместе с метилдопой получала небиволол.
Оценка по шкале Апгар на 1–й минуте достоверно не отличалась от таковой в группе с небивололом и контрольной группе. В то же время в двух других группах показатель достоверно отличался в более низкую сторону (рис. 3).
Важным наблюдением было то, как проводимая антигипертензивная терапия влияет на вес ново–рожденных. В группе с небивололом и в контрольной группе он не различался, в то время как в остальных двух группах был достоверно снижен (рис. 4).
При оценке производного показателя «новорож–денные с весом менее 2500 граммов» в группе без лечения таких детей оказалось 10 (17,9 %), в группе с обычными бета–блокаторами — 11 (19,3 %), в группе с небивололом — 6 (10,5 %), в контрольной группе — 2 (3,6 %). Снова налицо преимущества в той группе, которая вместе с метилдопой получала небиволол.
Следовательно, при сравнении средних значений изученных показателей (рис. 2–4) достоверные различия между группой с небивололом и контрольной группой отсутствовали. Однако при изучении специфических подгрупп (длительность I периода родов более 8 часов у первородящих, количество женщин, у которых кровопотеря превышала 400 мл, новорожденные с весом менее 2500 граммов) некоторое преимущество у контрольной группы все же сохранялось.
Авторы сделали вывод о том, что включение небиволола в схему лечения хронической артериальной гипертензии способствовало максимальному приближению длительности и характера течения родов, объема кровопотери, значения по шкале Апгар и веса новорож– денных к значениям данных показателей в группе здоровых рожениц.
Механизмы антигипертензивного действия небиволола
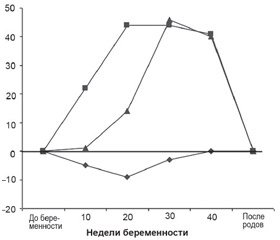
Физиологические изменения артериального давления во время беременности выглядят следующим образом. У исходно нормотензивных беременных наблюдается постепенное снижение давления в течение 1–го триместра и первой половины 2–го триместра. В низшей точке среднее артериальное давление снижается на 8–10 мм рт.ст. (причем ДАД снижается обычно больше, чем САД). Далее наоборот, наблюдается подъем давления в течение второй половины 2–го триместра и 3–го триместра, в результате чего к родам давление возвращается к своим исходным цифрам [2, 19–21].
Более детально эти процессы представлены на рис. 5. Видно, что в течение первой половины беременности наблюдается увеличение сердечного выброса и объема циркулирующей крови (верхние две кривые на рисунке). Такая перестройка позволяет сердцу прокачивать больше крови, что обеспечивает беременную и плод достаточным количеством кислорода и питательных веществ [21, 22].
Казалось бы, рост сердечной деятельности должен был привести к подъему давления. Однако на самом деле среднее артериальное давление снижается на 8–10 мм рт.ст. (нижняя кривая на рисунке). Это связано с расширением сосудов (вазодилатацией), достигаемой выбросом таких местных медиаторов, как простациклин (PGI2) и оксид азота (NO). Эта реакция носит защитный характер, предотвращая рост давления у беременных [20, 21, 23].
У беременных с хронической артериальной гипертензией во многом нарушен именно этот последний механизм. У них сохраняется известная доля сужения сосудов (вазоспазм), что вносит вклад в патологическое повышение давления [24–26]. Более того, во многом именно вазоспазм определяет нарушение плацентарной перфузии и функции с последующими осложнениями у плода и ново– рожденного [27–29].
Механизмы антигипертензивного действия небиволола у беременных с хронической артериальной гипертензией все еще требуют тщательного изучения. Однако предполагается, что основу эффекта составляет способность препарата стимулировать высвобождение оксида азота (NO) и вызывать то самое расслабление сосудов, которое наблюдалось у здоровых беременных [13, 14].
Важно, что небиволол меньше снижает ЧСС, чем другие кардиоселективные бета–блокаторы, что рассматривается как положительный эффект: чем меньше будет снижен сердечный выброс, тем меньше снижается прокачка сердцем крови, так необходимой для доставки кислорода и питательных веществ организму беременной и плода [13, 14, 30].
Безопасность
В дополнение к типичным побочным эффектам бета–блокаторов, которые могут проявляться у человека (бронхоспазм и пр.), в ряде исследований было сообщено о негативном влиянии на течение беременности. Например, при проведении крупного популяционного когортного исследования K. Meidahl Petersen и соавт. было обнаружено, что назначение бета–блокаторов беременным женщинам связано с увеличением риска рождения плода с низкой массой тела для данного срока беременности (англ. small for gestational age), преждевременных родов и перинатальной смертности [31].
Эти же данные были подтверждены в процитированной нами работе И.Е. Гуменной и соавт. [13, 14], хотя авторы не вынесли обнаруженный ими факт в подробное обсуждение к статье. На рис. 4 видно, что масса новорожденных в группе здоровых беременных составила в среднем 3298,5 г, в группе беременных без лечения — 3118,9 г (p < 0,05). Однако в группе беременных с обычными бета–блокаторами (атенолол, метопролол, бисопролол) масса новорожденных (3002,2 г) оказалась даже ниже, чем если бы беременных не лечили вовсе (p < 0,05 по сравнению с беременными без лечения; наш собственный пересчет по t–критерию Стьюдента).
Однако там же, в процитированной нами работе И.Е. Гуменной и соавт. [13, 14], в группе с небивололом не было отмечено снижения массы ново– рожденных по сравнению с группой здоровых беременных (p > 0,05).
Следовательно, полученные данные позволяют предположить, что негативное влияние бета–блокаторов на течение беременности не следует рассматривать как общеклассовый эффект, а нужно соотносить с тем или иным препаратом в отдельности. В частности, небиволол, похоже, негативного действия не проявляет.
Это положение было подтверждено и в ряде других работ. Приведем примеры некоторых из них.
О.Н. Ткачева и соавт. сообщают о том, что в ходе исследования женщин с артериальной гипертензией во время беременности (хроническая гипертензия и гестационная гипертензия) не было отмечено негативного влияния небиволола на плод, а также на состояние здоровья, рост и развитие детей. Применение небиволола предотвращало развитие (наслоение) преэклампсии и осложнений, свойственных гипертензии беременных, — внутриутробной задержки развития и гибели плода, а также преждевременных родов [32].
А.М. Пристром и соавт. в своем исследовании женщин с артериальной гипертензией во время беременности (хроническая гипертензия и гестационная гипертензия) пришли к заключению, что монотерапия небивололом в дозе 5 мг/сут или его комбинацией с метилдопой либо амлодипином в краткосрочных режимах направлена на снижение частоты нарушений плацентарного кровотока, а в длительных режимах (от 2 до 17 недель, в среднем 10 недель) не приводит к повышению частоты нарушений плацентарного кровотока и не повышает риск синдрома задержки развития плода [33].
Таким образом, хотя в одном экспериментальном исследовании на крысах K. Altoama и соавт. [34] обнаружили способность небиволола негативно влиять на развитие плода и на постнатальное развитие, в клинических исследованиях это не подтвердилось. В приведенных выше работах И.Е. Гуменной и соавт. [13, 14], О.Н. Ткачевой и соавт. [32], А.М. Пристрома и соавт. [33] не было обнаружено какого–либо негативного влияния небиволола на организм беременной, плода или новорожденного.
Выводы
В исследовании И.Е. Гуменной и соавт. [13, 14] было продемонстрировано, что назначение небиволола в составе комбинированной терапии беременным с хронической артериальной гипертензией имело важное значение для нормального протекания родов: состояние гемодинамики и частота осложнений у рожениц, состояние и вес новорожденных приближались к таковым у здоровых беременных. Обычные бета–блокаторы (атенолол, метопролол, бисопролол) не приводили к такому результату.
Негативное влияние бета–блокаторов на течение беременности не следует рассматривать как общеклассовый эффект, а нужно соотносить с тем или иным препаратом в отдельности. В частности, небиволол негативного действия не проявлял, о чем свидетельствуют результаты исследований И.Е. Гуменной и соавт. [13, 14], О.Н. Ткачевой и соавт. [32], А.М. Пристрома и соавт. [33].
Таким образом, в соответствии с данными отечественных исследований, небиволол может быть назначен в качестве эффективного и безопасного лечения беременным с хронической артериальной гипертензией.
1. Hypertension in Pregnancy. American College of Obstetricians and Gynecologists. 2013. https://www.acog.org
2. Seely E.W., Ecker J. Chronic hypertension in pregnancy. Circulation. 2014. V. 129, № 11. P. 1254–1261.
3. ACOG Practice Bulletin No. 203: Chronic Hypertension in Pregnancy. Obstet. Gynecol. 2019. V. 133, № 1. P. e26–e50.
4. Podymow T., August P. New Evidence in the Management of Chronic Hypertension in Pregnancy. Semin. Nephrol. 2017. V. 37, № 4. P. 398–403.
5. Magee L.A., von Dadelszen P., Rey E. et al. Less–tight versus tight control of hypertension in pregnancy. N. Engl. J. Med. 2015. V. 372, № 5. P. 407–417.
6. Webster L.M., Conti–Ramsden F., Seed P.T. et al. Impact of Antihypertensive Treatment on Maternal and Perinatal Outcomes in Pregnancy Complicated by Chronic Hypertension: A Systematic Review and Meta–Analysis. J. Am. Heart Assoc. 2017. V. 6, № 5. Pii: e005526.
7. Bramham K., Parnell B., Nelson–Piercy C. et al. Chronic hypertension and pregnancy outcomes: systematic review and meta–analysis. BMJ. 2014. V. 348. P. g2301.
8. Gilbert W.M., Young A.L., Danielsen B. Pregnancy outcomes in women with chronic hypertension: a population–based study. J. Reprod. Med. 2007. V. 52, № 11. P. 1046–1051.
9. Ankumah N.A., Cantu J., Jauk V. et al. Risk of adverse pregnancy outcomes in women with mild chronic hypertension before 20 weeks of gestation. Obstet. Gynecol. 2014. V. 123, № 5. P. 966–972.
10. Dayan N., Lanes A., Walker M.C. et al. Effect of chronic hypertension on assisted pregnancy outcomes: a population–based study in Ontario, Canada. Fertil. Steril. 2016. V. 105, № 4. P. 1003–1009.
11. Postnatal hypertension (high blood pressure): Advice for women after pregnancy. Guy’s and St Thomas’ NHS Foundation Trust. Date published: August 2016, Review date: August 2019. Leaflet number: 4285/VER1. https://www.guysandstthomas.nhs.uk
12. Sibai B.M. Etiology and management of postpartum hypertension–preeclampsia. Am. J. Obstet. Gynecol. 2012. V. 206, № 6. P. 470–475.
13. Геряк С.М., Гуменна І.Є., Корда І.В., Добрян–
ська В.Ю. Раціональний контроль артеріального тиску під час пологів у жінок з артеріальною гіпертензією. Збірник наукових праць асоціації акушерів–гінекологів України. 2018. Вип. 2. С. 51–57.
14. Humenna I.Y., Heryak S.N., Dobryanska V.Y. Rational control of arterial pressure during labor in women with arterial hypertension. Ginekol. Pol. 2019. V. 90, № 4. P. 206–211.
15. Hilas O., Ezzo D. Nebivolol (bystolic), a novel Beta blocker
for hypertension. P. T. 2009. V. 34, № 4. P. 188–192.
16. Kanti Das U., Ali Ahsan S., Salman M. et al. Nebivolol: a review. University Heart Journal. 2010. V. 6, № 2.
P. 93–96.
17. Fongemie J., Felix–Getzik E. A Review of Nebivolol Pharmacology and Clinical Evidence. Drugs. 2015. V. 75, № 12. P. 1349–1371.
18. Olawi N., Krüger M., Grimm D. et al. Nebivolol in the treatment of arterial hypertension. Basic. Clin. Pharmacol. Toxicol. 2019. [Epub ahead of print].
19. Brown C.M., Garovic V.D. Mechanisms and management of hypertension in pregnant women. Curr. Hypertens. Rep. 2011. V. 13, № 5. P. 338–346.
20. James P.R., Nelson–Piercy C. Management of hypertension before, during, and after pregnancy. Heart. 2004. V. 90, № 12. P. 1499–1504.
21. Mustafa R., Ahmed S., Gupta A., Venuto R.C. A comprehensive review of hypertension in pregnancy. J. Pregnancy. 2012. V. 2012. P. 105918.
22. Hall M.E., George E.M., Granger J.P. The heart during pregnancy. Rev. Esp. Cardiol. 2011. V. 64, № 11. P. 1045–1050.
23. Soma–Pillay P., Nelson–Piercy C., Tolppanen H., Mebazaa A. Physiological changes in pregnancy. Cardiovasc. J. Afr. 2016. V. 27, № 2. P. 89–94.
24. Tihtonen K., Kööbi T., Huhtala H., Uotila J. Hemodynamic adaptation during pregnancy in chronic hypertension. Hypertens. Pregnancy. 2007. V. 26, № 3. P. 315–328.
25. Hon E.H. The location of chronic pregnancy hypertension on the vasoconstriction–volume spectrum: working hypothesis. Am. J. Obstet. Gynecol. 1999. V. 181, № 1. P. 137–142.
26. Fukushima T. Hemodynamic patterns of women with chronic hypertension during pregnancy. Am. J. Obstet. Gynecol. 1999. V. 180, № 6 (Pt. 1). P. 1584–1592.
27. Soma H., Yoshida K., Mukaida T., Tabuchi Y. Morphologic changes in the hypertensive placenta. Contrib. Gynecol. Obstet. 1982. V. 9. P. 58–75.
28. Boulanger H., Ahriz Saksi S., Ekoukou D. Alternative explanations for linking chronic hypertension to adverse pregnancy outcome. Ultrasound Obstet. Gynecol. 2017. V. 50, № 6. P. 805–806.
29. Berman M.R. Parenthood Lost: Healing the Pain After Miscarriage, Stillbirth, and Infant Death. Westport, Connecticut; London: Bergin & Garvey, 2001. 247 p.
30. Duan L., Ng A., Chen W. et al. Beta–blocker subtypes and risk of low birth weight in newborns. J. Clin. Hypertens (Greenwich). 2018. V. 20, № 11. P. 1603–1609.
31. Meidahl Petersen K., Jimenez–Solem E., Andersen J.T. et al. β–Blocker treatment during pregnancy and adverse pregnancy outcomes: a nationwide population–based cohort study. BMJ Open. 2012. V. 2, № 4. Pii: e001185.
32. Ткачева О.Н., Барабашкина А.В., Разгуляева Н.Ф., Васильева А.В. Перспективы оптимизации фармакотерапии артериальной гипертонии в период беременности. Российский кардиологический журнал. 2006. № 4. С. 75–82.
33. Пристром А.М., Пацеев С.В., Примакова А.М., Фомин О.Ю. Место небиволола среди β–адреноблокаторов в лечении мягкой (умеренной) артериальной гипертензии у беременных. Медицинские новости. 2013. № 2. С. 70–75.
34. Altoama K., Mallem M.Y., Thorin C. et al. Effect of nebivolol treatment during pregnancy on the intrauterine fetal growth, mortality and pup postnatal development in the l–NAME–induced hypertensive rats. Eur. J. Pharmacol. 2016. V. 791. P. 465–472.

/42-1.jpg)
/43-1.jpg)
/44-1.jpg)
/44-2.jpg)